β-榄香烯诱导人骨肉瘤143B细胞增殖、凋亡及自噬的实验研究
2021-06-28赵茗周庄齐典文孙涛郭昶志赵桂松马天晓刘思源胡彤宇张国川
赵茗, 周庄, 齐典文, 孙涛, 郭昶志, 赵桂松, 马天晓, 刘思源, 胡彤宇, 张国川
骨肉瘤是儿童青少年最常见的骨原发恶性肿瘤,其年发病率约为(4~5)/100万[1]。随着手术结合新辅助化疗技术的发展,骨肉瘤患者的5年生存率由20世纪70年代以前的约20%提升到现在的60%以上,然而其转移、复发及多药耐药等问题尚未得到解决[2]。安全有效的新药研发与应用仍是目前亟待解决的问题。β-榄香烯是从中草药莪术中提取的具有抗肿瘤活性的物质,已被广泛应用于多种肿瘤的治疗,如肺癌、前列腺癌等[3-5]。多项研究表明β-榄香烯可以通过多种细胞通路诱导包括骨肉瘤在内的多种肿瘤细胞的凋亡并抑制细胞增殖[6-9]。还有研究表明,β-榄香烯能通过降低肿瘤基质金属蛋白酶(MMP)-2、MMP-9的水平抑制肿瘤细胞的侵袭和转移能力[10]。
自噬是将细胞内的细胞质成分转运到溶酶体并降解的过程。在正常情况下,自噬通过转化蛋白质及清除受损的细胞器以维持细胞的稳态。自噬起始于双膜结构的自噬小泡的形成,它可以吞噬受损细胞器或衰老的蛋白质,然后自噬体与溶酶体融合,形成自噬溶酶体,其中的内容物被降解。病理条件下诱导的自噬是一种细胞适应性反应,可以使细胞在生存压力下存活,但广泛或持久的自噬也会导致细胞死亡,因此自噬是平衡细胞死亡和存活的重要决定性因素[11-12]。目前已有多项研究证明β-榄香烯所诱导的自噬在胃癌、肝癌及肺癌细胞发生凋亡时起保护作用[13-15]。然而β-榄香烯是否能诱导骨肉瘤细胞发生自噬及其在凋亡中的作用机制尚未明确。本研究旨在对β-榄香烯在骨肉瘤中诱导自噬发生的信号通路及其对肿瘤细胞凋亡的作用进行初步探讨。
1 材料与方法
1.1 药品与试剂
人骨肉瘤细胞株143B购自中科院上海细胞库;β-榄香烯注射液购自大连金港制药有限公司;胎牛血清和DMEM培养基购自美国Corning公司;细胞计数试剂盒(cell counting kit-8,CCK-8)、DAPI均购自日本Dojindo公司;Annexin Ⅴ/PI凋亡检测试剂盒、BCA试剂盒、Alexa Fluor 488标记山羊抗兔IgG二抗均购自美国Thermo Fisher公司;ECL试剂盒购自美国Amersham Pharmacia GE公司;活化型半胱天冬酶3(Cleaved caspase-3)、β-肌动蛋白(β-actin)、丝氨酸/苏氨酸激酶(AKT)、磷酸化丝氨酸/苏氨酸激酶(p-AKT)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)、微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3 alpha B,LC3B)抗体购自美国CST公司。
1.2 方法
1.2.1 细胞培养 将143B细胞复苏后,培养于含10%胎牛血清的DMEM培养液中,置于37 ℃、饱和湿度、含5%CO2的培养箱内,根据细胞生长状况每天换液1次,每2~3天传代1次,选取状态佳、呈对数生长的细胞进行后续试验。
1.2.2 CCK-8法检测细胞增殖存活率 取对数生长期的143B细胞,用PBS洗涤后,胰蛋白酶消化制备单细胞悬浮液。将细胞以2×104/ml接种到96孔板,每孔100 μl,每组设3个复孔。贴壁培养24 h后,加入不同浓度(10、20、50、100、150 μg/ml)β-榄香烯的为实验组,未用β-榄香烯处理的为对照组,24、48 h后从培养箱中取出,每孔加入10 μl CCK-8。继续培养4 h。使用酶标仪在450 nm处检测每孔的吸光度(A)值。按公式计算细胞存活率(%)=(A实验组/A对照组)×100%。
1.2.3 流式细胞术Annexin Ⅴ-FITC/PI双染法检测细胞凋亡 将经0、20、50 μg/ml β-榄香烯处理48 h后的143B细胞用PBS洗涤后加入1 ml结合缓冲液,漂洗细胞1次弃上清液。依次加入100 μl结合缓冲液及2.5 μl Annexin Ⅴ,重悬混匀,于37 ℃避光温育15 min,再加入2 μl PI,于37 ℃避光温育3 min;每管加入结合缓冲液400 μl,1 h内进行流式细胞术检测。流式细胞数据分析:在双变量流式细胞仪的散点图上,左下象限(FITC-/PI-)为活细胞;右上象限(FITC+/PI+)为凋亡晚期细胞;右下象限(FITC+/PI-)为凋亡早期细胞。
1.2.4 荧光显微镜观察LC3B蛋白的表达及分布
将细胞接种于玻底培养皿中(2×104/孔),贴壁后加入0、20、50 μg/ml的β-榄香烯培养48 h,PBS清洗,于-20 ℃用乙醇固定10 min,3%BSA室温封闭30 min,LC3B一抗室温孵育2 h,Alexa Fluor 488标记山羊抗兔IgG二抗培养1 h。细胞核由DAPI共染。PBS清洗后用激光共聚焦显微镜观察蛋白表达、分布及细胞自噬情况。
1.2.5 蛋白印迹法(Western blotting)检测细胞凋亡及自噬相关蛋白表达水平 将143B细胞以5×104/ml的密度接种于6孔板中,贴壁后加入20 μg/ml β-榄香烯培养,分别于0、12及24 h收集细胞,测定AKT/mTOR通路相关蛋白水平;同样方法培养细胞贴壁后,加入0、20、50 μg/ml β-榄香烯,培养48 h后,收集细胞进行凋亡、自噬及AKT/mTOR通路相关蛋白测定。加入裂解液提取蛋白,BCA法进行蛋白定量,加热变性,10%SDS-PAGE电泳,转膜,5%脱脂牛奶封闭4 h,一抗(Cleaved-caspase 3、LC3B、AKT、p-AKT、mTOR、p-mTOR)4 ℃摇床孵育过夜,TBST洗膜3次,二抗反应1 h,ECL试剂盒显影,采用Bio-Rad ChemiDoc XRS System凝胶成像系统采集图像,应用Image J软件进行数据分析。
1.3 统计学方法
2 结果
2.1 β-榄香烯对骨肉瘤细胞增殖能力的影响
β-榄香烯对143B细胞增殖有明显的抑制作用,且呈浓度依赖性。β-榄香烯对143B细胞作用24 h和48 h时的半数抑制浓度(IC50)分别为58.89 μg/ml和18.48 μg/ml(图1)。
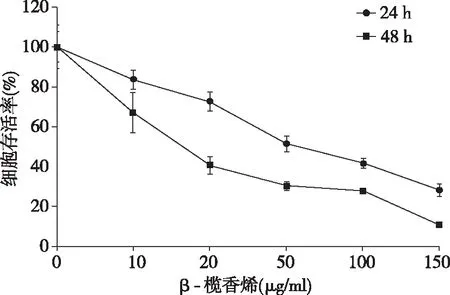
图1 β-榄香烯对骨肉瘤143B细胞存活率的影响
2.2 β-榄香烯对骨肉瘤细胞凋亡的影响
20、50 μg/ml β-榄香烯处理143B细胞48 h后,其细胞凋亡率明显高于0 μg/ml β-榄香烯组,差异有统计学意义(P<0.05,图2,表1)。20、50 μg/ml β-榄香烯处理143B细胞后,其Cleaved caspase-3蛋白的表达水平明显高于0 μg/ml β-榄香烯组(P<0.05,图3,表1)。

2A:0 μg/ml β-榄香烯组;2B:20 μg/ml β-榄香烯组;2C:50 μg/ml β-榄香烯组图2 β-榄香烯对骨肉瘤143B细胞凋亡的影响

图3 β-榄香烯对骨肉瘤143B细胞中Cleaved caspase-3蛋白表达水平的影响
2.3 β-榄香烯对骨肉瘤细胞自噬的影响
经20、50 μg/ml β-榄香烯处理骨肉瘤143B细胞48 h后,细胞质内的自噬体数量明显增多(图4)。Western blotting检测结果显示经20、50 μg/ml β-榄香烯处理143B细胞后,其自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ表达水平较0 μg/ml β-榄香烯组明显增高,差异有统计学意义(P<0.05),见图5,表1。

表1 各组细胞凋亡率、Cleaved caspase-3蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ表达水平比较
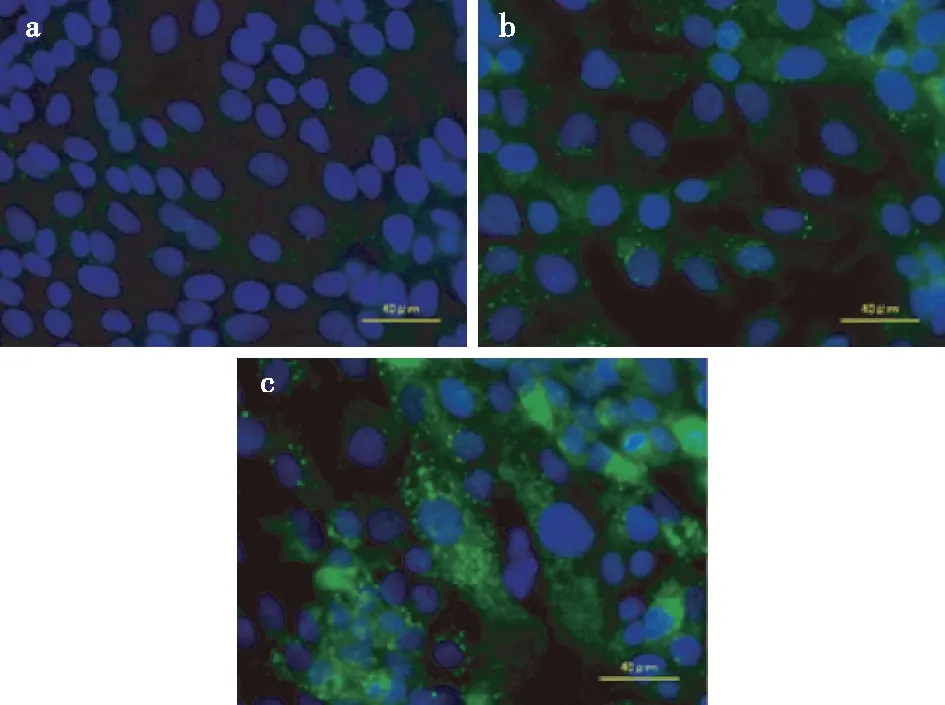
图4 0、20、50 μg/ml β-榄香烯组的143B细胞自噬情况(荧光显微镜 ×400)

图5 β-榄香烯对骨肉瘤143B细胞LC3-Ⅱ/LC3-Ⅰ表达水平的影响
2.4 β-榄香烯对骨肉瘤143B细胞AKT/mTOR信号通路相关蛋白的影响
Western blotting检测结果显示,20 μg/ml β-榄香烯处理骨肉瘤143B细胞12 h、24 h后,其p-AKT、AKT、p-mTOR及mTOR蛋白表达水平较0 h组均显著降低(P<0.05)。20、50 μg/ml β-榄香烯处理143B细胞48 h后,其p-AKT和p-mTOR蛋白表达水平较0 μg/ml β-榄香烯组明显降低(P<0.05,图6,表2、3)。

图6 β-榄香烯对骨肉瘤143B细胞AKT/mTOR通路相关蛋白的影响

表2 20 μg/ml β-榄香烯处理骨肉瘤143B细胞0、12、24 h后p-AKT、AKT、p-mTOR及mTOR蛋白表达水平比较

表3 各组p-AKT、AKT、p-mTOR及mTOR蛋白表达水平比较
3 讨论
近年来,许多研究证实中药具有良好的抗肿瘤活性。榄香烯作为一种新型的抗肿瘤中草药,在体内、体外实验中都表现出广泛的抗肿瘤作用。已获国家食品药品监督管理局批准,用于恶性积液及部分实体肿瘤的治疗。
本研究发现,β-榄香烯可以显著抑制骨肉瘤细胞的增殖,并呈浓度依赖性;且证实β-榄香烯可以诱导细胞凋亡率显著增加,Cleaved caspase-3蛋白表达水平显著升高,由此笔者推测β-榄香烯可能通过活化Caspase-3诱导骨肉瘤细胞凋亡并抑制其增殖。有研究表明,β-榄香烯可以通过诱导细胞凋亡及细胞周期阻滞抑制多种肿瘤的细胞增殖,如肝癌、肺癌及卵巢癌等[9,14,16],但其对胃癌细胞只是抑制了细胞增殖,对细胞周期并无明显影响[13],这可能是由于不同细胞株的调节机制不同所致。
本研究还发现β-榄香烯可以诱导骨肉瘤细胞发生明显的自噬现象,诱导细胞内产生大量的自噬小体。LC3是目前最常用的自噬标记物,常用LC3B抗体进行检测,当自噬发生后,胞浆内的LC3-Ⅰ经过修饰激活转变为LC3-Ⅱ以结合膜形式聚集于自噬体表面,LC3-Ⅱ/LC3-Ⅰ为检测自噬水平的重要指标。本研究发现,经Western blotting检测发现经β-榄香烯处理过的骨肉瘤细胞,其LC3-Ⅱ/LC3-Ⅰ的表达水平明显增高,与之前相关研究发现β-榄香烯可以诱导胃癌、肝癌及肺癌细胞发生自噬的结果一致[13-15]。在肿瘤发展过程中,自噬可以诱发细胞凋亡,促进细胞死亡[16-17],自噬也可抑制细胞凋亡,对细胞起到保护作用[5,12-13,18]。然而β-榄香烯诱导骨肉瘤细胞发生自噬的机制并未明确。
自噬是维持细胞内环境稳定以保证其正常增殖及分化的重要方式,可以使细胞渡过营养不足、缺氧等应激状态而存活下来,异常的细胞自噬会引起肿瘤、肝病及肺病等[11,19]。mTOR是细胞自噬的关键性调节因子,其下游有多种自噬相关蛋白参与自噬的各个环节。PI3K-AKT-mTOR通路是细胞自噬调节因素中重要的信号系统。正常条件下,处于活化状态的mTOR抑制细胞内的自噬;然而当细胞处于应激状态下时,活性受到抑制的mTOR则会促进自噬的发生[12,19]。本研究发现,20、50 μg/ml β-榄香烯处理骨肉瘤143B细胞48 h后,细胞中的p-AKT和p-mTOR蛋白表达水平较0 μg/ml β-榄香烯组明显降低;此外,20 μg/ml β-榄香烯处理骨肉瘤143B细胞12、24 h后,p-AKT、AKT、p-mTOR及mTOR蛋白表达水平较0 h组均显著降低。因此笔者认为β-榄香烯可以通过抑制AKT和mTOR的活化从而诱导细胞发生自噬。
综上所述,β-榄香烯可以显著抑制骨肉瘤143B细胞增殖,引起骨肉瘤细胞凋亡,同时诱发细胞自噬。但β-榄香烯所致自噬反应在其所诱导的细胞凋亡过程中所发挥的具体作用仍未明确,尚需进一步研究及评估。
