犬瘟热病毒、犬细小病毒和犬冠状病毒多重PCR方法的建立及应用
2022-12-07李少晗张广智刘维全
李少晗,陈 鑫,张广智,刘维全,秦 彤*
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.农业农村部兽用药物与诊断技术北京科学观测实验站,北京 100193;3.中国农业大学生物学院,北京 100193)
犬瘟热病毒(Canine distemper virus,CDV)及犬细小病毒(Canine parvovirus,CPV)是目前危害犬的2种主要病原体[1],二者具有高度接触传播性。CDV属于副黏病毒科(Paramyxoviridae)麻疹病毒属(Morbillivirus),为单股负链不分节的RNA病毒[2]。发病犬主要临床表现为双相热、结膜炎、白细胞减少、支气管及肺炎、中枢神经系统损害等[3]。犬细小病毒为单链DNA病毒,自1967年发现至今不断发生基因突变及重组并产生多种基因型,在全球范围内广泛分布[4]。该病毒能够引起典型出血性肠炎,在犬中传染性及致病性较强。犬冠状病毒(Canine coronavirus,CCoV)属于尼多病毒目(Nidovirales)、冠状病毒科(Coronaviridae)、α-冠状病毒属(Coronavirus),为单股正链RNA病毒[5],存在CCoV-Ⅰ及CCoV-Ⅱ两种基因型,氨基酸序列同源性仅为50%[6]。相关研究表明,CCoV-Ⅰ与CCoV-Ⅱ常在体内以混合感染形式存在[7-9]。该病毒在犬群中具有发病率高、病死率低的特点,但幼犬感染后病死率较高。临床腹泻病例中常发生CPV与CCoV混合感染,同时,CDV感染犬时会引起全身性的免疫抑制现象[10-11]。犬只在发生3种病毒混合感染时的存活率较低。由于临床治疗手段有限,目前针对该类疾病主要以疫苗免疫预防为主。因此在疾病早期及时的诊断干预,将大大降低动物的病死率。
普通PCR/RT-PCR具有灵敏性高、特异性强的优点,但该类方法操作复杂,耗时长,成本高,因此,在临床检测应用中,快速、高效的多重PCR正在不断普及。在本研究中,成功建立了一种同时检测CDV、CPV、CCoV-Ⅰ 及 CCoV-Ⅱ 的多重PCR方法,可为今后临床样品的快速鉴别检测提供帮助。
1 材料与方法
1.1 材料
1.1.1 菌毒株 CPV、CCoV-Ⅰ、CCoV-Ⅱ、CPIV、CAV 毒株及大肠埃希氏菌、沙门氏菌、多形拟杆菌菌株,均由本实验室保存及鉴定。CDV毒株由中国农业大学惠赠。
1.1.2 主要试剂 LATaqDNA 聚合酶、2×Prime STAR Max DNA Polymerase、DNA标准DL 1 000、pMD19T-Vector,宝生物工程(大连)有限公司产品;DNA/RNA核酸提取试剂盒,艾德莱生物公司产品;RNA反转录试剂盒,南京诺唯赞生物公司产品;胶回收试剂盒及EasyPure®Plasmid MiniPrep Kit,OMEGA公司产品;DH5α 感受态细胞,北京全式金生物科技公司产品。
1.1.3 主要仪器设备 电泳仪、PCR仪,Bio-Rad公司产品;凝胶成像系统,Tanon公司产品;细菌培养箱,上海一恒生物科技有限公司产品;Nanodrop分光光度计,Life Real公司产品;细菌超净工作台,北京亚泰科隆实验科技开发中心产品;小型台式离心机,Thermo公司产品;SHK-99-Ⅱ型台式空气恒温摇床,上海智城分析仪器制造有限公司产品。
1.2 方法
1.2.1 引物设计 参照GenBank中CDV的H基因序列,CPV的VP2基因序列及CCoV参考文献[12]设计合成4对特异性引物(表1),引物由北京六合华大基因科技股份有限公司合成。

表1 多重PCR扩增引物序列
1.2.2 标准质粒模板的构建 对CPV的DNA,CDV、CCoV-Ⅰ和CCoV-Ⅱ的cDNA进行PCR扩增。反应体系为:LATaq酶 0.5 μL,10×buffer 5 μL,dNTP Mix 8 μL,上、下游引物各1 μL,模板DNA 2 μL/cDNA 3 μL,ddH2O补足至50 μL。扩增条件为:94 ℃ 1 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,共35个循环;72 ℃ 延伸 10 min。PCR产物胶回收后,分别与pMD19-T Vector 16 ℃连接30 min,连接产物转化至DH5α感受态细胞中,菌液PCR鉴定得到阳性单菌落后,送至北京擎科生物公司进行测序,测序成功的质粒作为标准质粒模板。
1.2.3 多重PCR的建立 分别以相同浓度的重组质粒pMD-CPV、pMD-CDV、pMD-CCoV-Ⅰ、pMD-CCoV-Ⅱ 为模板,设置退火温度为48.0 ℃~62.5 ℃,进行温度梯度PCR。采用25 μL反应体系:2×Prime STAR Max 12.5 μL,CDV、CPV及CCoV-Ⅰ上、下游引物各0.5 μL,CCoV-Ⅱ上、下游引物各1.0 μL,重组质粒pMD-CPV,pMD-CDV,pMD-CCoV-Ⅰ 各0.5 μL,重组质粒pMD-CCoV-Ⅱ 1.0 μL,ddH2O补足至25 μL。扩增条件为:98 ℃ 1 min;98 ℃ 10 s,48.0 ℃~62.5 ℃ 10 s(设置15个梯度),72 ℃ 10 s,共35个循环;72 ℃ 10 min。PCR产物经20 g/L琼脂糖凝胶电泳检测。
1.2.4 多重PCR的特异性试验 利用优化后的多重PCR,对3种主要肠道病原菌大肠埃希氏菌、沙门氏菌和多形拟杆菌,以及CPV、CDV、CCoV-Ⅰ、CCoV-Ⅱ、CPIV、CAV及CPV+CDV+CCoV-Ⅰ+CCoV-Ⅱ 的DNA/cDNA进行扩增,来检测该方法的特异性。
1.2.5 多重PCR的敏感性试验 使用Nanodrop 2000分光光度计,测定重组质粒pMD-CPV、pMD-CDV、pMD-CCoV-Ⅰ和pMD-CCoV-Ⅱ 的浓度,将该浓度按照拷贝数公式进行换算。拷贝数(copies/μL)=质粒浓度(g/μL)×6.02×1023/(660×质粒长度bp)。将各重组质粒pMD-CPV、pMD-CDV、pMD-CCoV-Ⅰ和pMD-CCoV-Ⅱ均稀释至1×1010copies/μL,并进行10倍梯度稀释至1×101copies/μL,用于检测多重PCR的敏感性,并与单项PCR敏感性进行比较。
1.2.6 多重PCR的重复性 在对多重PCR的重复性检测中,选择3个不同稀释度质粒模板1×108copies/μL、1×107copies/μL和1×106copies/μL,在不同时间点、不同PCR扩增仪中进行3次重复试验,用于检测该多重PCR方法的重复稳定性。
1.2.7 多重PCR的初步应用 用建立的多重PCR方法对2020年-2021年由北京、河北等地区宠物医院采集的50份临床腹泻病料进行检测,同时与单项PCR检测结果进行比较。
2 结果
2.1 标准质粒模板的构建
对CPV、CDV、CCoV-Ⅰ和CCoV-Ⅱ的DNA/cDNA进行PCR扩增,PCR产物胶回收后连接至pMD19-T Vector,各重组菌液PCR扩增片段分别为573、410、289、105 bp,片段大小与预期相符(图1),菌液送至北京擎科生物公司测序比对结果正确。

M.DNA标准DL 1 000; 1.CPV目的基因; 2.CPV阴性对照; 3.CDV目的基因; 4.CDV阴性对照; 5.CCoV-Ⅰ目的基因; 6.CCoV-Ⅰ阴性对照; 7.CCoV-Ⅱ目的基因; 8.CCoV-Ⅱ阴性对照
2.2 多重PCR的建立
利用确定好的反应体系,以重组质粒pMD-CPV、pMD-CDV、pMD-CCoV-Ⅰ和pMD-CCoV-Ⅱ为模板,进行多重PCR扩增反应。经20 g/L琼脂糖凝胶电泳检测,同时获得573、410、289、105 bp目的片段,与预期大小相符。经退火温度条件的优化,最终选择50.7 ℃作为该方法的最佳退火温度(图2)。

M.DNA标准DL 1 000;1.阴性对照; 2~16.分别为48、48.5、49.3、50.7、52.3、53.6、54.5、55、56、56.5、57.4、58.7、60.3、61.6、62.5℃
2.3 多重PCR的特异性试验
采用建立的多重PCR对大肠埃希氏菌、沙门氏菌、多形拟杆菌、CPV、CDV、CCoV-Ⅰ、CCoV-Ⅱ、CPIV、CAV及CPV+CDV+ CCoV-Ⅰ+ CCoV-Ⅱ 进行检测,发现仅CPV、CDV、CCoV-Ⅰ、CCoV-Ⅱ 及CPV+CDV+ CCoV-Ⅰ+ CCoV-Ⅱ 有特异性条带,而大肠埃希氏菌、沙门氏菌、多形拟杆菌、CPIV及CAV未出现扩增条带(图3)。结果表明,该方法具有良好的特异性。
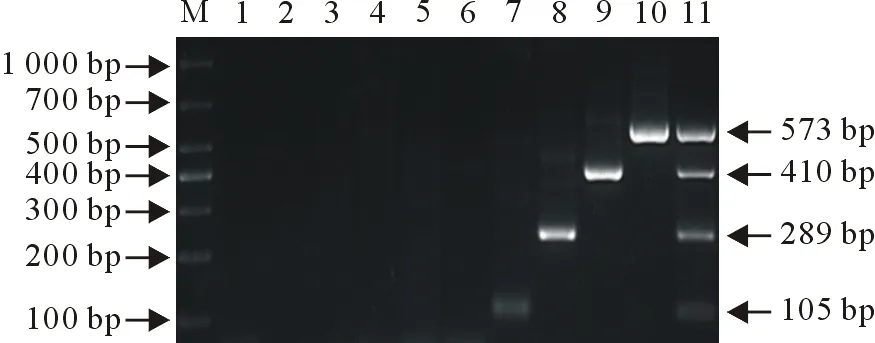
M.DNA标准DL 1 000;1.阴性对照; 2.大肠埃希氏菌;3.沙门氏菌;4.多形拟杆菌;5.CPIV; 6.CAV; 7.CCoV-Ⅱ; 8.CCoV-Ⅰ; 9.CDV; 10.CPV;11.CPV+CDV+ CCoV-Ⅰ+ CCoV-Ⅱ
2.4 多重PCR的敏感性试验
将初始浓度为1×1010copies/μL的重组质粒10倍稀释至1×101copies/μL,取各个稀释度的重组质粒模板进行多重PCR和单项PCR。结果表明,多重PCR可以检测到CPV、CDV、CCoV-Ⅰ及CCoV-Ⅱ的最低拷贝数分别为1×107copies/μL、1×103copies/μL、1×106copies/μL和1×104copies/μL。而单项PCR的最低拷贝数分别为1×107copies/μL、1×102copies/μL、1×104copies/μL和1×104copies/μL。对于CPV及CCoV-Ⅱ多重PCR与单项PCR的敏感性一致,而针对CDV及CCoV-Ⅰ多重PCR敏感性略逊于单项PCR,但差异不大(图4)。
M.DNA标准DL 1 000;1.阴性对照;2~11.pMD-CPV质粒浓度由1×1010~1×101 copies/μL、pMD-CDV质粒浓度由1×1010~1×101 copies/μL、pMD-CCoV-Ⅰ质粒浓度由1×1010~1×101 copies/μL和pMD-CCoV-Ⅱ质粒浓度由1×1010~1×101 copies/μL
2.5 多重PCR的重复性
采用建立的多重PCR,对1×108copies/μL、1×107copies/μL和1×106copies/μL 3个不同稀释度质粒模板,在不同时间,使用3个不同的PCR扩增仪进行检测,结果表明,不同条件下的扩增结果相似,证明该方法具有良好的重复稳定性(图5)。
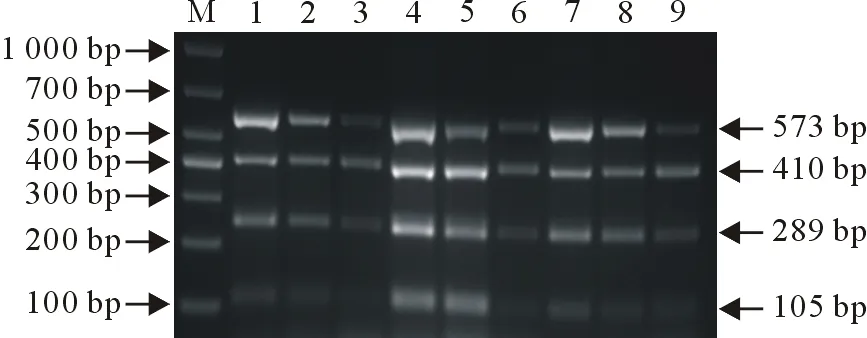
M.DNA标准DL 1 000;1~3.1×108 copies/μL、1×107 copies/μL和1×106 copies/μL稀释度质粒模板第一次扩增;4~6.1×108 copies/μL、1×107 copies/μL和1×106 copies/μL稀释度质粒模板第二次扩增;7~9.1×108 copies/μL、1×107 copies/μL和1×106 copies/μL稀释度质粒模板第三次扩增
2.6 多重PCR的初步应用
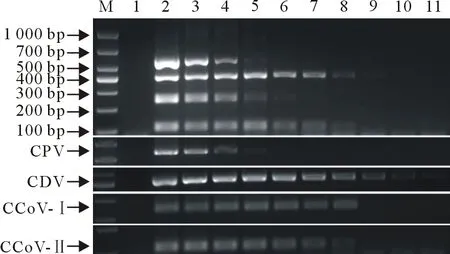
对2020年-2021年由北京、河北等地区宠物医院采集的50份临床腹泻病料进行多重PCR检测,结果表明,CPV、CDV、CCoV-Ⅰ及CCoV-Ⅱ的阳性率分别为32%(16/50)、24%(12/50)、18%(9/50)、10%(5/50)。双重感染类型CPV+CCoV-Ⅰ阳性率为2%(1/50),CCoV-Ⅰ+CCoV-Ⅱ阳性率为8%(4/50)。三重感染类型CDV+CCoV-Ⅰ+CCoV-Ⅱ阳性率为2%(1/50)。
同时对50个病料进行了常规单项PCR检测,比较结果发现,CPV、CDV、CCoV-Ⅰ及CCoV-Ⅱ的阳性率分别为30%(15/50)、24%(12/50)、18%(9/50)、16%(8/50),单项PCR未检测出CPV+CCoV-Ⅰ混合感染病例;CCoV-Ⅰ+CCoV-Ⅱ阳性率为12%(6/50);CDV+CCoV-Ⅰ+CCoV-Ⅱ 的结果与多重PCR一致(表2)。
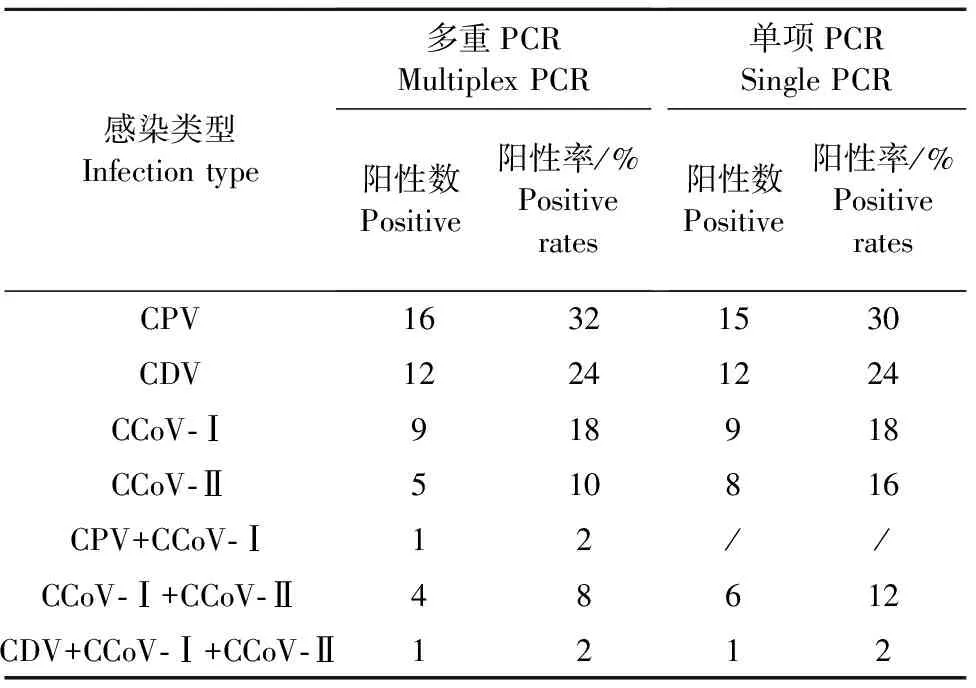
表2 多重PCR及单项PCR临床样品检测结果
3 讨论
近年来在对宠物医院临床犬病例的流行病学调查中发现,多种病原混合感染的现象普遍存在[13]。常规PCR具有检测灵敏性高、特异性强的优点,但是发生多种病毒混合感染时,存在操作流程繁琐、耗时长、成本高的缺点[14]。本研究成功建立了同时检测CPV、CDV、CCoV-Ⅰ及CCoV-Ⅱ的多重PCR,具有特异性强、灵敏度高、稳定性好的特点,大大缩短了检测周期,避免了试剂耗材的浪费及大量实验操作过程中存在的交叉污染现象。本试验中使用的高保真快速DNA聚合酶预混液,只需在体系中添加酶、ddH2O、预混合引物及模板即可完成快速高效扩增,使得检测过程更加简便,同时降低了操作污染的风险。
引物设计是多重PCR建立过程中的首要关键步骤,引物需要设计在序列保守区域内[15],避免非特异性扩增,具有相似的退火温度,避免引物二聚体及发夹结构[16]。本研究中针对CPV的VP2基因、CDV的H基因、CCoV的M基因保守序列设计并合成了4对引物,试验结果表明,各引物间无相互干扰、特异性强、各个模板扩增片段大小合适,易于区分,分别为573 bp、410 bp、289 bp和105 bp。多重PCR反应体系并非单项PCR各反应体系的叠加,需要对模板浓度、引物比例、退火温度及延伸时间等条件进行摸索[17-18]。本研究中适当提高了CCoV-Ⅱ的模板及引物浓度,并确定了50.7 ℃为最佳退火温度。本研究建立的多重PCR对CPV及CCoV-Ⅱ的灵敏度与普通PCR一致,而CDV及CCoV-Ⅰ的灵敏性略差于普通PCR,原因可能是在多个模板及多对引物存在的PCR反应体系中,PCR扩增反应存在竞争不平衡的现象,很难保证针对每一种模板的敏感性达到最优,但该方法在实际应用中能够较好的满足检测需求。在对50份临床病料检测过程中发现,该多重PCR能够较好的完成单一病原及多重病原混合感染的检测,结果与单项PCR结果大致相同,且对混合感染病例的检测更加高效便捷,值得后期推广应用。同时在检测过程中也发现了一些限制性因素,由于采集病料中的CCoV-Ⅱ病毒粒子含量较低,多重PCR反应体系中的各个混合引物组分可能会优先扩增较高浓度模板,从而降低对CCoV-Ⅱ的检出率,使得该多重PCR针对CCoV-Ⅱ的阳性检出率略低于常规单项PCR。后续还需不断提高临床检测的样本量,来更全面的评价该方法,同时也需要不断深入研究并对此方法进一步提升优化。
CPV及CDV目前仍是世界范围内犬科动物主要感染的两大病原体。CPV的遗传进化速度非常快,已报道发现有CPV-2/2a/2b/2c及new CPV-2a/2b 6种基因型[4,19-20],本研究设计的CPV引物能够扩增不同基因型毒株。CDV常与其他病原体共同感染,有报道指出CDV的感染宿主范围不断扩大,已有恒河猴感染的报道,这也使得CDV感染人成为可能[21]。CCoV有CCoV-Ⅰ和CCoV-Ⅱ两种基因型,由于该病毒难以分离培养,目前关于此类病毒的研究及报道较少[22-24]。Pratelli A等[25]发现在CCoV-Ⅱ 跨膜区和羧基末端,只有少数分散的替换,而CCoV-Ⅰ的M蛋白中发生许多类似于猫冠状病毒典型残基的替换,基于此可以区分Ⅰ型和Ⅱ型。在对采集的临床样本进行检测后发现CCoV-Ⅰ和CCoV-Ⅱ的混合感染普遍存在。随着新冠疫情的暴发流行,人们对于犬、猫冠状病毒的关注度也在不断提高,因此,做好对宠物疫病的监控,也是对人类健康的保护。
本研究为CPV、CDV、CCoV-Ⅰ及CCoV-Ⅱ的检测提供了一种高效、灵敏、特异、高通量、低成本的检测方法,可为今后的实验室诊断、病原学研究、宠物重要疫病流行监控及流行病学调查提供帮助。
