神经阻滞复合全身麻醉在腹腔镜胃癌手术中的应用效果及对患者血清肿瘤标志物的影响
2022-12-06朱丽王红云余红珠郭聪
朱丽,王红云#,余红珠,郭聪
1汉中市人民医院手术麻醉科,陕西 汉中 723000
2汉中职业技术学院附属医院麻醉科,陕西 汉中 723000
胃癌是起源于胃黏膜上皮的恶性肿瘤,其发病有一定的地域性,与生活环境、幽门螺杆菌感染、遗传和饮食有关,多表现为上腹疼痛、食欲缺乏及消瘦等,严重影响患者的生命健康和生活质量[1]。腹腔镜手术是胃癌患者常用的维持治疗方法,借助手术能切除病灶组织,延缓病情发展,延长生存期[2]。全身麻醉是胃癌患者腹腔镜手术的首选麻醉方式,虽然能保证手术顺利完成,但是麻醉药的剂量较大,疼痛改善效果不佳,导致患者围手术期应激反应强烈,增加手术风险[3-4]。神经阻滞是将局部麻醉药物注射到椎体旁椎间孔外口的楔形间隙,从而对同侧躯体与交感神经进行阻滞,对患者血流动力学的影响较小,可避免全身麻醉引起的呼吸抑制,但目前神经阻滞复合全身麻醉对胃癌患者肿瘤标志物影响的研究较少[5-6]。本研究探讨神经阻滞复合全身麻醉在腹腔镜胃癌手术中的应用效果及对患者血清肿瘤标志物的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年4月至2021年3月汉中市人民医院收治的胃癌患者。纳入标准:①符合胃癌的诊断标准[7],并经病理检查确诊为胃癌;②腹腔镜术中给予全身麻醉,且均可耐受;③凝血功能正常,无神经阻滞复合全身麻醉药物过敏史、禁忌证。排除标准:①合并精神异常、其他部位恶性肿瘤或近期免疫抑制类药物使用史;②术中需输血、存在药物过敏史或免疫功能异常;③临床分期为Ⅳ期,出现远处转移或伴有慢性疼痛。依据纳入和排除标准,本研究共纳入78例胃癌患者,均给予腹腔镜手术治疗,根据麻醉方式的不同分为对照组和观察组,每组39例,对照组患者给予全身麻醉,观察组患者给予神经阻滞复合全身麻醉。对照组中,男26例,女13例;年龄43~79岁,平均(64.61±5.69)岁;体重指数(body mass index,BMI)为19~31 kg/m2,平均(23.25±4.31)kg/m2;美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级:Ⅰ级23例,Ⅱ级16例。观察组中,男21例,女18例;年龄44~79岁,平均(65.11±5.65)岁;BMI为18~32 kg/m2,平均(24.14±4.37)kg/m2;ASA分级:Ⅰ级21例,Ⅱ级18例。两组患者性别、年龄、BMI、ASA分级比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准通过,所有患者均知情同意并签署知情同意书。
1.2 麻醉方法
两组患者均给予腹腔镜手术治疗,对照组患者术中给予全身麻醉,术前完善有关检查,评估患者身体状态,了解病灶部位、大小,预测手术时间,开放静脉通道,加强心电监护。麻醉诱导采用舒芬太尼 0.4 μg/kg、丙泊酚2.0 mg/kg、注射用苯磺顺阿曲库铵0.15 mg/kg。常规采用双腔支气管导管插管,并完成纤维支气管镜定位,围手术期借助呼吸控制器控制呼吸。术中给予丙泊酚2.0 mg/(kg·h)、瑞芬太尼0.05 μg/(kg·min)静脉泵注,且手术期不间断给予维库溴铵0.04 mg/kg维持麻醉,手术过程中加强监测患者呼气中的CO2浓度,保证CO2浓度<40 mmHg(1 mmHg=0.133 kPa)。
观察组患者给予神经阻滞复合全身麻醉,患者进入手术室后加强心电监护,静脉滴注乳酸钠林格液6~8 ml/(kg·h),全身麻醉方法与对照组相同。全身麻醉后在超声引导下进行神经阻滞,于T11~T12或 T12~L1节段椎旁神经阻滞,具体操作方法如下:以椎体棘突间隙2.5 cm部位作为穿刺点,常规消毒后进行局部麻醉,待麻醉生效后借助22号硬膜外穿刺针进行穿刺,经横突上缘进入椎旁间隙,进针后突破韧带,确认位置后借助Starling技术完成导管固定。然后单次注入罗哌卡因15 ml;术中根据患者脑电双频指数(bispectral index,BIS)调整全身麻醉药物用量,并将BIS维持在50~60;手术完成后,经椎旁管注入0.25%罗哌卡因15 ml,拔除导管。
两组手术完毕后均常规给予患者静脉自控镇痛(patient-controlled intravenous analgesia,PCIA)泵镇痛,将舒芬太尼100 μg、地佐辛 20 mg混入100 ml氯化钠溶液中,加入PCIA泵中。设定维持剂量为1 ml/h,自控量为1.0 ml,锁定时间20 min。
1.3 观察指标和评价标准
①麻醉诱导前、诱导后30 min、术后6 h,比较两组患者生命体征及血流动力学指标,包括收缩压、舒张压、平均动脉压(mean arterial pressure,MAP)、心率、经皮动脉血氧饱和度(percutaneous arterial oxygen saturation,SpO2)。②术前和术后 7天,采用酶联免疫吸附测定检测两组患者血清肿瘤标志物水平,包括糖类抗原125(carbohydrate antigen 125,CA125)、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)、癌胚抗原(carcinoembryonic antigen,CEA)。③比较两组患者麻醉期间丙泊酚、瑞芬太尼使用剂量。④比较两组患者并发症发生情况,包括切口感染、肠梗阻、嗜睡、呼吸抑制及恶心呕吐。
1.4 统计学方法
采用SPSS 24.0软件对所有数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验;正态分布计量资料以均数±标准差(±s)表示,不同时间点重复数据采用重复测量方差分析,组间比较采用t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 生命体征及血流动力学指标的比较
麻醉诱导前、麻醉诱导后30 min、术后6 h,两组患者SpO2比较,差异均无统计学意义(P>0.05)。麻醉诱导前,两组患者收缩压、舒张压、心率和MAP比较,差异均无统计学意义(P>0.05);麻醉诱导后30 min、术后6 h,两组患者收缩压、舒张压、心率及MAP均低于本组麻醉诱导前,但观察组患者收缩压、舒张压、心率及MAP均高于对照组,差异均有统计学意义(P<0.05)。(表1)
表1 不同时间点两组患者生命体征及血流动力学指标的比较(±s)
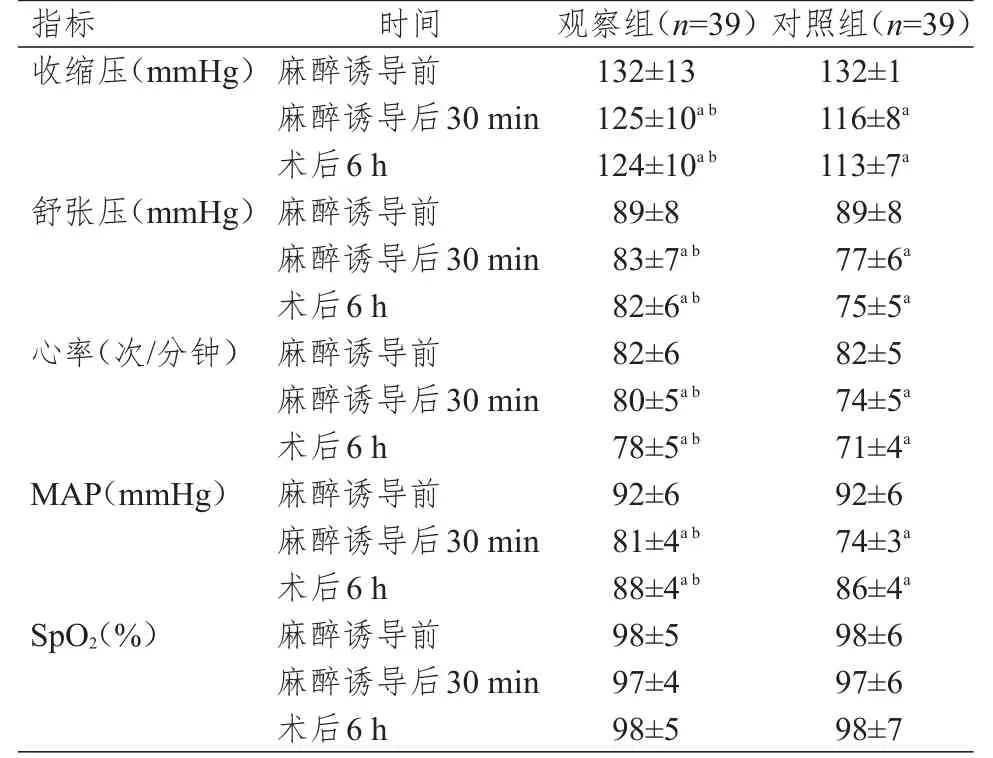
表1 不同时间点两组患者生命体征及血流动力学指标的比较(±s)
注:a与本组麻醉诱导前比较,P<0.05;b与同时间点对照组比较,P<0.05;1 mmHg=0.133 kPa
指标收缩压(m m H g)舒张压(m m H g)心率(次/分钟)M A P(m m H g)S p O 2(%)麻醉诱导前麻醉诱导后3 0 m i n术后6 h麻醉诱导前麻醉诱导后3 0 m i n术后6 h麻醉诱导前麻醉诱导后3 0 m i n术后6 h麻醉诱导前麻醉诱导后3 0 m i n术后6 h麻醉诱导前麻醉诱导后3 0 m i n术后6 h 1 3 2±1 3 1 2 5±1 0 a b 1 2 4±1 0 a b 8 9±8 8 3±7 a b 8 2±6 a b 8 2±6 8 0±5 a b 7 8±5 a b 9 2±6 8 1±4 a b 8 8±4 a b 9 8±5 9 7±4 9 8±5 1 3 2±1 1 1 6±8 a 1 1 3±7 a 8 9±8 7 7±6 a 7 5±5 a 8 2±5 7 4±5 a 7 1±4 a 9 2±6 7 4±3 a 8 6±4 a 9 8±6 9 7±6 9 8±7时间观察组(n=3 9)对照组(n=3 9)
2.2 肿瘤标志物水平的比较
手术前和术后7天,两组患者CA125、CA19-9、CEA水平比较,差异均无统计学意义(P>0.05)。术后7天,两组患者CA125、CA19-9、CEA水平均低于本组手术前,差异均有统计学意义(P<0.05)。(表2)
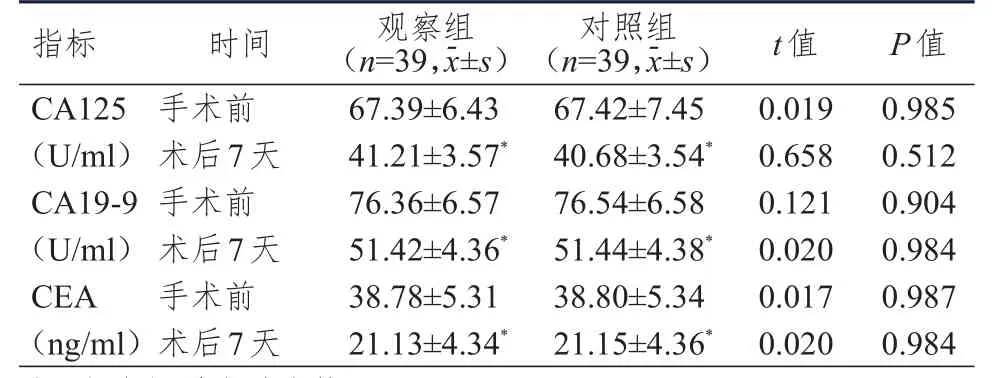
表2 手术前和术后7天两组患者肿瘤标志物水平的比较
2.3 麻醉药物使用量的比较
观察组患者瑞芬太尼、丙泊酚使用量均明显低于对照组,差异均有统计学意义(P<0.01)。(表3)
表3 两组患者麻醉药物使用量的比较(mg,±s)
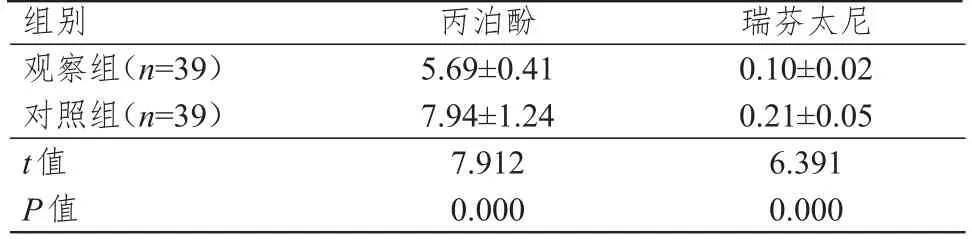
表3 两组患者麻醉药物使用量的比较(mg,±s)
组别观察组(n=39)对照组(n=39)t值P值丙泊酚5.69±0.41 7.94±1.24 7.912 0.000瑞芬太尼0.10±0.02 0.21±0.05 6.391 0.000
2.4 术后并发症发生情况的比较
观察组患者的并发症总发生率为5.13%(2/39),与对照组患者的10.26%(4/39)比较,差异无统计学意义(P>0.05)。(表4)

表4 两组患者的并发症发生情况[n(%)]
3 讨论
胃癌是临床发病率较高的恶性肿瘤,且随着腹腔镜手术的实施,多数患者能从手术中受益,但选择何种麻醉方式缺乏统一的标准[8-11]。李禾南[12]研究结果显示,胃癌患者腹腔镜手术治疗过程中应激反应的发生率较高,主要是因为机体对外界刺激的一种非特异性防御机制。对健康者来讲,应激反应有助于机体对外界刺激产生有效反应,降低不良事件发生率。但腹腔镜手术过程中,过度的应激反应会引起胃癌患者神经、内分泌系统失调、免疫功能下降等,不利于患者的术后恢复[13]。近年来,神经阻滞复合全身麻醉逐渐应用于胃癌患者腹腔镜手术过程中,且效果理想[14]。
本研究结果显示,麻醉诱导前、麻醉诱导后30 min、术后6 h,两组患者SpO2比较,差异均无统计学意义(P>0.05);麻醉诱导后30 min、术后6 h,两组患者收缩压、舒张压、心率及MAP均低于本组麻醉诱导前,但观察组患者收缩压、舒张压、心率及MAP均高于对照组,差异均有统计学意义(P<0.05)。表明神经阻滞复合全身麻醉能改善胃癌腹腔镜手术患者的血流动力学指标,利于患者的术后恢复。椎旁神经阻滞麻醉能阻断相应节段的神经传导功能,发挥镇痛效果,且该麻醉方法能减少围手术期丙泊酚等药物剂量,保证手术顺利完成[15]。吴天红等[16]研究显示,腹腔镜胃癌手术中神经阻滞能减少麻醉药物剂量,对患者正常生理功能的影响较小,可减轻患者的疼痛程度。同时,腹腔镜手术的创口较小,有助于患者的术后恢复,可降低术后并发症发生率[17]。本研究结果显示,观察组患者的并发症总发生率为5.13%,与对照组患者的10.26%比较,差异无统计学意义(P>0.05)。表明神经阻滞复合全身麻醉在胃癌腹腔镜手术中安全性较高。
肿瘤标志物是目前临床常用的肿瘤筛查、疗效判定、预后评估指标。熊成龙等[18]的研究表明,CA125多用于卵巢癌的诊疗,但近年来发现其表达亦可反映消化系统肿瘤的进展,除分布于输卵管上皮细胞外,亦可分布在腹膜、胸膜间皮细胞表面。因此,CA125水平能反映胃癌患者的腹腔镜手术效果,亦可评价围手术期麻醉对手术效果的影响[19]。CA19-9广泛存在于胃肠道肿瘤细胞表面,水平升高是胃癌复发的高危因素,可反映患者的预后。李运等[20]研究表明,CEA在多种实体瘤中高表达,其水平能反映患者术后生存期、转移和复发情况等,具有较高的独立预测价值。本研究结果显示,术后7天,两组患者CA125、CA19-9、CEA水平均低于本组手术前,观察组患者瑞芬太尼、丙泊酚使用量均低于对照组,差异均有统计学意义(P<0.05)。表明神经阻滞复合全身麻醉有助于降低胃癌腹腔镜手术患者的肿瘤标志物水平,减少麻醉药物剂量。麻醉方式的选择对手术的成功至关重要,神经阻滞复合全身麻醉在腹腔镜手术中应用效果较好。这可能是因为神经阻滞复合全身麻醉能保证患者顺利完成手术,完整地切除病灶及细小组织,使患者获得良好的手术效果,从而降低肿瘤标志物水平。
综上所述,神经阻滞复合全身麻醉能改善胃癌腹腔镜手术患者的生命体征,降低血清肿瘤标志物水平,且不增加并发症发生风险。
