内镜黏膜下剥离术对早期胃癌患者胃肠功能、肿瘤标志物的影响
2022-12-06龙飞燕魏惠马慧
龙飞燕,魏惠,马慧
延安市人民医院消化内科,陕西 延安 716000
胃癌是严重威胁人类健康的消化系统恶性肿 瘤,发病率居中国恶性肿瘤首位,且近年来呈逐年增长趋势[1]。相关调查报告显示,中国每年新发胃癌患者已超过40万例,且呈年轻化趋势[2]。胃癌的主要症状是腹痛,但早期症状缺乏特异性,容易被忽略,就诊时多已处于中晚期,肿瘤已发生局部转移,失去了最佳的手术治疗时机[3]。早期手术能够最大程度上切除肿瘤病灶,改善预后。目前,临床主要采用传统外科根治切除术治疗早期胃癌,患者术后5年生存率可超过90%,但该手术破坏了患者胃的正常解剖结构,术后并发症发生风险较大[4]。随着内镜技术的发展,内镜黏膜下剥离术逐渐成为早期胃癌的治疗方式,能够有效减少病灶残留,整块切除率较高,术后复发率较低[5]。探讨内镜黏膜下剥离术对胃癌患者肿瘤标志物的影响,有助于减少肿瘤细胞的脱落数量,防止肿瘤复发,对改善患者的预后有重要作用。目前,临床关于内镜黏膜下剥离术对胃癌患者肿瘤标志物影响的研究较少。基于此,本研究探讨内镜黏膜下剥离术对早期胃癌患者胃肠功能、肿瘤标志物的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年3月至2021年3月延安市人民医院收治的早期胃癌患者。纳入标准:①符合《中国早期胃癌筛查流程专家共识意见(草案)》[6]中胃癌的诊断标准;②经胃镜检查及病理检查确诊为胃癌;③既往未进行过腹部手术;④术前未进行过放疗、化疗;⑤无溃疡糜烂及淋巴结转移;⑥单发肿瘤;⑦TNM分期为Ⅰ~Ⅱ期。排除标准:①入院前已接受放化疗;②转移性、继发性或复发性胃癌;③内镜检查及手术禁忌证;④合并严重凝血功能障碍。依据纳入和排除标准,本研究共纳入100例胃癌患者,依据手术方式的不同分为开腹组和内镜组,每组50例,开腹组患者给予开腹手术,内镜组患者给予内镜黏膜下剥离术。开腹组中,男30例,女20例;年龄25~75岁,平均(45.22±5.58)岁;平均病程(1.01±0.02)年;肿瘤直径1~3 cm,平均(1.33±0.11)cm;TNM 分期:Ⅰ期 25例,Ⅱ期 25例。内镜组中,男28例,女22例;年龄25~72岁,平均(44.89±5.46)岁;平均病程(1.02±0.01)年;肿瘤直径1~3 cm,平均(1.32±0.10)cm;TNM分期:Ⅰ期31例,Ⅱ期19例。两组患者性别、年龄、病程、肿瘤直径比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准通过,所有患者均知情同意并签署知情同意书。
1.2 治疗方法
开腹组患者给予常规开腹胃癌根治术治疗,患者取仰卧位,全身麻醉,腹部正中线剑突下做一长约15 cm的切口,逐层进腹行胃癌根治术。内镜组患者给予内镜黏膜下剥离术治疗,采用胃镜探查病变程度,在病灶边缘0.5 cm处进行电凝标记,采用亚甲蓝与甘油果糖混合物在黏膜下多点注射,使用针型切开刀切开黏膜,剥离黏膜下层,保持剥离层在黏膜下侧,完整取出病灶后测量组织体积并送检,术中及时止血。术后常规给予止血药物、抗生素、黏膜保护剂等。
1.3 观察指标和评价标准
①比较两组患者的围手术期指标,包括手术时间、术中出血量、住院时间、首次进食时间。②手术前后,比较两组患者的胃肠动力激素和胃蛋白酶原水平,采用放射免疫法检测血管活性肠肽和血浆胃动素水平,酶联免疫吸附测定检测血清胃蛋白酶原Ⅰ和胃蛋白酶原Ⅱ水平。③手术前后,采用双抗体夹心酶联免疫吸附测定检测两组患者腹腔冲洗液中肿瘤标志物水平,包括癌胚抗原(carcinoembryonic antigen,CEA)、多巴胺脱羧酶、血管内皮生长因子(vascular endothelial growth factor,VEGF)和糖类抗原 19-9(carbohydrate antigen 19-9,CA19-9)。④比较两组患者的术后并发症发生情况,包括肺部感染、胃穿孔、迟发性出血、肠梗阻。
1.4 统计学方法
采用SPSS 22.0软件对所有数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验;正态分布计量资料以均数±标准差(±s)表示,组间比较采用t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 围手术期指标的比较
内镜组患者手术时间、住院时间、首次进食时间均明显短于开腹组,术中出血量明显少于开腹组,差异均有统计学意义(P<0.01)。(表1)
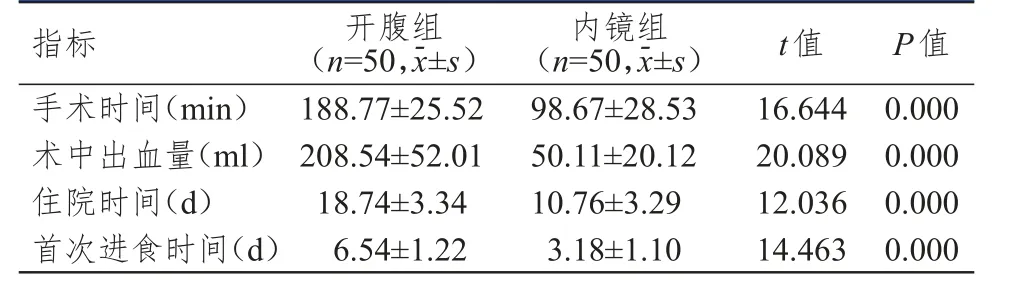
表1 两组患者围手术期指标的比较
2.2 胃肠动力激素和胃蛋白酶原水平的比较
手术前,两组患者血管活性肠肽、胃动素、胃蛋白酶原Ⅰ、胃蛋白酶原Ⅱ水平比较,差异均无统计学意义(P>0.05)。手术后,两组患者血管活性肠肽、胃蛋白酶原Ⅰ水平均高于本组手术前,胃动素、胃蛋白酶原Ⅱ水平均低于本组手术前,但内镜组患者血管活性肠肽、胃蛋白酶原Ⅱ水平均低于开腹组,胃动素、胃蛋白酶原Ⅰ水平均高于开腹组,差异均有统计学意义(P<0.05)。(表2)
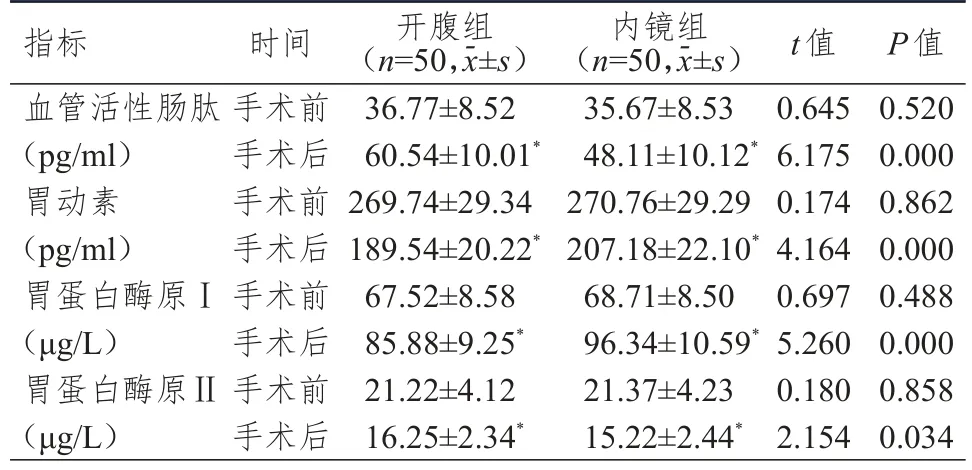
表2 手术前后两组患者胃肠动力激素和胃蛋白酶原水平的比较
2.3 肿瘤标志物水平的比较
手术前,两组患者CEA、多巴胺脱羧酶、VEGF、CA19-9水平比较,差异均无统计学意义(P>0.05)。手术后,两组患者CEA、多巴胺脱羧酶、VEGF、CA19-9水平均低于本组手术前,且内镜组患者CEA、多巴胺脱羧酶、VEGF、CA19-9水平均低于开腹组,差异均有统计学意义(P<0.05)。(表3)
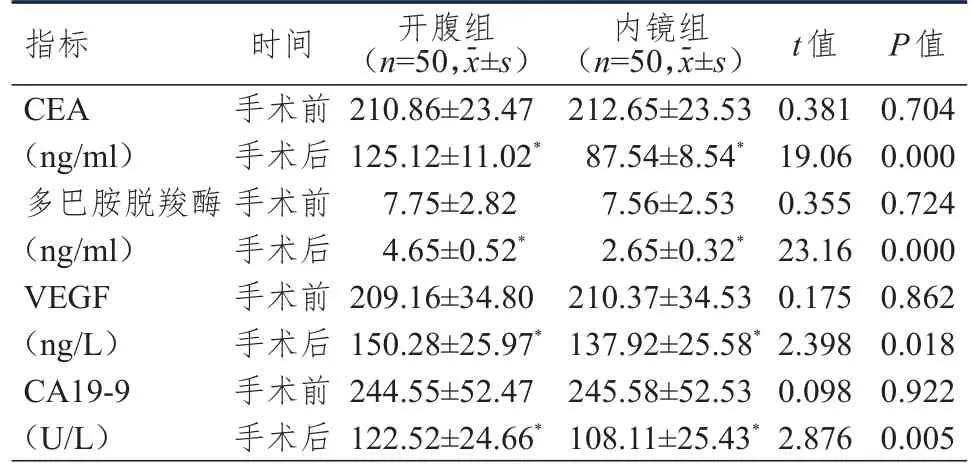
表3 手术前后两组患者肿瘤标志物水平的比较
2.4 手术并发症发生情况的比较
内镜组患者的术后并发症总发生率为4.00%(2/50),明显低于开腹组患者的22.00%(11/50),差异有统计学意义(χ2=7.162,P=0.007)。(表4)
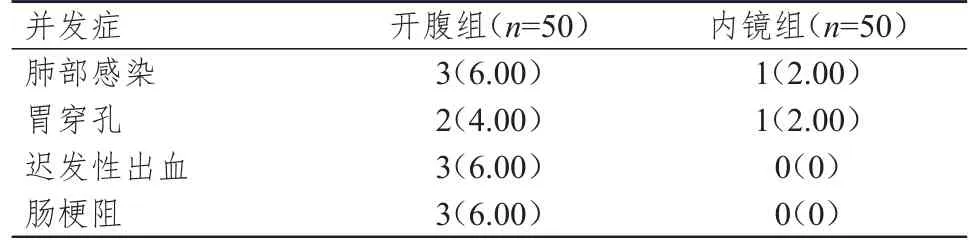
表4 两组患者的术后并发症发生情况[n(%)]
3 讨论
目前,开腹手术是早期胃癌的主要治疗方法,但该手术的切口较大、术中出血量较多,不利于手术的顺利实施。如何减轻患者的痛苦、提高术后生存率,成为临床研究的重点[7]。近年来,内镜技术逐渐应用于临床外科手术中,具有创伤小、出血量少的优点,患者的应激反应较小[8]。但内镜手术对患者肿瘤标志物的影响是否优于常规开腹手术,目前临床尚存在争议[9]。随着内镜器械不断的更新换代,内镜手术治疗早期胃癌的微创性和术后恢复迅速等优势已得到学术界的肯定[10]。与开腹手术相比,内镜手术对组织的解剖较为精细,可减少肿瘤细胞从淋巴管和血管脱落。本研究结果显示,内镜组术中临床指标改善情况优于开腹组,提示内镜黏膜下剥离术作为微创手术,对患者的创伤较小,可提高近期疗效。
内镜黏膜下剥离术是在内镜下黏膜切除术的基础上发展而来,通过内镜直接从黏膜下层剥离黏膜,从而完整切除大面积病变组织,尽管该手术的操作难度较高,对技术要求高,步骤繁琐,但与常规开腹手术相比,内镜黏膜下剥离术在保留器官完整性和预防复发方面有一定的优势[11]。内镜精准定位可为操作者提供良好的手术视野,减少肿瘤细胞脱落造成的腹腔种植,可加快患者的恢复进程,增强治疗效果[12]。既往研究报道显示,内镜黏膜下剥离术的整块切除率为96%,完整切除率为88%,术后患者的5年生存率高达100%,且手术创伤较小,为患者的康复创造了有利条件[13]。
本研究结果显示,手术后,内镜组患者血管活性肠肽、胃蛋白酶原Ⅱ、CEA、多巴胺脱羧酶、VEGF、CA19-9水平均低于开腹组,胃动素、胃蛋白酶原Ⅰ水平均高于开腹组,并发症总发生率低于开腹组。表明早期胃癌患者应用内镜黏膜下剥离术可有效切除肿瘤,促使胃肠功能恢复,降低肿瘤标志物水平和术后并发症发生率,与杨迅等[14]的研究结果相符。手术产生的创伤及各种外界环境刺激会诱发急性应激反应,手术容易刺激交感-肾上腺髓质系统释放大量儿茶酚胺,活化的巨噬细胞和中性粒细胞会激活多种炎性因子,引起炎症损伤,导致组织缺血、缺氧,出现代谢失调,影响患者的预后[15]。血管活性肠肽能够抑制消化道运动,胃动素能够加速胃排空和小肠蠕动[16]。内镜手术的手术创伤较小,可避免交感神经处于兴奋状态,减少对胃肠道的干扰,缩短肠麻痹时间,对胃肠动力的影响较小[17-18]。此外,内镜黏膜下剥离术的整块切除率较高,可有效改善胃壁受损的病理结构,恢复胃黏膜功能。胃癌手术过程中会有肿瘤细胞脱落于腹膜,这是胃癌患者术后腹膜种植转移的原因。CEA属于上皮源性肿瘤标志物,可评估游离肿瘤细胞;多巴胺脱羧酶与神经内分泌性质的肿瘤细胞生长有关;VEGF对促进肿瘤细胞的生长和转移有重要作用;CA19-9与胃癌肿瘤体积、浸润深度等病理特征有关[19-20]。内镜黏膜下剥离术可减少肿瘤细胞的脱落数量,彻底清除肿瘤病灶,并防止肿瘤复发。探讨早期胃癌患者术后肿瘤标志物水平能够帮助临床及时采取有效的治疗措施,降低肿瘤局部残留和术后复发率,有利于患者的预后。
综上所述,内镜黏膜下剥离术治疗早期胃癌的效果较好,可促使患者胃肠功能恢复,降低肿瘤标志物水平,减少术后并发症。
