西红花花瓣主黄酮的大孔吸附树脂纯化工艺研究
2022-12-05刘书蒙
洪 雨,李 论,刘书蒙,汪 豪
(中国药科大学 中药学院,江苏 南京 210009)
西红花为鸢尾科植物番红花Crocus sativusL.的干燥柱头,具有活血化瘀、凉血解毒、解郁安神之功效,用于治疗经闭癥瘕、温毒发斑、忧郁痞闷等症[1]。西红花药材产量低导致市场价格高昂,但是其生产过程中大量的副产物——西红花花瓣被作为农业废弃物丢弃[2],造成严重的资源浪费。为充分利用西红花资源,开发西红花花瓣药用价值,本研究对其活性成分黄酮类物质进行提取并纯化。
现有研究表明,西红花花瓣含有黄酮、酚酸、单萜、生物碱等成分,其中最主要的黄酮类成分为山柰酚-3-O-槐糖苷[3],具有明显的抗炎和抗氧化活性[4-9]。目前国内外关于西红花花瓣中黄酮类成分的提取和分离报道较少,尤其是针对主黄酮成分山柰酚-3-O-槐糖苷的纯化工艺尚未见报道。因此,本实验基于对西红花花瓣资源的综合利用,优化西红花花瓣中山柰酚-3-O-槐糖苷大孔吸附树脂纯化工艺,为该成分的后续开发研究提供技术参考。
1 材料与仪器
西红花花瓣购买于安徽省亳州市药材市场,经中国药科大学汪豪教授鉴定为西红花Crocus sativusL.的干燥花瓣;山柰酚-3-O-槐糖苷为本实验室自西红花花瓣中分离得到,经NMR、MS等确定结构,纯度>98.0%(HPLC-UV法,面积归一化法);HPD-100、HPD-450、HPD-600、AB-8、D101和ADS-17型大孔吸附树脂(沧州宝恩吸附材料科技有限公司);HPLC用甲醇为色谱纯;其它试剂均为分析纯。
XS105DU型电子天平(瑞士METTLER TOLEDO公司);TXB622L型电子天平(日本SHIMADZU公司);Agilent 1260型高效液相色谱仪(美国安捷伦科技公司);THZ-100B型恒温培养摇床(上海一恒科学仪器有限公司);PB-10型PH计(德国Sartorius公司)。
2 方法与结果
2.1 山柰酚-3-O-槐糖苷含量测定
2.1.1 色谱条件 Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 μm),流动相为0.2%甲酸(A)-甲醇(B),梯度洗脱程序见表1,流速:1.0 mL/min;检测波长:266 nm;柱温:40℃;进样量:10 μL。色谱图见图1。

图1 山柰酚-3-O-槐糖苷HPLC色谱图Fig. 1 HPLC of kaempferol-3-O-sophoroside

表1 梯度洗脱程序Tab. 1 Gradient elution program
2.1.2 对照品溶液制备 精密称取山柰酚-3-O-槐糖苷对照品适量,加60%甲醇溶解并定容至10 mL容量瓶中,摇匀,即得(山柰酚-3-O-槐糖苷质量浓度为1 604 μg/mL)。
2.1.3 供试品溶液制备 粉碎后的药材过40目筛,取样品粗粉约0.1 g,精密称定,精密加入60%甲醇25 mL,称重,室温下超声提取30 min,放冷,加60%甲醇补足失重,摇匀,滤过,取续滤液,即得。
2.1.4 线性关系考察 精密吸取对照品溶液适量,等比稀释配制质量浓度依次为160.4、80.2、40.1、20.05、10.03、5.01、2.51、1.25 μg/mL的溶液,滤过,取续滤液在“2.1.1”项色谱条件下进样测定。以山柰酚-3-O-槐糖苷质量浓度(X,μg/mL)为横坐标,峰面积(Y)为纵坐标进行线性回归,得到方程为Y= 23.27X+ 23.08(R2= 0.999 7),在1.25 ~160.4 μg/mL范围内线性关系良好。
2.1.5 精密度试验 取“2.1.4”项下溶液,注入色谱仪连续测定6次,测得山柰酚-3-O-槐糖苷峰面积RSD为0.47%,表明色谱仪精密度良好。
2.1.6 重复性试验 取同批药材的干燥粉末,按照“2.1.3”项平行制备供试品溶液6份,注入色谱仪检测,测得山柰酚-3-O-槐糖苷含量RSD为1.36%,表明该方法重复性良好。
2.1.7 稳定性试验 取“2.1.6”项下供试品溶液1份,分别于0、2、4、8、12、24 h进样测定,测得山柰酚-3-O-槐糖苷峰面积RSD为1.29%,表明溶液在24 h内稳定性良好。
2.1.8 加样回收率试验 取已知含量的同批药材干燥粉末,精密称定0.1 g,精密加入适量“2.1.2”项下对照品溶液,按“2.1.3”项制备供试品溶液,进样测定,测得山柰酚-3-O-槐糖苷平均加样回收率为101.03%,RSD为0.94%,表明该方法准确度较高。
2.2 单因素试验
2.2.1 上样液制备 取同批次西红花花瓣200 g,加入95%乙醇,料液比分别为1∶10、1∶8,加热回流提取两次,提取时间均为2 h,滤过,滤液合并,减压浓缩至100 mL(含生药2.0 g/mL),4℃冷藏备用。
2.2.2 大孔吸附树脂预处理 将树脂用95%乙醇浸泡过夜,淋洗至溶液无白色浑浊异物,再用纯水淋洗至无醇味,抽滤,备用。
2.2.3 大孔吸附树脂类型的筛选 分别称取预处理好的6种大孔吸附树脂各3 g,置于50 mL具塞锥形瓶中,加入西红花花瓣上样液(生药浓度为0.15 g/mL)各30 mL,置恒温摇床中振摇24 h(25℃,120 r/min),在“2.1.1”项色谱条件下测定吸附前后山柰酚-3-O-槐糖苷浓度。抽滤吸附后的树脂,并用少量纯水洗涤,各加入45%乙醇30 mL,置恒温摇床中振摇24 h(25℃,120 r/min),在“2.1.1”项色谱条件下测定解吸液中山柰酚-3-O-槐糖苷的浓度。计算静态吸附量、解吸量及解吸率[吸附量=上样液体积×(上样液初始质量浓度-吸附后上样液质量浓度)/树脂干重;解吸量=解吸液体积×解吸液质量浓度/树脂干重;解吸率=(解吸量/吸附量)×100%,吸附率=(吸附量/上样液总量)×100%][10]。结果显示,AB-8、HPD-100型大孔吸附树脂吸附量最高,但AB-8型的解吸量和解吸率低于HPD-100型大孔吸附树脂,故最终确定选用HPD-100型大孔吸附树脂,见图2。

图2 6种大孔吸附树脂对山柰酚-3-O-槐糖苷的静态吸附与解吸附性能Fig. 2 Adsorption and desorption capacity of kaempferol-3-Osophoroside on the six macroporous adsorption resins
2.2.4 静态吸附曲线绘制 称取HPD-100型树脂3 g,加入30 mL上样液,以25℃、120 rpm振摇12 h,分别在第0、2、4、6、8、10、12 h取样测定,绘制静态吸附曲线,见图3。在吸附的起始阶段,吸附速率快,吸附量随时间延长明显增大,随后吸附变慢,吸附平衡时间为4 h,最大吸附量为93.12 mg/g。

图3 HPD-100型树脂对山柰酚-3-O-槐糖苷静态吸附曲线Fig. 3 Static adsorption curve of kaempferol-3-O-sophoroside on HPD-100 resin
2.2.5 静态吸附等温线绘制 称取5份HPD-100型树脂于50 mL具塞锥形瓶中,每份3 g,加入30 mL不同浓度的上样液,分别在25、30、35、40、45℃下120 rpm振摇吸附12 h,进样测定,计算吸附量,绘制吸附等温线,见图4。随着温度的升高,同一初始质量浓度下的吸附量呈下降趋势,说明HPD-100型树脂吸附山柰酚-3-O-槐糖苷属于放热过程,适当降低温度有利于吸附。因此确定吸附温度为25℃。
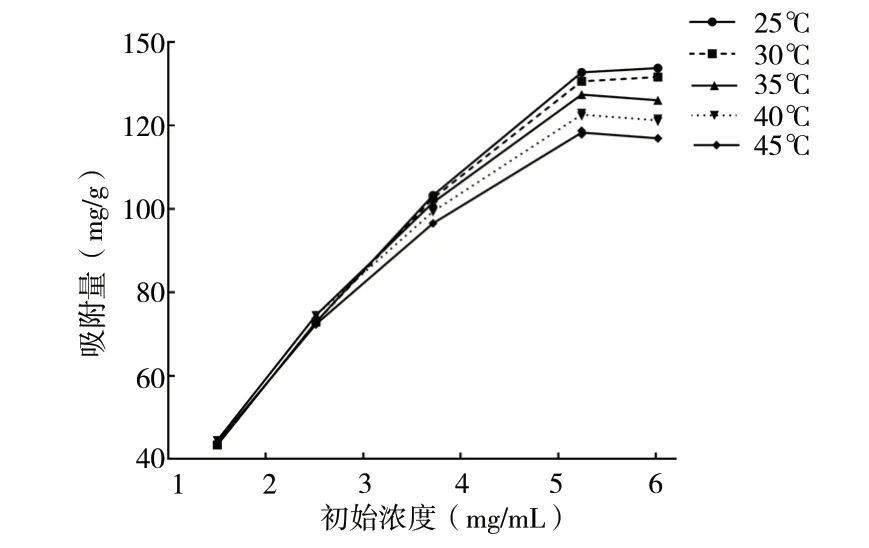
图4 HPD-100型树脂对山柰酚-3-O-槐糖苷的吸附等温线Fig. 4 Adsorption isotherms of kaempferol-3-O-sophoroside on HPD-100 resin
Langmuir和Freundlich吸附等温模型常用于描述吸附剂与被吸附物质的相互作用[11],图4中实验数据拟合结果见表2。由此可知,Langmuir和Freundlich两种模型都能较好地拟合吸附平衡数据,但Langmuir方程(R2>0.99)更合适,吸附过程更趋于单分子层吸附[12]。Freundlich模型中,常数1/n介于0.1 ~0.5之间,表明山柰酚-3-O-槐糖苷在HPD-100型树脂上的吸附过程易进行,为优惠型吸附[13]。

表2 Langmuir和Freundlich拟合方程Tab. 2 Regression equations of Langmuir and Freundlich adsorption isotherms
2.2.6 上样液pH筛选 使用10% HCl或4% NaOH溶液分别调节上样液的初始pH值为2、4、6、8,各取30 mL加入HPD-100型树脂3 g,在25℃恒温振摇12 h,进样测定,计算吸附量。结果上样液pH值2、4、6、8的吸附量分别为148.06、160.94、152.02、140.87 mg/g。由此可知,pH值为4时,HPD-100型树脂吸附量最大,其次是pH值为6,这是因为山柰酚-3-O-槐糖苷属于弱酸性化合物,在这个pH范围内主要以游离型存在,且酸性越强,游离型占比越大,山柰酚-3-O-槐糖苷通过范德华力被树脂吸附[14];而在pH值为2时,过酸导致山柰酚-3-O-槐糖苷析出,吸附量反而下降。综上考虑,上样液pH值选用4。
2.2.7 上样液质量浓度的筛选 称取HPD-100型树脂15 g,湿法装柱(2 cm×20 cm,1 BV = 40 mL),分别以1 BV/h将不同生药浓度(2.0、1.0、0.5、0.1 g/mL,pH = 4)的上样液加载于4根上述树脂柱,总上样量均相当于15 g生药,收集流出液,减压浓缩定容至50 mL,进样测定,计算吸附量和吸附率。结果显示,总上样量相同时,HPD-100型树脂对不同生药浓度(0.1 ~ 2.0 g/mL)上样液吸附率基本相同,均超过99%。但从上样效率考虑,上样浓度越大,上样体积越小,上样时间越短,因此选择生药浓度为2.0 g/mL的上样液以1 BV/h加载到HPD-100型大孔吸附树脂上。
2.2.8 泄露曲线绘制 称取HPD-100型树脂15 g,湿法装柱(2 cm×20 cm,1 BV = 40 mL),量取2.0 g/mL、pH = 4的上样液60 mL,上样流速为1 BV/h,每5 mL收集一管流出液,共收集12管,进样测定,绘制动态泄露曲线,见图5。在上样40 mL时,上样流出液中山柰酚-3-O-槐糖苷的浓度很低,几乎没有泄露;在上样45 mL时,开始泄露;继续上样,泄露量逐渐增加,上样50 mL时,泄露量达到山柰酚-3-O-槐糖苷初始质量浓度的10%,为保证上样液中该成分吸附完全,最佳上样量确定为40 mL,即1 BV。

图5 山柰酚-3-O-槐糖苷动态泄露曲线Fig. 5 Dynamic leakage curve of kaempferol-3-O-sophoroside
2.2.9 洗脱剂体积分数筛选 称取HPD-100型树脂5份,每份3 g,加入30 mL一定质量浓度的上样液,在恒温摇床上振摇12 h,抽滤。配制体积分数为15%、30%、45%、60%、75%的乙醇溶液,各取30 mL对吸附饱和的HPD-100型大孔吸附树脂进行解吸,在25℃下120 rpm振摇24 h,在“2.1.1”项色谱条件下测定吸附液和解吸液中山柰酚-3-O-槐糖苷浓度,计算解吸率。结果解吸率分别为38.38%、62.66%、78.54%、79.46%、71.39%,体积分数为45%和60%的乙醇溶液解吸率较高,且差别不大,根据经济性原则,选择体积分数为45%的乙醇溶液为洗脱剂。
2.2.10 洗脱曲线绘制 称取HPD-100型树脂15 g,湿法装柱(2 cm×20 cm,1 BV = 40 mL),设定上样液生药浓度2.0 g/mL,pH = 4,上样体积为40 mL,以1 BV/h上柱,先用纯水洗脱3 BV,流出液弃去,再以45%乙醇进行洗脱,流速为1 BV/h,每5 mL收集一管流出液,测定山柰酚-3-O-槐糖苷的浓度,绘制动态洗脱曲线,见图6。由此可知,45%体积分数乙醇洗脱的曲线峰形集中,没有明显拖尾,120 mL(3 BV)的洗脱剂即可将山柰酚-3-O-槐糖苷完全洗脱,故选择3 BV作为洗脱剂体积。

图6 山柰酚-3-O-槐糖苷的动态解吸曲线Fig. 6 Dynamic desorption curve of kaempferol-3-O-sophoroside
2.2.11 验证试验 根据上述各单因素实验结果确定最佳工艺条件为:上样液pH = 4,上样生药浓度为2.0 g/mL,上样体积为1 BV(40 mL),25℃下,1 BV/h加载到15 g处理好的HPD-100型大孔吸附树脂柱上,依次用纯水洗脱3 BV,45%乙醇洗脱3 BV,洗脱流速为1 BV/h,进行3次平行试验,收集45%乙醇洗脱部分,测定山柰酚-3-O-槐糖苷浓度。剩余洗脱液浓缩至干,称重,计算浸膏中山柰酚-3-O-槐糖苷的纯度和回收率,分别为57.4%和54.7%,RSD分别为1.54%和2.16%。纯化后的浸膏中山柰酚-3-O-槐糖苷的纯度提高到纯化前的8.61倍,可知此工艺条件下HPD-100型大孔吸附树脂对西红花花瓣中山柰酚-3-O-槐糖苷的富集效果和重复性良好。
3 讨论
长期以来,西红花花瓣被当成农业废弃物处理,但其含有丰富的黄酮类成分,尤其是抗炎抗氧化效果显著的山柰酚-3-O-槐糖苷,具有可观的开发潜力。大孔吸附树脂是一种人造的聚合物吸附剂,其球形内部含有无数立体网状孔穴结构,具有表面电性或氢键而具有吸附性[15],并且其理化性质稳定、成本低、比表面积大、吸附容量大、有选择性和吸附速度快,已广泛应用于黄酮类化合物的分离纯化[16]。因此本实验中采用大孔吸附树脂对西红花花瓣中山柰酚-3-O-槐糖苷进行富集。在大孔吸附树脂筛选实验中,HPD-100型树脂对山柰酚-3-O-槐糖苷吸附率和吸附量最大,这与大孔吸附树脂的极性、孔径、比表面积等性质有关[12]。HPD-100型树脂为弱极性树脂,与被吸附的山柰酚-3-O-槐糖苷的极性接近,且HPD-100型树脂的比表面积在6种大孔吸附树脂中最大,比表面积越大越有利于吸附[17],故HPD-100型大孔吸附树脂吸附性能最佳。
本实验通过单因素法优选出了利用大孔吸附树脂纯化西红花花瓣主黄酮成分山柰酚-3-O-槐糖苷的工艺条件,有效提高了提取物中山柰酚-3-O-槐糖苷的纯度,为后续活性研究提供了物质基础。但是本实验得到的最佳工艺是实验室优化的结果,对于山柰酚-3-O-槐糖苷工业生产时如何上样与洗脱还需结合实际生产条件进一步探索。
4 结论
本研究最终确定的纯化工艺为:以生药浓度2.0 g/mL西红花花瓣提取液(pH = 4),25℃下1 BV/h 加载到15 g预处理好的HPD-100型大孔吸附树脂柱上,上样体积为40 mL,先用纯水洗脱3 BV,再以45%乙醇洗脱3 BV,洗脱流速为1 BV/h,收集45%乙醇洗脱部分。纯化后的浸膏中山柰酚-3-O-槐糖苷的纯度达到57.40%,是西红花花瓣粗提物的8.61倍,此工艺对西红花花瓣中山柰酚-3-O-槐糖苷的富集效果良好,且简单、稳定、可行。
