低温胁迫下红榄李(Lumnitzera littorea)DEAD-box RNA 解旋酶基因的表达分析
2022-12-05郝露露柯明思朱奕秀许燕敏张颖郑春芳
郝露露, 柯明思, 朱奕秀, 许燕敏, 张颖,3, 郑春芳
1. 温州大学生命与环境科学学院, 浙江 温州 325035;
2. 岭南师范学院生命科学与技术学院, 广东 湛江 524048;
3. 海南省林业科学研究(海南省红树林研究院), 海南 海口 571129
RNA 解旋酶是一类利用ATP 结合或修饰RNA和RNA-蛋白质复合物的高度保守的酶(Tanner et al,2001; Linder et al, 2011), 参与复制、修复、重组和转录等众多生命代谢活动(Anantharaman et al,2002)。DEDA-box 家族是现今发现的最大的RNA解旋酶家族(Fairman-Williams et al, 2010), 在植物的生长发育(Lorković et al, 1997; Jacobsen et al, 1999;Stonebloom et al, 2009)、抗病(Li et al, 2008)和抗逆(Gollan et al, 2015; Nawaz et al, 2018a)等生命过程中都具有非常重要的作用。作为最大的解旋酶家族,多项研究证明DEAD-box 家族基因参与植物的非生物胁迫响应过程(Nishimura et al, 2010; Tuteja et al,2013; Nawaz et al, 2018a), 番 茄 (Solanum lycopersicum)中SIDEAD31 通过调控干旱胁迫和盐胁迫相关的抗性基因的表达, 从而提高植物的抗逆性(Zhu et al, 2015); 水稻(Oryza sativa) 中OsDEAD58 能够通过影响叶绿素的翻译提高水稻的抗盐性和抗寒性(Nawaz et al, 2019); 水稻中PDH45 通过增强超氧化物歧化酶、过氧化氢酶、愈创木酚过氧化物酶等各种抗氧化酶的活性来提高植物的耐盐性(Tuteja et al, 2013); 拟南芥(Arabidopsis thaliana)中MH1 通过增强活性氧(reactive oxygen species, ROS)的清除能力和渗透调节能力, 从而提高自身的抗旱性和耐盐性(Luo et al, 2009); 拟南芥中RH7 影响rRNA 的加工调控低温胁迫下植物正常的生长发育(Liu et al, 2016)。由于DEAD-box RNA解旋酶具有多重作用(陈丹 等, 2016; 蔡敬 等,2017), 目前已成为研究植物抗逆性的良好基因家族(Vashisht et al, 2006; Nidumukkala et al, 2019)。
红榄李(Lumnitzera littorea)为使君子科, 榄李属红树植物, 在中国仅分布在海南省(张颖 等,2018)。该物种极不耐低温, 分布地狭窄, 野生种数量9 棵, 均生长于海南三亚铁炉港红树林保护区(钟才荣 等, 2011)。由于数量少、繁殖力低, 目前已经被列为国家一级重点保护植物(张颖 等, 2021)。在红榄李的生长过程中, 低温不仅是限制其纬度分布的环境因子, 而且是人工育种和生态修复的一大难题。培育适应低温环境的红榄李种苗对红榄李生态修复具有重要意义。
本研究基于低温胁迫下红榄李幼苗差异表达的DEAD-box 解旋酶家族基因的分析, 筛选出 4 个DEAD-box 解旋酶基因:LlDEAD12、LlDEAD32、LlDEAD43和LlDEAD65, 通过生物信息学分析及荧光定量PCR 检测技术分析揭示这4 个基因的生物学特性及在低温胁迫下的分子响应机制, 为红榄李的人工辅助育种及培育耐冷植物材料奠定基础。
1 材料与方法
1.1 实验材料和材料处理
红榄李样品采集自三亚铁炉港红树林自然保护区。2021 年6 月取自然生长条件下红榄李不同的组织(根、茎、叶、花、果)于液氮中速冻, 然后保存在–80℃的超低温冰箱中备用。
选取长势良好, 株高30±2cm 的一年生红榄李幼苗作为实验材料, 选取生长状态相同的红榄李幼苗分别在温度34/30℃、25/23℃、15/12℃和8/5 ℃,相对湿度为50%/70%、光照强度为80%, 12h/12h(日/夜)的植物冷光源气候培养箱(LRG-450-LED, LV BO, 中国)中培养48h 后, 立即用液氮速冻幼苗的根、茎、叶, 混样后保存在–80℃的超低温冰箱中。每个处理设置3 个生物学重复。
1.2 生物信息学分析
蛋白质理化特性的分析所用软件及网址见表1。以DEAD-box 为关键词, 在NCBI (national center for biotechnology information, https://www.ncbi.nlm.nih.gov/) 数据库搜索并下载同源氨基酸序列,运用ClustalW 进行同源序列的比对, 利用MEGA X 软件最大似然法(maximum likelihood method) 构建分子进化树(Kumar et al, 2018)。
1.3 基因特异性表达分析
植物组织材料用植物RNA 提取试剂盒(艾德莱,中国, RN53)根据说明书进行RNA 的提取。1%的琼脂糖凝胶电泳检测RNA 的完整性, 用超微量分光光度计(丹诺尔, 中国, DS-11)检测RNA 的浓度, 检测合格的RNA 用于后续实验。
用 HiScript QRT SuperMix for qPCR(+gDNA wiper)(诺唯赞, 中国, R123-01)合成cDNA 的第一条链。根据核酸序列, 设计用于荧光定量PCR 检测实验的特异性引物, 引物序列见表2。

表2 qPCR 引物序列Tab. 2 Primer sequence of qPCR
用SYBR® Select Master Mix (2X)(4472908)试剂盒在StepOnePlusTM实时荧光定量PCR 仪(ABI,美国, QS1) 进行测定。反应体系如表3, 每个处理3个生物学重复。利用 2-ΔΔCT算法计算相对表达量(Livak et al, 2001), 用SPSS 进行显著性分析, 用Origin 2018 软件作图。

表3 qPCR 反应体系Tab. 3 qPCR reaction system
2 结果分析
2.1 红榄李DEAD-box 蛋白的理化性质分析
等电点预测分析表明LlDEAD12、LlDEAD32、LlDEAD43 和LlDEAD65 都是酸性蛋白; 稳定指数和亲水性总平均值预测分析表明LlDEAD43 是稳定的疏水蛋白, 而 LlDEAD12、LlDEAD32 和LlDEAD65 是不稳定的疏水蛋白(表4)。
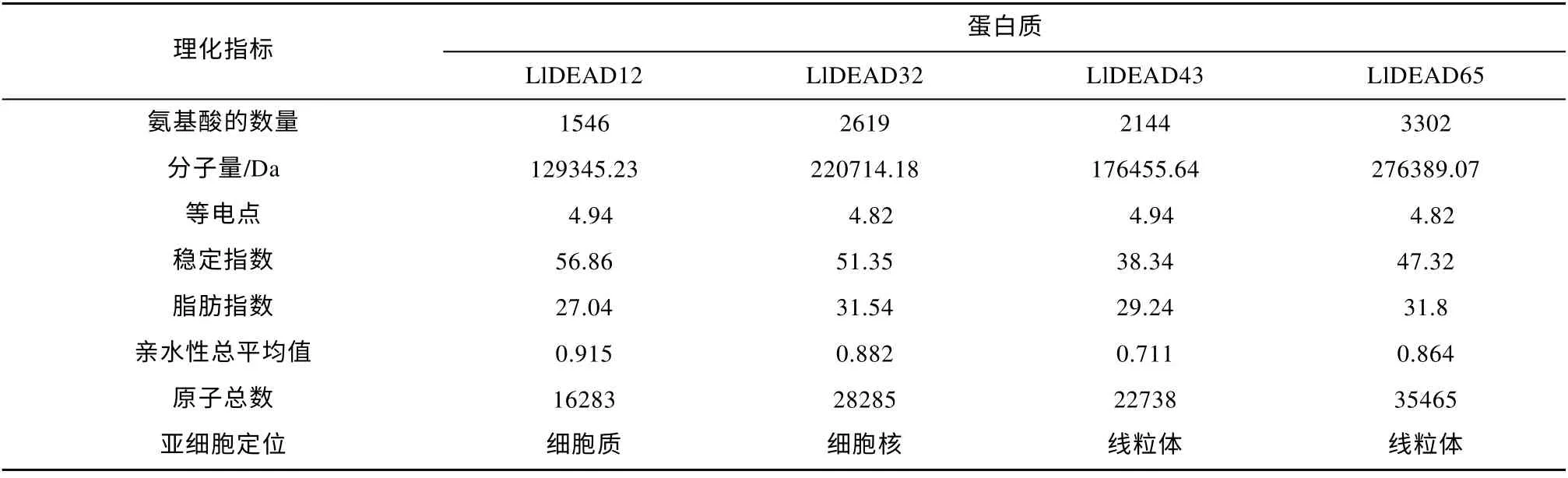
表4 红榄李DEAD-box 蛋白理化性质分析及亚细胞定位分析Tab. 4 Physicochemical property and subcellular localization
2.2 红榄李DEAD-box 蛋白的亲水性和疏水性预测分析
利用ProtScale 分析4 个蛋白质的亲水性(图1),y轴以0 为界限, 0 以上, 值越大表示该氨基酸的疏水性越强; 0 以下, 值越小表示亲水性越强。分析结果表明, LlDEAD12、LlDEAD32、LlDEAD43 和LlDEAD65 亲水性最高的位点分别是87、91、192和192 位置上的氨基酸; 疏水性最强的位点分别为271、14 和15、62、55 位置上的氨基酸, 并且这4个蛋白质的亲水性总平均值都大于0, 表明这4 个蛋白质都属于疏水性蛋白, 此结果与等电点预测分析结果相同。
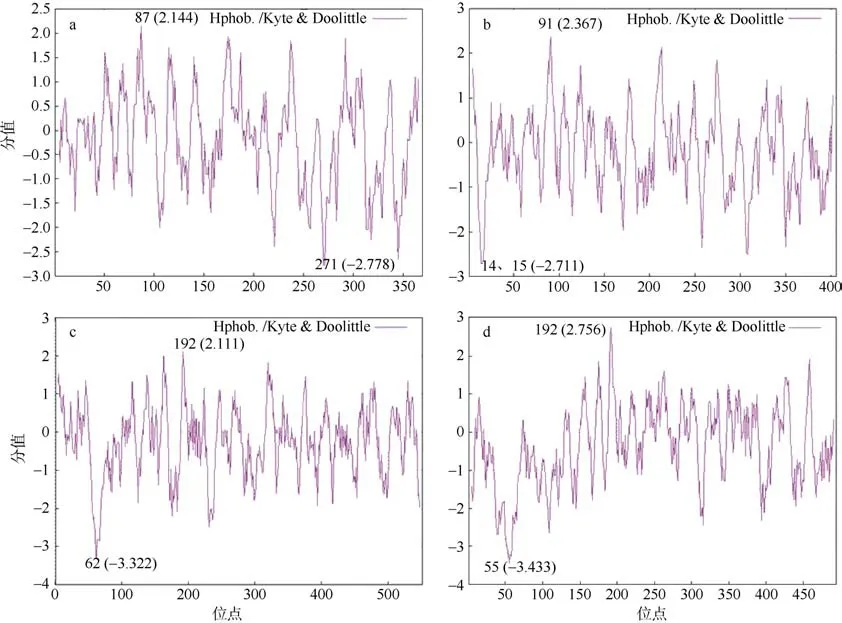
图1 红榄李DEAD-box 蛋白质的亲水性分析a. LlDEAD12; b. LlDEAD32; c. LlDEA43; d. LlDEAD65Fig. 1 Hydrophilic analysis of proteins. (a) LlDEAD12; (b) LlDEAD32; (c) LlDEA43; (d) LlDEAD65
2.3 红榄李DEAD-box 蛋白的二级结构和三级结构
蛋白质二级结构的预测表明: 4 个蛋白质的二级结构均由α-螺旋、β-转角、延伸链和无规则卷曲组成,其中LlDEAD12 和LlDEAD32 的二级结构主要由α-螺旋和无规则卷曲组成, 占到全部组成结构的42.82%; LlDEAD43 和LlDEAD65 的二级结构组成结构最多的是无规则卷曲, 分别占 44.28%和40.69%(图2、表5)。
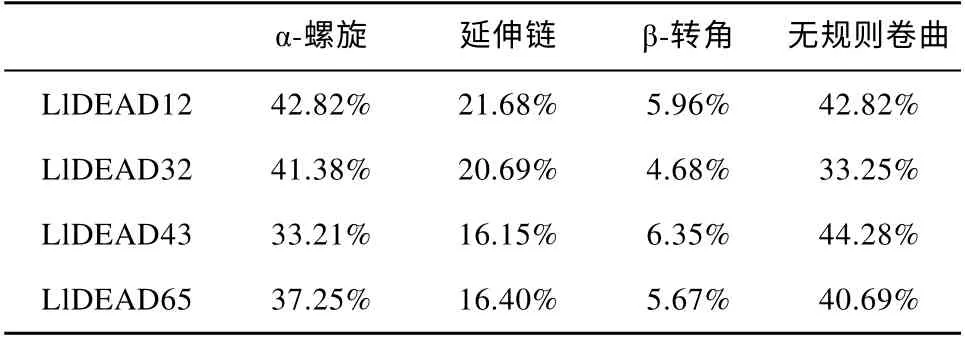
表5 DEAD-box 蛋白质的二级结构类型及占比Tab. 5 Secondary structure types and percentages of DEAD-box proteins
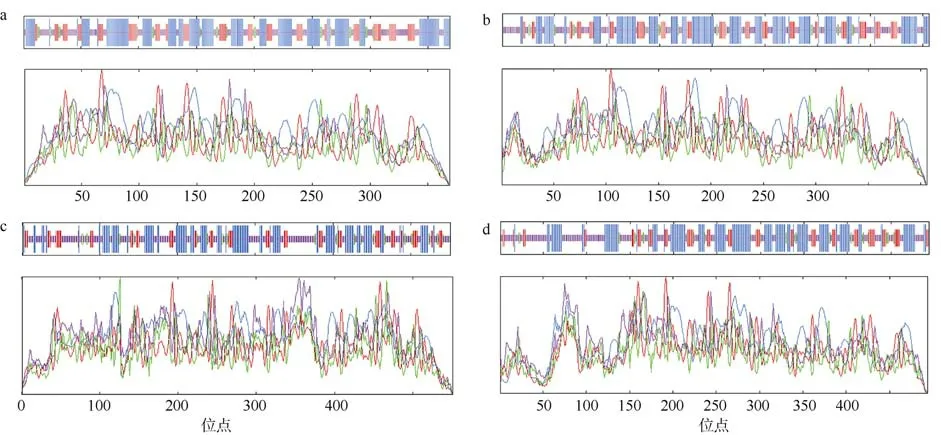
图2 DEAD-box 蛋白质的二级结构预测a. LlDEAD12; b. LlDEAD32; c. LlDEA43; d. LlDEAD65。图中蓝色的方块和线条代表α-螺旋; 绿色的方块和线条代表β-折叠; 黄色的方块和线条代表无规则卷曲; 红色的方块和线条代表延伸链Fig. 2 Predicted secondary structure of DEAD-box protein. (a) LlDEAD12; (b) LlDEAD32; (c) LlDEA43; (d) LlDEAD65.Blue squares and lines in the figure represent α-helices; green squares and lines represent β-sheets; yellow squares and lines represent random coils; red squares and lines represent extended chains
LlDEAD12 的三级结构以Pdcd4-eIF4A 的晶体结构为模板构建模型, 序列相似度为 80.49%, 预测结果质量较高; LlDEAD32 以4A-III 过渡态EJC的晶体结构为模板构建模型, 序列相似度为78.22%, 预测结果较好; LlDEAD43 以ATP 依赖性DEAD-box RNA 解旋酶CshA 为模板, 序列相似度为36.06%, 预测质量较差; LlDEAD65 以ATP 依赖性DEAD-box RNA 解旋酶DHH1 为模型, 序列相似度为70.62%, 预测质量较好。这4 个蛋白的三级结构的预测主要包括α-螺旋、延伸链、β-转角和无规则卷曲这4 种结构(图3), 预测结果与二级结构的预测结果一致。

图3 DEAD-box 蛋白质的三级结构预测Fig. 3 3D structure prediction of DEAD-box protein
2.4 跨膜结构和信号肽预测
跨膜结构和信号肽预测表明 LlDEAD12、LlDEAD32、LlDEAD43 和LlDEAD65 均不含跨膜结构和信号肽, 说明这4 个蛋白均属于非分泌蛋白(图4); 并且这4个蛋白N-端位于细胞质中侧膜的总概率分别为0.00281、0.00528、0.00074、0.00413(图5)。
图4 DEAD-box 蛋白的跨膜结构预测蓝色线条表示该氨基酸序列在膜内的可能性为0, 在膜外的可能性为100%Fig. 4 Predicted transmembrane structure of DEAD-box protein. The blue line in the figure indicates that the probability of the amino acid sequence in the membrane is 0, and the probability of being outside the membrane is 100%.

图5 DEAD-box 蛋白的信号肽预测Fig. 5 Signal peptide prediction of DEAD-box protein
2.5 糖基化位点和磷酸化位点预测
根据糖基化位点的预测分析(图6), LlDEAD12在355 号位上有一个糖基化位点, LlDEAD32 在296位上有一个糖基化位点, LlDEAD43 在229、358 和413号位上分别有一个糖基化位点, LlDEAD65 在166和358 号位上各有一个糖基化位点。

图6 DEAD-box 蛋白质的糖基化和磷酸化位点预测Fig. 6 Predicted glycosylation and phosphorylation sites of DEAD-box proteins
LlDEAD12一共有11个丝氨酸磷酸化位点, 16个苏氨酸磷酸化位点; LlDEAD32 一共有18 个丝氨酸磷酸化位点、17 个苏氨酸磷酸化位点、2 个酪氨酸磷酸化位点;LlDEAD43 一共有36 个丝氨酸磷酸化位点、18 个苏氨酸磷酸化位点; LlDEAD65 一共有17 个丝氨酸磷酸化位点、13 个苏氨酸磷酸化位点、7 个酪氨酸磷酸化位点。
2.6 蛋白多序列比对和系统进化
比较分析红榄李 LlDEAD12、LlDEAD32、LlDEAD43 和LlDEAD65 与其他植物的DEAD-box家族蛋白的亲缘关系, 表明与LlDEAD12 进化关系最近的植物是马尾松的eIF4A2, 和LlDEAD32 进化关系最近的是巨桉的eIF4A3, LlDEAD43 进化关系最近的是石榴的RH47(图7)。
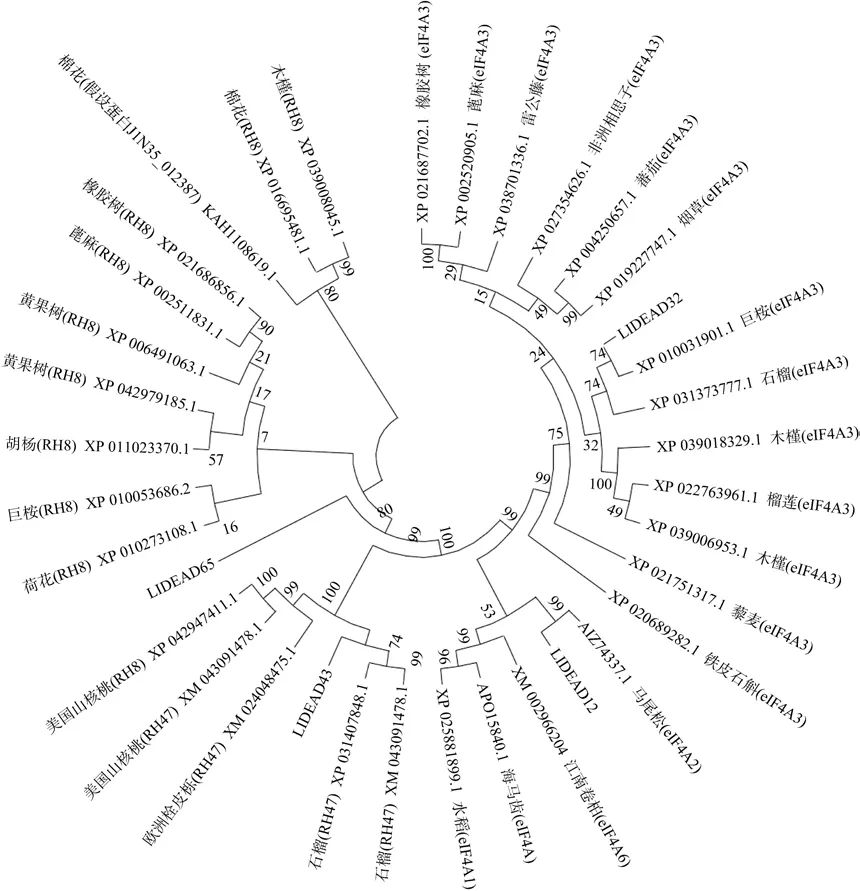
图7 DEAD-box 蛋白质的进化关系分析此分子进化树是利用MEGA X 进行构建的。分支上的数值表示可信度为1000 次重复节点的BootstrapFig. 7 Evolutionary relationship analysis. This molecular phylogenetic tree was constructed using MEGA X. The numbers on the branches represent the reliability percent of bootstrap values based on 1000 replication
2.7 特异性表达分析
在各组织的特异性表达中,LlDEAD12和LlDEAD32在叶中高表达,LlDEAD43和LlDEAD65在茎和花中高表达, 在花中的表达量略高于茎中,且这4 个基因在根中都不表达(图8)。在红榄李响应低温胁迫的过程中, 这4 个基因的表达量都显著低于常温条件下的表达量, 且随处理温度的降低, 表达量降低(图9)。
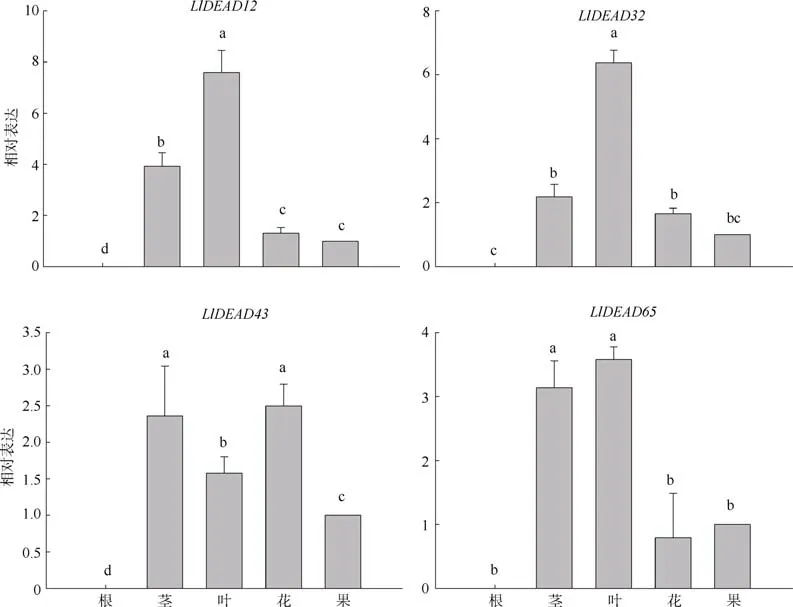
图8 DEAD-box 基因在不同组织的相对表达水平不同字母表示具有显著性差异(P<0.05)Fig. 8 Relative expression levels of DEAD-box genes in different tissues. a, b, c indicate significant differences in P<0.05
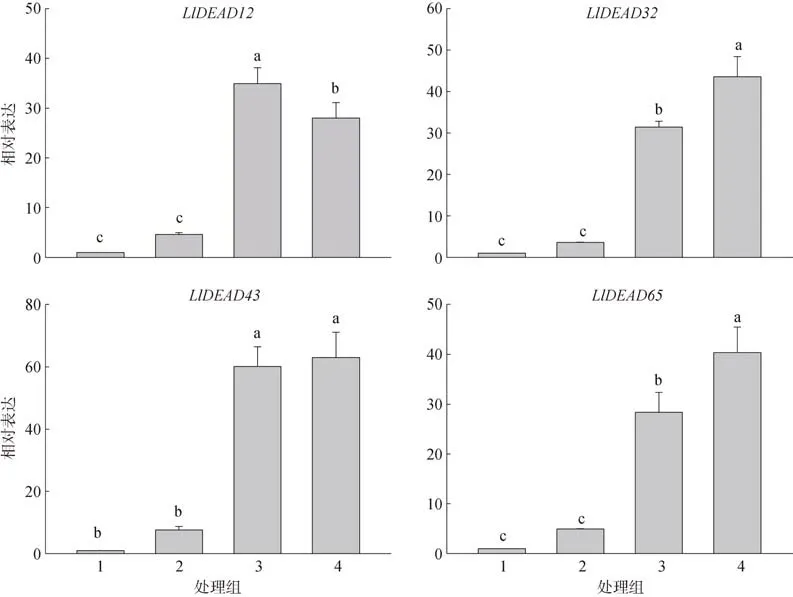
图9 DEAD-box 基因在不同温度下的相对表达水平第1 处理温度为8/5 ℃; 第2 组处理温度为15/12 ℃; 第3 组处理温度为25/23 ℃; 第4 组处理温度为34/30℃。不同字母表示具有显著性差异(P<0.05)Fig. 9 Relative expression levels of DEAD-box genes at different temperatures. Group 1 treated at 8/5°C; Group 2 treated at 15/12°C; Group 3 treated at 25/23°C; Group 4 treated at 34/30°C. a, b, c indicate significant difference in P<0.05
3 讨论
DEAD-box 基因在细胞中的位置与其发挥的生理功能密不可分(铁原毓 等, 2021)。在前人的研究中, PMH1(AtRH9)和PMH2 作为一种线粒体蛋白,在低温胁迫下能够通过形成RNA 的高分子蛋白复合体来维持线粒体功能的稳定(Cordin et al, 2006;Matthes et al, 2007; Köhler et al, 2010)。通过亚细胞定位红榄李LlDEAD43 和LlDEAD65 位于线粒体中,推测其功能可能与PMH1 和PMH2 相近, 维持低温胁迫后植物体中线粒体行使正常的功能。已有研究表明, 位于细胞核边缘的AtRH38 与核孔复合体的成员相互作用, 参与mRNA 从细胞核向细胞质的运输, 在低温胁迫中起积极作用(Gong et al, 2005;Linder et al, 2011; Braud et al, 2012); 位于细胞核的ZmDRH1 通过与RNA 结合蛋白MA16 相互作用, 在核糖核蛋白的组成与核糖体RNA 的代谢过程中发挥作用(Li et al, 2001; Seki et al, 2001)。红榄李LlDEAD32 的亚细胞定位在细胞核上, 推测其可能参与核糖体的生物发生。定位于叶绿体的DEAD-box 基因AtRH39 与叶绿体调控的光合蛋白的翻译相关, AtRH39 的突变体会表现出叶片失绿(Nishimura et al, 2010); 同样位于叶绿体的RH3 和RH22 参与叶绿体中核糖体的组装, 在质体分化成含有叶绿素的叶绿体中具有重要作用, 是植物幼苗进行光合作用的基础(Chi et al, 2012; Asakura et al,2012; Nawaz et al, 2018b)。红榄李LlDEAD12 位于细胞质, 可能参与 mRNA 的加工和蛋白的合成(Linder et al, 2011)。为了验证亚细胞定位预测的正确性以及功能预测的可靠性, 后续会通过亚细胞定位分析的方法加以确定。
DEAD-box 蛋白在植物的生长发育过程中通过磷酸化修饰来发挥自身的作用(Webster et al, 1991;op den Camp, 1998; Vashisht et al, 2005; Linder,2006); 在植物受到逆境胁迫形成应激颗粒的过程中也涉及到eIF2α 的磷酸化修饰(Anderson et al, 2006;Mazroui et al, 2006), 表明DEAD-box 蛋白自身功能的实现受到其他调控因子的调控。在对修饰位点的预测结果中, 这4 个蛋白含有多个糖基化位点和磷酸化位点, 表明这4 个RNA 解旋酶也是通过多种修饰作用后发挥作用。 通过功能域的预测,LlDEAD12、LlDEAD32、LlDEAD43、LlDEAD65不含有跨膜结构域和信号肽, 表明这4 个蛋白是在各自存在的细胞器中发挥作用的非分泌蛋白。
通过系统进化树分析, LlDEAD12 与马尾松的eIF4A2 具有较近的亲缘关系, LlDEAD32 与巨桉的eIF4A3 具有较近亲缘关系, LlDEAD43 与石榴的RH47 具有较近亲缘关系。这些具有较近亲缘关系的物种的原产地均为热带、亚热带地区(Oberschelp et al, 2020; Ren et al, 2020; Ge et al, 2021; Chen et al,2021), 而红榄李是典型的分布于热带、亚热带地区的植物, 表明地理位置相近的物种的基因序列具有较高的相似性, 环境是影响基因进化的另一重要因素(Zhang et al, 2016)。
对红榄李的4 个基因进行实时荧光定量PCR 分析, 发现各个基因的表达具有明显的组织特异性。LlDEAD12和LlDEAD32在叶中高表达, 其功能可能与TCD33 的功能相似, 参与低温胁迫下植物叶绿体的发育和叶绿体核糖体的组装(孔荣荣, 2019)。LlDEAD43和LlDEAD65在茎和花中高表达, 在花中的表达量略高于茎, 其功能可能与花发育相关(Western et al, 2002)。不同温度处理下的实时荧光定量PCR 检测发现, 各个基因的表达量具有很大区别,低温胁迫的程度越严重, 基因的表达量越低。与25 ℃/23 ℃的培养条件相比, 红榄李受到15/12℃的低温胁迫时LlDEAD12、LlDEAD32、LlDEAD43、LlDEAD65的表达量分别降低了7.59、8.73、7.94、5.74 倍, 受到更严重的低温胁迫(8 ℃ /5 ℃)时分别降低了34.93、31.41、60.17、28.35 倍。这与前人在拟南芥、番茄等物种中对DEAD-box 基因的研究相反(Seki et al, 2001; Cordin et al, 2006; Matthes et al,2007; Kim et al, 2008), 但与拟南芥中发现的At5g08610 及At1g59990 两个基因在冷胁迫环境下转录水平发生下调的研究结果相同(Kreps et al,2002), 造成这种结果的原因可能是物种间的差异性产生的。
通过上述研究证明,LlDEAD12、LlDEAD32、LlDEAD43和LlDEAD65在红榄李中参与了对茎、叶、花、果等组织器官的调控以及对低温胁迫的响应, 为红榄李的抗寒研究提供了方向。在后续实验中, 有必要通过转基因的方法对这些基因的功能进行验证, 进一步揭示其在低温胁迫响应过程中的分子机制。
