高分辨T2WI联合DWI鉴别肠壁内外直肠腺癌价值研究
2022-12-05张晓金齐东华
过 永,杜 涛,张晓金,张 祥,齐东华,张 虎
国际、国内诊疗管理指南推荐使用MRI对直肠癌进行术前分期诊断[1,2],并推荐采用高分辨T2加权成像(high resolution T2-weight imaging,HR-T2WI)作为术前分期的主要扫描序列,但该序列在鉴别肿瘤组织与增生反应的炎症组织、纤维化组织中的准确度不尽如人意[3,4]。准确区分直肠癌T分期对治疗决策和患者预后均有重要影响,2018版美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)发布指南指出[5],对于无淋巴结和远处转移的局限于肠壁内的T1和T2期直肠癌可直接采用直肠癌根治术,而突破肠壁的T3和T4期肿瘤术前应采取新辅助放化疗(neoadjuvant chemoradiotherapy,nCRT),再行根治性手术切除。
肠壁内外直肠癌的治疗决策和预后均存在差异,而术前鉴别诊断主要依赖MRI检查,扩散加权成像(diffusion weighted imaging,DWI)可反映活体组织中水分子的随机运动,细胞间水分子的随机运动是否受限反映了组织结构的特性,其被广泛应用于肿瘤的术前检测。目前将HR-T2WI和DWI联合应用鉴别肠壁内外直肠癌的相关研究报道较少,笔者研究主要探讨HR-T2WI联合DWI鉴别肠壁内外直肠腺癌的价值,并与单独使用HR-T2WI进行比较,旨在进一步提高对直肠腺癌术前评估的认识。
1 资料与方法
1.1 临床资料
选择2018年7月至2021年10月在芜湖市第二人民医院住院治疗的直肠腺癌患者92例,其中男性61例,女性31例;年龄39~87岁,平均年龄66.82岁(标准差9.78岁);其中黏液腺癌12例;隆起型41例,溃疡型51例。
选择标准:①所有患者均行HR-T2WI和DWI扫描,图像质量满足研究要求;②MRI检查1周内行直肠腺癌根治术,手术病理检查资料完整;③所有患者术前均未行任何针对直肠癌的放化疗;④检查前签署知情同意书。
排除标准:①MRI检查禁忌,不能配合完成检查;②MRI图像质量不满足研究要求或病理检查资料不完整。
1.2 方法
1.2.1 MRI扫描方法
所有患者均在荷兰PHILIPS ACHIEVA 3.0 T MRI扫描系统完成检查,运用SENSE-XL-Torso 16通道体部相控阵线圈。检查前禁食4 h以上,排空直肠,膀胱适度充盈,并对患者行呼吸训练。DWI扫描范围从肾门水平至肛门,采用单次激发平面回波成像(single-shot echo-planar imaging,ss-EPI)序列,b值取0、800 s/mm2,重复时间(repetition time,TR)3 170 ms,回波时间(echo time,TE)50 ms,层厚5 mm,层间距0.5 mm,视野(field of view,FOV)300 mm×250 mm,矩阵100×82,平均次数3次,扫描时间1 min 42 s。HR-T2WI不压脂,横轴面垂直病灶扫描,冠状面平行肛管扫描,扫描范围包括整个病灶。HR-T2WI采用快速自旋回波(turbo spin echo,TSE)序列,TR 3 200 ms,TE 80 ms,层厚3 mm,层间距0 mm,FOV 200 mm×200 mm,矩阵280×256,平均次数2次,扫描时间4 min 12 s。
1.2.2 图像分析
图像传至荷兰PHILIPS Release v7.0.4工作站进行处理,甲乙两名从事腹部MRI诊断工作(5年以上工作经验)的医师分别运用HR-T2WI图像进行直肠腺癌T分期诊断;1周后分别运用HR-T2WI联合DWI图像重新进行诊断(图1、2)。HR-T2WI和DWI图像显示直肠壁内侧出现肿瘤信号,与固有肌层分界清楚,诊断为T1期;肿瘤延伸入肠壁肌层或与肌层分界不清,肠壁外缘光整,无变形,诊断为T2期;肠壁外缘不光整,结节状凸起并广基底与肠壁相连,肿瘤直接延伸至邻近系膜脂肪组织内,诊断为T3期;肿瘤侵犯直肠系膜筋膜、腹膜或邻近器官,诊断为T4期。T1和T2期归为肠壁内组,T3和T4期归为肠壁外组。
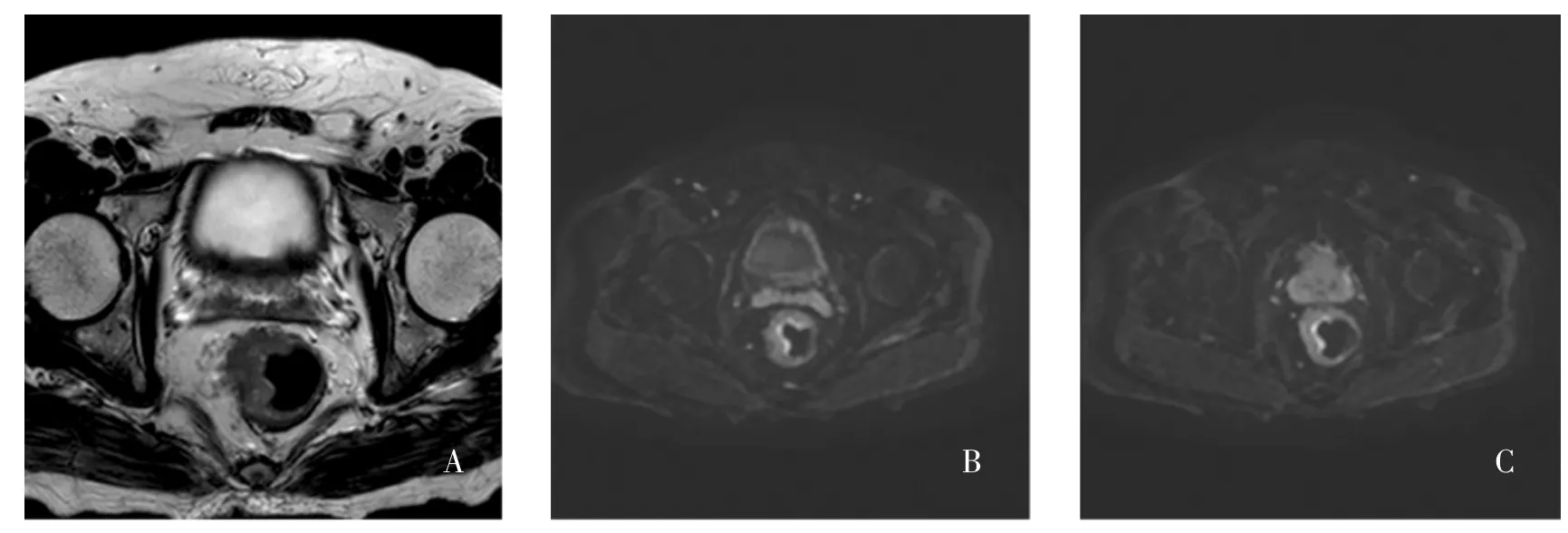
图1 T2期肠壁内直肠腺癌HR-T2WI和DWI图像Fig.1 HR-T2WI and DWI images of T2 rectal cancer interior intestinal wall
1.2.3 病理组织检查
术后组织标本需经10%甲醛溶液浸泡,石蜡包埋固定,苏木精-伊红(hematoxylin-eosin,HE)染色。在光学显微镜下评估癌组织浸润深度并进行病理T分期诊断:T1期,肿瘤侵至黏膜下层;T2期,肿瘤侵犯固有肌层;T3期,肿瘤穿透肌层或侵犯周围无腹膜覆盖的直肠旁组织;T4期,肿瘤穿透脏层腹膜或直接侵犯周围器官。
1.3 统计学方法
采用SPSS 23.0和Medcalc 15.0统计学软件进行分析。Kappa分析甲乙医师诊断结果的一致性,以Kappa系数为0.61~0.80为一致性较强,0.81~1.00为一致性很强。采用受试者工作特性(receive operating characteristic,ROC)曲线分析分别运用HR-T2WI、HR-T2WI联合DWI诊断肠壁内外直肠腺癌的诊断效能,以曲线下面积(area under curve,AUC)0.70~0.90为诊断价值中等,AUC>0.90为诊断价值较高,并计算灵敏度和特异度。采用Delong检验分别比较甲乙两位医师采用不同方法诊断效能间的差异。P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
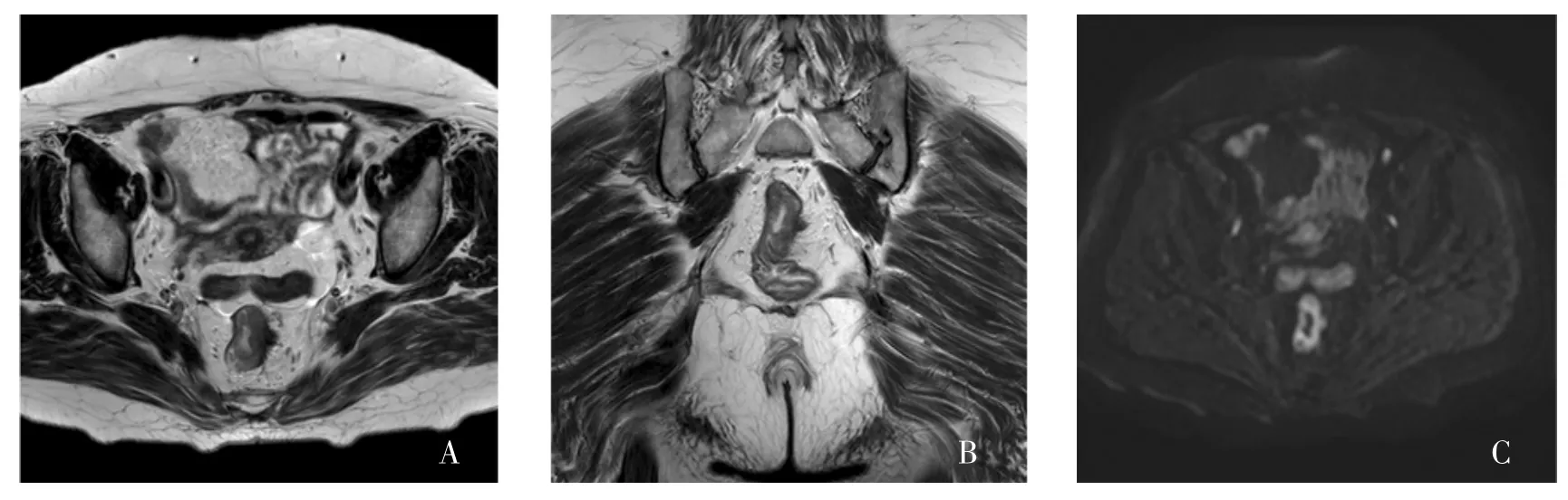
图2 T3期肠壁外直肠腺癌HR-T2WI和DWI图像Fig.2 HR-T2WI and DWI images of T3 rectal cancer exterior intestinal wall
2 结果
2.1 术后病理诊断分期结果
术后病理诊断结果显示,直肠腺癌T1期4例,T2期32例,T3期51例,T4期5例。T1期和T2期为肠壁内组(36例),T3期和T4期为肠壁外组(56例)。
2.2 影像诊断结果
以术后病理诊断为金标准,甲乙医师运用HRT2WI诊断T1、T2、T3、T4期直肠腺癌正确例数分别依次为2/4例、2/4例,17/32例、19/32例,40/51例、38/51例,4/5例、4/5例;HR-T2WI联合DWI正确例数分别依次为2/4例、2/4例,28/32例、29/32例,48/51例、48/51例,5/5例、4/5例。
2.3 一致性分析
甲乙医师运用HR-T2WI诊断肠壁内外直肠腺癌一致性较高,Kappa值为0.757,95%可信区间(confidence interval,CI)为0.616~0.898,P<0.001;甲乙医师运用HR-T2WI联合DWI诊断肠壁内外直肠腺癌的一致性很高,Kappa值为0.909,95%CI为0.821~0.997,P<0.001。
2.4 HR-T2WI单独和联合诊断效能分析
甲乙医师单独运用HR-T2WI诊断肠壁内外直肠腺癌的价值中等,AUC值分别为0.720(95%CI 0.608~0.833),P<0.001;0.753(95%CI 0.646~0.860),P<0.001。甲乙医师运用HR-T2WI联合DWI诊断肠壁内外直肠腺癌价值较高,AUC值分别为0.932(95%CI 0.869~0.994),P<0.001;0.954(95 % CI 0.903~1.000),P<0.001(图3、表1)。甲乙医师运用HRT2WI联合DWI诊断肠壁内外直肠腺癌的AUC值均较单独运用HR-T2WI时高,Z值分别为4.777(P<0.001)、4.584(P<0.001)。
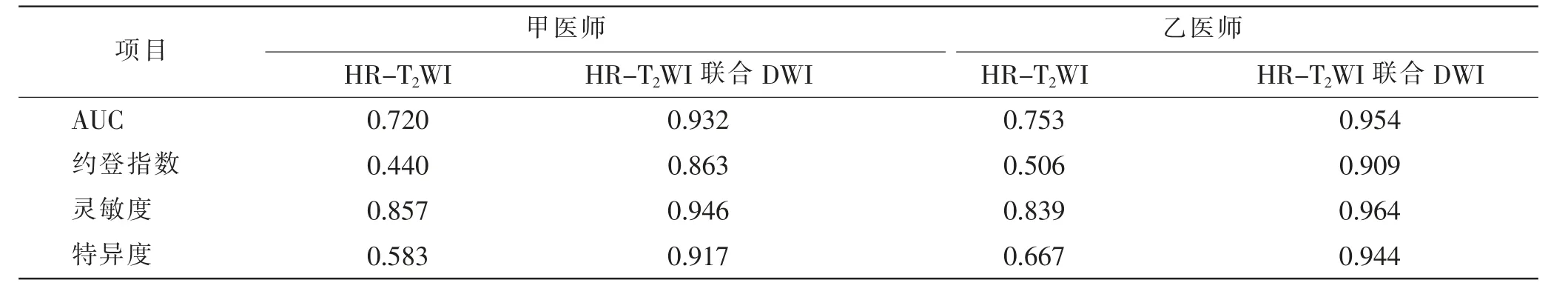
表1 甲乙医师分别运用HR-T2WI、HR-T2WI联合DWI诊断肠壁内外直肠腺癌效能比较Tab.1 Comparison of diagnosis efficacy of rectal cancer exterior and interior intestinal wall by HR-T2WI and HR-T2WI combined DWI between 2 physicians
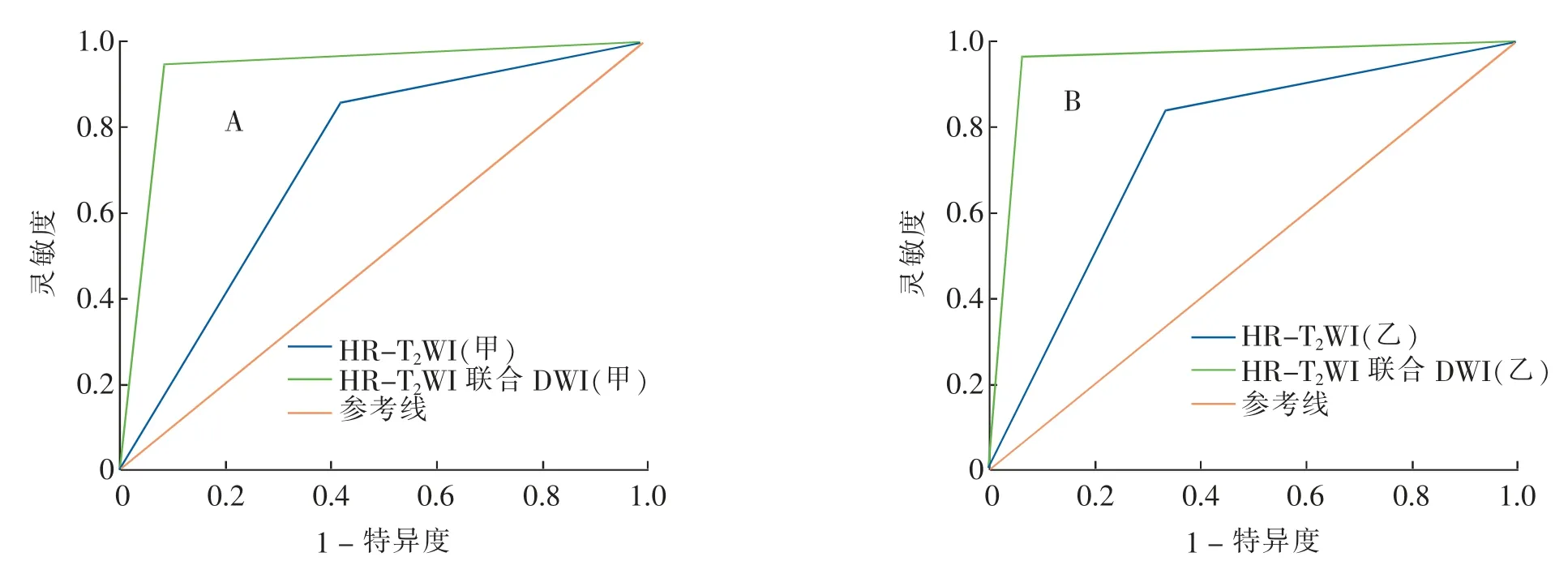
图3 肠壁内外直肠腺癌的ROC曲线Fig.3 ROC curves of rectal cancer exterior and interior intestinal wall
3 讨论
据最新全球癌症统计资料显示,2020年全球新发直肠癌约73万例,死亡约34万例,严重威胁人类生命、健康[6],精准治疗有赖于术前准确分期。nCRT对治疗肠壁外直肠癌至关重要,判断错误将导致肠壁内直肠癌被过度治疗,从而增加与nCRT相关的并发症风险;分期不足,肠壁外直肠癌直接手术后,复发风险增加。因此,精准判断肠壁内外直肠癌可指导临床决策,且可根据肿瘤的浸润深度等情况制订个体化治疗方案,对提升患者生存率和生存质量有重要意义。
HR-T2WI TE长,图像清晰度高,层厚薄,可显示诸多病变细节,在疾病的诊断与分期、疗效评估中研究逐渐深入[7,8]。笔者研究HR-T2WI运用斜轴面、冠状面和矢状面多方位观察,对病变细节的显示进一步提高。然而,直肠癌灶周围的黏膜下层和肌层组织可发生水肿和炎性细胞浸润,在HR-T2WI上表现为中等信号,与肿瘤信号类似、有时较难区分,这可能导致对肿瘤边界的误判,从而过度诊断肠壁外直肠癌[9]。此外,直肠癌灶邻近的系膜发生纤维化在临床屡见不鲜,发生率约为25%,癌灶与其周围的促纤维增生反应在HR-T2WI图像中有一定重叠,这也可能导致过度诊断肠壁外直肠癌[10]。再者,尽管HR-T2WI的信噪比、对比度极佳,但其仍是常规序列的改进,不能做定量分析。
DWI序列可通过人体组织中水分子的扩散运动来间接反映人体组织的微观结构变化,是一种无创检查手段。直肠癌灶的水分子扩散运动受到限制,DWI图像信号增高;而癌灶周围的直肠壁和炎症、水肿的肠壁组织的水分子扩散运动受到的限制越少,其DWI信号衰减较多,图像的信号强度不高[11]。直肠癌灶周围系膜发生的纤维化反应和突破肠壁的肿瘤组织间水分子扩散运动亦存在差异,二者在DWI图像上的信号强度存在差异。纤维结缔组织在HR-T2WI上表现为斑片、针状低信号影,DWI显示水分子弥散不受限、信号不高;肿瘤侵犯直肠系膜会形成向直肠系膜延伸的、较厚的、中等信号强度的结节,弥散受限,信号增高[12]。此外,表观扩散系数(apparent diffusion coefficient,ADC)值作为DWI成像的定量参数,可反映直肠癌的生物学特性,为鉴别诊断和疗效评价等提供客观依据[13~15]。鉴于上述HR-T2WI和DWI序列各自特点,笔者将其用于鉴别肠壁内外直肠腺癌,研究发现,不同读片者单独运用HR-T2WI进行诊断,一致性较高(Kappa=0.757);运用HR-T2WI联合DWI进行诊断时一致性很高(Kappa=0.909),两者联合运用可提高可重复性。此外,单独运用HR-T2WI,诊断效能中等,AUC 0.720~0.753;两者联合运用诊断效能明显提高,AUC 0.932~0.954,与胡飞翔等[4]的研究结果基本一致。
笔者研究的局限性:①样本量较小,未将肠壁外直肠腺癌进一步分组,不同的T3期与T4期肿瘤预后存在一定差异,今后将扩大样本量,进一步细化分组;②回顾性研究中只纳入了直肠腺癌患者,剔除了特殊病理类型直肠腺癌,研究不够全面;③病例均为直接手术患者,造成T4和T3晚期病例相对较少,可能造成选择偏倚。
综上所述,运用HR-T2WI联合DWI鉴别肠壁内外直肠腺癌,读片者一致性和诊断效能均优于单独使用HR-T2WI,HR-T2WI联合DWI有助于改善临床个体化治疗抉择,使患者获益。
