一种新贴壁细胞冻存液的研发与评价
2022-12-05刘思景张咏怡李柳郡梅晓雯余佳蓓
刘思景,李 雪,张咏怡,李柳郡,邱 峰,梅晓雯,余佳蓓,秦 笙
急性呼吸道病毒感染 (acute respiratory virus infection)是全球性多发、常见病之一,较易造成突发性、流行性传染病;老年人和儿童发病率及致死率较高,且目前临床应对重症呼吸道病毒感染的措施仍极为有限,故在感染初期即对其进行检出并诊断成为了临床的迫切需要。病毒培养是世界卫生组织(World Health Organization,WHO)提出的检测“金标准”,可检出未知病毒,目前也发展出离心小瓶和混合细胞培养等快速病毒培养的方法[1];但由于其培养需用到大量细胞,准备细胞的步骤和实验要求较为繁琐和严格,都是由实验室各自准备,没有统一的质量控制和批量生产的条件,因此病毒培养不能广泛地应用于基层单位。为了解决不能批量生产细胞、细胞质量不统一、细胞准备量与临床标本量不符、细胞传代操作繁琐等问题,简化细胞使用流程,笔者对现有的细胞冻存液进行改良,开发出一种使贴壁状态下的细胞直接原位冻存的冻存液并申请了发明专利(CN201810323244.1)。该冻存液是一种不需对细胞使用胰蛋白酶消化,冻存和复苏的步骤不需要离心也可以使得细胞在复苏后呈正常生长状态的冻存液,极大地简化了细胞准备程序,为下一步大批量生产和配送预制式细胞产品提供良好的冻存介质。实验对该改良冻存液的使用进行初步评价。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞与病毒
MDCK、LLC-MK2、HEp-2细胞,甲型流感病毒、副流感3型病毒、呼吸道合胞病毒毒株,由广东省中医院检验科病毒室提供。
1.1.2 主要试剂与仪器
丙二醇、甘油、聚乙二醇、二甲基亚砜(dimethyl sulfoxide,DMSO)(Sigma,美 国);胎 牛 血 清(fetal bovine serum,FBS)、达氏修正依氏培养液(Dulbecco"s modified Eagle"s medium,DMEM)(Gibco,美国);呼吸道病毒7项荧光试剂盒 (Diagnostic Hybrids Inc,美国)。
Z2细胞计数仪(Beckman,美国);正置荧光显微镜及显微摄像系统(Leica,德国)。
1.2 方法
1.2.1 贴壁细胞冻存液制备
将体积比占总体积7.5%DMSO(V/V%)、17.5%丙二醇(V/V%)、2.5%聚乙二醇(V/V%)、10%FBS(V/V%)溶解在DMEM中,经无菌过滤后分装至10 mL离心管中,放置于4℃条件下备用。
1.2.2 常规冻存液制备
将体积比占总体积10 % DMSO(V/V%)、90 %FBS(V/V%)溶解在DMEM中,经无菌过滤后分装至10 mL离心管中,放置于4℃条件下备用。
1.2.3 细胞冻存与复苏
贴壁细胞准备:收集对数期MDCK、LLC-MK2、HEp-2细胞,用胰酶消化后调整细胞悬液浓度至3×105/mL,于96孔板中每孔加细胞悬液100μL,于37℃、体积分数5%CO2培养箱中孵育24 h,获得单层贴壁细胞。
冻存:取出预先准备好的单层贴壁细胞,吸弃96孔板中培养液,用磷酸盐缓冲溶液(phosphate buffered saline,PBS)洗涤细胞1次,弃去PBS。贴壁细胞冻存组:每孔加入贴壁细胞冻存液100μL;贴壁细胞冻存对照组:每孔加入常规冻存液100μL。两组细胞用封口膜密封,放入异丙醇梯度降温盒中,密封盒盖,将降温盒直接置于-80℃超低温冰箱。常规冻存组:用胰酶分别消化3种细胞,把细胞悬液转至离心管,于1 500 r/min条件下离心5 min,弃上清液,加入常规冻存液;轻柔打散后转至1 mL冻存管,移入降温盒,置于-80℃超低温冰箱。常规冻存组、贴壁细胞冻存对照组和贴壁细胞冻存组冻存7 d后进行复苏。
复苏:将贴壁细胞冻存组及贴壁细胞冻存对照组96孔板自冰箱中取出,于37℃水浴5~7 min至完全解冻,轻柔吸弃冻存液,加入预温的PBS轻柔洗涤细胞,去除残余冻存液。每孔加入细胞培养液100μL,置于37℃、体积分数5%CO2培养箱中孵育。从冰箱中取出常规冻存组冻存管,放入37℃水浴迅速化冻,化冻后轻柔混匀,将细胞转至含培养液的离心管,于1 500 r/min条件下离心5 min,弃上清液,将沉淀的细胞用培养液重悬后调整至3×105/mL,于96孔板中每孔加细胞悬液100μL,置于37℃、体积分数5%CO2培养箱中孵育,复苏的细胞为新鲜贴壁细胞。
1.2.4 HEp-2细胞生长曲线的绘制
各组细胞复苏后,连续培养5 d,每天消化前用PBS洗细胞面2~3次,去除死细胞;用胰酶消化细胞,并用Beckman Z2细胞计数仪进行细胞计数,记录实验结果。以时间为横轴、细胞数为纵轴,绘制生长曲线。
1.2.5 细胞病变法
采 用 细 胞 病 变(cytopathic effect,CPE)法 比 较新鲜贴壁细胞与冻存后贴壁细胞对不同病毒的敏感性。
各组细胞复苏后分别感染甲型流感病毒、副流感3型病毒及呼吸道合胞病毒,于37℃、体积分数5%CO2培养箱中培养3~5 d,每天在光学显微镜下观察CPE。
1.2.6 免疫荧光法
采用免疫荧光法比较新鲜细胞与冻存后细胞对不同呼吸道病毒的敏感性。
取各组细胞感染病毒,培养5 d后按照试剂说明书进行免疫荧光染色;在正置荧光显微镜下观察。细胞内特异性苹果绿荧光视为阳性。
2 结果
2.1 3种细胞冻存后复苏细胞形态比较
在光学显微镜下观察结果显示,3种贴壁细胞冻存组细胞复温后细胞状态恢复正常,与常规冻存组细胞复苏培养3 d后的新鲜贴壁细胞形态基本一致。3种贴壁冻存对照组细胞复苏后其细胞大量死亡,数量急剧减少,细胞间隙增大,细胞呈破碎样。见图1。

图1 3种细胞冻存后复苏细胞的细胞形态比较(100×)Fig.1 Comparison of cell morphology images of resuscitation after cryopreservation in 3 kinds of cells(100×)
2.2 HEp-2细胞生长曲线的绘制
经过冻存处理的3组HEp-2细胞复苏后,贴壁细胞冻存组细胞密度一直保持5×105/mL水平;常规冻存组在生长潜伏期(第1天至第3天)细胞密度保持在(2~3)×105/mL水平,指数生长期内(第4天、第5天)升至5×105/mL。贴壁细胞冻存对照组只有极少数细胞存活。见图2。

图2 HEp-2细胞经冻存处理后的生长曲线Fig.2 Growth curves of HEp-2 cells after cryopreservation
2.3 冻存后3种复苏细胞对不同呼吸道病毒的敏感性CPE法检测结果
贴壁细胞冻存组与常规冻存组的细胞对不同的病毒均呈现典型的CPE,感染了甲型流感病毒、副流感3型病毒的冻存后的贴壁细胞变圆,折光性提高,呈破碎样CPE,感染呼吸道合胞病毒的冻存后的贴壁 细胞呈巨细胞融合样CPE(图3)。
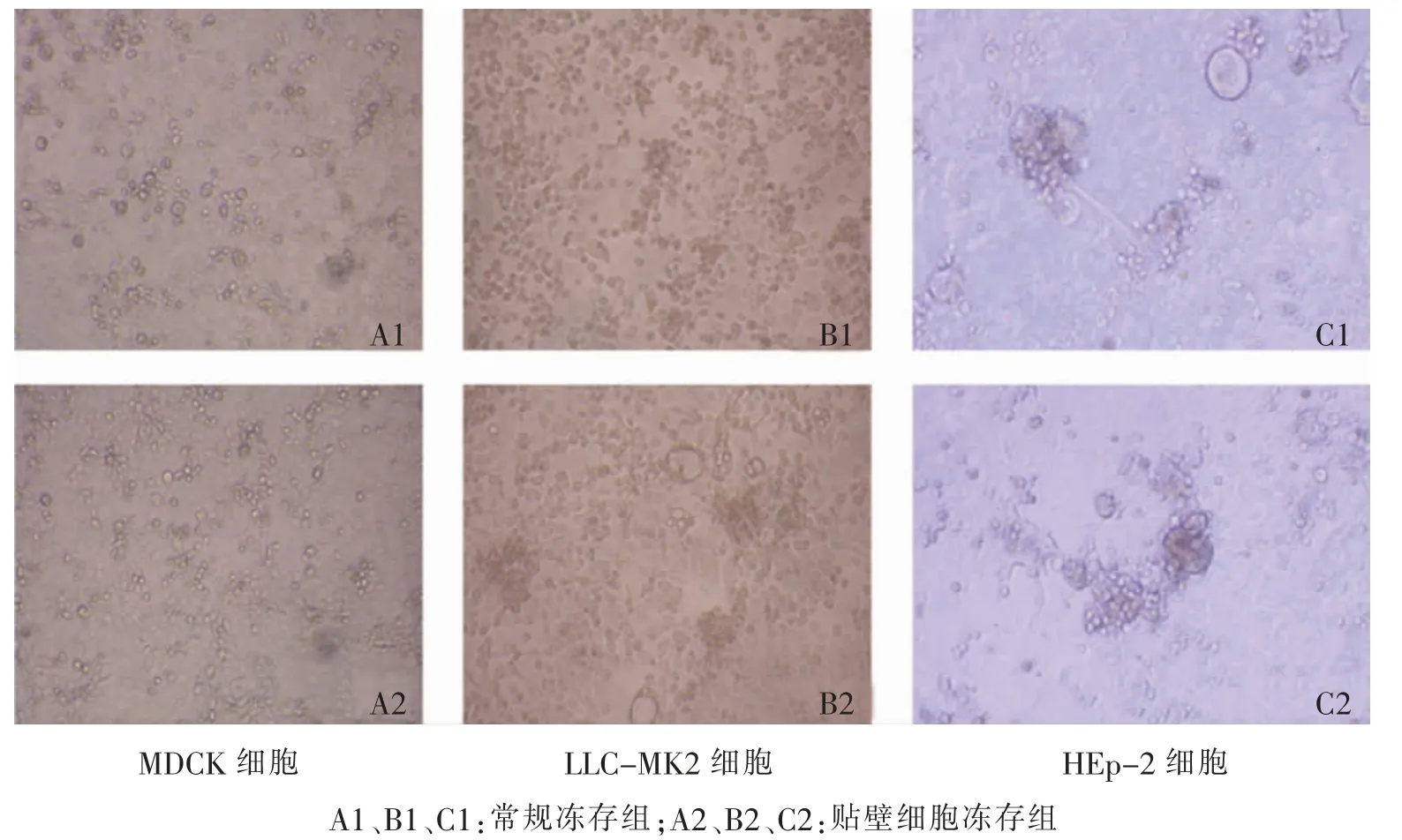
图3 CPE法比较不同冻存液冻存后3种细胞对不同病毒的敏感性(100×)Fig.3 Comparison of sensitivity images in 3 kinds of cells after different cryopreservation by CPE method(100×)
2.4 冻存后3种复苏细胞对不同病毒的敏感性免疫荧光法检测结果
贴壁细胞冻存组与常规冻存组的细胞均出现强的绿色荧光,感染甲型流感病毒的细胞荧光呈胞浆颗粒型或细胞核均质型;感染呼吸道合胞病毒的细胞荧光呈胞浆颗粒型,合胞体中亦可见小块包涵物染荧光;感染副流感3型病毒的细胞荧光呈胞浆颗粒型(图4)。
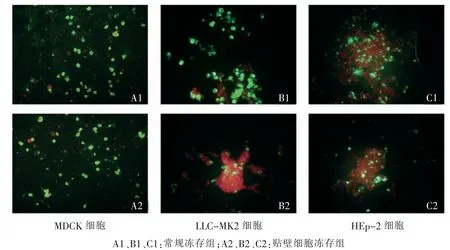
图4 冻存后3种复苏细胞对不同病毒的敏感性(100×)Fig.4 Images of sensitivity in 3 resuscitation cells for different viruses after cryopreservation(100×)
3 讨论
细胞在慢速冻存过程中将受到多种损伤作用,针对损伤的不同机制,许多研究人员曾提出各种假说。其中最为经典的即冰晶物理损伤学说,在进行了大量有关冷冻保护剂与冰晶晶格形成的相关性研究后[2],此假说可基本得以证实。此外,在冷冻与复苏过程中细胞内外渗透压的剧烈变化导致的渗透性休克致伤假说同样占据重要地位[2,3]。而近年来的大量研究结果表明,低温使细胞膜脂质发生相位变化,导致膜通透性增大,胞内成分流失[4~6],以及细胞在冷冻过程中代谢产生的过量活性氧对细胞膜、蛋白质、DNA等各种组分的损伤同样是细胞冻存过后存活率下降的重要原因[7]。目前通用的细胞冻存方法为细胞单个悬浮冻存;偶见集落冻存,如内皮细胞球状集落冻存[8];贴壁细胞原位冻存较少报道。Miyamoto Y等[9]曾经报道了一种在胶原玻璃凝胶膜上直接原位冷冻保存原代肝细胞和小鼠成纤维细胞的新技术,可用在即用型细胞的制备工艺中,可满足实验需求。Amps KJ等[10]研究了在透气膜培养盒中原位冷冻保存人胚胎干细胞,该方法能够原位冷冻保存相对大量的人胚胎干细胞,同时保证了细胞的高产量和遗传稳定性,从而扩大了生产规模并提高效率。以往对冻存液的研究及使用基本是以悬浮细胞或培养物作为对象,与冻存液的接触面为100%,通常使用10%DMSO即可获得较好的保护。但在笔者研究中,实验对象为贴壁细胞,与冻存液的接触面只有50%,实验结果表明常规的冻存液并不适用于贴壁细胞的原位冻存。笔者研究中选用的DMSO、丙二醇属于渗透性保护剂,可透过细胞膜渗入细胞内,容易结合水分子,发生水和作用,使溶液的黏性增加,从而弱化了水的结晶过程,并降低未结冰溶液的电解质浓度,避免溶质损伤;聚乙二醇属于非渗透性保护剂,可以优先同水分子结合,降低溶液中自由水的含量,降低冰点,减少冰晶的形成,同时也使电解质溶液浓度降低,防止溶质损伤。渗透性保护剂与非渗透性保护剂的联合使用可达到较好的冷冻前脱水作用,并能有效降低渗透性保护剂的浓度,从而减少其对组织的毒性作用。FBS则通过改变渗透压,防止冷冻时细胞过度脱水、解冻时细胞发生渗透性休克,从而保护细胞膜及细胞的完整性[11]。
在感染病毒的实验中,可见贴壁细胞冻存组各细胞均呈现较为典型的CPE现象。经免疫荧光染色后,可见荧光集中分布于胞内,胞外病毒颗粒较少,证明病毒成功感染细胞,并在胞内大量繁殖。且各实验组结果未与常规冻存组表现出明显差异性,证明细胞对病毒感染的敏感性未因贴壁冻存而产生明显影响。
此外,在实验过程中比值发现,细胞密度是影响细胞复苏后贴壁率及细胞状态的重要因素。细胞密度过小,存活率无法保证;而细胞密度过大,复苏后的细胞很容易整块脱落。目前看来80%长满时状态较佳,且铺板时务必将细胞吹打均匀,使细胞均匀分布板底。此外,由于3种细胞并非来自同一种属,生存环境及生物学行为不同,因此对冻存环境的要求具有一定差异性,研究小组将进行更加具有细胞针对性的配方实验,并继续深入探讨低温环境对不同细胞损伤的具体机制,以及细胞冻融对病毒侵袭的敏感性在细胞器乃至分子层面是否具有影响。
笔者研究的贴壁细胞冻存液是实验者在长期的工作积累和观察中,从实际情况出发对原有材料及其使用范围进行新的思考和应用。贴壁细胞冻存液的开发可有效降低细胞消化、传代次数,简化细胞准备程序,满足临床对细胞按需取用的要求并避免实验室浪费的情况出现,同时新的冻存液使用也为下一步大批量生产和配送预制式细胞产品提供了良好的冻存介质。
