山豆根种子带菌检测和杀菌处理的效应分析
2022-12-05冯世鑫蒋妮陈乾平
冯世鑫 蒋妮 陈乾平
山豆根种子带菌检测和杀菌处理的效应分析
冯世鑫 蒋妮 陈乾平
(广西壮族自治区药用植物园 广西南宁 530023)
以山豆根种子为材料,研究不同产地的种子携带真菌的种类及其带菌率,观察杀菌处理对真菌抑制作用及种子萌发的影响,为山豆根种子育苗前处理提供参考。采用洗涤离体、PDA培养的平皿法,对种子外部和内部携带真菌进行检测,考察其携带真菌的孢子负荷量、种类、分离频率;选用5种杀菌剂对种子进行杀菌处理,以清水为对照,观察其对真菌抑制作用及对种子萌发的影响。结果表明:(1)种子外部表面携带的优势菌群为刺盘孢属(spp.)、镰孢霉属(spp.)和亚隔壳孢属(spp.)。种子内部寄藏的真菌主要为刺盘孢属、假尾孢属 ()、间作壳属(spp.)真菌。不同产地的种子表面携带真菌种类差异较大,而种子内部寄藏的真菌种类差异不明显。(2)多菌灵、多抗霉素、大黄素甲醚·绿色木霉、蛇床子素·枯草芽孢杆菌对山豆根种子携带的真菌有较好的抑制作用,以大黄素甲醚·绿色木霉较好。常用的多菌灵抑制的真菌主要是刺盘孢属和青霉菌属真菌;而大黄素甲醚·绿色木霉对山豆根种子携带的刺盘孢属、镰孢霉属、亚隔孢壳属、链格菌属、青霉菌属真菌的杀菌效果均达到82.4%以上。(3)各杀菌处理对种子发芽率影响差异不显著;大黄素甲醚·绿色木霉处理和蛇床子素·枯草芽孢杆菌处理对发芽势和根的生长有促进作用。
山豆根;种子;真菌;杀菌处理;效应
山豆根为豆科植物越南槐(Gagnep.)的干燥根及根茎,又名广豆根,为《中华人民共和国药典》历年收载的品种。主产于广西、贵州、云南。含生物碱和黄酮等活性成分。具有清火解毒、消肿利咽之功效[1]。现代药理研究表明:山豆根提取物有抗病毒、保肝抗炎、抗肿瘤、解痉平喘等药理作用[2-3]。以山豆根为主要原料的药品有肝炎灵、清咽利火丸、鼻咽片、桂林西瓜霜、复方山豆根注射液、复方山豆根片、复方山豆根口服液、咽热清合剂、参莲胶囊等[4]。此外,山豆根还广泛用于中药配伍。原料供不应求。然而,在生产中,山豆根常受根腐病、白绢病[5]、圆斑病、白粉病、炭疽病和豆荚螟虫[6]等病虫的危害,造成生长滞慢,产量品质下降、甚至失收,增大了生产成本,阻碍其产业的发展。
山豆根以种子繁殖为主,每年的10~11月种子成熟,育苗分春播和秋播。春播在2月下旬至3月中旬进行,种子需低温保湿贮藏[7]。秋播于11月前后进行,采收果荚,阴晾取出种子后,即可播种[8]。种子在生长、脱荚、筛选、储存的过程中,容易受到病原菌的依附、侵染或再侵染,导致种子带菌,增大病害发生和流行的风险。作物种子安全是农产品丰产优质的重要前提和保证,对种子的健康检验和杀菌消毒是关键[9]。目前,种子消毒有物理、化学和生物等方法,其中化学方法最为常见[10-12]。然而,化学杀菌剂毒性大、污染和残留风险高,已不符合当今社会可持续发展和绿色农业的要求。生物农药具有对人畜和非标靶生物安全、环境污染小、不容易产生抗性、容易保护生物多样性、来源广泛等优点[13]而倍受关注和利用。本试验拟对山豆根种子外部和内部携带真菌进行检测,了解其携带真菌种类和带菌程度,并探讨利用生物杀菌剂对种子进行消毒处理,筛选出效果较佳的生物杀菌剂,降低污染,消除或减弱山豆根种传病害,提高种子活力。
1 材料与方法
1.1 材料
1.1.1 供试种子 于2020年11月,采集广西河池市金城江区(代号T1,下同)、广西百色市靖西县(T2)、广西桂林市兴安县(T3)、云南文山州富宁县(T4)、贵州黔西南布依族自治州安龙县(T5)共5个产区的山豆根种子作为携带真菌的检测材料。为减小因材料而引起的误差,选用来源于广西金城江的种子为代表,进行杀菌效果试验及其对种子活力的影响试验。
1.1.2 供试杀菌剂 选用的5种杀菌剂中,化学杀菌剂1个、抗生素类杀菌剂1个、植物源和微生物源复合制剂2个、纯微生物源杀菌剂1个。具体的品名和使用浓度等信息见表1。
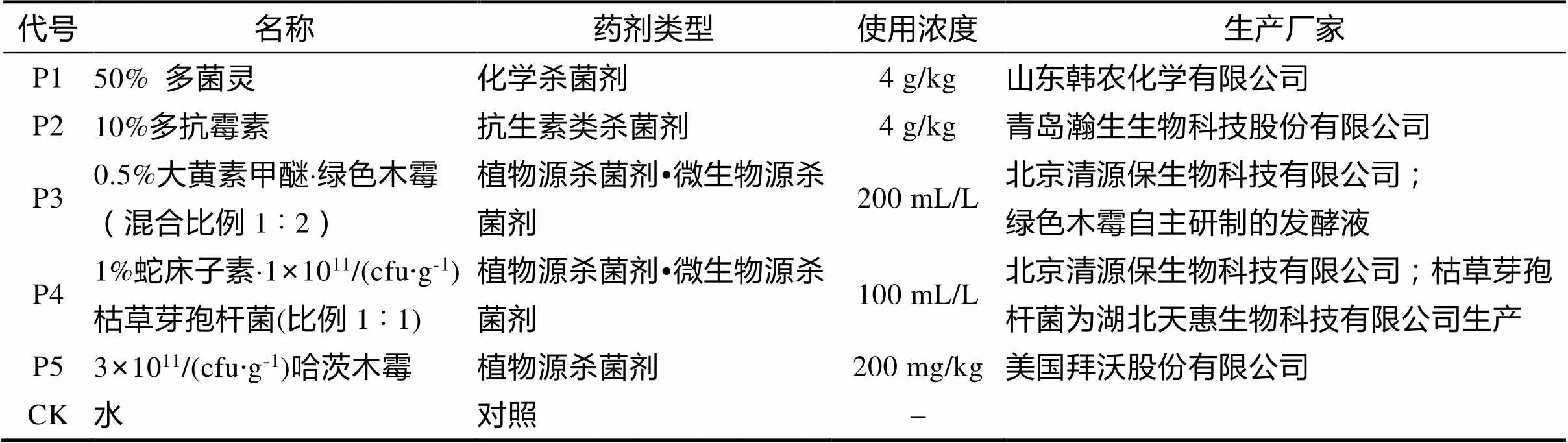
表1 供试杀菌剂
1.2 方法
1.2.1 山豆根种子携带真菌的检测
1.2.1.1 种子外部带菌检测 取种子100粒,放入250 mL锥形瓶中,加入25 mL无菌水充分振荡,吸取悬浮液5 mL以2 000 r/min的转速离心15 min,弃除上清液5 mL,再加入5 mL无菌水悬浮,制成孢子悬浮原液;吸取100mL悬浮原液,制成稀释100倍的孢子悬浮液;从中吸取100mL加入到PDA平板的培养皿上涂匀,以无菌水作对照,重复4次;置于28 ℃的恒温箱中,黑暗条件下培养5 d,记录菌落数量、真菌种类和数量,计算出孢子负荷量()和分离频率()。
=/××············································(1)
式中,为每百粒种子的孢子负荷量;为4个重复菌落总数的平均值;为吸取悬浮原液数量;为稀释倍数;为最初添加的溶液数量。
=×100%································· (2)
式中,为某一种类真菌的分离频率;为某一种类真菌数;为真菌总数。
1.2.1.2 种子内部带菌检测 取种子适量,放入水中浸泡24 h,弃去浮于水面的种子,随机选取饱满的种子40粒,放入10%次氯酸钠溶液中浸泡10 min,无菌水冲洗,70%乙醇浸泡1 min,然后用无菌水冲洗4遍;将种子分成4等份,每份10粒,将每份种子分别横切,每粒种子弃去一半保留另一半,保留的一半即为供试组织块;将供试组织块均匀摆放在PDA平板上,切口一侧紧靠培养基,以空白培养基作对照;4次重复。在28 ℃恒温培养箱中,黑暗下培养5 d,考察带菌种子数和菌落生长情况;记录真菌种类、带菌率(N)。
=×100%································· (3)
式中,为带菌率;带菌种子数;为检测种子总数
1.2.1.3 种子带菌鉴定 将分离到的真菌分别进行纯化、形态镜检和转管保存,根据真菌培养性状和形态特征,参照《种子病理学》[14]和《植物病原真菌学》[15]等真菌鉴定工具书进行鉴定。
1.2.2 杀菌剂对种子杀菌效果分析 取供试种子240粒,按设计,用杀菌剂分别浸种24 h;取出、沥干表面水分,分成4等份(即4次重复),每份60粒,待用;以无菌水浸种为对照;按处理将种子均匀摆放在PDA平板上,每皿10粒,置于28 ℃的恒温箱中黑暗条件下培养5 d,观测种子经处理后的带菌种类和数量,计算带菌率和杀菌率(T)。
=(ck-t)/ck×100% (4)
式中,为杀菌率;ck为对照组的带菌率;t处理组的带菌率。
1.2.3 杀菌剂处理后对种子活力的影响 参照已有的发芽方法[16],取供试种子120粒,分别用杀菌剂水溶液浸种,方法与1.2.2项相同。播种于装有已灭菌沙子的塑料盒中,每盒30粒,每个处理4次重复,在28℃的恒温光照培养箱中(L:D=14∶10)进行培养,每24 h观测一次,记录其种子发芽情况。以胚芽冒出土时记为种子发芽。根据山豆根种子萌发特点,在第20天时,计算种子发芽势;第36天统计发芽种子数,并用游标尺和天平测定已发芽生长的植株高度、根长和鲜重。
发芽率=()×100% (5)
式中,指种子正常发芽粒数(在规定时间内),指供试种子总数。
发芽势=()×100% (6)
式中,指规定时间内发芽种子总数,指供试种子总数。
1.2.4 数据处理与分析 试验数据采用Excel 2016和SPSS 19.0进行处理,用Duncan'法进行多重比较。
2 结果与分析
2.1 山豆根种子携带真菌的分析
2.1.1 种子外部携带真菌种类和分离频率 实验结果表明,山豆根种子外部携带的真菌较多,百粒种子的孢子负荷量为470~1 086。包含有镰孢霉属、刺盘孢属、亚隔孢壳属、链格菌属和青霉菌属5个属的真菌。所携带真菌的种类、分离频率与种子产地有关。从表2可以看出,携带镰孢霉属真菌最高的处理是T1,为来自广西金城江的种子,其分离频率为26.7%,与其他来源的种子相比,差异达到显著水平。携带青霉菌属真菌则以T2处理最高,差异显著性也很明显。携带刺盘孢属真菌较多的是云南富宁的种子(T4),分离频率高达37.6%,显著高于其他处理。再有,T4处理的链格菌属真菌分离频率也显著高于T2、T3、T5和CK。来源于广西兴安县的T3处理,却携带亚隔孢壳属真菌较多,分离频率位居第一,显著高于其他处理。根据各产地种子携带的真菌及其分离频率,依照优势菌种的分类原则:菌种总数的百分比(分离频率)大于10%的菌株属于优势菌种来划分,山豆根种子外部表面携带的优势菌群为刺盘孢属(spp.)、镰孢霉属(spp.)和亚隔孢壳属(spp.)真菌。
2.1.2 种子内部携带真菌的种类和分离频率 从表3可知,5个产地的种子内部带菌率高达62.5%~90%。种子内部携带的真菌种类与外部携带的不完全相同。种子内部携带的真菌除了分离得到刺盘孢属、链格孢属、青霉菌属真菌以外,还分离得到假尾孢属、间作壳属、枝孢属、尾孢菌属、小球腔菌属、炭角菌属、腔菌属7个属的真菌。不同产地种子内部所携带真菌种类无明显差别,但分离频率不尽相同。来自广西金城江(T1)和云南富宁县(T4)的种子携带刺盘孢属真菌较高,显著高于其他处理;来自广西靖西县(T2)的种子携带的枝孢属真菌较高,而来自贵州安龙(T5)的种子携带假尾孢属真菌较多。其他的虽然有一定差异,但差异不显著。按优势菌种的分类原则划分,山豆根种子内部寄藏的优势真菌是刺盘孢属真菌、假尾孢属()真菌和间作壳属(spp.)真菌。
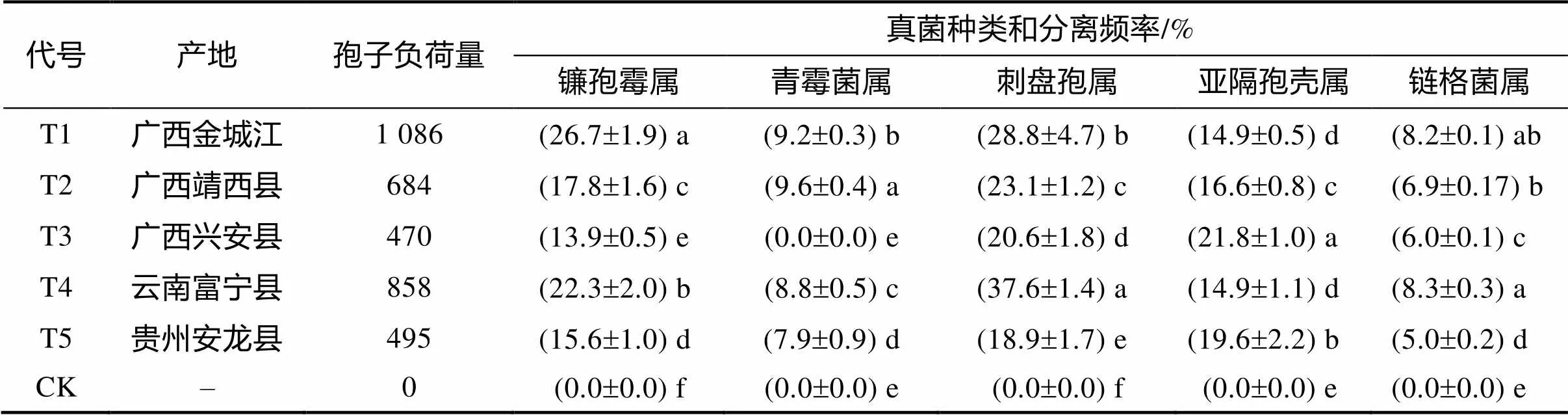
表2 山豆根种子悬浮液携带真菌种类和分离频率
注:表中数据为4个重复平均值;±为标准差;不同小写字母表示样品间有显著性差异(<0.05)。下同。
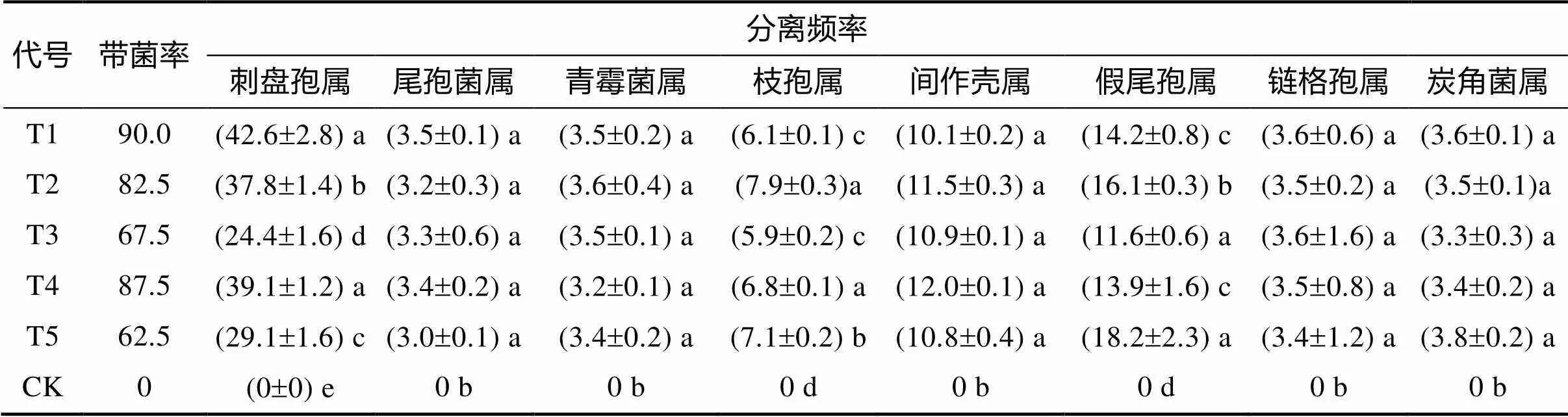
表3 山豆根种子内部寄藏真菌检测结果 单位:%
2.2 杀菌剂对种子携带真菌的杀菌效果分析
从表4可看出,5种杀菌剂对山豆根种子外部携带的真菌均有一定的杀菌效果,其杀菌率均显著高于对照组。不同的杀菌剂对所抑制真菌种类及其杀菌率有较大的区别。以抑制真菌种类多、杀菌率高为评价指标,P3处理较优。P3处理对刺盘孢属、镰孢霉属、青霉菌属、亚隔孢壳属和链格菌属真菌均有很好的抑制作用,其杀菌率为82.4%~100.0%,尤其是对链格菌属真菌杀菌率更高,经处理后已检测不到该属真菌病原菌。其次为P2处理,P2对携带的5个属真菌的杀菌率为70.4%~91.5%,集中表现在对青霉菌属和刺盘孢属真菌抑制较好。第三为P4处理,整体的杀菌率在52.8%~82.3%,对镰孢霉属真菌有较好的抑制作用。P1处理对携带的5个属真菌的杀菌率为49.4%~81.5%,比P5处理稍好。其主要是对青霉菌属真菌、刺盘孢属真菌有较好的抑制作用,而对其他真菌的抑制效果则较差。也就是说,对山豆根种子所携带的真菌而言,用P3消毒处理其杀菌广谱性和杀灭效果均优于P2、P4、P1、P5和CK处理。
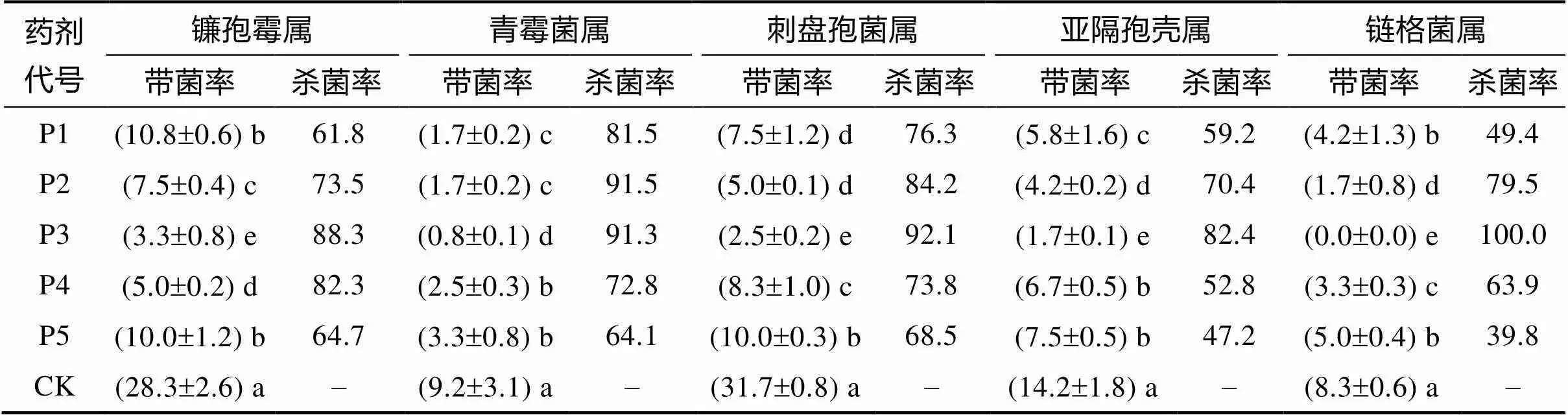
表4 杀菌处理后对山豆根种子携带真菌情况及杀菌效果 单位:%
2.3 杀菌剂对山豆根种子活力的影响
从杀菌剂浸种后的发芽情况(表5)可知,5个处理组和对照组之间的种子发芽率虽有一定的差异,但差异不显著,说明5种杀菌剂对山豆根种子萌发所造成的影响均不大。而种子的发芽势和幼苗的株高、根长、鲜重则有不同的表现。发芽势以P3处理的最高,达到74.2%,其次为P4处理,二者差异不显著,但均显著高于其他处理。P1、P2、P5和CK之间差异不显著。发芽势衡量种子发芽力,发芽势高则表示种子活力强,发芽整齐,也就是说P3和P4有增强种子活力、提高出苗整齐度的作用。幼苗的株高以P4处理的最大,P3处理次之,两者差异不显著,但均显著高于其他处理;大小排序为P4>P3>P5>P2>P1>CK。根长以P3处理最大,显著高于P4处理,P4与P5、P2和P1、CK之间差异达显著水平。幼苗的鲜重也以P3处理最高,显著高于其他处理,大小排序为P3>P4>P2>P5>CK>P1。株高和根长是衡量植株地上部和地下部器官生长速度重要指标;幼苗鲜重是体现植株内在质量增减程度。说明P4和P3均有促进山豆根幼苗生长的作用,P3则更能提升内在质量,有利于培育壮苗。
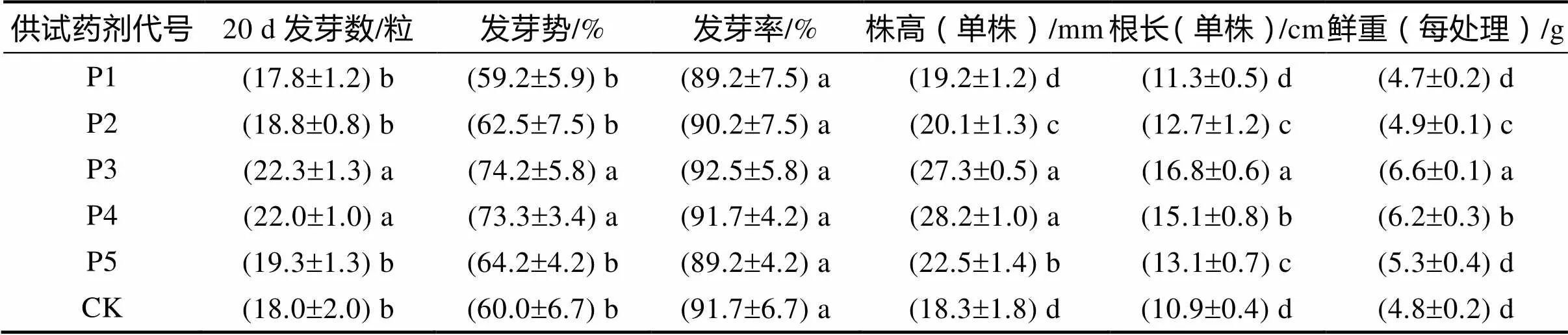
表5 杀菌剂处理种子对其萌发和生长的测定
3 讨论与结论
山豆根种子外部和内部均携带有较多的真菌,虽然外部和内部所携带的真菌优势菌群有所区别,但均有刺盘孢属、镰孢菌属和亚隔孢壳属真菌。有研究报道,山豆根根腐病是由半知菌类镰孢霉属真菌茄腐镰孢[(Mart) Sacc.]引起[17];山豆根圆斑病的病原菌为亚隔壳菌属真菌()菌株[18],该真菌可为害近百种植物[19],病原可以通过种子传播,是一种潜在危险性病原菌,我国将其列入进境植物检疫有害生物名录[20];刺盘孢菌属真菌可引发植物炭疽病,如核桃炭疽病菌()[21]。黄瓜炭疽病病原()[22]均为刺盘孢菌属真菌。山豆根种子所携带的真菌中有与致病病原菌同为一个属的真菌,尽管它们是何菌株及致病性还需进一步鉴定和验证,山豆根种子播前杀菌消毒也显得十分必要。
如何选择环保、有效的山豆根种子杀菌剂,是生产急需解决的问题。实验中,植物源与微生物源复配的大黄素甲醚·绿色木霉(P3)杀菌剂,对山豆根种子外部携带的真菌均有较强抑制作用。大黄素甲醚是从掌叶大黄()根茎提取的高活性抗菌化合物,具有较好的广谱抑菌作用[23]。Pham等[24]测定用大黄根提取物对5种真菌的抑制作用,发现提取物大黄素甲醚浓度在75~300 mg/L时对大麦白粉病的抑制率达80%~96.7%。元维军等[25]用0.8%大黄素甲醚悬浮种衣剂,以有效成分计算,按8~16 g/100 kg种子的用药量,在小麦播前进行种子包衣,对小麦纹枯病防治效果较好。大黄素甲醚与杀菌剂(如三唑类杀菌剂)按一定比例混用,对病害(如稻瘟病)的防治有增效作用[26]。绿色木霉是木霉菌中活性较高的菌株之一,木霉菌具有明显的抗山豆根根腐病的效果,其机理是菌丝缠绕和寄生的方式,产生大量木霉孢子于病原菌体上,使病原菌菌丝断裂、缢缩、消解,从而达到抑菌效果[27]。木霉菌对黄瓜枯萎病也有较好的抑制作用[28]。木霉菌与杀菌剂联用增效作用明显[29-30]。结果与前人的研究相一致。在相同环境条件下,种子的萌发主要受种子活力的影响。试验中,5种杀菌剂处理后的山豆根种子发芽率差异不明显,说明所选用的5种杀菌剂对山豆根种子活力影响不大。而大黄素甲醚·绿色木霉处理种子的发芽势、株高、根长和生物量(幼苗鲜重)的促进较明显,可能是有绿色木霉存在的缘故。木霉菌除了有较强的抗拮作用外,还能促进植株生长,结果与谷祖敏等[28]、周罗娜等[31]研究相同。
种子在生产、采收、加工和运输过程中,均有感染、携带病原微生物菌的风险。在扩大生产中,种子病原菌检测和有效的消毒药剂筛选起到关键作用。化学杀菌剂虽有较好的速效性,但长期使用会引起生物安全、环境污染,研制或筛选出无毒、无残留的生物型广谱杀菌制剂对药材绿色生产具有十分重要的意义。
[1] 国家药典委员会. 中华人民共和国药典:一部[M]. 中国医药科技出版社, 2020: 28-29.
[2] 王君明, 崔瑛. 山豆根化学成分、药理作用及毒性研究进展[J]. 中国实验方剂学杂志, 2011, 17(4): 229-232.
[3] 戴五好, 钱利武, 杨士友, 等. 苦参、山豆根生物碱及其总碱的抑菌活性研究[J]. 中国实验方剂学杂志, 2012, 18(3): 177-180.
[4] 林杨. 山豆根种子生产若干技术研究[D]. 南宁: 广西大学, 2014.
[5] 覃文流, 凌征柱, 吴庆华, 等. 山豆根野生变家种研究[J]. 时珍国医国药, 2006(9): 1 668-1 669.
[6] 蓝祖栽, 姚绍嫦, 凌征柱, 等. 中药材山豆根栽培技术规程[J]. 现代中药研究与实践, 2009, 23(2): 9-10+30.
[7] 覃柳燕, 唐美琼, 黄永才, 等. 贮藏温度及时间对山豆根种子活力的影响[J]. 中国种业, 2011(12): 35-37.
[8] 孙长生, 朱虹, 龙祥友, 等. 山豆根种子的贮藏与寿命研究[J]. 种子, 2016, 35(1): 90-92+96.
[9] 王建华, 何志昆, 茹藓, 等. 健康度检验在种子检验中的重要性及其发展[J]. 种子, 2002(1): 41-43.
[10] 车志平, 田月娥, 周骥, 等. 二甲戊灵和2, 4-滴丁酯对5种作物种子萌发的影响[J]. 贵州农业科学, 2017, 45 (2): 31-35.
[11] 车志平, 田月娥, 周骥, 等. 吡虫啉与三唑酮对小麦种子萌发的影响 [J]. 贵州农业科学, 2017, 45 (5): 20-23.
[12] 田月娥, 车志平, 刘圣明, 等. 十种植物生长调节剂处理对苦瓜和葫芦种子萌发的影响[J]. 北方园艺, 2018 (12): 1-6.
[13] 柴建萍, 谢道燕, 江秀均, 等. 4种生物杀虫剂对桑蓟马的室内毒力测定及田间防效试验[J]. 南方农业学报, 2017, 48(8): 1 409-1 414.
[14] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979.
[15] 陆家云. 植物病原真菌学[M]. 北京:高等教育出版社, 2001.
[16] 覃柳燕, 唐美琼, 梁莹, 等. 不同温度贮藏后山豆根种子酶活性与发芽率相关性研究[J]. 种子, 2011, 30(11): 8-10.
[17] 覃柳燕, 唐美琼, 蒋妮, 等. 广豆根根腐病病原鉴定[J]. 中药材, 2010, 33(10): 1 528-1 531.
[18] 蒋妮, 宋利沙, 陈乾平, 等. 越南槐圆斑病病原鉴定[J]. 植物病理学报, 2021, 51(3): 460-463.
[19] Aghapour B, Fotouhifar K B, Ahmadpour A, et al. First report of leaf spot disease on Ficus elastic caused by phoma glmerata in Iran [J]. Australasian Plant Disease Notes, 2009, 4(1): 82-83.
[20] Zhang Y, Xu P P, Wu J, et al. Identification of Dtaidymella glomerata on imported Sorghum bicolor(in China )[J]. Piant Protection, 2017, 43(3): 192.
[21] 贤小勇, 朱桂宁, 林珊宇, 等. 吡唑醚菌酯与苯醚甲环唑对核桃炭疽病菌的联合毒力及林间防治效果[J]. 南方农业学报, 2021, 52(6): 1 633-1 640.
[22] 韩帅, 吴婕, 张河庆, 等. 黄瓜新炭疽病原的鉴定及生物学特性初探[J]. 中国农学通报, 2021, 37(28): 96-102.
[23] 龚双军, 杨立军, 杨小军, 等。新型植物源农药0.5%大黄素甲醚水剂对黄瓜白粉病菌的毒力测定及田间药效[J]. 植物保护, 2010, 36(5): 168-170.
[24] Pham D Q , Ba D T , Dao N T, et al. Antimicrobial efficacy of extracts and constituents fractionated fromMaxim. ex Balf. rhizomes against phytopathogenic fungi and bacteria[J]. Industrial Crops and Products, 2017, 108: 442-450.
[25] 元维军, 周忠雄, 刘美玲, 等. 0.8%大黄素甲醚悬浮种衣剂防治小麦纹枯病效果初探[J]. 湖北植保, 2020, 183(6): 29-30.
[26] 王娜, 大黄素甲醚对稻瘟菌的生物活性和作用机理研究[D]. 北京: 中国农业大学, 2016.
[27] 覃柳燕, 蒋妮, 唐美琼, 等. 木霉菌对山豆根根腐病菌的拮抗作用[J]. 中药材, 2011, 34(4): 499-502.
[28] 谷祖敏, 毕卉, 张兵, 等. 不同木霉菌株对黄瓜枯萎病菌的拮抗作用[J]. 西北农业学报, 2018, 27(3): 426-431.
[29] 张亚玲, 唐雪婷, 王兵, 等. 木霉菌与杀菌剂联合使用对水稻纹枯病菌的抑制效果[J]. 河南农业科学, 2021, 50(9): 96-104.
[30] 何俊烺, 吴卓慧, 程东美. 木霉和杀菌剂联用对橡胶榕白绢病菌的抑制作用[J]. 湖南农业大学学报(自然科学版), 2021, 47(3):312-316.
[31] 周罗娜, 陈银翠, 周玉锋, 等. 一株拮抗茶炭疽病菌的木霉菌发酵液对茶树幼苗的促生作用[J]. 茶叶通讯, 2021. 48(2): 247-252.
Detection of Germs in Seed and Effect Analysis of Sterilization Treatment ofHook. f. ex Regel
FENG Shixin JIANG Ni CHEN Qianping
(Guangxi Botanical Garden of Medicinal Plant, Nanning, Guangxi 530023, China)
Taking the seeds ofHook. f. ex Regel as materials, this paper studied the species and rate of fungi carried by seeds from different producing areas, and observed the effect of sterilization treatment on fungal inhibition and seed germination, so as to provide reference for the pre-treatment ofHook. f. ex Regel. The fungi carried outside and inside the seeds were detected by washing in vitro and PDA culture plate method, and the spore load, species and isolation frequency of the fungi were investigated; Five kinds of fungicides were selected to sterilize the seeds, and the effects of water on fungal inhibition and seed germination were observed. The results showed that: (1) the dominant flora carried on the outer surface of seeds were.,. and. The fungi in the seeds were mainly,and. The species of fungi carried on the surface of seeds from different producing areas were quite different, but the species of fungi embedded in seeds were not obvious. (2) Carbendazim, polyoxins, Emodin methyl ether·Trichoderma green and Osthole·Bacillus subtilis had good inhibitory effects on the fungi carried byseeds, and Emodin methyl ether·Trichoderma green was better. The fungi inhibited by carbendazim were mainlyandFungi. The fungicidal effect of Emodin methyl ether·Trichoderma green on five dominant fungi of.,,.. Andstored inseeds was more than 82.4%. (3) There was no significant difference between seed germination rate among sterilization treatments; The treatments of Emodin methyl ether·Trichoderma green and Osthole·Bacillus subtilis could promote the growth of root and germination.
Hook. f. ex Regel; seeds; fungus; sterilization treatment; effect
S567.19
A
10.12008/j.issn.1009-2196.2022.06.012
2021-11-09;
2022-03-21
广西中医药适宜技术开发和推广项目(No.GZSY20-02);广西药用植物园科研创新团队建设项目(No.2019003);广西卫健委重点实验室(No.ZJC2020003)。
冯世鑫(1966—),男,主任技师,研究方向为药用植物资源保护和持续利用,E-mail:870330655@qq.com。
(责任编辑 龙娅丽)
