枫香C4H基因的克隆及生物信息学分析
2022-12-05刘雄盛尹国平肖玉菲王仁杰黄荣林王勇
刘雄盛 尹国平 肖玉菲 王仁杰 黄荣林 王勇
枫香基因的克隆及生物信息学分析
刘雄盛 尹国平 肖玉菲 王仁杰 黄荣林 王勇
(广西壮族自治区林业科学研究院/广西优良用材林资源培育重点实验室 广西南宁 530002)
肉桂酸-4-羟基化酶(cinnamate 4- hydroxylase,C4H)是花色素苷合成过程第二步中的重要酶。以变色期枫香叶片为试验材料,根据前期研究获得的枫香叶片RNA-Seq数据库中筛选的基因序列设计一对引物,利用RT-PCR技术克隆核苷酸序列,命名为;将基因上传至GenBank数据库获得枫香基因的登录号(OL871170),并对其进行生物信息学分析。结果显示:枫香基因长度为1 551 bp,包含一个1 518 bp的完整开放阅读框,编码505个氨基酸;保守结构域分析显示,基因编码的蛋白包含一个p450家族蛋白的结构域,分子量为58.00 kDa,理论等电点为9.13,为亲水性的不稳定蛋白质,定位在内质网,存在多个磷酸化位点,无信号肽,不含有跨膜结构域,蛋白的二级结构主要为-螺旋和无规则卷曲,基因在氨基酸水平与莲同源性最高(94.5%);进化分析结果表明,与青脆枝亲缘关系相对较近。本研究成功克隆了枫香基因,并分析了的蛋白质结构功能,对下一步利用基因工程技术进行枫香叶色调控及新品种培育具有重要意义。
枫香;肉桂酸-4-羟基化酶;基因克隆;生物信息学分析
枫香(Hance)为落叶乔木,属于金缕梅科(Hamamelidaceae)枫香树属()[1]。枫香木材纹理美观,耐腐耐虫,落叶量大,可兼用于食用菌产业,经济价值高,应用前景广阔,是我国优良的乡土树种;耐火力和适应性强,天然条件下易更新,有荒山先锋树种之称;树干高大通直,枝叶繁茂,入秋后,其叶片颜色会由绿色变成红色、紫色等,极具观赏价值[2],已成为优良的城市景观彩叶树种。目前,国内外对枫香叶色方面的研究多集中在叶色变化与叶片组织结构[3]、花色素苷含量等生理基础[4]及季节变化之间的关系[5-6],而对于枫香叶片变色的分子机理及其关键基因的研究鲜有报道。
枫香叶色变化过程中起决定性作用的主要是花色素苷[7],花色素苷合成需要很多酶参与。肉桂酸-4-羟基化酶(cinnamate 4- hydroxylase,)亦称反式肉桂酸-4-单氧化酶(trans-cinnamate 4-monooxygenase)[8],是花色素苷合成过程第二步中的重要酶。归为亚家族,是细胞色素P450氧化酶家族成员之一[9],因在植物次生代谢中具有重要作用,基因研究已获得国内外学者的关注[10]。迄今,有关学者已从斑地锦()[11]、膜荚黄芪()[12]、滇水金凤(I)[13]、白梨()[14]、山葡萄()[15]、芍药()[16]、青稞()[17]、桂花()[18]等50多种植物中克隆出基因,但有关枫香基因克隆及其相关特性的研究尚未见报道。
本研究以枫香无性系叶片为试验材料,利用RT-PCR分离克隆其基因,并借助多种生物信息学软件分析其序列,获得其蛋白质理化性质和结构、氨基酸同源性、系统发育等特点,为枫香花色素合成途径中关键酶基因功能的研究奠定基础,对下一步应用基因工程技术进行枫香的叶色改良及新品种的培育具有重要意义。
1 材料与方法
1.1 材料
1.1.1 供试材料 供试材料采自广西林科院森林经营研究所苗圃,该圃地处南宁市郊,属湿润的亚热带季风气候。选用长势优良、变色效果良好的枫香优良无性系叶片作为供试材料,用超纯水将样品洗净后置于液氮中处理,然后储存于–80℃超低温冰箱中备用。
1.1.2 主要试剂 RNA提取试剂盒(天根生化科技有限公司);反转录试剂盒(TaKaRa杭州公司);质粒提取和DNA凝胶回收试剂盒(美国Axygen公司);琼脂糖(美国海晋生物);克隆载体pEASY®-T5 Zero、大肠杆菌trans1-T1(Transgen中国公司);引物合成及测序委托上海生工生物公司完成。
1.2 方法
1.2.1基因特异引物设计 根据枫香转录组测序得到的序列,采用Blast分析其基因保守区,利用primer3 plus(http://www.primer3p lus.com/cgi-bin/dev/primer3plus.cgi),根据expasyTr- anslate tool(https://web.expasy.org/tran slate/)译出的最长编码区,在编码区两端设计引物:F(ATGGATCTTCTCCTCTTGGAGAAAA)/R(TCAAAAGGATCTCGGCTTTGCAACA)。
1.2.2 枫香叶片RNA的提取和反转录 以枫香叶片作为试验材料,使用相应试剂盒提取总RNA,琼脂糖凝胶电泳检测RNA质量,用合格的RNA反转录合成第一链cDNA,获得cDNA样品。
1.2.3 枫香基因PCR扩增 以cDNA为模板,对cDNA片段进行扩增。PCR扩增体系(50 μL):模板2.0 μL+-F 1.0 μL+-R 1.0 μL+2×Taq PCR Master Mix 25 μL+ddH2O 21.0 μL。扩增程序为:95℃预变性5 min,95℃变性30 s,54℃退火30 s,72℃延伸120 s,35个循环;72℃再延伸120 s。采用1.0%琼脂糖凝胶电泳检测cDNA的PCR扩增产物并进行纯化回收。
1.2.4 载体构建 在16℃条件下,将回收产物与pMD19-T载体连接构建重组质粒,然后转化大肠杆菌trans1-T1。挑取阳性克隆,用引物进行PCR验证并测序。
1.2.5 测序序列分析 分析预测开放阅读框:NCBI ORFFinder;分析蛋白保守结构域:NCBI CD-Search;序列的相似性及同源性查找:NCBI Protein BLAST;预测理化特性:ExPASy ProtParam tool;预测编码蛋白的疏水性:ProtScale;亚细胞定位:Euk-mPLoc 2.0;蛋白质的N-磷酸化预测:NetPho 3.1;预测蛋白质二级结构:PSIPRED和SOPMA;同源三级结构建模分析:SWISS- MODEL;跨膜结构域分析:TMHMM Server 2.0;预测氨基酸信号肽:SignalP 4.1;序列同源性比较:DNAMAN软件的Multiple Alignment;通过MEGA (version 7.0.26)软件,采用相邻连接法(neighbor- joining NJ,执行参数为Bootstrap method 1000, Pairwise deletion)构建系统进化树。
2 结果与分析
2.1 枫香LfC4Hb基因克隆
以枫香叶片材料中RNA反转录得到的cDNA为模板,根据前期研究转录组测序得到的(GenBank:OL871171)序列设计的特异引物,进行RT-PCR扩增后获得了1条1 500 bp左右的条带,经琼脂糖凝胶电泳检测可见明显条带(图1-A),与预期大小一致。将PCR产物回收纯化,连接转化大肠杆菌(Trans1-T1),挑取单菌落进行菌落PCR验证,琼脂糖凝胶电泳结果如图1-B所示。将阳性菌液进行测序,所得基因和氨基酸序列见图2。将基因测序结果与序列进行核苷酸序列比对,发现二者之间存在7个碱基差异(图3),扩增核苷酸序列与序列基本一致,序列相似度达到97.29%;7个碱基的变化仅引起了1个氨基酸的变化(图4),氨基酸序列一致性达到99.8%,表明克隆得到的序列为枫香基因序列,将其命名为(GenBank: OL871170)。的cDNA序列全长为1 551 bp,其中5¢非翻译区长15 bp,3¢非翻译区长18 bp。
2.2 LfC4Hb保守结构域分析
对基因编码区进行翻译,发现其包含一个以ATG为起始密码子、TAG为终止密码子的完整开放阅读框,长度为1 518 bp,共编码505个氨基酸。对氨基酸序列进行比对分析,结果(图5)显示,基因编码的蛋白为多结构域蛋白,序列中包含p450家族蛋白的结构域。

A. 目的基因克隆(1为目的基因);B. 菌落PCR验证阳性克隆(1~8为阳性克隆)。

A. 目的基因cDNA序列;B. 目的氨基酸序列。

图3 目的基因与LfC4Ha基因序列比对

图4 目的基因与LfC4Ha氨基酸序列比对

图5 LfC4Hb编码蛋白的保守结构域分析
2.3 LfC4Hb蛋白理化性质分析与蛋白质结构预测
对LfC4Hb蛋白理化性质进行分析,结果发现,LfC4Hb蛋白质由505个氨基酸残基组成,氨基酸序列的预测结果见表1。由表1可知,Leu、Lys、Val、Glu、Arg氨基酸的使用频率相对较高,使用频率依次为12.3%、7.1%、7.1%、7.1%、6.7%。LfC4Hb蛋白分子式为C2638H4173N715O724S16,原子总数为8 266,分子量为58.00 kDa,其中带正电荷的氨基酸残基(Arg+Lys)有70个,带负电荷的氨基酸残基(Asp+Glu)有61个,理论等电点为9.13;LfC4Hb蛋白氨基酸残基中以A17(3.156)疏水性最强,A196(–2.722)亲水性最强,疏水性氨基酸的数量小于亲水性氨基酸的数量,平均亲水系数为-0.231(图6),不稳定指数为46.61,说明LfC4Hb蛋白为亲水性的不稳定蛋白质。利用Euk-mPLoc 2.0进行在线亚细胞定位分析,结果表明,LfC4Hb蛋白为膜蛋白,定位于内质网。LfC4Hb蛋白序列的磷酸化位点预测结果显示,LfC4Hb蛋白存在丰富的磷酸化位点,有潜在磷酸化位点35个(图7)。
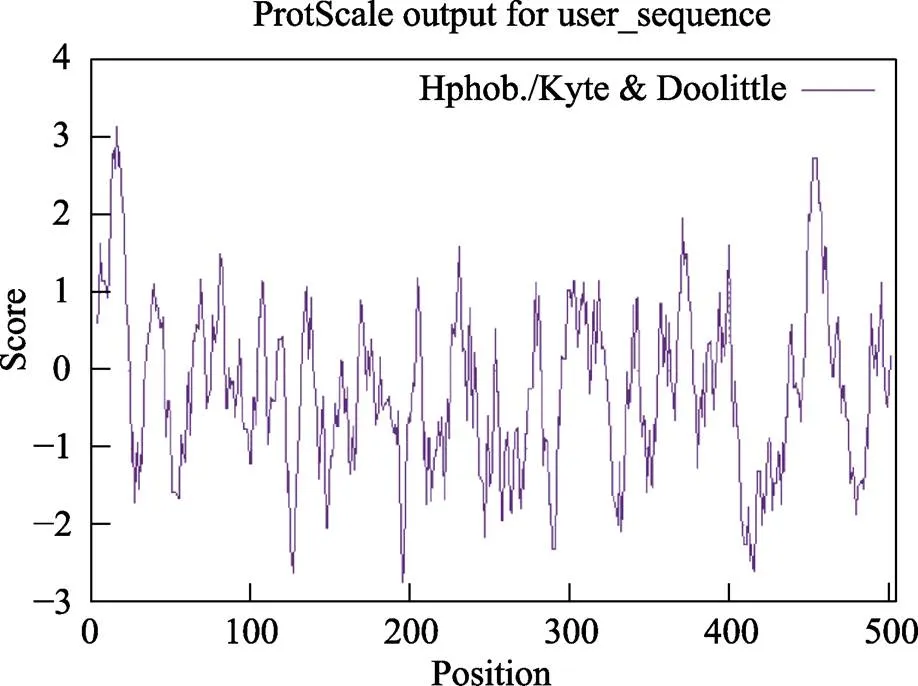
图6 LfC4Hb蛋白氨基酸序列的亲/疏水性分析
图7 LfC4Hb蛋白氨基酸序列的磷酸化位点预测
对蛋白的二级结构进行预测分析,结果显示,该蛋白具有20段-螺旋(Alpha helix)和9段-折叠(Beta turn)结构(图8),-螺旋占比为46.53%,无规则卷曲(Random coil)占比为34.46%,延伸链(Extended strand)占比为14.26%,-折叠占比为4.75%,说明该蛋白的二级结构主要为-螺旋和无规则卷曲。
运用SWISS-MODEL对LfC4Hb进行三级结构同源建模时发现,数据库中匹配度最高的模板是6vby.1.A,建模区域32~502位氨基酸中序列一致性为76.91%,注释为肉桂酸-4-羟基化酶即C4H蛋白。将LfC4Hb预测的三级结构(图9)与6vby.1.A模板相比较,可见蛋白结构组成、装配形式基本一致,从蛋白三级结构来推测,LfC4Hb可能具有与之类似的羟化酶活性,与预期相符。
2.4 LfC4Hb信号肽、跨膜区预测
蛋白质的信号肽序列位于其N端,在蛋白质后被切除,作用是指导分泌性蛋白合成,通常包含疏水核心区、信号肽N端和C端[19]。本研究分析了枫香LfC4Hb的信号肽序列,结果发现,该蛋白序列并不存在信号肽(图10)。同时对的跨膜区域进行预测,结果表明,LfC4Hb蛋白不含有跨膜结构域(图11)。

图8 LfC4Hb编码蛋白质二级结构分析

A. LfC4Hb编码蛋白三级结构;B. 6vby.1.A模板。

图10 LfC4Hb信号肽预测

图11 LfC4Hb跨膜区预测
2.5 LfC4Hb蛋白的同源比对分析
通过NCBI数据库查询到其他植物基因的氨基酸序列,利用DNAman软件进行比对分析。结果表明,枫香LfC4Hb蛋白与10个不同的植物均有较高的同源性。枫香基因在氨基酸水平与莲()同源性最高(94.5%),与青脆枝()同源性为94.1%,与喜树()同源性为93.9%,与蒂罗花()同源性为92.5%,与澳洲坚果()同源性为91.7%,与紫竹()同源性为91.3%,与芸香唐松草()同源性90.9%,与芍药()和雷公藤()同源性均为90.7%,与大麻槿()同源性为90.5%。分析还显示,LfC4Hb蛋白含有P450超家族的特征序列:FGVGRRSCPG(血红素结合域)和PPGPIPVG(富含脯氨酸的保守区域)(图12),同时还具有CYP73A1的5个特征性底物结合位点(substrate recognition sites, SRS):SRTRNVVFDTFTGKGQ MVFTVY(SRS1)、YNYGDFIPI(SRS2)、VENIN VAAIETTLWS(SRS3)、RMAIPLLVPHMNL(SRS4)以及KGGQFSLHI(SRS5)。
2.6 LfC4Hb蛋白的系统进化树构建
从NCBI数据库中筛选出与LfC4Hb氨基酸序列同源性较高的蛋白共9个,分别为芍药(,AGG55322.1)、雷公藤(,XP_038693505.1)、芸香唐松草(,KAF5177303.1)、青脆枝(,QNS29969.1)、莲(,XP_010252045.1)、蒂罗花(,XP_043723676.1)、澳洲坚果(,XP_042501716.1)、紫竹(,XP_021297241.1)、大麻槿(,AGJ84133.1)。利用MEGA 7.0.26软件的Neighbor-Joining法构建系统进化树(图13),发现枫香LfC4Hb蛋白与青脆枝亲缘关系相对较近,与紫竹、大麻槿亲缘关系较远。

红线方框. 富含脯氨酸和血红素结合域的保守区域; 黑线方框. 底物结合位点(SRS1~SRS5)。

图13 LfC4Hb系统进化树
3 讨论与结论
苯丙烷代谢途径是植物次生代谢的重要途径之一,对于植物的生长发育具有重要作用[20]。通常认为,此途径参与一系列生物反应形成花色素苷,并由几种酶共同参与完成催化[21],而C4H是其中的关键酶之一,对基因的克隆与功能研究已有一些报道[14,22]。
本研究克隆得到的枫香基因cDNA全长序列,命名为;该基因编码区存在一个长度为1 518 bp的完整开放阅读框,共编码505个氨基酸,与斑地锦[11]、龙血树[23]一致。基因相对而言,以小基因家族存在,是遗传多样性低、保守性较高的基因,杜仲(,Unigene9197)基因与川椒(ACF19421.1)、马铃薯(ABC69046.1)、紫草(, BAB71716.1)的C4H氨基酸序列相似性高达90%以上[24],龙血树与拟南芥的基因同源性亦达到92%以上[23]。本研究中基因在氨基酸水平与莲、青脆枝、喜树等的相似性也均高达90%以上,再次印证了植物中C4H蛋白具保守性这一结论。对LfC4Hb蛋白亲水性分析发现,其为亲水性的不稳定蛋白,与榅桲C4H[25]蛋白一致。预测LfC4Hb蛋白的二级结构发现,其由无规卷曲、-螺旋、-折叠构成,这与爬山虎、山葡萄等C4H蛋白二级结构相同[15],再次证明了为枫香的基因,且与已报道的基因的同源性极高。
本研究分离克隆了枫香的基因,丰富了基因资源,也为探讨枫香苯丙烷类次生代谢途径(包括黄酮类化合物生物合成途径)奠定了一定的基础,同时为枫香叶色新品种的培育提供了可操作基因。但枫香叶色的变化也受光照、温度等条件的影响,这些因素是否影响基因的表达尚不明确。在开展下一步研究时,可在本研究基础上探讨枫香的转录因子对结构基因的作用以及表达特性,从而进一步在分子层面揭示枫香叶片的呈色和变色机理,实现枫香的叶色调控。
[1] 李勇. 枫香速生优良无性系组织培养技术体系[J]. 广西林业科学, 2019, 48(2): 252-256.
[2] 杨继生. 枫香叶色变化过程中叶片结构和生理特征的研究[D]. 南宁: 广西大学, 2020.
[3] 尹国平, 刘雄盛, 蒋燚, 等. 枫香变红过程中叶片组织结构、光合特性及色素含量变化研究[J]. 广西植物, 2021: 5-10. https: //kns. cnki. net/kcms/detail/detail. aspx?dbcode= CAPJ&dbname=CAPJLAST&filename=GXZW20210719001&uniplatform=NZKPT&v=nld-w7thijbKahM_pf_mFmvAP b0rj61gXmeGojguZnooWaZqSfDmG1PJ_oUy4r3E
[4] 唐生森, 陈虎, 覃永康, 等. 枫香秋季变色期叶色变化及其生理基础[J]. 广西植物, 2021, 41(12): 2 061-2 068.
[5] 王冬雪, 孙海菁, 德永军, 等. 不同光质处理对枫香幼苗叶色的影响[J]. 林业科学研究, 2019, 32(4): 158-164.
[6] 赖玖鑫. 枫香叶色季节性变化及常彩叶机理研究[D]. 北京: 中国林业科学研究院, 2020.
[7] 李文鑫. 枫香优良无性系筛选及紫叶品系叶色变化相关基因模块鉴定[D]. 长沙: 中南林业科技大学, 2020.
[8] 王安娜, 王婵婵, 吴蕾, 等. 大豆基因克隆及生物信息学分析[J]. 东北农业大学学报, 2010, 41(4): 12-16+161.
[9] 赵乐, 马利刚, 杨泽岸, 等. 独行菜基因克隆与表达分析[J]. 药学学报, 2017, 52(5): 821-831.
[10] 魏建华, 宋艳茹. 木质素生物合成途径及调控的研究进展[J]. 植物学报, 2001, 43(8): 771-779.
[11] 郭三保, 黄胜和, 邹嘉轩, 等. 斑地锦肉桂酸4-羟基化酶基因及启动子的克隆与分析[J]. 分子植物育种,2021:1-10. https: //kns. cnki. net/kcms/detail/detail. aspx?dbcode= CAPJ&dbname=CAPJLAST&filename=FZZW20210312004&uniplatform=NZKPT&v=_MB1PS_Ch2CPdB0xVtwonH OaDpHHW3tgUsQ87cWvL_MdHvb-jt6X9lAvz9DbX9CY.
[12] 冯艺川, 赵洋, 全雪丽, 等. 膜荚黄芪基因的克隆及表达分析[J]. 分子植物育种, 2021, 19(1): 130-136.
[13] 朱佳鹏, 高珊, 罗超, 等. 滇水金凤C4H基因的克隆及序列分析[J]. 分子植物育种, 2020, 18(19): 6 247-6 255.
[14] LI G, LIU X, ZHANG Y, et al. Cloning and functional characterization of two cinnamate 4-hydroxylase genes from[J]. Plant Physiology and Biochemistry, 2020, 156(11): 135-145.
[15] 陈蒙, 刘海峰. 山葡萄基因的克隆表达及遗传转化分析[J]. 西南大学学报(自然科学版), 2019, 41(10): 11- 21.
[16] 陈德伟, 王昕, 李红叶, 等. 芍药基因的克隆及其在钙处理下的表达特性分析[J]. 分子植物育种, 2018, 16(9): 2 795-2 801.
[17] 罗小娇, 刘新春, 杨晓云, 等. 青稞基因的克隆及组织表达分析[J]. 植物遗传资源学报, 2014, 15(3): 589-596.
[18] 曾祥玲, 郑日如, 罗靖, 等. 桂花基因的克隆与表达特性分析[J]. 园艺学报, 2016, 43(3): 525-537.
[19] 张弢. 不同植物查尔酮合成酶基因的生物信息学分析[J]. 江西农业学报, 2012, 24(6): 5-8.
[20] 张雪, 唐铭浩, 陈蒙, 等. 山葡萄不同着色时期果皮转录组测序分析[J]. 果树学报, 2017, 34(7): 781-789.
[21] 王安娜. 大豆基因克隆及生物信息学分析[D]. 哈尔滨: 东北农业大学, 2010.
[22] Millar D J, Long M, Dononvan G, et al. Introduction of sense constructs of cinnamate 4-hydroxylase (CYP73A24) in transgenic tomato plants shows opposite effects on flux into stem lignin and fruit flavonoids[J]. Phytochemistry, 2007, 68(11): 1 497-1 509.
[23] 李爽, 杨春勇, 李戈, 等. 国产龙血竭基原植物肉桂酸-4-羟基化酶基因(C4H)分离比较[J]. 分子植物育种, 2021: 1-12. https: //kns. cnki. net/kcms/detail/detail. aspx?dbcode= CAPJ&dbname=CAPJLAST&filename=FZZW20211102001&uniplatform=NZKPT&v=_MB1PS_Ch2AQtWkHZl1T3N 1TSU4AupSkByJqbaqvO8Ayhe5ccomAVF8e1bAJh0vq.
[24] 李铁柱, 杜红岩, 王淋. 杜仲基因cDNA全长序列特征分析[J]. 经济林研究, 2014, 32(1): 34-39.
[25] 车玉红, 杨波, 郭春苗, 等. 榅桲基因的克隆、序列分析及表达[J]. 经济林研究, 2020, 38(2): 1-8.
Cloning and Bioinformatics Analysis ofGene of
LIU Xiongsheng YIN Guoping XIAO Yufei WANG Renjie HUANG Ronglin WANG Yong
(Guangxi Forestry Research Institute/Guangxi Key Laboratory of Superior Trees Resource Cultivation, Nanning, Guangxi 530002, China)
Cinnamate 4- hydroxylase() is the second important enzyme in anthocyanin synthesis. A pair of primers were designed based on thegene sequence screened from the RNA-Seq database ofleaves obtained in previous studies and then the nucleotide sequence ofwas cloned by RT-PCR and named. The gene was uploaded to GenBank database to obtain the gene login number (OL871170) of, and the bioinformatics analysis was conducted. The results showed that the length ofgene was 1 551 bp, which contained a complete open reading frame of 1 518 bp and encoded 505 amino acids. The conserved domain analysis showed that there was a p450 family protein domain. The molecular weight was 58.00 kDa and the theoretical isoelectric point was 9.13. The protein encoded bywas an unstable hydrophilic protein located in the endoplasmic reticulum. There were multiple phosphorylation sites,there was no signal peptide and no transmembrane domain. The secondary structure of the protein was mainly α -helix and random coil. The homology ofgene withwas the highest(94.5%).The phylogenetic analysis showed thatwas relatively close to.In this study,gene ofwas successfully cloned and the protein structure and function ofwere analyzed. It will be of great significance for further application of genetic engineering technology in leaf color regulation and breeding of new varieties of
; cinnamate 4- hydroxylase; gene cloning; bioinformatic analysis
S533
A
10.12008/j.issn.1009-2196.2022.06.008
2022-02-24;
2022-03-21
广西优良用材林资源培育重点实验室自主课题(No.2019-A-03-02);2021年自治区林业科技推广示范项目(No.桂林科研[2021]26号)。
刘雄盛(1988—),男,硕士,副研究员,研究方向为森林培育,E-mail:517261654@qq.com。
王勇(1983—),男,硕士,副高级工程师,研究方向为森林培育,E-mail:742722538@qq.com。
(责任编辑 林海妹)
