橙皮苷脂质体的制备及其体内药动学研究
2022-12-04吕东霞谈秀凤
禹 瑞, 吕东霞, 谈秀凤, 2
(1.郑州澍青医学高等专科学校,河南 郑州 450064;2.上海中医药大学,上海 201203)
橙皮苷是广泛存在于蝶形花科、芸香科、豆科植物中的二氢黄酮类化合物,具有抗肿瘤、抗氧化、调节糖脂质代谢、抗炎、保护心血管系统等药理活性[1-3],在妇科肿瘤及护理中也有较多应用[3],但该成分水溶性和脂溶性均较差[4],胃肠道容易被代谢[5],生物利用度仅为3.51%[6],从而限制其活性发挥及临床应用。目前,关于橙皮苷制剂新技术的研究涉及磷脂复合物[7]及其固体分散体[4]、自微乳[8]、包合物[9]等。
脂质体是一种具有类生物膜的纳米囊泡,主要材料是磷脂、胆固醇等,均可在机体内降解[10-11],故生物相容性好,安全性高。文献[12]报道,脂质体可有效改善药物溶解度及跨膜渗透性,将药物包裹后可使其免受体内各种酶的破坏作用,最终提高体内稳定性、生物利用度、药效等[13-14]。本实验制备橙皮苷脂质体,并对其体内药动学进行研究,以期为今后相关工作奠定基础。
1 材料
1.1 仪器 Agilent 1260型高效液相色谱仪(配置DAD检测器、温控进样器,美国Agilent公司);SH-2-001型磁力搅拌器(常州市亿能实验仪器厂);FA2204N型电子分析天平(配置防风罩,上海梅颖浦仪器仪表制造有限公司);RE-52AA型旋转蒸发仪(绍兴上虞艾科仪器设备有限公司);Tevnai-G2型透射电镜(美国Fei公司);FD-1C-50挂瓶型冷冻干燥机(江苏恒敏仪器制造有限公司);JC-WD-24型氮气吹扫仪(青岛聚创环保集团有限公司)等。
1.2 试剂与药物 橙皮苷对照品(批号110721-201927,纯度98.8%,中国食品药品检定研究院);橙皮苷原料药(批号MUST-18916011,纯度97.0%,成都曼思特生物科技有限公司);大豆磷脂酰胆碱(批号201016-2,上海辅必成医药科技有限公司);胆固醇(批号20200719,上海谱振生物有限公司)。
1.3 动物 清洁级SD大鼠,体质量230~260 g,购自河南省动物实验中心,动物生产许可证号SCXK(豫)2016-0001,在温度25 ℃、相对湿度45%的条件下饲养。
2 方法与结果
2.1 橙皮苷含量测定
2.1.2 线性关系考察 取橙皮苷对照品20.08 mg至50 mL量瓶中,加入3 mL吡啶溶解,甲醇定容至刻度,得401.6 μg/mL贮备液,流动相依次稀释至20.08、10.04、5.02、1.004、0.502、0.02 μg/mL,在“2.1.1”项色谱条件下进样测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=16.478 2X+0.976 3(r=0.999 8),在0.02~20.08 μg/mL范围内线性关系良好。
2.1.3 供试品溶液制备 取脂质体混悬液1 mL,置于100 mL量瓶中,甲醇超声处理3 min后定容,过0.45 μm微孔滤膜,取5 mL续滤液,置于10 mL量瓶中,流动相定容,即得。
2.1.4 方法学考察 按“2.1.3”项下方法制备6份供试品溶液,在“2.1.1”项色谱条件下进样测定,测得橙皮苷峰面积RSD为1.58%,表明该方法重复性良好。取同一份供试品溶液,于0、4、8、12、24、48 h在“2.1.1”项色谱条件下进样测定,测得橙皮苷峰面积RSD为0.64%,表明溶液在48 h内稳定性良好。取0.02、5.02、20.08 μg/mL对照品溶液适量,在“2.1.1”项色谱条件下各进样测定6次,测得橙皮苷峰面积RSD分别为0.96%、0.22%、0.47%,表明仪器精密度良好。取9份橙皮苷脂质体,每份0.5 mL,加入对照品溶液0.5、1.0、1.5 mL各3份,按“2.1.3”项下方法制备供试品溶液,在“2.1.1”项色谱条件下进样测定,测得橙皮苷平均加样回收率分别为100.32%、99.15%、100.77%,RSD分别为1.02%、1.60%、0.81%。
2.2 脂质体制备 采用薄膜分散法[13-14],取50 mg橙皮苷、1 g大豆磷脂酰胆碱,置于圆底烧瓶中,加入30 mL无水乙醇,在50 ℃下磁力搅拌至澄清,加入处方量胆固醇,继续搅拌至澄清后置于旋蒸仪(水浴温度50 ℃)中抽真空,除去有机溶剂,加入一定pH值的水相溶液30 mL,在一定温度下振荡使其充分水化,超声处理15 min,0.45 μm微孔滤膜过滤,即得。
2.3 包封率、载药量测定 采用低温高速离心法[15],取2 mL橙皮苷脂质体,4 ℃、14 500 r/min离心45 min,取上清液,HPLC法测定游离药量W1;取离心后沉淀物,真空干燥后精密称定质量W;按“2.1.3”项下方法制备供试品溶液,测定总药量W0,计算包封率、载药量,公式分别为包封率=[(W0-W1)/W0]×100%、载药量=[(W0-W1)/W]×100%。
2.4 粒径、Zeta电位测定 取0.2 mL脂质体,加入5 mL蒸馏水稀释,取约3.5 mL至比色皿中,采用粒径分析仪测定粒径、Zeta电位。
2.5 单因素试验 以包封率、载药量、粒径、Zeta电位为评价指标,对其进行归一化处理后得到总评“归一”值(OD值)。参考文献[16]报道,包封率(d1)、载药量(d2)、Zeta电位绝对值(d3)越大越好,公式为d1~3=(Mi-Mmin)/(Mmax-Mmin);粒径(d4)越小越好,公式为d4=(Mmax-Mi)/(Mmax-Mmin),Mi为测量值,Mmax和Mmin为所有试验中最大值和最小值,OD值=d1×25%+d2×25%+d3×25%+d4×25%。
2.5.1 药脂比 固定橙皮苷用量50 mg,大豆磷脂酰胆碱与胆固醇比例12.5∶1,水相pH值6.8,水化温度40 ℃,分别考察药脂比1∶10、1∶15、1∶20、1∶25对包封率、载药量、粒径、Zeta电位的影响,结果见表1。由此可知,随着脂质用量增加,包封率逐渐升高,载药量、粒径逐渐降低,而Zeta电位绝对值先升后降,在1∶20时OD值最高,故以其为最佳药脂比。
Gray clustering evaluation of university engineering survey laboratory safety management based on COWA
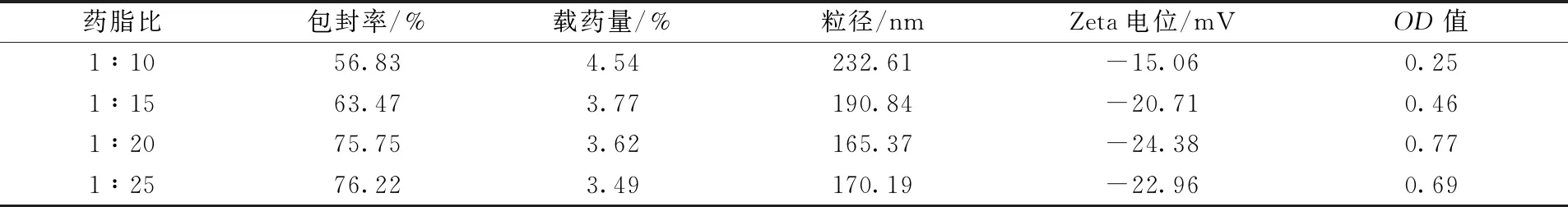
表1 药脂比对包封率、载药量、粒径、Zeta电位的影响(n=3)
2.5.2 大豆磷脂酰胆碱与胆固醇比例 固定橙皮苷用量50 mg,药脂比1∶20,水相pH值6.8,水化温度40 ℃,分别考察大豆磷脂酰胆碱与胆固醇比例8∶1、10∶1、12.5∶1、15∶1对包封率、载药量、粒径、Zeta电位的影响,结果见表2。由此可知,随着大豆磷脂酰胆碱用量增加,包封率、载药量、Zeta电位绝对值均呈现先升高后降低的趋势,而粒径恰好相反,在12.5∶1时OD值最高,故以其为最佳大豆磷脂酰胆碱与胆固醇比例。
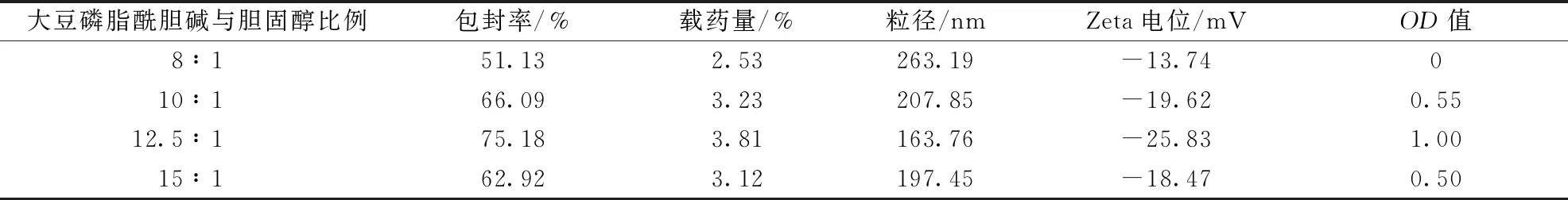
表2 大豆磷脂酰胆碱与胆固醇比例对包封率、载药量、粒径、Zeta电位的影响(n=3)
2.5.3 水相pH值 固定橙皮苷用量50 mg,药脂比1∶20,大豆磷脂酰胆碱与胆固醇比例12.5∶1,水化温度40 ℃,考察水相pH值5.5、6.0、6.5、7.0对包封率、载药量、粒径、Zeta电位的影响,结果见表3。由此可知,随着水相pH值增加,包封率、载药量均呈现先升高后降低的趋势,而粒径恰好相反,在6.5时OD值最高,故以其为最佳水相pH值。

表3 水相pH值对包封率、载药量、粒径、Zeta电位的影响(n=3)
2.5.4 水化温度 固定橙皮苷用量50 mg,药脂比1∶20,大豆磷脂酰胆碱与胆固醇比例12.5∶1,水相pH值6.5,分别考察水化温度30、35、40、45、55 ℃对包封率、载药量、粒径、Zeta电位的影响,结果见表4。由此可知,随着水化温度增加,包封率、载药量均呈现先升高后降低的趋势,可能是由于温度过低(低于大豆磷脂酰胆碱相变温度)不利于脂质膜吸水溶胀,从而影响包裹药物效率[13,17],但温度过高又可能会影响大豆磷脂酰胆碱稳定性,导致包封率、载药量降低,在45 ℃时OD值最高,故以其为最佳水化温度。

表4 水化温度对包封率、载药量、粒径、Zeta电位的影响(n=3)
2.6 验证试验及冻干粉制备 平行制备3批脂质体,按“2.5”项下结果进行验证试验,测得包封率为(75.41±1.78)%,载药量为(3.61±0.28)%,粒径为(161.28±8.04)nm,PDI为0.092±0.018,Zeta电位为(-24.86±1.77)mV,见图1~2。
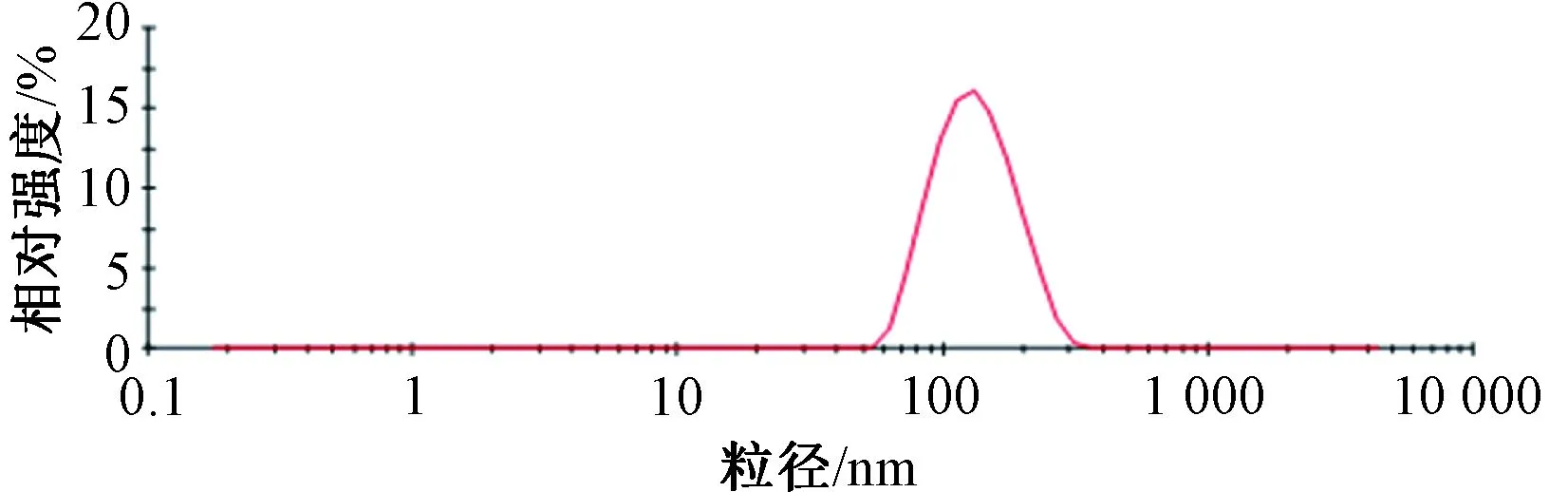
图1 橙皮苷脂质体粒径分布
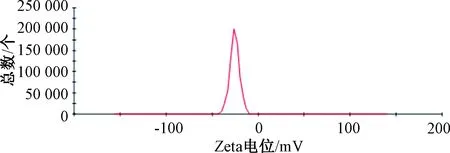
图2 橙皮苷脂质体Zeta电位
采用10%葡萄糖-甘露醇(1∶1)作为冻干保护剂,加到脂质体混悬液中,混匀后取3 mL至西林瓶中,置于-30 ℃冰箱中冷冻2 d后放到-25 ℃真空冻干机中冷冻2 d,即得冻干粉,其包封率为(70.31±1.46)%,粒径为(187.76±8.79)nm,PDI为0.162±0.031,Zeta电位为(-22.23±1.52)mV,外观见图3,可知其外形饱满,色泽均一。

图3 脂质体混悬液(A)、冻干粉(B)外观
2.7 体外释药研究
2.7.1 人工胃液制备 取3.8 mL浓盐酸,加入500 mL纯化水;另取10 g胃蛋白酶,加入400 mL纯化水溶解,将2种溶液合并后加入5 mL 吐温-80,纯化水定容至1 000 mL,摇匀后超声处理15 min,即得。
2.7.2 人工肠液制备 取6.8 g磷酸二氢钾,加入500 mL纯化水溶解,0.1 mol/L NaOH调节pH至6.8;另取10 g胰蛋白酶,加入400 mL纯化水溶解,将2种溶液合并后加入5 mL吐温-80,纯化水定容至1 000 mL,摇匀后超声处理15 min,即得。
2.7.3 操作过程 橙皮苷在25 ℃水、人工胃液、人工肠液中的溶解度分别为28.63、116.79、202.04 μg/mL,故30 mg该成分在1 000 mL人工胃液或人工肠液中可达漏槽条件。取橙皮苷及其脂质体冻干粉(含20 mg橙皮苷)适量,加入3 mL人工胃液,置于透析袋(截留分子量8 000~14 000 Da)中,两端系紧。取1 000 mL人工胃液作为释放介质,设置转速为100 r/min,温度为37 ℃,在0、0.5、1、1.5、2、3、4、6、8、12、24、36 h各取样4 mL,0.45 μm微孔滤膜过滤,在“2.1.1”项色谱条件下进样测定,计算累积释放度,然后将两者在人工肠液中进行相同实验,结果见图4。由此可知,脂质体在人工胃液、人工肠液中36 h内累积释放度分别为84.26%、79.61%,均明显高于原料药。

图4 橙皮苷体外释药曲线(n=3)
2.8 体内药动学研究
2.8.1 分组、给药与采血 取橙皮苷、物理混合物(空白脂质体冻干粉+橙皮苷)、脂质体冻干粉适量,0.3%CMC-Na溶液制成灌胃液(橙皮苷质量浓度均为10 mg/mL),临用现配。18只大鼠禁食12 h,自由饮水,随机分为取橙皮苷组、物理混合物组、橙皮苷脂质体组,每组6只,称定质量,5 mL注射器吸取灌胃液后通过灌胃针输送至胃内,剂量均为60 mg/kg。乙醚麻醉大鼠后,于0、0.167、0.5、0.75、1、2、3、4、6、8、10、12 h眼眶后静脉丛取血各约0.3 mL,置于抗凝剂浸润后的离心管中,3 000 r/min离心2 min,取上层浅黄色血浆,冷冻保存。
2.8.2 血浆处理 参考文献[6]报道,取100 μL血浆至离心管中,加入甲醇1.0 mL,密封后涡旋5 min,0 ℃、6 000 r/min离心6 min,取有机相至另一空白离心管中,40 ℃氮气吹除有机溶剂,得残渣,100 μL甲醇复溶。
2.8.3 线性关系考察 取橙皮苷对照品适量,甲醇制成4 016、2 008、1 004、502、100.4、20.08 ng/mL溶液,分别取100 μL,40 ℃氮气吹除有机溶剂,得残渣,加入100 μL空白血浆密封涡旋5 min,按“2.8.2”项下方法处理,即得血浆对照品溶液,在“2.1.1”项色谱条件下进样测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=0.004 7X+0.224 8(r=0.990 7),在20.08~4 016 ng/mL范围内线性关系良好。
2.8.4 专属性试验 取空白血浆、给药12 h后血浆、20.08 ng/mL血浆对照品溶液适量,在“2.1.1”项色谱条件下进样测定,结果见图5,可知该方法专属性良好。
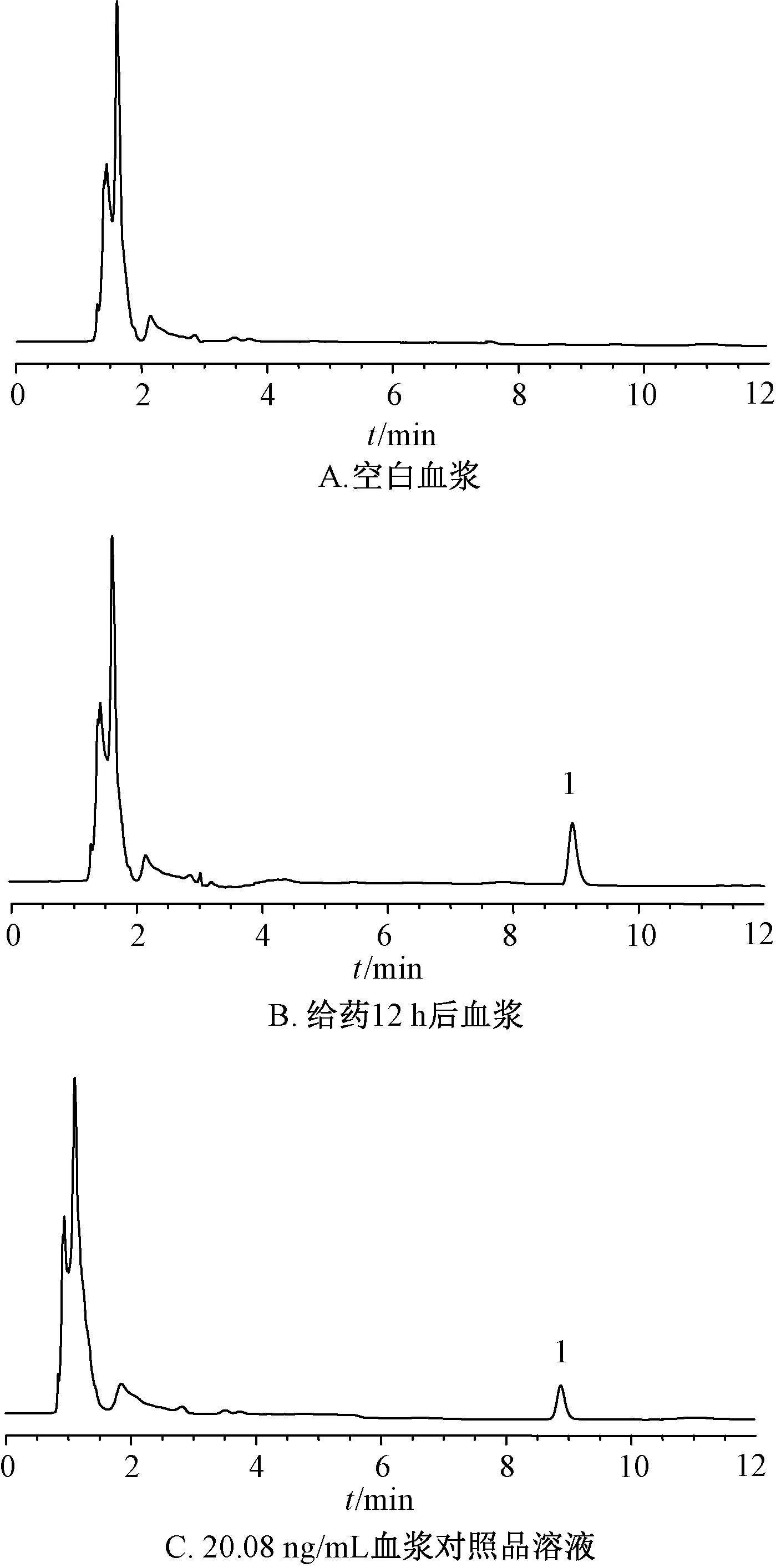
1. 橙皮苷1.hesperidin
2.8.5 方法学考察 分别取20.08、1 004、4 016 ng/mL血浆对照品溶液适量,在“2.1.1”项色谱条件下各进样测定6次,测定橙皮苷峰面积RSD分别为10.91%、6.78%、8.44%,表明仪器精密度良好。取上述3种溶液适量,于0、3、6、9、12、18、24 h在“2.1.1”项色谱条件下进样测定,测得橙皮苷峰面积RSD分别为8.04%、4.96%、7.13%,表明溶液在24 h内稳定性良好。取上述3种溶液适量,在“2.1.1”项色谱条件下各进样测定3次,测得橙皮苷平均加样回收率分别为93.66%、88.75%、91.80%,RSD分别为9.93%、4.76%、8.17%。
2.8.6 结果分析 血药浓度采用DAS2.0软件进行非房室模型拟合,统计矩法计算主要药动学参数,达峰浓度(Cmax)、药-时曲线下面积(AUC)经对数转换后进行t检验,达峰时间(tmax)、半衰期(t1/2)采用非参数法秩和检验,结果见表5、图6。由此可知,与原料药比较,物理混合物tmax、t1/2、Cmax、AUC0~t、AUC0~∞有一定变化,但差异无统计学意义(P>0.05),表明简单混合后并不能起到明显的促吸收作用;与原料药、物理混合物比较,脂质体tmax延长(P<0.01),t1/2、Cmax、AUC0~t、AUC0~∞升高(P<0.01),口服生物利用度提高至4.16倍。
3 讨论
本实验发现,橙皮苷原料药在达到漏槽条件时仍未完全溶出,可能与其粒度较大、疏水性较强等原因有关[18]。前期报道,脂质体在人工胃液中的稳定性相对较低,但在人工肠液中较高,并且结构稳定,可发挥缓释作用[10,14],与本实验结果一致。另外,糖类冻干剂可通过水取代机制附着在脂质体周围[19],进而起到保护作用,但其外观一般较差,故需与醇类保护剂联合使用以弥补不足。

表5 橙皮苷主要药动学参数

图6 橙皮苷血药浓度-时间曲线(n=6)
凡小燕[8]将橙皮苷制成自微乳,但需使用大量表面活性剂。牛晓磊等[4]对橙皮苷磷脂复合物固体分散体进行研究,但药物与磷脂复合物容易发生解离,生物利用度的提高程度有限(仅为2.54倍)。本研究制备了橙皮苷脂质体,辅料安全性高,tmax延长,可能是由于脂质体缓释作用所致,同时也影响了入血速度,使t1/2延长;Cmax升高可能与脂质体促进原料药释放有关。李正荣[20]报道,脂质体口服3 h后在大鼠胃肠道中均可检测到,表明该剂型在机体内可保持原有结构,有助于发挥其促吸收作用;本实验发现,橙皮苷脂质体生物利用度得到提高是多种原因共同作用的结果,如脂质体促进药物释放、降低首过效应、增加药物渗透性、延长药物t1/2使其被充分吸收等[14,21]。
本实验结果显示,虽然物理混合物生物利用度有所提高,但程度远低于橙皮苷脂质体,表明未被破坏的脂质体发挥了促吸收作用。脂质体口服后,在体内的结构稳定性、表面性质、膳食成分等因素也会影响其递药效率及生物利用度的提高程度。
