菊苣酸体外抗呼吸道合胞病毒的作用
2022-12-04王红,冯帅,史磊,李鹏,李峰*
王 红, 冯 帅, 史 磊, 李 鹏, 李 峰*
(1.山东中医药大学药学院,山东 济南 250355;2.山东省医学科学院基础医学研究所,山东第一医科大学,山东 济南 250062)
呼吸道合胞病毒(RSV)是副黏病毒科肺炎病毒属的一种在全球范围内引起婴幼儿急性下呼吸道感染的人类呼吸道病毒[1-2],其易感人群主要为6个月以下的婴儿及高龄人群,RSV感染后可引起毛细支气管炎、肺炎、上呼吸道感染等多种临床疾病,严重者还可引起病毒性哮喘[3]。全球每年约有3 300万名婴幼儿死于呼吸道疾病,因RSV感染死亡的婴幼儿和老人数量也呈现出上升的趋势,严重危害人类健康,逐渐引发社会关注[4]。
菊苣酸是一种主要存在于紫锥菊、菊苣中的苯丙酸类化合物,具有抑菌、抗病毒、抗炎及调节免疫的作用[5-8]。菊苣酸对多种病毒具有抑制作用。Zhang等[9]通过D-半乳糖胺诱导的人正常肝细胞HL-7702损伤模型研究菊苣叶中菊苣酸抗乙型肝炎的特性,结果表明,10~100 μg/mL菊苣酸能够减轻其损伤;1~100 μg/mL菊苣酸在受感染的鸭胎肝细胞中显著抑制鸭乙型肝炎病毒(DHBV)的DNA复制。Langland等[10]发现,菊苣酸等具有咖啡酰基部分有机化合物与各种金属和其他无机离子配对时,其咖啡酸抗单纯疱疹病毒(HSV)的特性增强。Robinson等[11]通过体外实验验证,人类免疫缺陷病毒(HIV)整合酶抑制剂L-菊苣酸与蛋白酶抑制剂、齐多夫定组合具有抗HIV活性的作用。
目前,菊苣酸抗病毒作用已有不少报道,但其抗RSV的研究却很少,本实验从细胞水平研究菊苣酸抗RSV的作用,以期为进一步开展菊苣酸抗病毒机制研究和新药研制提供理论基础。
1 材料
1.1 试剂与药物 菊苣酸对照品(纯度≥98%,批号P08M10F82474),购自上海源叶生物科技有限公司;利巴韦林注射液(批号01905083),购自石药银湖制药有限公司;Quacell特级胎牛血清(南美血源,批号1234567890),购自中山康天晟合生物技术有限公司;不完全RPMI-1640细胞培养液(不含双抗)、青链霉素混合液(批号20190622、20190724),购自江苏凯基生物技术股份有限公司;0.25% Trysin-EDTA(批号2048080),购自美国Gibco公司;TRNzol Universal总RNA提取试剂(批号U8807),购自天根生化科技(北京)有限公司;HiScript® Ⅲ RT SuperMix for qPCR(+gDNA wiper)(批号7E402G0),购自南京诺唯赞生物科技股份有限公司;TB Green® Premix Ex Taq Ⅱ(Tli RNaseH Plus)(批号AJF25979A),购自宝日医生物技术(北京)有限公司;50×TAE缓冲液(批号20191204),购自北京索莱宝科技有限公司;Regular AGAROSE G-10(批号182215),购自上海徕创生物科技有限公司;磷酸盐缓冲液(PBS,pH 7.4),购自国药集团化学试剂有限公司。中性红、氯仿(批号20120710、20130730),购自天津市科密欧化学试剂有限公司;氯化钠(NaCl)、氯化钾(KCl)、磷酸二氢钾(KH2PO4)、磷酸氢二钠(Na2HPO4)、异丙醇、无水乙醇(批号20180602、20150315、20160929、20180410、20190227、20190517),购自国药集团化学试剂有限公司;DEPC水(批号011720200417),购自上海碧云天生物技术有限公司。
1.2 细胞与病毒 人喉癌上皮细胞(Hep-2)和RSV均由山东省医学科学院基础医学研究所提供。所有涉及RSV的实验均在山东省医学科学院基础医学研究所BSL-2实验室中进行。
1.3 仪器 ABI 7500型荧光定量PCR仪(美国ABI公司);Nanodrop One超微量紫外光度计、-80 ℃ 725型超低温冰柜(美国Thermo公司);超净工作台(上海力申科学仪器有限公司);CO2恒温培养箱(山东莱索科技有限公司);TD5M型高速台式离心机(长沙湘智离心机仪器有限公司);酶标仪(芬兰Labsystems公司);倒置显微镜(日本Olympus公司);DYY-6C型电泳仪(北京六一生物科技有限公司);微波炉(广东格兰仕微波生活电器制造有限公司)。
1.4 引物 根据Genebank已收录的呼吸道合胞病毒融合蛋白(RSV-F),甘油醛-3-磷酸脱氢酶(GAPDH)应用引物设计与合成委托铂尚生物技术(上海)有限公司,见表1。
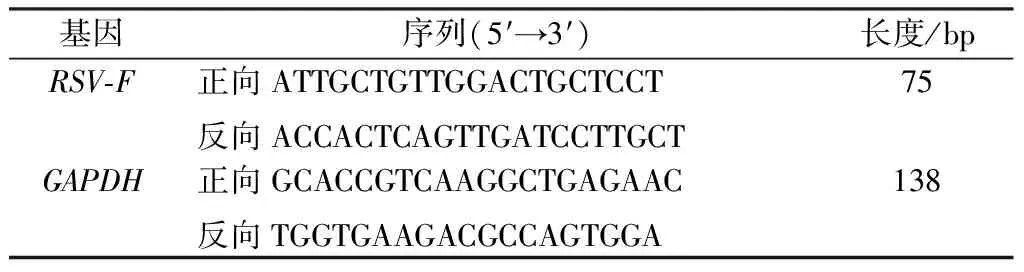
表1 引物序列
2 方法
2.1 溶液配制
2.1.1 菊苣酸 称取菊苣酸对照品4 mg,加入2 mL PBS,用移液器吹打均匀使其完全溶解,0.22 μm微孔滤膜过滤,配制成质量浓度为2 mg/mL的溶液,避光冷藏保存。
2.1.2 利巴韦林 将100 mg/mL利巴韦林注射液用PBS稀释成4 mg/mL,0.22 μm微孔滤膜过滤除菌,置4 ℃冰箱保存备用。
2.1.3 PBS 称取NaCl 80 g、KCl 2 g、KH2PO42.4 g、Na2HPO436.28 g,加蒸馏水至1 L,调整pH值为7.4,过滤除菌,分装,置4 ℃冰箱保存备用。
2.1.4 中性红染液 称取NaCl 50 g、中性红2.5 g,在450 mL蒸馏水中加入50 g NaCl使其完全溶解,配制成0.9% NaCl溶液,与中性红粉末混匀,即得。
2.1.5 脱色液 50%乙醇与0.1 moL/L Na2HPO4溶液混匀,即得。
2.2 细胞复苏传代 将冻存于液氮罐中的Hep-2细胞冻存管取出,迅速放入37 ℃水中搅动使其快速溶解,1 200 r/min离心5 min,弃去冻存管内的冻存液,于离心管中加入1 mL含10%特级胎牛血清(FBS)的RPMI 1640,将细胞吹打均匀并转移至细胞培养瓶中,加入9 mL含10% FBS的RPMI 1640,于37 ℃、5% CO2条件下培养24 h,待其长成单层后,用0.25%胰蛋白酶消化,进行1∶2传代,细胞长成单层时用于病毒扩增或体外抗病毒实验。
2.3 病毒扩增 将长有单层Hep-2细胞的培养瓶中的培养液弃去,PBS冲洗3次,将RSV接种到已长成单层的细胞上,37 ℃吸附30 min,加入10 mL 1640维持液(含2% FBS的RPMI 1640),置37 ℃、5% CO2条件下培养。同时设置细胞对照组,只添加等体积含2% FBS的RPMI 1640,显微镜下观察细胞病变效应,待病变达到85%以上时终止实验,反复冻融3次,1 200 r/min离心5 min,上清液定量分装,于-80 ℃冰箱保存备用。
2.4 病毒毒力检测 采用Reed-Muench法[12]检测病毒半数组织培养感染剂量(TCID50)。将Hep-2细胞以每孔1×105个的密度接种到96孔板中,在37 ℃、5% CO2条件下培养过夜,用2% RPMI 1640将病毒液以10倍比依次稀释(1×10-1~1×10-12),横向依次接种在96孔板内单层细胞上,纵向重复3孔,在37 ℃、5% CO2条件下培养,每天观察细胞病变效应,96 h后每孔加入100 μL中性红染液,置37 ℃染色1 h,弃去染液,用水将多余染料充分洗涤,每孔加入100 μL脱色液,室温放置15 min,在540 nm处检测吸光度(A),计算TCID50。
2.5 药物对Hep-2细胞毒性实验 在96孔板中接种Hep-2细胞,培养24 h使细胞形成单层,用2% RPMI 1640将菊苣酸、利巴韦林进行2倍比系列稀释,按稀释度顺序横向接种于96孔板中的Hep-2细胞上,每孔100 μL,每个稀释度设置3个复孔,并设置细胞对照组,在37 ℃、5% CO2条件下培养72 h,采用Reed-muench法计算药物半数中毒浓度(TC50),在540 nm处检测吸光度(A),计算细胞存活率。
2.7 菊苣酸不同给药方式对RSV增殖的影响 将Hep-2细胞接种于96孔板中,培养24 h后使细胞长成单层,按照以下3种方式进行抗RSV活性检测,分别为先加RSV,2 h后添加菊苣酸;先加菊苣酸,2 h后添加RSV;同时添加RSV和菊苣酸,按“2.5”项下方法检测不同给药方式对菊苣酸抗RSV活性的影响。
2.8 菊苣酸抑制RSV复制时段的影响
2.8.1 吸附实验 参考文献[14]报道,将长成单层的Hep-2细胞在4 ℃下预冷1 h,弃去培养液,接种100 TCID50的RSV和62.5、31.25、15.63、7.813、3.91、1.953、0.98、0.49 μg/mL菊苣酸(50 μL/孔),在4 ℃下孵育3 h,弃去培养液,PBS洗3次,添加细胞维持液,放入37 ℃、5% CO2培养箱中培养,同时设置正常细胞对照和病毒对照,按“2.5”项下方法检测菊苣酸对RSV吸附细胞的影响。
2.8.2 穿入实验 参考文献[14]报道,将长成单层的Hep-2细胞在4 ℃下预冷1 h,弃去培养液,接种RSV(50 μL/孔),4 ℃ 孵育3 h,加入62.5、31.25、15.63、7.813、3.91、1.953、0.98、0.49 μg/mL菊苣酸药液(50 μL/孔),37 ℃、5% CO2孵育1 h,弃去培养液,用碱性PBS(pH 11)处理1 min,灭活未穿入病毒,立即用酸性PBS(pH 3)中和,弃去中性PBS,添加细胞维持液,放入37 ℃、5% CO2培养箱中继续培养,同时设正常细胞对照和病毒对照,按“2.5”项下方法检测菊苣酸对RSV穿入细胞的影响。
2.9 RT-qPCR法检测RSV基因组复制 将长成单层的Hep-2细胞在37 ℃、5%CO2条件下孵育12 h,弃上清,接种RSV,2 h后弃病毒液,PBS冲洗2次,加入125 μg/mL菊苣酸及250 μg/mL利巴韦林药液,同时设置细胞对照组和病毒对照组,当病毒对照组细胞病变达到85%以上时,采用TRIzol法提取总RNA,1.2%琼脂糖凝胶电泳观察RNA 28S、18S、5S条带清晰度,检测RNA降解和DNA污染。在260、280 nm波长处检测吸光度(A),计算RNA的纯度和含量。按照逆转录试剂盒说明书配制相应试剂,37 ℃ 15 min,85 ℃ 15 s进行逆转录,-20 ℃保存备用。按照PCR扩增反应试剂盒说明书配置相应试剂,进行扩增反应,反应条件为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,共40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。以GAPDH为内参,采用2-ΔΔCT法进行RSV-F相对定量分析。

3 结果
3.1 病毒TCID50检测 RSV的TCID50为1×10-6.667/0.1 mL。
3.2 菊苣酸对Hep-2细胞的毒性 随着菊苣酸质量浓度的减小,细胞折光性、皱缩、变圆、破碎甚至脱落等细胞病变效应特征减弱。当菊苣酸质量浓度≥250 μg/mL时,细胞存活率低于50%;当菊苣酸质量浓度≤125 μg/mL时,细胞病变极少,存活率达90%以上,见图1。菊苣酸TC50值为171.9 μg/mL,其阳性对照利巴韦林TC50值为578.7 μg/mL。
3.3 菊苣酸对RSV的抑制作用 由图2可知,细胞对照组细胞呈现鳞形,数量多,排列紧密;病毒对照组细胞变圆,皱缩,间隙增大,脱落;菊苣酸组细胞排列紧密,未变圆;利巴韦林组中细胞出现大量病变,细胞变圆,发生皱缩,间隙增大,甚至脱落,提示药物在无药物毒性范围内能有效地抑制RSV引起的细胞病变。对菊苣酸和利巴韦林(两者质量浓度均为62.5~0.122 μg/mL)抗RSV效果进行比较,发现菊苣酸优于利巴韦林(P<0.05),见图3。菊苣酸抑制RSV的EC50值为0.083 μg/mL,TI为2 071;利巴韦林EC50值为138.825 μg/mL,TI为4.2。
3.4 菊苣酸不同给药方式对RSV增殖的影响 感染RSV 2 h后添加菊苣酸,添加菊苣酸2 h后再接种RSV以及同时添加菊苣酸和RSV的3组实验中,菊苣酸对RSV均具有抑制作用,并且各实验组之间无明显差异(P>0.05),见图4。
3.5 菊苣酸抑制RSV复制时段的影响 分别在RSV吸附和穿入细胞时,添加不同浓度的菊苣酸进行干预,结果表明吸附和穿入组的细胞存活率皆与病毒组相当,并未因菊苣酸的干预而延缓细胞病变。由此表明,菊苣酸对RSV吸附和穿入细胞的过程无抑制作用,菊苣酸的抗RSV作用应发生在病毒穿入细胞以后的某个阶段,见图5~6。
3.6 菊苣酸对RSV基因组复制的影响 与病毒对照组比较,菊苣酸组和阳性对照利巴韦林组RSV-FmRNA表达低于病毒对照组(P<0.01),说明在复制阶段,菊苣酸能够抑制RSV的复制表达(P<0.01),见表2。
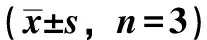
表2 菊苣酸对RSV基因组复制的影响
4 讨论
本研究通过细胞病变效应法在细胞水平研究菊苣酸抗RSV的作用,结果表明,菊苣酸对RSV在Hep-2细胞内的复制过程具有抑制作用,其EC50值为0.083 μg/mL,TI为2 071,根据新药药理毒理学研究指导原则,TI>2则视为高效低毒[15]。不同给药方式的实验结果显示,无论是先感染RSV还是先加入菊苣酸,菊苣酸都具有抑制RSV的作用,表明菊苣酸在RSV侵入细胞的阶段并未发挥其抗病毒作用。菊苣酸阻断RSV穿入与吸附的实验研究表明,干预组细胞存活率与病毒对照组无显著差异,并未因为菊苣酸的干扰而延缓细胞病变,即菊苣酸对RSV吸附和穿入细胞的过程均无抑制作用。RT-qPCR结果表明,菊苣酸可以抑制RSV基因组的复制。因此,可以确定菊苣酸对RSV的抑制是发生在病毒穿入细胞后的阶段。
菊苣酸是从天然植物中提取出来的活性成分,成分单一明确,安全性相对较高。目前,临床上常用的抗RSV药物为西药利巴韦林,然而其只适合病重者及高危人群的治疗[16],并且在临床上具有一定的不良反应,如头痛、恶心、出血、高剂量利巴韦林对心脏还有损伤[17-18],因此其治疗的有效性和安全性依然有待研究[19]。本研究还发现其阳性对照利巴韦林的TI为4.2,抑制RSV的效果弱于菊苣酸,提示菊苣酸有望成为抗RSV的候选药物的主要有效成分。
另外,菊苣酸对RSV穿入细胞后的抗病毒机制可能为①阻止RSV的蛋白表达,或阻断非结构蛋白的功能;②诱导细胞产生IFN;③刺激免疫细胞或诱导多种细胞因子发挥免疫调节作用。菊苣酸确切的抗病毒机制还需要进一步的研究。
综上所述,菊苣酸具有显著的抗RSV作用,提示其具有用于治疗RSV感染的良好前景,且为进一步的体内实验和临床应用提供了理论基础。
