内镜下不同方法治疗直肠神经内分泌肿瘤的疗效分析*
2022-12-02曹友红庄端明邢一鸣马亦旻顾磊唐月华丁松徐桂芳
曹友红,庄端明,邢一鸣,马亦旻,顾磊,唐月华,丁松,徐桂芳
(1.南京大学附属鼓楼医院高淳分院 消化科,江苏 南京 211300;2.南京大学附属鼓楼医院 消化科,江苏 南京 210008)
直肠神经内分泌肿瘤(neuroendocrine neoplasm,NEN)为分布于直肠神经内分泌细胞的少见肿瘤。直肠NEN 较为罕见[1],其发病率约为0.17%[2]。结直肠、小肠、胃及胰腺部的NEN 占全身的2/3[3]。传统上,直肠NEN 根据分化程度分为:分化良好的直肠神经内分泌瘤(neuroendocrine tumor,NET)和分化较差的直肠神经内分泌癌(neuroendocrine carcinoma,NEC)[4]。由于直肠NEN 的高度异质性和不确定性,给临床诊治带来了困惑。本研究回顾性分析了内镜下3 种不同手术方法治疗直肠NEN 的R0 切除率、安全性及生存情况,探讨3种手术方式的优缺点,以及临床采取何种方式更简便和高效。
1 资料和方法
1.1 一般资料
回顾性分析2014年1月-2020年1月南京鼓楼医院高淳分院消化科86例经肠镜白光及活检病理判断为直肠NEN的患者的临床资料,根据不同手术方式,将患者分为内镜下黏膜切除术(endoscopic mucosal resection,EMR)组(EMR组,n=23)、内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)组(ESD组,n=49)和内镜全层切除术(endoscopic full thickness resection,EFR)组(EFR 组,n=14)。86例患者中,男49例,女37例,年龄27~74岁,平均(52.16±11.07)岁。3 组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
本研究通过本院医学伦理委员会的审查。纳入标准:病变位于直肠;内镜治疗前行胸腹部CT 检查,确保无淋巴结及远处转移者;患者均知情同意并签署同意书。排除标准:有内镜下治疗绝对禁忌证的患者;长期服用抗凝药物,且未进行提前干预者;有严重的基础疾病及心肺功能异常者。
1.2 器材
Olympus CV-290主机、CF-HQ 290、GIF-Q 260J治疗镜、尼龙圈和透明帽,一次性使用高频电刀(南微医学“黄金”刀),波士顿科学注射针及圈套器、注水和热活检钳,ERBE 高频电外科工作站(VIO300S),Olympus CO2气泵,西甲硅油乳剂(德国柏林化学股份有限公司),和谐夹(南微医学科技股份有限公司)。
1.3 方法
1.3.1 术前处理 由2 名熟练掌握ESD 操作技巧,经验丰富的副主任医师及其以上级别者完成操作。3组患者术前均行血小板、凝血常规、胸腹部增强CT和肠镜及超声内镜等检查,初步确定病灶的部位、大小、色泽、浸润深度和病变范围等。
1.3.2 EMR 在病变处黏膜下注射生理盐水+肾上腺素,抬高病变组织,使黏膜层和固有肌层分离,使用圈套器圈套病变后,行高频电刀通电切除。见图1。

图1 EMR过程Fig.1 Process of endoscopic mucosal resection
1.3.3 ESD 完成病灶边缘标记、黏膜下注射、切开边缘、剥离病变、止血和部分钛夹封闭创面等步骤,最后切除病变组织。见图2。
1.3.4 EFR 完成病灶边缘标记、黏膜下注射、切开边缘步骤,再连同消化道管壁全层一并切除,最后切除病变组织,创面止血后,尼龙圈联合钛夹封闭创面或直接钛夹封闭创面。见图3。

图3 EFR过程Fig.3 Process of endoscopic full thickness resection
1.3.5 标本处理 3 种手术方式取出离体标本后展平,使用“大头针”反面或正面平铺固定于平面泡沫上。
1.4 随访
NEN 具有潜在恶性,故需长期随访。治愈性切除的患者,术后6个月以及之后每年进行一次肠镜检查,同时复查胸腹部增强CT,以明确是否有淋巴结和其他脏器远处转移;非治愈性切除的患者,3个月后复查内镜和胸腹部增强CT。
1.5 观察指标
1.5.1 一般资料 性别、年龄、吸烟史和饮酒史。
1.5.2 病变资料 病灶部位、形态、色泽、病灶面积和术前超声深度等。
1.5.3 内镜疗效 手术时间、病灶切除面积、住院时间、一次性整块切除率、一次性R0 切除率、术后并发症发生率和3年生存率。
1.5.4 术后病理 NEN病理分型、脉管及神经浸润、浸润深度、水平及垂直切缘、突触小泡蛋白(synaptophysine,Syn)、嗜铬粒蛋白A(chromogranin A,CgA)和CD56表达情况。
1.6 统计学方法
选用SPSS 26.0 软件对数据进行统计分析。计量资料经正态性检验,符合正态分布的资料以均数±标准差()表示,采用单因素方差分析进行组间比较,进一步两两比较采用SNK 法;不符合正态分布的计量资料以中位数(四分位数)[M(P25,P75)]表示,采用Kruskal-WallisH检验进行组间比较,用Nemenyi法进行两两比较。计数资料以例(%)表示,无序分类资料组间比较采用χ2检验或校正χ2检验,进一步两两比较采用χ2分割法;有序分类资料组间比较采用Kruskal-WallisH检验。采用Kplan-Meier法绘制生存曲线,Log-rank检验比较不同手术方式的3年生存率。P<0.05为差异有统计学意义。
2 结果
2.1 3组患者病变特征比较
EFR组直肠周边有淋巴结人数所占比例明显高于ESD组及EMR组(P<0.05)。EFR组病灶面积明显大于EMR 组和ESD 组,差异有统计学意义(P<0.05)。3组患者病灶部位、病灶形态和病灶色泽比较,差异无统计学意义(P>0.05)。见表2。
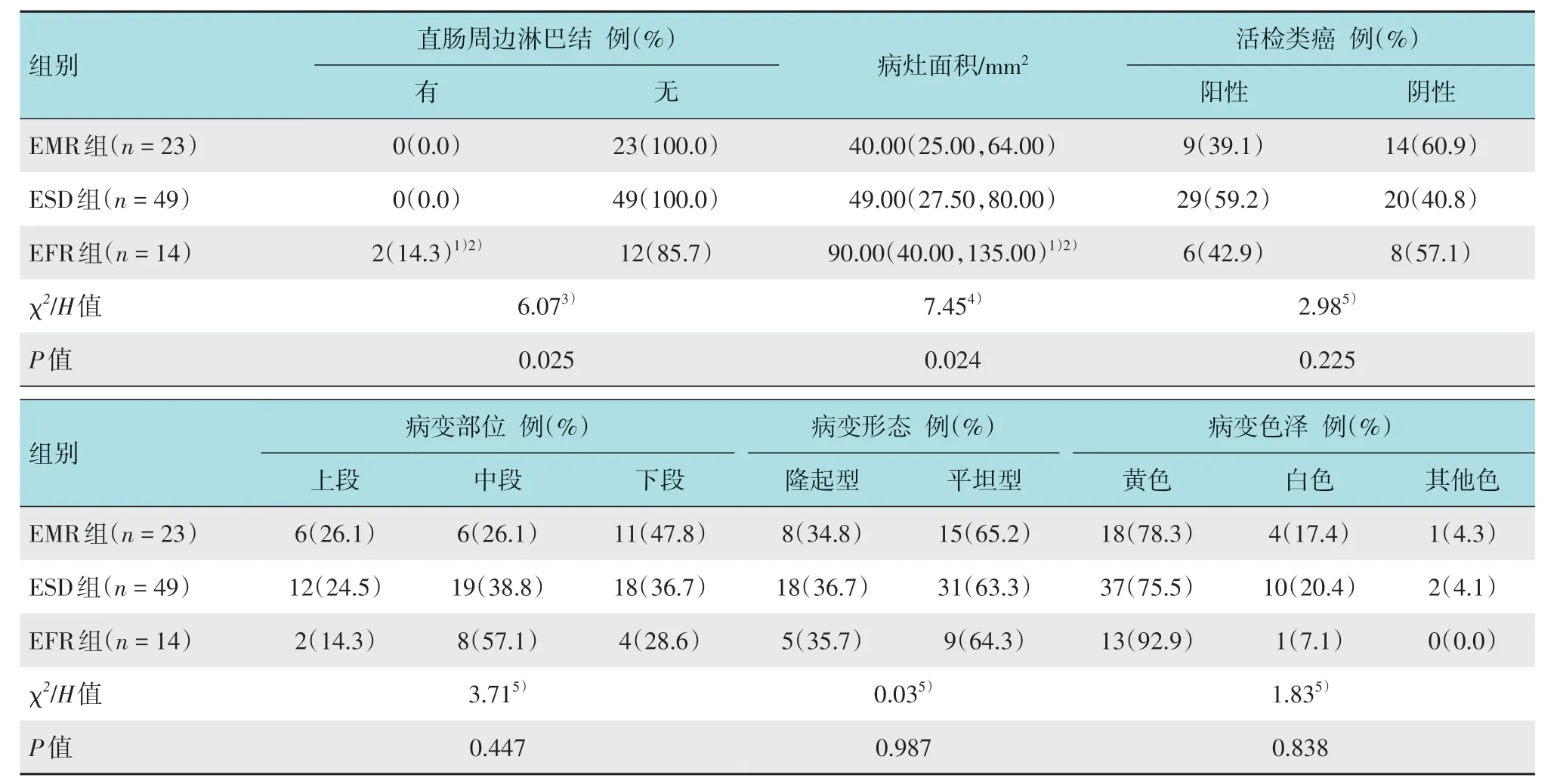
表2 3组患者病变特征比较Table 2 Comparison of lesion characteristics among the three groups
2.2 3组患者手术情况比较
经Kruskal-WallisH检验结果显示,3组患者病变切除面积比较,差异有统计学意义(P<0.05),两两比较结果显示,EFR组和ESD组病灶切除面积明显大于EMR 组(P<0.05)。EFR 组和ESD 组手术时间明显长于EMR 组,EFR 组手术时间明显长于ESD 组,差异均有统计学意义(P<0.05)。EMR 组、ESD 组和EFR 组术后住院时间分别为(2.17±0.42)、(4.40±0.90)和(5.07±0.68)d,EFR 组和ESD 组术后住院时间明显长于EMR 组,EFR 组术后住院时间明显长于ESD 组,差异均有统计学意义(P<0.05)。3 组患者术后并发症发生率及R0 切除率比较,差异均无统计学意义(P>0.05)。EFR组外科手术追加率明显高于EMR 组和ESD 组,差异有统计学意义(P<0.05)。见表3。
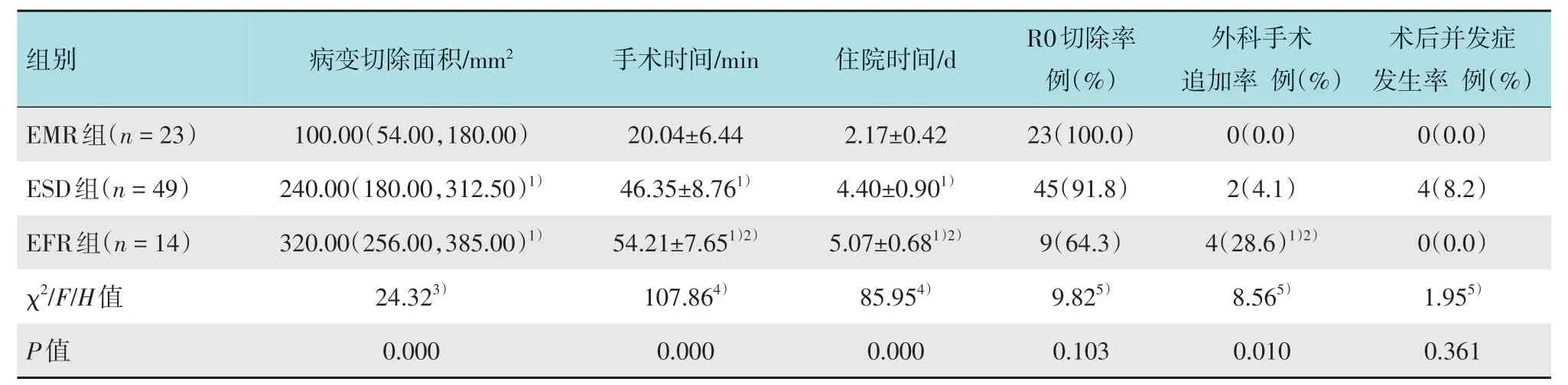
表3 3组患者手术情况比较Table 3 Comparison of operation related situations among the three groups
2.3 3组患者病理特征比较
3组患者术后NEN病理分型比较,差异无统计学意义(P>0.05)。3 组患者血管浸润率、淋巴管浸润率、神经侵犯率、垂直切缘阳性率、CD56 表达率和CgA 表达率比较,差异均无统计学意义(P>0.05),EFR 组病变固有肌层浸润人数所占比例明显高于EMR 组,免疫组化显示:Syn 阳性人数所占比例明显低于EMR 组,差异均有统计学意义(P<0.05)。见表4和图4。

图4 直肠NEN病理图片及免疫组化图片Fig.4 Pathological and immunohistochemical images of rectal neuroendocrine neoplasm (NEN)

表4 3组患者病理特征比较例(%)Table 4 Comparison of pathological characteristics among the three groups n(%)
2.4 3组患者随访情况比较
术后随访22~81 个月,中位随访时间52 个月。82例患者完成随访,包括:EMR 22例,ESD 47例,EFR 13例,4例(4.6%)失访。其中,仅1例行EFR的患者在随访过程中发生死亡(该患者合并肝脏NEN 转移及心肌梗死,与本身为直肠NEN 发病无明确关联,直肠病变为非直接死亡原因,但也有一定关联性),行EMR和ESD的患者在随访过程中均未发生死亡。Log-rank检验结果显示,不同手术组累积生存率比较,差异有统计学意义(χ2=8.17,P=0.017)。见图5。

图5 不同手术方式累积生存率比较Fig.5 Comparison of cumulative survival rates in different surgical methods
3 讨论
3.1 直肠NEN
直肠NEN 一般为无功能性肿瘤,多在健康体检时被发现,患者常无临床症状,或仅表现为粪便性状改变、肛门坠胀及下腹部隐痛不适,少部分患者可表现为:面色潮红、腹部包块或间接肿块压迫后继发症状,极少部分患者早期有肝、肾和淋巴结转移征象。随着内镜技术的提升及大型肠镜筛查的普及,直肠NEN 的检出率越来越高,其常位于距肛缘10 cm 以内[5],外观形态呈扁平或半球状隆起,色泽发黄或发白。本研究病变发黄率为79.1%,发白率17.4%,其他颜色占3.5%。直肠NEN因病变表面绝大部分发黄,行结肠镜白光检查即能发现。直肠NEN质地硬,表面覆盖正常黏膜,黏膜下有滑动感,内镜下表现为可移动的黏膜下结节,80.0%的直肠NEN直径<10 mm[6],本研究患者病变平均直径7.71 mm。虽然直肠NEN直径小,但仍具有潜在恶性的可能[7]。因此,内镜下切除是有必要的。
3.2 直肠NEN的干预
对于直肠NEN 的干预,取决于其病变特点,尤其是大小、分化程度、深度、淋巴和血管浸润性、肿瘤增殖指数和转移的风险率。如无黏膜下层侵犯的证据,且不存在局部疾病,小于10 mm 且分化良好的NEN被认为是淋巴管和血管侵袭风险较低者[8],需要内镜下切除。直肠NEN的生物学行为可能存在差异,但预测转移风险的因素已有结论。本研究中,直肠NEN直径<10 mm,分化程度为G1~G3的患者很少出现转移,与KIM等[9]报道的直肠NEN转移扩散的趋势通常取决于肿瘤大小、病变起源深度、淋巴血管的浸润以及组织病理学的分化一致。BASUROY 等[5]亦报道,直径<10 mm的直肠NEN发生远处转移的概率极低(<3.0%),大部分内镜下局部切除后,长期预后良好,5年生存率较高,而直径>20 mm的直肠NEN,且有区域淋巴结肿大(N1)和远处转移(M1)的患者,预后较差,5 年生存率仅为54.0%~74.0%和15.0%~37.0%,间接提示:直肠NEN 病灶大小是预后的关键性指标之一。本组病例中,1例直肠NEN病变大小为18 mm×15 mm,行EFR 后病理提示:肿瘤浸润深度达SM3,后追加外科手术,以防止后期继发转移。10 mm 以下的NEN 极少发生远处转移,以肝脏、淋巴结及腹腔转移为主。
3.3 直肠NEN的手术治疗
目前,治疗直肠NEN 的内镜手术常规有EMR、ESD和EFR,3种手术方式均能达到切除病灶的目的。本研究结果提示,ESD 及EFR 技术难度高于EMR,手术时间和术后住院时间均明显长于EMR(P<0.05),切除病灶大小亦明显大于EMR 组;EFR组手术时间及术后住院时间长于ESD 组(P<0.05),EFR 组和ESD 组在R0 切除率上与EMR 组相似(P>0.05),EFR 组外科手术追加率高于EMR 组和ESD组,考虑原因为:EFR组选择病例时,偏向于选择肿瘤组织过深及病灶面积较大的患者,与选择的主观性有一定关联。EMR 组和EFR 组术后未出现明显并发症,ESD 组术后出现1例阴囊气肿,1例迟发性出血,2例创面小穿孔,经积极治疗后痊愈,3 组患者术后并发症发生率比较,差异无统计学意义(P>0.05)。由此可见,内镜下切除直肠NEN 是安全可靠的,采用ESD 及EFR 更能达到完整性切除的目的。此外,临床还发展了改良手术方法,包括:套扎辅助内镜黏膜切除术、透明帽辅助内镜黏膜切除术、预切开内镜黏膜切除术、双通道内镜辅助黏膜切除术和混合ESD[10-12],以上方法的病变标本侧切缘及垂直切缘的病理阴性率较高,均能缩短手术时间,达到切除病灶的目的。ESD 及EFR 相对于EMR,能整块切除较大的黏膜病变及轻度侵袭性胃肠道肿瘤,但并发症风险较高(穿孔和出血)。本研究中,ESD 组及EFR组追加手术均为病灶浸润黏膜下层SM2以下及部分出现脉管浸润转移,而非病灶未完整切除。EFR为病变处全程切除,全切率高,并发症少,更适用于难以切除的病变,包括:解剖定位和黏膜下注射后不能抬起的病变(如:瘢痕组织),但其对患者肠道解剖破坏较大,术后恢复时间及住院时间长于ESD组,明显长于EMR 组。有文献[13-14]报道,EMR 和ESD 在切除直肠NEN 时,分别实现了46.3%~65.5%和75.0%~82.6%的镜下完整切除,EFR及经肛门内镜微创手术可实现100.0%的病变游离切缘阴性。
3.4 直肠NEN的术后病理
本研究中,直肠NEN 患者的术后病理组织学为瘤细胞呈腺体小梁管状结构,表现为巢状、条索状、玫瑰状。NEN 最敏感的免疫组化标记物[15]是Syn、CgA和神经元特异性烯醇化酶(neuro specific enolase,NSE)。本研究结果提示,Syn阳性率为88.4%(76/86),CgA 为82.6%(71/86),CD56 为66.3%(57/86)。但有文献[16]报道,对直肠NEN 最敏感的免疫组化标记物为SATB2,阳性表达率高达88.0%,同时其阳性率表明为直肠起源。术后病理及免疫组化对指导后续治疗及随访有重大意义,切缘阳性、浸润深度SM2以下或脉管转移均为术后追加手术的适应证。但国内窦晓坛等[17]研究提示,未发现病灶切缘阳性者因未追加手术治疗而出现复发,考虑原因为:直径<10 mm的直肠NEN 具有惰性生物学行为。因此,术后是否追加手术,目前仍存在争议。
3.5 本研究的局限性
本研究为单中心的回顾性研究,纳入样本量偏小,3组患者例数差异明显,且选择哪种手术方式有术者主观指导性,易导致研究结果发生偏倚。仍需进一步行前瞻性、多中心和大样本量的研究佐证,以得出更为准确的结论。
综上所述,对于直径为10 mm左右及以下的直肠NEN,生长于黏膜下深层的概率相对低,可通过内镜下切除,EMR 法相对简单,手术时间和术后住院时间明显短于ESD及EFR。EFR是一种安全、有效的直肠壁全层切除技术,具有较高的整体切除率和组织学切除率,可能优于传统的EMR 及ESD,但手术时间和术后住院时间明显长于ESD和EMR,而3种方法在病变治愈性切除(R0切除)、术后并发症及随访生存率上并无较大区别。因此,3种方法在完全切除方面具有类似的效果,哪种优势更大,有待进一步研究证实。
