三例脑干出血继发肥大性下橄榄核变性的临床分析并文献复习
2022-12-02李辉黄波徐沙贝朱文浩
李辉,黄波,徐沙贝,朱文浩
肥大性下橄榄核变性(hypertrophic olivary degeneration,HOD)是一种少见的神经系统变性疾病,是由于Guillain-Mollaret三角原发病变导致齿状核-红核-下橄榄核环路(dentato-rubro-olivary pathway,DROP)连接中断,引发下橄榄核(inferior olivary nucleus,ION)跨突触变性,进一步导致ION 退行性肥大[1]。HOD常见的临床表现包括腭肌阵挛、震颤、共济失调等,在MRI上表现为特征性的ION肥大及T2WI高信号[2]。临床上由于其部分症状的隐匿性、非特异性,及其病灶与脑梗死等病变的相似性,易导致漏诊和误诊。HOD最常见的原因是脑血管病变,尤其是脑干的海绵状血管瘤破裂和原发出血等[3]。及早明确诊断对合理正确地评估病情、及时治疗和判断预后意义重大。本研究对3 例脑干出血后继发HOD 患者的病例资料进行总结,以及归纳既往文献中脑干出血后继发HOD的报道,以期对本病的诊治起一定借鉴作用。
1 资料与方法
1.1 一般资料
纳入2019~2021年就诊于我院神经内科,依据病史、症状、体征结合影像学表现诊断为HOD 的患者3例。另对自1990年以来英文文献中报道的脑干出血后继发HOD 的病例通过PUBMED、EMBASE 数据库进行检索,共检索出相关文献51篇。选取其中完全符合HOD临床和影像特点,资料相对完整的临床病例纳入后续分析,最终纳入病例39例。
1.2 方法
收集3 例HOD 患者的临床和影像学资料,包括病史和临床表现、原发病变部位、性质、HOD症状距原发疾病的延迟时间、MRI特点、治疗及转归。另外对纳入的39例既往文献报道的脑干出血继发HOD病例的临床和影像学特点进行详细归纳整理。
2 结果
2.1 一般情况
本组3 例患者为男性,平均年龄57.3 岁(52~66岁);其中原发病变为海绵状血管瘤出血1 例,原发性脑干出血2 例,见表1。既往患者39 例,男25 例(65.9%),女14 例(34.1%),平均年龄50.7 岁(27~75 岁);原发病变为海绵状血管瘤出血16 例(41.0%),原发性脑干出血23例(59.0%),见表2。
2.2 临床表现
本组病例的临床症状分别迟于原发疾病4月、3月、4月出现,主要临床表现包括腭肌阵挛、头晕、复视、共济失调和眼球震颤(病例1),头部震颤、共济失调和眼球震颤(病例2),眼球震颤、言语不清和肢体偏瘫(病例3),见表1。既往病例中,HOD延迟于原发病3月至15年出现(中位时间6月),主要与HOD有关的临床表现包括腭肌阵挛(15/39,38.5%),肢体或头部震颤(13/39,33.3%),眼球震颤(12/39,30.8%),构音障碍(8/39,20.5%),共济失调(7/39,17.9%)。其他较少见的表现包括视震荡、复视、头晕、面瘫、吞咽困难和饮水呛咳等,见表2。
2.3 HOD影像学改变与原发病变的关系
本组3例患者原发病变部位均在脑桥,病例1的原发疾病为右侧脑桥海绵状血管瘤破裂出血;病例2 为左侧脑桥出血;病例3为脑干出血累及双侧,见图1、表1。既往病例原发病变在脑桥或中脑,其中16 例(41.0%)为海绵状血管瘤出血,其余23例(59.0%)为原发性脑干出血。单侧ION 受累24 例(61.6%),其中单侧病变对应同侧ION 受累21 例(53.8%),单侧病变对应对侧ION 受累3 例(7.7%);双侧ION 受累15 例(38.4%),其中双侧病变对应双侧ION 受累10 例(25.6%),单侧病变对应双侧ION受累5例(12.8%),见表2。
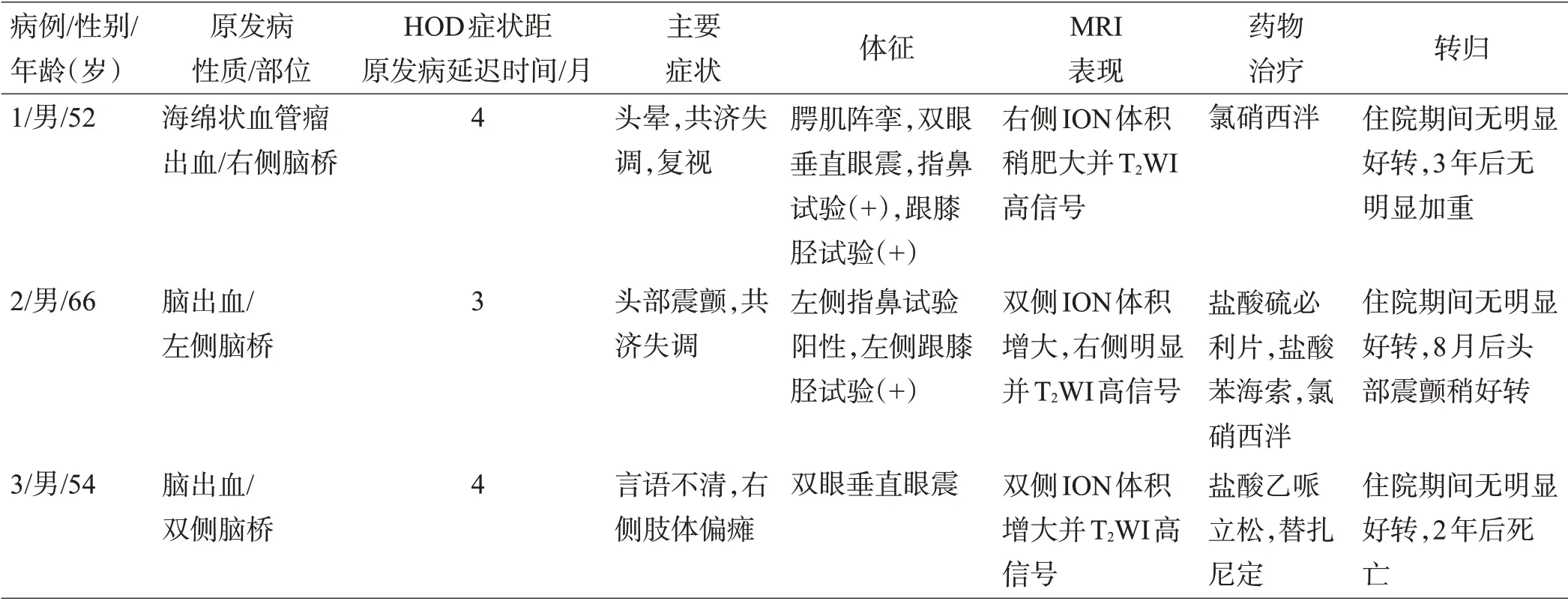
表1 3例患者临床及影像学表现
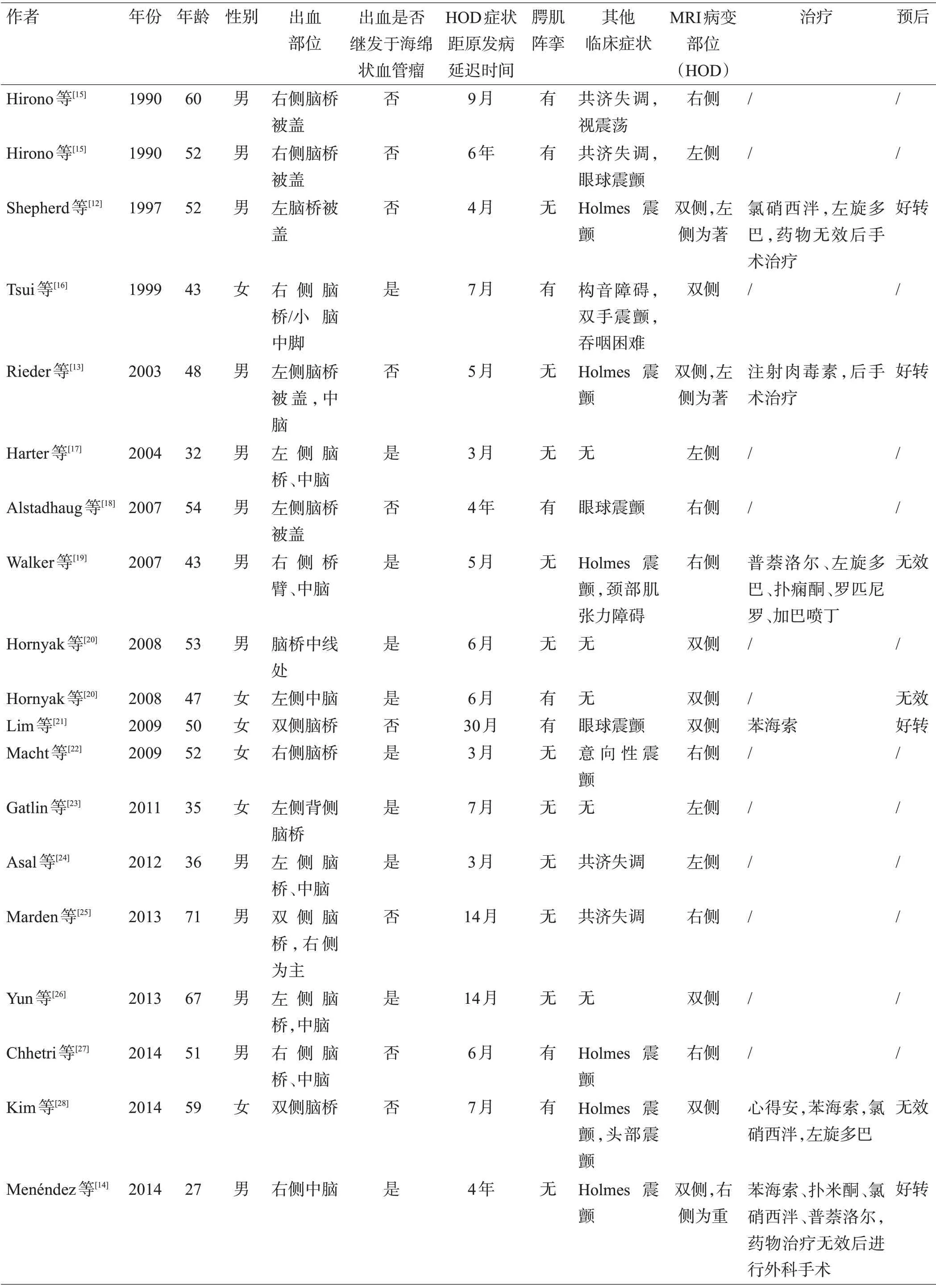
表2 既往脑干出血继发HOD病例汇总
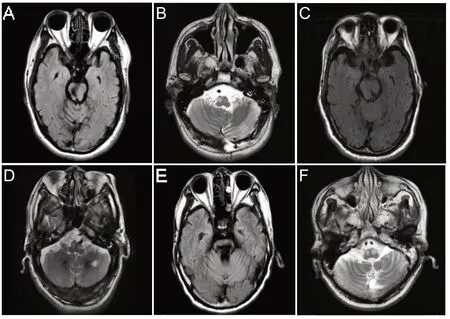
图1 3例患者头部MRI
2.4 治疗与转归
本组3 例患者住院期间临床症状均无明显改善。出院后随访,1 例患者情况稳定,无明显加重(病例1,出院后3年随访),1例头部震颤稍好转(病例2,出院后8月随访),1 例死亡(病例3,出院后2年随访),见表1。既往文献分析提示,脑干出血后继发HOD 的治疗方式包括药物治疗和手术治疗。治疗药物主要有氯硝安定、心得安、盐酸苯海索、左旋多巴、左乙拉西坦、加巴喷丁、乙哌立松、硫必利、美金刚、美托洛尔、注射肉毒素等;手术治疗主要包括深部脑刺激、丘脑切除术等。纳入统计分析的文献中,使用药物治疗的患者有6/13 例获得好转,好转率46.2%;手术治疗3例,均明显好转。
3 讨论
HOD 是由于DROP 病变所导致的一种少见疾病。该解剖环路涉及脑干和小脑,隶属于精细反射弧的一部分:首先由小脑齿状核(dentate nucleus,DN)的传入纤维穿过小脑上脚(superior cerebellar peduncle,SCP)至对侧红核(red nucleus,RN),接着从中央被盖束(central tegmental tract,CTT)下行进入ION,又通过小脑脚下部的上升纤维将其传入信息发送到对侧小脑皮质的浦肯野细胞,最终传递至同侧DN,构成了完整的Guillain-Mollaret三角[4]。该通路中大多数结构的破坏都可引发跨突触变性,造成远隔的ION 神经元细胞肥大、空泡样变性、胶质细胞增生等病理改变,继而引起HOD 的临床症状。但是由ION 上升到对侧DN 的橄榄齿状纤维(即小脑下脚)并不参与HOD,它们提供ION 的突触输出,因此其中断不会导致ION 的跨突触退化[5]。引起HOD常见的原因包括脑卒中、血管畸形、肿瘤和与手术相关的医源性损伤,其中脑干出血是HOD最重要的病因之一[6]。
临床上HOD 最常见、最具诊断价值的特征是腭肌阵挛,表现为规律的1~3 Hz 节律的腭部肌肉收缩[7]。然而,既往报道显示,所有HOD 中仅有20%~45%表现出这一体征[1],这与本文脑干出血继发HOD 的结果大体一致。腭肌阵挛的详细机制不清,推测可能与迷走神经疑核相连、控制腭肌运动的CTT受损,继而导致HOD 有关[7]。眼球震颤是另一个HOD 的主要临床表现,一般认为其继发于ION 抑制输入的丧失和由此导致的ION神经元的过度活动[1]。肢体和/或头部震颤在HOD中亦较常见。既往脑干出血继发HOD的病例中有1/3 出现震颤,其中8 例表现为典型的Holmes 震颤(Holmes tremor,HT)。HT 通常表现为低频、静止性、意向性的不规则震颤或姿势性震颤,多累及肢体近端肌群,其机制可能是多巴胺能和小脑-丘脑/小脑-橄榄核通路的联合损伤[8]。虽然HT 多与HOD 相关,但是既往报道显示其在HOD 中的整体发生率并不高,而脑干出血继发的HOD 是HT 的主要病因之一[8]。还有部分患者出现无法归结为典型HT的肢体/头部震颤或共济失调,可能是由于DROP 环路受损,导致协调运动、调节张力的能力下降所致[5]。既往研究提示HOD患者共济失调的发生率很高[3],但值得注意的是部分文献报道的共济失调可能是脑干病变本身的症状而非继发的HOD所致,而既往文献分析仅将新发生的共济失调归结为HOD相关症状,因此比例相对较低。脑干出血继发HOD尚有一些不典型或者非特异性临床表现,如构音障碍、复视、面瘫等,并且病例之间差异较大。这也从另外的角度提示临床医师,当脑干出血恢复期患者出现上述症状时,除了要考虑病变本身是否复发进展以外,还需要警惕HOD。此外,本文结果提示,有约1/5 的脑干出血继发HOD 的患者无明显临床症状,提示大量潜在HOD患者的可能性。
原发病灶和ION受累侧之间的关系是另一个值得关注的问题。在DROP环路中,当病变局限于单侧RN或CTT 时,ION 肥大发生于原发病变同侧;原发病变局限于单侧DN或SCP时,ION肥大通常发生于对侧;当病变累及双侧RN、CTT、DN,或同时累及CTT 和SCP时,ION肥大可发生于双侧[3,6]。本组病例1出血部位与肥大的ION 均在右侧,推测其累及右侧RN 或CTT;病例3原发病变和ION均累及双侧,推测其损伤的是双侧DROP环路。在本组病例2(对侧ION受累更明显)和既往病例中,还出现了单侧病变对应双侧ION受累的现象,推测其原因可能有:其潜在的病变范围影响了双侧的DROP 环路;同时累及单侧CTT 和SCP。此外,对既往脑干出血继发HOD 的回顾分析结果显示,相比之前全因HOD 的报道,单侧ION 受累比例明显较高[9],笔者推测这可能与原发疾病(脑干出血)有关。随着时间的推移,双侧HOD进一步加重的可能性更大[6],这与本组3 例患者的随访结果一致;而由于相当部分患者缺乏预后信息,未能对既往病例进行相关统计,也是本研究的局限性之一。
HOD的诊断主要依靠MRI,一般表现为T2WI高信号,T1WI 等或稍低信号,FLAIR、DWI、ADC 等或稍高信号[2]。T2WI 高信号较其他序列更为稳定,一般用作诊断依据。既往研究描述了HOD的几个病理阶段:最初的24 h 无明显变化,2~7 d ION 轻微退化,1~3 周ION 轻度肥大而无胶质增生,8 个月至约3~4年星形胶质细胞和神经元肥大,然后是ION 萎缩[4]。随后有研究描述了一系列与这些病理阶段相关的MRI 影像变化[4]。HOD 的MRI 改变可分为3 个阶段:①ION 无肥大病变(发病后1月内),T2WI 信号增高;②T2WI 信号持续增高伴ION肥大(发病后4月至3年);③ION萎缩伴T2WI信号持续增高(发病后3年以上)。本组3例患者据其HOD影像学特点均处于第2阶段,既往病例也基本符合他们的影像-病理阶段。遗憾的是,由于常规MRI中不包含T2WI矢状位扫描,未能够多角度详细了解本组病例下橄榄核的影像学改变。
HOD目前的治疗手段仍以对症处理为主,既往文献报道了多种药物在HOD 中的应用。有研究称苯二氮卓类药物和卡马西平对本病有一定效果,也有注射肉毒素治疗严重腭肌阵挛的成功案例;左乙拉西坦、左旋多巴、盐酸苯海索则对HOD 相关震颤的治疗可能有效,大约一半的该类患者经上述药物的联合治疗震颤症状获得好转[10];另有报道提示,应用氯硝西泮、普瑞巴林、盐酸美金刚及巴氯芬治疗均无效,采用拉莫三嗪和放射治疗甚至会使临床症状加重[11]。本组病例使用氯硝西泮、盐酸硫必利、盐酸苯海索、盐酸乙哌立松、替扎尼定均无明显疗效,其中1 例患者在出院后2年的随访中发现死亡,但遗憾的是家属拒绝告知其详细的死亡情况。对既往脑干出血继发HOD的病例总结分析显示,部分患者采用药物治疗也可获得一定改善,包括盐酸苯海索、左旋多巴、硫必利、氯硝西泮等。虽然既往报道和本次文献回顾分析均提示血管因素引起的HOD对药物治疗反应相对较佳,但总体上本病的药物疗效依然较有限。手术治疗则可望为本病的治疗提供新的途径,包括植入慢性丘脑刺激器[12]、丘脑切除术[13]、立体定向消融手术等[14]。既往文献中进行手术治疗的患者震颤症状均明显改善,深部脑刺激可能成为脑干出血继发HOD 中致残震颤患者的较佳选择[6]。
HOD 是一种少见的跨突触神经变性疾病,其中脑干出血是HOD 的重要病因。本研究在总结临床病例的同时,对既往文献中报道的脑干出血继发的HOD亦首次进行系统性分析。总的来说,DROP 区的原发病变和T2WI 高信号是诊断HOD 的要点;脑干出血继发HOD 患者中ION 单侧受累较多,出现HT 的比例相对高,对药物治疗的反应相较于其他原因所致的HOD好,但总体效果依然有限;手术可能是治疗该类患者严重震颤的有效手段。未来还需进一步探索新的有效的干预措施,使患者的预后得到最大程度的改善。
