特发性肥厚性硬脑膜炎的治疗方法探讨:2例病例报告并文献复习
2022-12-02何光建薛兴森陈贝克储卫华林江凯
何光建,薛兴森,陈贝克,储卫华,林江凯
肥厚性硬脑膜炎(hypertrophic cranial pachymeningitis,HCP)是一种以颅内硬脑膜弥漫性或局灶性增厚和纤维化炎性反应为特征的一组神经系统少见疾病的总称,一般根据病因分为特发性肥厚性硬脑膜炎(idiopathic hypertrophic cranial pachymeningitis,IHCP)及继发性肥厚性硬脑膜炎(secondary hypertrophic cranial pachymeningitis,SHCP)两 大类[1],其中IHCP较罕见。目前该类患者的治疗手段主要是应用皮质类固醇激素,但伴随IHCP 的纤维化,患者可能对包括类固醇和免疫抑制剂在内的药物治疗无效[2]。对于药物治疗无效的患者,因病情的发展而严重危急生命时,应考虑紧急进行神经外科治疗。但目前国内外极少有IHCP进行外科干预的报道,故缺少相关指南规范其具体治疗方法。现将我院发现的2 例IHCP 患者(其中1 例为手术患者)的临床表现、影像学特征及治疗经验回顾性总结。
1 资料与方法
1.1 一般资料
回顾性分析我科收治的IHCP患者2例,2例患者均以头痛为首发症状,病例1以头昏、伸舌左偏、言语不清为特点;1例患者经活检明确诊断,另一例患者诊断依据病史和影像学特点临床诊断。
1.2 方法
收集资料并分析。通过Pubmed、知网数据库,输入关键词“idiopathic hypertrophic cranial pachymeningitis”或“特发性肥厚性硬脑膜炎”,收集近5年所有相关文献(截止时间2021年2月28日),得到关于106 例HCP 患者的病例报道。对符合条件的所有病例采取描述性统计,并从临床症状和治疗方法进行分析。
2 结果
2.1 病例资料
2.1.1 病例1 患者,女,60岁,因“反复头痛,头昏,伸舌左偏2年,言语不清1月”于2016年3月28日收入我院神经内科。患者于2014年左右无明显诱因出现头昏,昏沉感,无视物旋转,恶心、呕吐,无站立不稳等,并发现伸舌左偏,诊断“慢性主观性头晕;伸舌左偏待查”,予以黛力新等治疗,头昏有所改善。此后,逐渐间断出现较多躯体症状,如头痛、口腔不适、腰痛、失眠、心慌、坐立不安等,在口腔科、神经科、五官科等多科室就诊。因头痛于2014年再次就诊,考虑紧张型头痛等,予以“阿米替林半片/晚,妥泰25 mg/晚”,服用1年左右。于2016年2月开始出现言语不清,开始症状间断出现,诊断为舌下神经瘫痪,建议度罗西汀30~60 mg/晚,托吡酯25 mg/晚;但服药无依从性,患者自行停药。半月后开始症状较为持续,并出现饮水呛咳,无明显吞咽困难等。体格检查:伸舌左偏,左侧舌肌萎缩。辅助检查:MRI 增强平扫提示延髓、小脑扁桃体及上段颈髓轻度受压,第四脑室下部受压变窄,幕上脑室扩张积液;左侧颞部硬脑膜、桥脑、延髓及上段颈髓水平相应硬脑(脊)膜、左侧小脑幕及小脑半球硬脑膜增厚(图1A~C)。入院后给予甘露醇125 mL+氢化泼尼松10 mg 静滴治疗,症状无明显缓解。入院后,完善术前检查,无绝对手术禁忌证,在全麻下行后颅窝减压并成形术+硬脑膜病变活检术。术中硬脊膜张力较高、发白,Y 型切开硬膜,见硬膜厚2~3 mm,质地韧,取少许送冰冻,回报见大量淋巴细胞浸润,考虑炎症性病变。术后病理:(硬脑膜)组织提示脑膜可见纤维化、钙化及少量炎性细胞浸润(图1D);免疫组化染色:CK(-)、阳性对照(+),CD3(+)、阳性对照(+),CD20(+)、阳性对照(+),Ki67阳性细胞数<5%、阳性对照(+),CD68(+)、阳性对照(+),CD138(+),CD34血管(+)、阳性对照(+)。术后给予甘露醇125 mL+氢化泼尼松10 mg 静滴3 次/日,治疗10 d,饮水呛咳症状消失,语言清晰,无其他神经系统阳性体征。术后复查MR 增强平扫提示治疗后左侧颞部硬脑膜、桥脑、延髓病变较治疗前明显缩小(图1E、F)。出院后继续口服激素醋酸地塞米松片2 mg 维持,随访12月病情稳定。
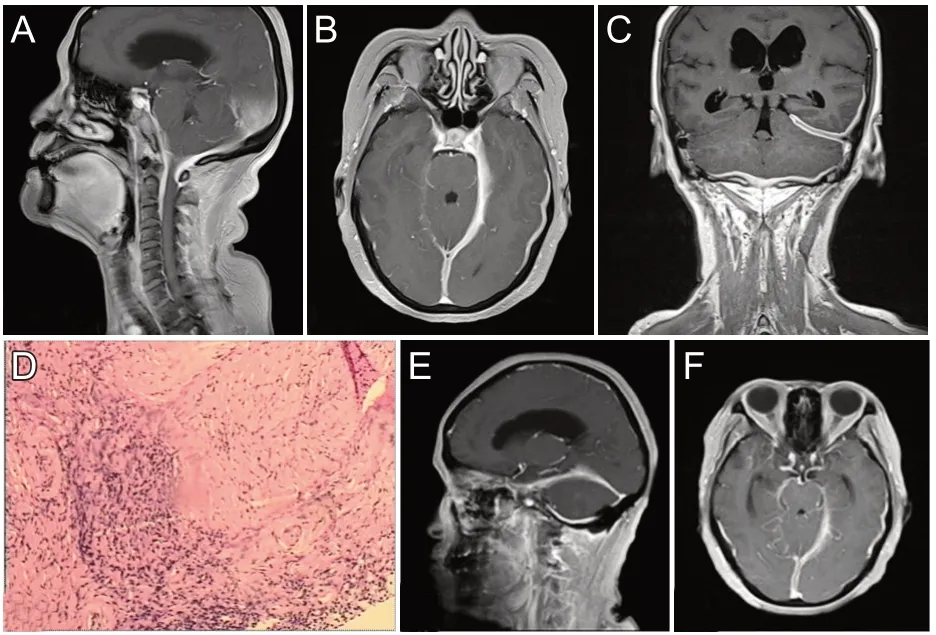
图1 病例1的术前及术后MR增强及病检结果
2.1.2 病例2 患者,男,45 岁,因“间断头痛,睡眠差4月”于2017年2月16日入住我院。患者于2016年10月10日感冒后出现头痛,睡眠变差,无恶心、呕吐,无畏寒、发热,无肢体麻木、乏力。曾行头颅CT检查未见明显异常,头痛反复发作,进一步行脑电图检查未见明显异常;血常规示白细胞计数增高,考虑上呼吸道感染。给予都梁胶囊、阿奇霉素肠溶胶囊口服,头痛症状有所好转,睡眠无明显改善。患者自觉睡眠进一步变差,头痛持续存在,脖子僵硬。后就诊于心理门诊,考虑精神紧张导致睡眠差,引起头痛,给予右佐匹克隆片治疗。入院前11 d开始睡前服用1.5 mg,睡眠明显改善,但头痛仍存在,呈胀痛,常于午后出现,活动时头痛加重,静止不动时可有所缓解,无恶心、呕吐,无肢体麻木、乏力及其他不适。进一步行头颅MRI 检查提示:双侧小脑幕、大脑镰中后份不均匀性增厚,异常强化。体格检查:粗测视力降低,间断头痛,无恶心、呕吐,余无明显异常。辅助检查:头颅MRI 示:双侧小脑幕、大脑镰中后份不均匀性增厚,增强后可见明显强化。中线结构居中,无偏移(图2A~C)。全身PET-CT 示:小脑幕不均匀增厚,考虑慢性炎性病变(结果未示)。入院后行腰椎穿刺测得颅内压为230 mmH2O。入院后给予甘露醇125 mL+氢化泼尼松10 mg 静滴治疗,期间辅以间断腰穿,治疗2周后复查头颅MRI提示双侧小脑幕、大脑镰中后份病变较治疗前明显缩小(图2D~F)。再次行腰穿测颅压降至正常范围,头痛明显缓解。出院后继续口服激素醋酸地塞米松片2 mg维持,随访12月病情稳定。
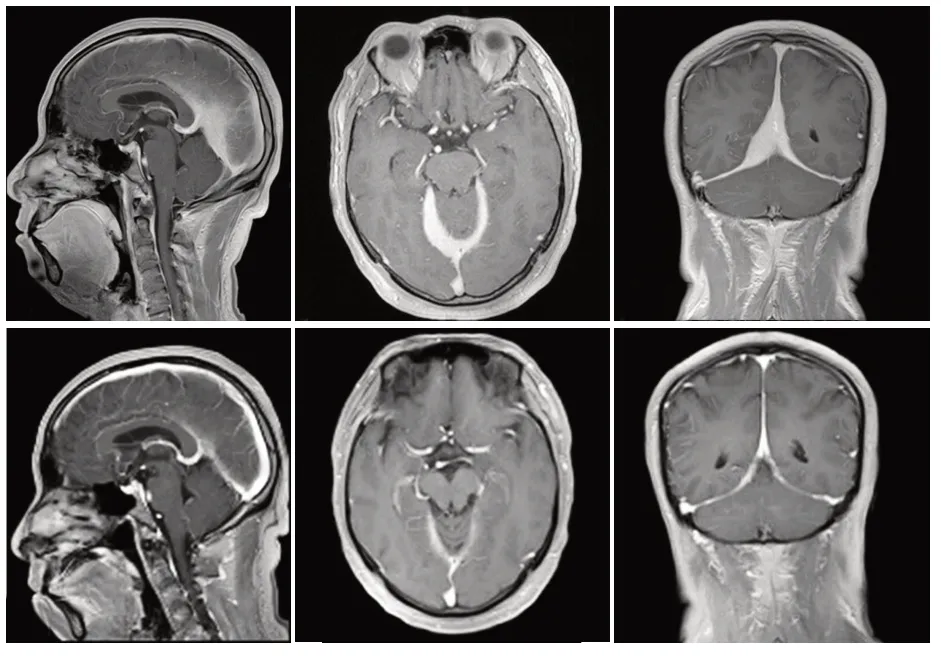
图2 病例2治疗前后MR增强扫描
2.2 文献复习资料
通过搜索关键词“idiopathic hypertrophic cranial pachymeningitis”或“肥厚性硬脑膜炎”,共搜索到IHCP 患者106例。
2.2.1 临床表现 IHCP 患者以头痛为首发症状(约92%)。此外,由于硬脑膜对颅神经压迫部位的不同,还有患者以视力障碍(约5.8%)、吞咽功能障碍(约1.1%)、听力障碍(约0.6%)、眼球运动障碍(约0.5%)为首发症状。有约76.6%的患者合并颅神经受累,其中颅神经Ⅱ受累约43.1%,颅神经Ⅲ受累约38.4%,颅神经Ⅳ受累约7.5%,颅神经Ⅴ受累约11.4%,颅神经Ⅵ受累约28.5%,颅神经Ⅷ受累约5.0%,其余颅神经受累表现约4.5%。
2.2.2 治疗方法 IHCP 患者主要以神经免疫学治疗为主(约99.2%)。类固醇是所有报告病例的主要治疗手段,通常采用泼尼松龙(约70.2%)或甲强龙(约45.2%),且约37.8%的患者使用甘露醇降低颅内压。此外,在一些报告中,采用如硫唑嘌呤(约2.5%)、甲氨蝶呤(约1.2%)、环磷酰胺(约3.6%)或脑室内注射阿糖胞苷(约1.2%)等免疫调节剂,对于病程迁延且复发的病例进行治疗。此外,仅有一例患者采取手术治疗(内镜下第三脑室造瘘术)。治疗后多数患者(约89.5%)的临床症状和影像学表现均有所改善。
3 讨论
异常的硬膜增厚可见于淋巴瘤、硬膜癌病、脑膜瘤/脊膜瘤和结核病等[3]。此外,系统性自身免疫性疾病(即结节病、肉芽肿伴多血管炎、类风湿性关节炎、贝歇氏病、狼疮)、结核病、梅毒、囊虫病、莱姆病和真菌感染等因素也能引起硬膜增厚[3-7]。当患者没有明确或特异性疾病,且硬膜因非特异性炎症而增厚时,则可诊断为IHP[3]。研究显示,在IHP 患者中约有78.9%为病灶仅位于颅内的IHCP患者,约有13.2%的患者是病灶仅位于硬脊膜的特发性肥厚性硬脊膜炎(idiopathic hypertrophic spinal pachymeningitis,IHSP),另约有7.9%的IHP 患者硬脊膜和硬脑膜病灶同时存在[8]。IHCP发病率约为3/100 000人,患者通常在60~70岁时起病[9],且男性发病率明显高于女性[10],亦有研究显示在我国女性发病率高于男性[11]。本文2 例患者既往无鼻窦炎、中耳炎、乳突炎等相关病史,腰穿查脑脊液细菌、真菌、隐球菌、脑脊液抗酸染色涂片等均为阴性,脑脊液蛋白、氯化物、糖含量及白细胞数等均正常,考虑不是细菌自解感染所致,可能与潜在的自身免疫病有关[11]。
约有92%的IHCP 患者以头痛为首发症状[10]。头痛可能由硬脑膜炎性刺激及因硬脑膜增厚所致的颅内压增高共同作用所引起[12]。如果增厚的硬脑膜压迫眶上裂或海绵窦,可引起Tolosa-Hunt综合征,其表现主要包括Ⅱ~Ⅵ颅神经麻痹和随之而来的视力改变、眶后疼痛和眼外肌麻痹等症状[13]。如若颅中窝、后窝的镰幕交界处及小脑天幕受累,可能会导致小脑共济失调和/或Ⅵ~Ⅻ颅神经麻痹症状[12]。随着病程的进展,更广泛的脑膜因非特异性炎症改变而出现纤维化时(如病变累及基底或半球硬脑膜时),除了神经结构的局灶性压迫症状所引起的颅神经麻痹,还可能引起如认知能力减退、精神症状[14]、垂体功能低下[15]及癫痫发作[2]等表现。IHCP患者同时也可能并发硬脊膜增厚,硬脊膜病变多见于颈椎和胸椎,因压迫节段不同,可能会出现相应节段的肢体无力、麻木、瘫痪、括约肌功能障碍和其他神经根性疾病[8,10]。报道显示,IHCP 患者多因Ⅱ~Ⅵ颅神经受压而产生相应症状[16]。本组病例2以颅神经Ⅱ受损症状为主要表现,可能和受累硬膜主要集中于双侧小脑幕、大脑镰中后份有关;而病例1患者主要以头痛及颅神经Ⅻ受损症状为主要表现,这可能与病变主要集中于后颅窝及小脑幕相应硬脑(脊)膜有关。之前国外有文献报道,弥漫性厚脑膜肿大和多灶结节性病变占据后颅窝,可能导致神经结构拥挤,造成小脑扁桃体在枕骨大孔下方向下移位[17]。本组病例2 还伴发获得性Chiari 畸形(Acquired Chiari malformation,ACM)、脑积水,这是国内第一次报道有关IHCP 后的这些罕见表现。尽管Chiari 畸形的机制仍有待阐明,但解剖变异(包括异常脑膜增厚)被认为是导致颅后窝拥挤和小脑扁桃体向下突出的因素[18]。目前对于IHCP 的治疗主要以神经免疫学治疗为主,但对于药物治疗无效,且出现严重症状的患者,可能需要紧急进行神经外科治疗。
目前,IHP普遍被认为是一种潜在的自身免疫性疾病[2]。类固醇是所有报告病例的主要治疗手段,治疗上通常采用泼尼松龙或甲基泼尼松龙,每天20~60 mg,至少2~4 周,之后在几个月到几年内缓慢减量[19]。多数患者在经此治疗后,临床症状和影像学表现均有所改善[20-22];但也有报道显示,约有40%的患者使用类固醇可能会导致病情恶化或出现新的糖尿病[23]。此外,IHCP 对类固醇的耐药性和因类固醇用量逐渐减少所导致的疾病复发经常被报道[24]。在一些报告中,因该病的病程是慢性和复发性的,需使用免疫调节剂进行更积极的治疗,如硫唑嘌呤[25]、甲氨蝶呤[26]、环磷酰胺[27]或脑室内注射阿糖胞苷[28]等。这些治疗在一定程度上,有助于缓慢减少类固醇的使用,在一些难治性病例中有着较好疗效。此外,也有报道显示单克隆抗体的利妥昔单抗可对类固醇难治的患者产生较好的治疗作用[13],但该药的治疗效果可能仍然与硬膜纤维化程度有关[29],且该药对于此适应证的治疗仍需我国监管部门批准。本组2 例患者中,均采取甘露醇125 mL+氢化泼尼松10 mg 静滴的方式进行保守治疗,病例2 在治疗后症状明显缓解,出院后口服激素醋酸地塞米松片随访未复发;而病例1在治疗后症状无明显改善,笔者认为其主要原因是由于病变集中于后颅窝及小脑幕相应硬脑(脊)膜,对后颅窝压迫重;此外患者病程较长,可能导致硬脑膜纤维化程度高,病理改变已经无法逆转,故内科治疗效果并不理想。
对于药物治疗无效的患者,当出现神经功能缺损和癫痫发作等严重症状时,或出现如非交通性脑积水和/或ACM时,因病情严重危及生命,故考虑紧急进行神经外科治疗。临床上,极少有IHCP 合并脑积水的报道出现,故缺少相关指南规范其具体治疗方法。目前,笔者认为对于IHCP 后单纯合并非交通性/梗阻性脑积水的患者,对脑积水情况进行分流手术,从而缓解压迫性症状;对于IHCP 后合并ACM 的患者,因后颅窝压迫较严重,在内科治疗无效的情况下,需要进行后颅窝减压手术,具体手术需要根据解剖部位的不同,制定手术方案。对于以上目的,外科治疗可主要采取脑室-腹腔分流术(ventriculo-peritoneal shunt,VPS)、内镜下第三脑室造瘘术(endoscopic third ventriculostomy,ETV)及枕下入路的C1 椎板切除+后颅窝减压等方式进行手术。VPS是目前治疗儿童和成人脑积水最常见的治疗方法,但同时有文献报道约有40%的患者,出现了诸如引流管阻塞、感染和断裂等并发症[30,31]。ETV 作为一种传统VPS 的替代途径,能恢复生理性脑脊液流,避免与VPS放置相关的已知风险[32]。此方法也在之前报道的一例HCP伴发脑积水的儿童患者中,取得了良好的治疗效果[33]。而对于病例1,由于病变集中于后颅窝及小脑幕相应硬脑(脊)膜,考虑脑积水主要继发于ACM所致;此外患者的后组颅神经压迫为主要症状,考虑压迫症状主要同该水平脑膜增厚导致的小脑扁桃体向下移位和第四脑室出口阻塞相关,单纯的脑脊液分流可能无法完全缓解患者症状,故采取枕下入路的C1椎板切除+后颅窝减压等方式进行手术。在术后,患者应继续进行神经免疫治疗,控制病变的发展。
综上所述,IHCP 的临床表现缺乏特异性,确诊应结合临床特征、实验室结果、影像学表现及病理结果。本文对IHCP的治疗方法进行了回顾,特别是在缺少相关指南规范的情况下,对IHCP的神经外科治疗的适应证、手术方式等方面进行总结,为今后临床医生合理选择神经免疫治疗方法和/或神经外科治疗方法提供参考。
