氧化淀粉的抑菌效果及草莓涂膜保鲜应用
2022-11-30宋俏微张水洞胡长鹰
陈 卓,宋俏微,张水洞,胡长鹰,,*
(1.暨南大学理工学院,广东 广州 510632;2.暨南大学包装工程学院,广东省普通高校产品包装与物流重点实验室,广东 珠海 519070;3.华南理工大学机械与汽车工程学院,广东 广州 510640)
草莓脂肪含量低且不含胆固醇,最新研究发现草莓中富含的酚类、花色苷类和黄酮类等多种天然抗氧化活性物质不仅能对抗衰老,在对抗肥胖和肥胖并发症方面也具有出色潜力[1-3]。但草莓在常温下仅可保存1~3 d,在贮运过程中容易发生由微生物、呼吸和酶等因素造成的腐败,其中由微生物腐败引起的品质下降问题尤为严重[4]。相关研究表明,从采摘到销售过程中的草莓表面检出12~19 种革兰氏阴性菌、2 种革兰氏阳性菌和5 种霉菌,且这些细菌中多数具有致病性[5-6],因此,研发能够抑制草莓表面细菌生长的保鲜剂或保鲜关键技术对于草莓保鲜十分关键。
目前对草莓的保鲜方式主要有气调保鲜、低温贮藏和辐射处理等,此外,操作简单且绿色高效的涂膜保鲜也越来越受到人们的关注。涂膜保鲜能够阻止果蔬表面与空气的接触,抑制呼吸作用,减少水分的散失,阻止微生物的侵染[7-8],在生鲜食品的保鲜上具有广泛的应用前景[9-11]。
氧化淀粉(oxidized starch,OST)是指在氧化剂的作用下将淀粉分子中的羟基转化成羧基和羰基的变性淀粉,与天然玉米淀粉相比,具有糊化温度更低、成膜性和流动性更好等特点[12]。OST在食品保鲜领域的应用大多是以传统OST作为基质,通过加入如乙酰水杨酸、单甘酯和纳米银[12-14]等抑菌性物质赋予涂膜液抑菌功能,但使用OST直接进行涂膜的研究相对较少[14]。
目前关于OST抑菌性以及OST能否抑制果蔬表面微生物生长而起到保鲜效果等的研究鲜有报道。因此,本实验首先探究自制的羧基相对含量不同的OST对常见致病菌金黄色葡萄球菌、大肠杆菌和草莓表面典型的两种腐败菌青霉菌和链格孢菌的抑菌能力,再将抑菌性能最好的羧基相对含量57%的OST(OST-57)通过涂膜方式应用于草莓表面,通过在贮藏期间对草莓生理生化指标的跟踪检测,探究具有抑菌性的OST涂膜对草莓保鲜的效果。
1 材料与方法
1.1 材料与试剂
“双流东”草莓于2021年10月2日下午采摘于四川省双流区东燕草莓采摘园,选择无机械损伤、无病虫害且成熟度均一的草莓采后当天采用4 ℃冷链运至实验室,于冰箱4 ℃冷藏,次日开始草莓保鲜实验。
食品级玉米淀粉 山东恒仁有限公司;金黄色葡萄球菌(ATCC6538)、大肠埃希氏菌(ATCC8739)上海鲁微科技有限公司;青霉菌(ATCC1109)、链格孢菌(CGMCC3.4255) 北京生物保藏中心;马铃薯液体培养基、酵母浸出粉胨葡萄糖琼脂培养基、YPD液体培养基、马铃薯葡萄糖琼脂 青岛海博生物技术有限公司;氢氧化钠、酚酞、乙醇 上海阿拉丁生化科技股份有限公司;三氯乙酸(trichloroacetic acid,TCA)、磷酸 上海麦克林生化科技有限公司;丙三醇 广州化学试剂厂;三氯化铁(FeCl3) 广州市梓兴化玻仪器有限公司;亚硫酸氢钠 天津市大茂化学市机厂;红菲咯啉(bathophenanthroline,BP) 天津希恩思奥普德科技有限公司;盐酸 上海穗试化工科技有限公司;实验所用试剂均为分析纯。
1.2 仪器与设备
LX-B50L型立式数显式灭菌锅 合肥华泰医疗设备有限公司;SHA-B型水浴恒温振荡器 金坛市医疗仪器厂;GZX-924MBE型电热鼓风干燥箱 上海博迅实业有限公司医疗设备厂;KLCZ-880A型超净工作台 北京亚泰科隆仪器技术有限公司;HCS-265A-A型生化培养箱广州恒创实验仪器有限公司;Hei-Standard型磁力搅拌器德国Heidolph公司;EL 104型电子天平 梅特勒-托利多仪器(上海)有限公司;QTS型质构仪 美国Brookfield公司;LC-DR-53B型糖度仪 上海力辰邦西仪器科技有限公司;UV-9600型紫外分光光度计 北京瑞利分析仪器公司。
1.3 方法
1.3.1 OST的制备
以过氧化氢为氧化剂、硫酸铜为催化剂,通过玉米淀粉氧化制备含有不同相对含量羧基的OST[15-16],并测定羧基相对含量[17-18]。将羧基相对含量分别为13%、31%和57%(即氧化度为13%、31%和57%)的OST分别命名为OST-13、OST-31和OST-57。
1.3.2 OST-13、OST-31和OST-57抑菌能力的测定
细菌菌悬液的制备:将大肠杆菌、金黄色葡萄球菌进行平板划线激活处理,挑取菌落,培养至对数期后调整浓度至105CFU/mL备用。
真菌菌悬液的制备:青霉菌和链格孢菌的孢子悬浮液采用李倩[19]的方法进行制备,将鲜绿青霉和链格孢菌孢子悬浮液转移至100 mL生理盐水中,调整浓度至105CFU/mL备用[20]。
采用抑菌圈法分析OST-13、OST-31和OST-57的抑菌能力。各称取0.05 g放入烘箱干燥一段时间后的OST-13、OST-31和OST-57以及未经氧化的玉米淀粉,放入紫外灯下照射40 min备用[21]。以金黄色葡萄球菌、大肠杆菌、青霉菌和链格孢菌作为受试菌,将105CFU/mL的菌液各取100 μL均匀涂布于固体平板上,在固体平板上打出4 个直径为6 mm的圆孔以填充样品粉末,将上述不同OST均匀填充至圆孔中并压实,分别记为玉米淀粉、OST-13、OST-31和OST-57,确保将淀粉样品填充进孔中且不影响孔周围的琼脂区域。其中金黄色葡萄球菌和大肠杆菌放入37 ℃培养箱中进行培养24 h,真菌在26 ℃温度下培养5 d,最后观察并采用十字交叉法测量抑菌圈直径,每组设置3 个平行实验。
1.3.3 涂膜液与草莓的处理
1.3.3.1 涂膜液的制备
经抑菌实验得出OST-57抑菌效果最佳,因此以下实验用于草莓保鲜的OST均为OST-57。草莓的涂膜参照于广伟等[22]方法,准确称取30 g OST于1 L烧杯中,一边搅拌一边缓慢加入970 mL蒸馏水,制成质量分数为3%的OST溶液,置于80 ℃水浴中充分糊化至液体透明,然后加入体积分数1%的甘油作为辅料,在磁力搅拌器中1 000 r/min搅拌30 min,冷却至室温,300 W超声均质2 次后成透明且黏稠状液体备用。
1.3.3.2 草莓预处理
将挑选好的草莓果实随机分为3 组,每组80 颗,同时根据不同研究中[5,13-22]所用浸泡时间优化草莓涂膜浸泡时间,分别进行以下处理:1)空白对照组(CK组):未做任何处理;2)浸泡时间为1 min的处理组(T1组):用灭菌后的镊子将草莓放入制备的OST涂抹液中,浸泡1 min后取出自然晾干;3)浸泡时间为5 min的处理组(T2组):用灭菌后的镊子将草莓放入制备的OST涂抹液中,浸泡5 min后取出自然晾干。
将以上处理好的3 组草莓贮藏于4 ℃、相对湿度85%~95%的恒温恒湿培养箱中,草莓取样时间分别为0、2、4、6 d和8 d。
1.3.4 质量损失率和腐烂率的测定
采用称质量法称量每颗草莓的初始质量,记为m0,贮藏期间每隔2 d对果实进行质量的跟踪测定,记为mX,按照公式(1)计算每组草莓的质量损失率。
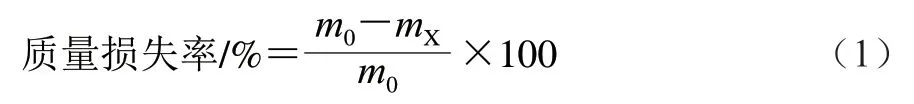
草莓的腐烂率测定参考郑永华等[23]的方法并稍作修改,观察贮藏期间每组草莓的腐烂个数,记为n0,果实总数量记为n1,按照公式(2)求得腐烂率。

1.3.5 菌落总数的测定
参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[24]测定菌落总数,所有微生物计数均表示为lg(CFU/g),实验重复3 次。
1.3.6 硬度和咀嚼性的测定
草莓的硬度及咀嚼性测定参考Reddy等[25]的方法并稍作修改,在果实赤道部位测定其硬度,每组分别测定4 个果实。测定条件如下,测试类型:质构剖面分析(texture profile analysis,TPA);目标深度:5.0 mm;触发点负载:2 g;预测试速率:2.00 mm/s;返回速率:1.00 mm/s;探头:TA11/1000;夹具:TA-RT-KIT;循环次数:2 次。
1.3.7 可溶性固形物质量分数和可滴定酸质量分数的测定
可溶性固形物(total soluble solids,TSS)质量分数采用糖度仪测定。
采用酸碱滴定法[26]进行可滴定酸(titratable acidity,TA)质量分数的测定,取10 g果实样品于研钵中进行研磨,然后转移到100 mL容量瓶中,用蒸馏水多次冲洗研钵,将洗液一起转移到100 mL容量瓶中,定容,摇匀。静置30 min后过滤到三角瓶中,吸取20 mL溶液,用0.1 mol/L NaOH溶液滴定至溶液浅粉色并在30 s内不褪色,终止滴定,记录消耗的NaOH溶液体积,以蒸馏水为空白。根据NaOH溶液消耗量计算果蔬组织中TA质量分数,如公式(3)所示。
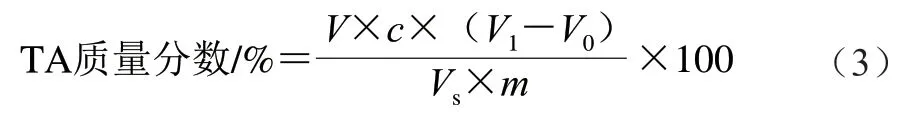
式中:V为样品提取液总体积/mL;Vs为滴定时所取滤液体积/mL;c为NaOH溶液浓度/(mol/L);V1为滴定滤液消耗的NaOH溶液体积/mL;V0为滴定蒸馏水消耗的NaOH溶液体积/mL;m为样品质量/g;f为折算系数/(g/mmol)。
1.3.8 抗坏血酸含量的测定
标准曲线的绘制:称取10 mg抗坏血酸,用质量浓度50 g/L TCA溶液溶解,定容至100 mL,制成质量浓度100 μg/mL标准抗坏血酸溶液,保存于棕色瓶中,低温冷藏。加入TCA、无水乙醇、0.4%磷酸-乙醇溶液、BP-乙醇溶液、FeCl3-乙醇溶液进行反应,使各样品中抗坏血酸质量分别为0、10、20、30、40、50 μg和60 μg,将混合溶液置于30 ℃反应60 min,然后以含抗坏血酸质量浓度为0 μg/mL的样液为参照,于534 nm波长处测定吸光度,以抗坏血酸质量为横坐标,吸光度为纵坐标绘制标准曲线,求得回归方程。
将草莓洗净,吸干表面水分,剪碎后混匀,称取5 g样品置于研钵中,加入20 mL质量浓度50 g/L TCA溶液,在冰浴条件下研磨成浆状,转入到100 mL容量瓶中,并用质量浓度50 g/L TCA溶液定容,混合、提取10 min后,过滤收集滤液后取1 mL样液按绘制标准曲线的实验方法加入无水乙醇等试剂,混合溶液于30 ℃反应60 min,于534 nm波长处测定吸光度。按式(4)计算草莓中抗坏血酸含量,抗坏血酸含量以100 g样品中含有的抗坏血酸的质量表示,单位为mg/100 g。

式中:m1为由标准曲线求得的抗坏血酸质量/μg;Vs为测定时所用样品中提取液体积/mL;V为样品提取液总体积/mL;m2为样品质量/g。
1.3.9 花色苷质量浓度的测定
花色苷的提取参考于广伟[27]的方法并进行改进,取2 g草莓果肉于具塞试管中,加入20 mL 60%(体积分数,下同)乙醇溶液(含0.096 mol/L盐酸),40 ℃、300 W超声30 min,于25 ℃、2 500 r/min离心5 min,果渣再重复提取2 次,收集上清液用体积分数60%乙醇溶液(含0.096 mol/L盐酸)定容至25 mL,室温保存,测定提取液的OD520nm,并计算花色苷质量浓度。
1.4 数据处理与分析
采用SPSS Statistics 25软件进行数据统计分析,数据均表示为平均值±标准差,采用单因素方差分析(Oneway ANOVA)和Duncan多重检验进行差异显著性分析(以P<0.05表示差异显著),并利用Origin 2018软件制图。
2 结果与分析
2.1 OST的抑菌能力
草莓表面存在多种天然微生物群,其中以青霉菌和链格孢菌为主,这两种菌被认为是潜在的真菌毒素生产者[28]。同时采摘后的草莓容易受到多种微生物的感染,其中以金黄色葡萄球菌和大肠杆菌为主。通过抑菌圈法[29-31]可以直观地看出抑菌剂对不同菌种的抑菌能力。
由图1A可知,羧基相对含量达57%的OST(OST-57)对金黄色葡萄球菌、大肠杆菌和青霉菌形成的抑菌圈直径分别为(29.00±0.87)、(28.00±1.73)、(15.75±0.65)mm。在同一菌种中,抑菌圈直径随着OST羧基相对含量的提升而增加,OST-57组抑菌圈直径均显著长于其他OST组(P<0.05),说明OST的抑菌能力可能与OST中羧基含量有关,羧基的大量存在可能会破坏细菌正常膜电位,影响细胞膜的生物功能,同时能够引发细菌生长环境酸度的降低,进一步抑制细菌的生长繁殖[16]。OST对4 种菌的抑菌效果如图1B所示,玉米淀粉本身不具备任何抑菌效果,因此无抑菌圈出现,OST对金黄色葡萄球菌和大肠杆菌及青霉菌具有抑菌作用,其中对金黄色葡萄球菌抑制效果最明显,而对链格孢菌未表现出明显抑菌作用。链格孢菌适应性强,能在培养基上无限生长,同时其孢子含有多个横、纵和斜膈膜,能够更好地阻隔外界抑菌物质的干扰[31],阻止OST对其产生抑制作用。
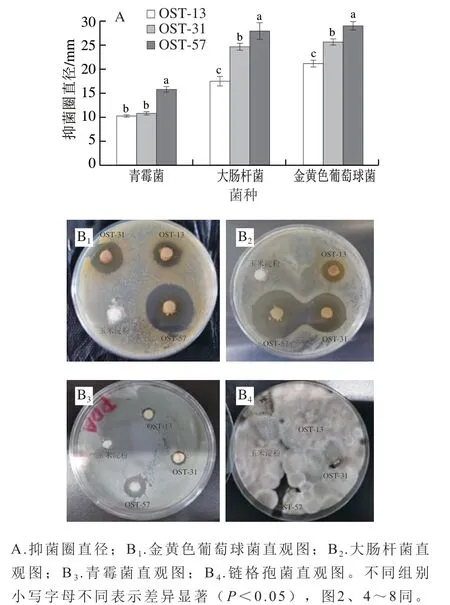
图1 氧化度不同的OST的抑菌圈(A)和直观图(B)Fig. 1 Diameters of inhibition zones (A) and pictures (B) of OST with different degrees of oxidation against pathogenic and spoilage organisms
2.2 OST涂膜处理对草莓贮藏期间质量损失率和腐烂率的影响
草莓在贮藏过程中进行的有氧呼吸和水分挥发导致草莓的质量变化,微生物污染导致草莓的腐烂率发生变化,因此,质量损失率和腐烂率一定程度上可以反映草莓的有氧呼吸强度和菌落总数的变化情况。
从图2可以看出,CK组草莓在贮藏4 d后,质量损失率与腐烂率明显上升,原因是CK组草莓开始出现霉菌,消耗草莓内的营养成分,同时草莓开始进入成熟后期,呼吸速率的增强加快了草莓中营养物质的消耗。贮藏6 d后CK组草莓表面出现大块霉菌和果皮溃烂的情况,微生物的大量繁殖成为草莓质量损失率和腐败率快速上升的主要原因。贮藏至第6天,OST处理组(T1组和T2组)的质量损失率和腐烂率显著低于CK组(P<0.05),说明OST涂膜对草莓表面起到保护作用,能够有效地抑制微生物的生长繁殖,减少草莓在贮藏过程中营养成分的消耗,同时降低有氧呼吸强度,减少贮藏期间的质量损失。结果表明,经OST涂膜的草莓保存时间至少可延长2 d,同时发现前处理浸泡时间对于质量损失率和腐烂率没有明显影响。

图2 OST涂膜对草莓质量损失率(A)和腐烂率(B)的影响Fig. 2 Effect of OST coating on mass loss rate (A) and decay incidence (B)of strawberries
2.3 OST涂膜对草莓贮藏期间菌落总数的影响
草莓表面的致病菌和霉菌会对草莓表皮组织结构产生严重破坏,是导致草莓腐烂的主要原因之一,因此,菌落总数可作为评价其保鲜效果的指标之一。在发现OST对金黄色葡萄球菌、大肠杆菌和青霉菌具有一定抑菌能力的基础上(图1),通过测定菌落总数对真实草莓的抑菌效果进行探究,结果如图3所示。实验中草莓菌落总数随着贮藏时间的延长而增多,贮藏时间2 d时,CK组草莓菌落总数与第0天相比明显增长,贮藏2~8 d,处理组(T1组和T2组)草莓菌落总数均极显著低于CK组(P<0.01),贮藏至第8天则出现大片菌群,而T2组第8天表面光滑仍可食用。综上说明OST涂膜处理后的草莓能够显著抑制草莓表皮微生物的生长繁殖,有效地延缓微生物对草莓表皮的损伤以及微生物对果实营养的消耗。贮藏期间T2组草莓的菌落总数始终低于T1组,但未出现显著性差异,即前处理浸泡时间对菌落总数的变化没有显著影响。
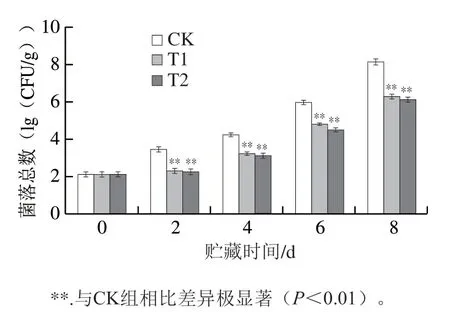
图3 OST涂膜对草莓菌落总数的影响Fig. 3 Effect of OST coating on total viable count on strawberries
2.4 OST涂膜对草莓贮藏期间硬度和咀嚼性的影响
果实质地是评价果实品质的重要指标,本实验通过质构仪来测定草莓贮藏过程中硬度和草莓果肉咀嚼性。贮藏期间,草莓硬度和咀嚼性的变化趋势总体上随着贮藏时间的延长先升高后降低(图4),且涂膜组与CK组在两项指标中均存在明显差异。

图4 OST涂膜对草莓硬度(A)和咀嚼性(B)的影响Fig. 4 Effect of OST coating on strawberry hardness (A) and chewiness (B)
硬度的升高说明细胞初生壁和中胶层的果胶含量仍处于增长阶段[32-33],草莓的成熟过程会伴有果胶酶对果胶的分解、初生壁和中胶层结构的分解以及细菌对草莓表皮的侵染,导致果实软化硬度下降[34]。其中CK组草莓硬度第2天明显升高,4 d后开始下降;T2组草莓硬度在0~4 d持续上升,在4~8 d,草莓硬度始终保持在约4.9 N水平;而T1组草莓硬度的变化趋势介于CK组与T2组之间,贮藏2 d后,与CK组和T2组均无显著性差异(P>0.05)。结果表明,T2组草莓中硬度得到长期的保持,推测是OST涂膜在草莓表面形成的保护膜抑制了草莓的有氧呼吸,延缓了草莓果肉细胞初生壁的老化和果胶的消耗,从而有效地保持了草莓硬度。
咀嚼性增大说明CK组草莓在贮藏前期仍处于转红期,果肉细胞分子之间结合力增大导致果肉紧实性提升,而随着果实的成熟,果实内果胶和纤维素的分解导致果肉细胞分子之间结合力下降,咀嚼性快速下降[35]。与第0天相比,3 组草莓在贮藏第2天咀嚼性均明显升高,其中CK组在2~4 d咀嚼性明显下降,而涂膜组(T1和T2组)在贮藏4 d后咀嚼性开始下降,且T2组草莓第8天的咀嚼性仍保持在较高水平(6.43 mJ),这是由于草莓经OST涂膜处理后,草莓表面的涂膜层抑制了草莓成熟后期的呼吸作用和蒸腾作用[36],对果肉的新鲜度和紧实度起到了保护作用。综上可知,OST涂膜既保证了贮藏过程中草莓内营养物质含量的稳定,同时能够有效维持果肉细胞间的结合力,延缓草莓硬度和咀嚼性下降。
2.5 OST涂膜对草莓贮藏期间TSS质量分数和TA质量分数的影响
TSS是影响草莓口感风味的重要因素,在一定程度上能够反映出贮藏过程中草莓营养物质的保留情况。
贮藏早期,草莓中高分子碳水化合物水解转化为可溶性糖,而随后可溶性糖随着呼吸作用的加大被不断消耗,因此贮藏过程中草莓TSS质量分数总体呈现先上升后下降的趋势(图5),其中T1组与CK组的变化趋势相同,而T2组草莓的TSS质量分数则更加稳定,第8天时TSS质量分数显著高于其他组(P<0.05),说明T2组草莓在贮藏前期果实内部TSS生成速率变慢,同时成熟后TSS的消耗速率降低,有研究发现,TSS质量分数与总抗氧化-亚铁还原能力(ferric reducing-antioxidant power,FRAP)以及氧自由基吸收能力(oxygen radical absorption capacity,ORAC)之间存在明显的相关性[37]。总地来说,在TSS质量分数的维持上,T2组贮藏末期与其他两组之间存在明显差异,故对草莓进行OST涂膜浸泡5 min处理不仅能够保存果实中的风味物质,对草莓果肉中抗氧化物质的维持可能同样有效。

图5 OST涂膜对草莓TSS质量分数的影响Fig. 5 Effect of OST coating on TSS content in strawberries
草莓果实所含酸主要以有机酸为主,包括苹果酸、柠檬酸、酒石酸等。研究表明草莓在贮藏过程中,TA可在果实内转化为糖分或作为呼吸反应底物被一直消耗[38-39],本实验结果也显示3 组草莓TA质量分数在0~2 d内显著下降(P<0.05),随后下降速率减缓(图6)。草莓采摘后仍处于成熟前期,而这一阶段的呼吸作用速率和营养物质的转换活跃,而后逐渐降低,这与Saleem等[40]的研究结果一致。总体而言,CK组TA质量分数第8天下降到0.832%,涂膜组高于CK组,但涂膜组与CK组之间并未出现显著性差异(P>0.05),因此OST涂膜可能对草莓中TA质量分数影响不大。
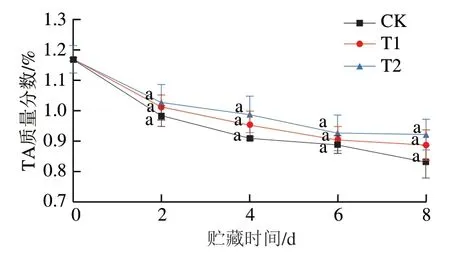
图6 OST涂膜对草莓TA质量分数的影响Fig. 6 Effect of OST coating on TA content in strawberries
2.6 OST涂膜对草莓贮藏期间抗坏血酸含量的影响
抗坏血酸对草莓生长发育起着重要作用。贮藏期间草莓抗坏血酸含量的变化结果如图7所示,3 组草莓在贮藏期间的抗坏血酸含量整体呈现下降的趋势,其中CK组在贮藏前期(0~4 d)下降趋势最为明显,T1组和T2组比CK组的下降速率缓慢,原因可能是贮藏前期的草莓果浆中顶部存在氧气,而抗坏血酸主要以有氧降解为主,OST涂膜后阻碍了草莓与外界氧气的接触,抑制了抗坏血酸的有氧降解,而当浆果中氧气消耗殆尽或不足时,抗坏血酸的降解方式转变为无氧降解,降解效率大幅降低。
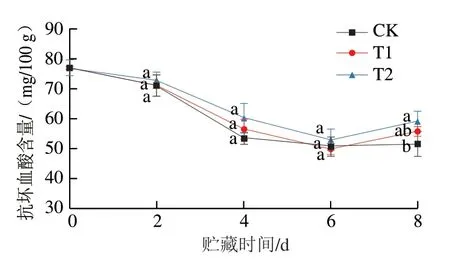
图7 OST涂膜对草莓抗坏血酸含量的影响Fig. 7 Effect of OST coating on vitamin C content in strawberries
T1组和T2组草莓抗坏血酸含量在6~8 d上升,可能是经过涂膜后的草莓在贮藏后期会造成抗坏血酸在体内积累,最终导致抗坏血酸含量升高,也可能是草莓个体之间的差异导致。总体来说,涂膜组草莓中抗坏血酸含量下降速率较CK组更为迟缓,同时涂膜浸泡时间的长短对于草莓抗坏血酸含量的保持没有显著影响(P>0.05),即OST对抗坏血酸的保护作用并不明显。
2.7 OST涂膜对草莓贮藏期间花色苷质量浓度的影响
花色苷是草莓中多酚类物质的重要组成成分,草莓表观颜色主要由天竺葵素3-O-葡萄糖苷、天竺葵素3-O-芸香苷和矢车菊素3-O-葡萄糖苷等酚类花色苷提供,其中天竺葵素3-O-葡萄糖苷使草莓颜色更加明亮,而矢车菊素3-O-葡萄糖苷则提供了更深的红色[41-43]。
如图8所示,在贮藏0~4 d内,3 组草莓花色苷质量浓度均明显增加,果皮颜色向深红转变,推测是天竺葵素3-O-葡萄糖苷和矢车菊素3-O-葡萄糖苷含量增多导致。随着贮藏时间的延长,由于CK组草莓的呼吸作用和微生物入侵对果内营养物质的消耗逐渐增大,第8天花色苷质量浓度相比于第6天明显下降。对于T1组和T2组,花色苷质量浓度的增长期在0~6 d,相比于CK组延长了2 d,且贮藏期在8 d时CK组和T1组存在显著差异(P<0.05)。在贮藏期2、4 d和8 d时,CK组和T2组草莓花色苷质量浓度均存在显著差异(P<0.05)。结果说明,贮藏期间,涂膜组与CK组在花色苷的保持上存在显著性差异(P<0.05),对草莓进行OST涂膜处理可以有效地延缓草莓进入成熟期,并且在成熟后期能够很好地保持花色苷质量浓度,对于草莓的颜色和品质起到积极作用(图9)。同时注意到草莓花色苷的种类、含量和比例与草莓品种有较大关系,故草莓花色苷的检测方法应视具体情况而定,本实验中花色苷质量浓度检出值偏低,后续可进一步改进测定方法。
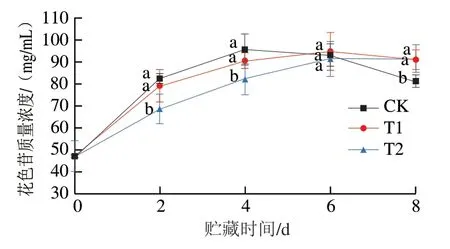
图8 OST涂膜对草莓花色苷质量浓度的影响Fig. 8 Effect of OST coating on anthocyanin content in strawberries

图9 OST涂膜对CK、T1和T2组在贮藏第0、8天草莓外观品质的影响Fig. 9 Effect of OST coating on appearance of strawberries on days 0 and 8 of storage
3 结 论
OST对金黄色葡萄球菌、大肠杆菌和青霉菌具有良好的抑菌能力,其中OST-57的抑菌能力最为出色。OST-57涂膜处理能够在草莓表面形成一层抑菌薄膜,一方面能够显著抑制草莓表面微生物的生长;另一方面可以延缓草莓的有氧呼吸,显著降低草莓在贮藏过程中的质量损失率和腐烂率(P<0.05),对于TSS质量分数、硬度、咀嚼性和花色苷质量浓度等指标的变化也具有明显改善作用,且T2组在大部分指标中均表现更优。综上所述,采用具有抑菌效果的OST-57对草莓进行涂膜浸泡处理5 min能够更大限度地发挥其保鲜效果,使其保持良好的食用品质和营养价值,延长草莓保鲜期。
