高F值玉米肽通过改善大鼠骨骼肌线粒体功能提高运动能力
2022-11-30刘金美付翠元贾绍辉
刘金美,付翠元,马 坤,李 哲,贾绍辉,4,*
(1.武汉体育学院健康科学学院,湖北 武汉 430079;2.济南大学体育学院,山东 济南 250024;3.湖北开放大学经济贸易学院,湖北 武汉 430074;4. 武汉体育学院 运动训练监控湖北省重点实验室,湖北省运动与健康促进协同创新中心,湖北 武汉 430079)
众所周知,运动能力下降的主要原因是运动疲劳的产生,运动疲劳是指“机体的生理过程不能维持其机能在某一特定水平或不能维持预定的运动强度”的一种生理现象[1]。运动疲劳容易诱发运动损伤,直接影响人体的正常运动,降低运动员的运动能力和表现。线粒体是机体内三磷酸腺苷(adenosine triphosphate,ATP)产生的重要场所,已有研究显示运动疲劳的发生与骨骼肌线粒体呼吸链的损伤有直接关系,会引起骨骼肌线粒体钙代谢、膜流动性和膜脂质过氧化的改变。脂质过氧化水平增高会导致线粒体内膜分子动力学改变和内膜组分活性的变化,并且剧烈运动会引起ATP酶活性降低,导致能量供应不足,引发运动疲劳产生[2]。报道显示,通过补剂的方式保持线粒体功能的完整性可能对运动疲劳的消除和运动能力提高具有显著效果,例如,Liu Lixia等[3]发现吡咯喹啉醌可通过改善小鼠线粒体功能预防运动性疲劳和氧化损伤的产生,提高小鼠运动能力。Zhu Hongkang等[4]也发现马蹄莲可通过减少氧化应激的产生保护线粒体功能的完整性,从而降低骨骼肌疲劳,提高骨骼肌运动能力。
玉米肽是玉米蛋白经定向酶切及特定小肽分离技术获得的小分子多肽,其营养丰富,并且具有稳定性高、溶解性好、易吸收等优点[5]。近年来,玉米肽的应用范围越来越广泛,包括降血压、醒酒、护肝、增强免疫及运动能力、抗氧化应激等。
F值是指支链氨基酸与芳香族氨基酸的物质的量比值,正常人体血液中F值为3.0~3.5,高F值活性肽的F值应大于20[6]。高F值活性肽中支链氨基酸含量高,具有为机体提供能量、促进胰岛素分泌、促进蛋白合成等重要生理功能[7]。比较普通玉米肽与高F值玉米肽的抗氧化能力发现,高F值玉米肽具有更强的清除细胞内活性氧的能力,说明高F值玉米肽相比普通玉米肽具有更强的抗氧化能力[8]。
鉴于高F值玉米肽具有更强的抗氧化能力,而体内氧自由基产生过多导致的线粒体损伤是运动疲劳产生、运动能力下降的重要原因,因此推测高F值玉米肽具有潜在的抗运动疲劳、提高运动能力的功效。本研究选取SD大鼠,在长期给予高F值玉米肽并进行游泳训练后,进行一次性力竭运动,分析高F值玉米肽对大鼠骨骼肌氧自由基清除能力及线粒体功能的影响,考察高F值玉米肽对实验大鼠运动能力的影响,以期为明确高F值玉米肽的抗运动疲劳、提高运动能力功效提供参考依据。
1 材料与方法
1.1 动物、材料与试剂
80 只SPF级雄性SD大鼠,体质量约250 g,购于湖北省预防医学中心,生产许可证号:SCXK(鄂)2016-0018,使用许可证号:SYXK(鄂)2021-0087。
高F值玉米肽(F值为27.8)由山东中食都庆生物科技有限公司提供。
超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)检测试剂盒 南京建成生物工程研究所;ATP合成酶与水解酶检测试剂盒美国Abcam生物技术公司;BCA蛋白定量试剂盒 上海碧云天生物技术有限公司;核因子2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)、Kelch样ECH关联蛋白1(Kelch-like ECH-associated protein 1,Keap1)抗体 美国Santa Cruz Biotechnology公司;线粒体融合蛋白(mitofusin2,Mfn2)、动力相关蛋白(dynaminrelated protein,Drp1)、GAPDH抗体 美国Cell Signaling生物公司。
1.2 仪器与设备
Lactate-scout血乳酸测定仪 德国EFK公司。
1.3 方法
1.3.1 实验动物分组及游泳训练
80 只SPF级雄性SD大鼠于SPF级动物房适应性喂养1 周后,随机分为4 组,每组20 只,分别为对照组(A组)、高F值玉米肽低剂量组(B组)、高F值玉米肽中剂量组(C组)与高F值玉米肽高剂量组(D组)。B、C、D组每天灌胃给予0.1、0.2、0.4 g/kgmb高F值玉米肽(采用生理盐水配制成0.1 g/mL混悬液),A组给予等体积生理盐水。每天上午给药,下午进行无负重游泳训练,训练时间为每天1 h,每周第1~5天连续运动5 d、安静状态休息2 d,共训练8 周。实验结束后次日进行一次性负重力竭运动,负重为体质量5%,参考文献[9-10]确定力竭标准为大鼠沉入水中10 s不再浮上水面,捞出后在平面上无法完成翻正反射。记录大鼠力竭运动时间并测定其血乳酸浓度。待安静状态休息3 d后,处死实验大鼠,取外周血以及骨骼肌组织。
1.3.2 血乳酸浓度测定
分别于力竭运动前、力竭运动后5 min、力竭运动后15 min,取实验大鼠尾静脉血1 滴,利用血乳酸测定仪检测并记录其血乳酸浓度。
1.3.3 抗氧化指标测定
称取骨骼肌组织约1 mg,加入1 mL预冷磷酸盐缓冲液(phosphate buffered saline,PBS),60 Hz匀浆2 min后超声1 min。收集超声后组织液,4 ℃、3 000 r/min离心20 min,收集上清液分别按照MDA以及SOD检测试剂盒说明书要求检测各组大鼠肌肉组织MDA含量以及SOD活力,结果均以蛋白质量计。
1.3.4 Western blot检测抗氧化应激蛋白及线粒体融合与分裂蛋白的表达
取大鼠腓肠肌100 mg,冰浴上加入细胞裂解液充分裂解细胞和一定剂量蛋白酶抑制剂,60 Hz脉冲条件对组织进行匀浆(匀浆4 次,每次2 min、间隔20 s),然后用超声裂解仪裂解释放总蛋白,采用BCA蛋白定量试剂盒测定蛋白质量浓度。裂解后的细胞悬液中加入蛋白上样缓冲液,100 ℃煮沸5~10 min使蛋白完全变性。取制备好的40 μg蛋白利用15%聚丙烯酰胺凝胶进行分离电泳(85 V、30 min,120 V、90 min),250 mA条件下将分离后蛋白转印到聚偏二氟乙烯膜上,转膜时间2.5 h,转膜结束后,5%脱脂奶粉室温封闭1 h,TBST洗涤3 次,然后分别加入Nrf2、Keap1、Mfn2、Drp1以及GAPDH抗体(稀释比均为1∶1 000),4 ℃孵育过夜,TBST洗涤3 次,加入二抗室温孵育1 h。最后用增强型化学发光剂显影,自动曝光机检测蛋白条带灰度,分析蛋白表达水平。
1.3.5 线粒体ATP合成酶活力测定
称取100~200 mg新鲜腓肠肌及股四头肌组织,PBS洗涤,洗净血水,用定性滤纸吸干;然后将肌肉组织置于冰上的培养皿中,剪碎,加入预冷裂解液1.5 mL,冰上用手工研杵反复研磨约30 次,在显微镜下观察,组织中应至少50%以上细胞保持完整。然后将组织匀浆物转入预冷离心管中,4 ℃、4 000 r/min离心5 min,收集上清液。在另一预冷离心管中加入0.5 mL预冷的A液(1 mol/L KCl、0.5 mol/L Tris,pH 7.4),将上清液小心转移到离心管中,覆于A液上层,4 ℃、12 000 r/min离心10 min,上清为胞浆,沉淀即为所需提取线粒体。向沉淀中加入0.2 mL漂洗液重悬线粒体,4 ℃、12 000 r/min离心10 min,弃上清液,沉淀中加入100 μL 0.1mol/L KCl溶液重悬,按照试剂盒说明书操作,测定大鼠骨骼肌线粒体中ATP合成酶活力。
1.3.6 ATP水解酶活力测定
取新鲜腓肠肌和股四头肌肌肉组织适量,加入100 μL细胞裂解液和1 μL苯甲基磺酰氟溶液(0.01 mol/L),采用组织匀浆机在60 Hz下匀浆(匀浆4 次,每次2 min、间隔20 s),然后用超声裂解仪裂解释放总蛋白。4 ℃、10 000 r/min离心10 min,收集上清液,按照试剂盒说明书操作,测定大鼠骨骼肌中ATP水解酶活力。
1.4 数据处理与分析
每个实验至少重复3 次,结果均以平均值±标准差表示。采用GraphPad Prism 6.0软件,使用单因素方差分析对各组数据进行差异显著性分析,P<0.05被认为具有显著差异。
2 结果与分析
2.1 高F值玉米肽对大鼠力竭运动时间的影响
如图1所示,口服低、中、高剂量高F值玉米肽并同时进行8 周游泳训练后,大鼠力竭运动时间由对照组的(41.56±3.97)min分别延长至(107.25±5.26)、(148.20±5.34)min以及(185.80±8.53)min。提示随着高F值玉米肽剂量的提高,大鼠力竭运动时间呈线性递增。
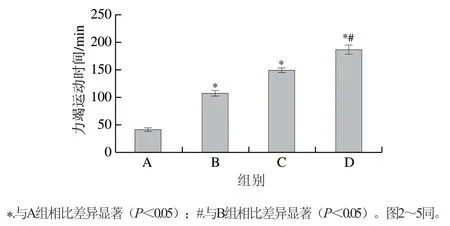
图1 高F值玉米肽对大鼠力竭运动时间的影响Fig. 1 Effect of high F-value corn peptide on exhaustive exercise time in rats
2.2 高F值玉米肽对大鼠力竭运动后血乳酸水平的影响
血乳酸水平是评价运动疲劳的一项重要指标。如图2所示,对照组在力竭运动后5 min,其血乳酸水平急剧上升(由运动前的(2.38±0.26)mol/L上升至(17.88±0.89)mol/L),且在力竭运动后15 min其血乳酸浓度依然维持在(14.90±0.85)mol/L,恢复较慢。在力竭运动前,灌胃3 种剂量高F值玉米肽的实验大鼠血乳酸水平没有明显差异,低、中、高剂量组分别为(2.84±0.46)、(2.87±0.53)mol/L和(2.90±0.34)mol/L;而在力竭运动后5 min,低、中、高剂量组大鼠的血乳酸浓度分别为(8.94±0.54)、(7.86±0.57)mol/L和(6.98±0.91)mol/L,均显著低于对照组(P<0.05);在力竭运动后15 min,灌胃高F值玉米肽实验大鼠的血乳酸水平进一步下降,分别为低剂量组(7.52±0.47)mol/L、中剂量组(6.47±0.44)mol/L、高剂量组(5.50±0.62)mol/L。高F值玉米肽高剂量组在力竭运动后5、15 min的血乳酸水平均显著低于低剂量组(P<0.05)。
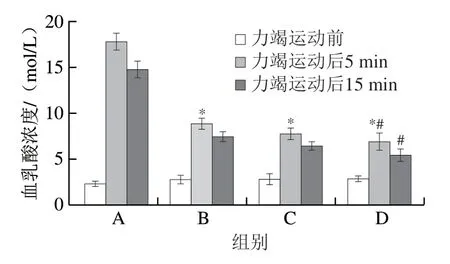
图2 高F值玉米肽对大鼠力竭运动后血乳酸水平的影响Fig. 2 Effect of high F-value corn peptide on blood lactate levels in rats after exhaustive exercise
2.3 高F值玉米肽对大鼠骨骼肌线粒体ATP酶活力的影响
如图3所示,在服用低、中、高剂量高F值玉米肽并进行长期游泳训练后,运动疲劳模型大鼠股四头肌线粒体ATP合成酶活力由对照组的(1.47±0.18)U/mg分别上升至(1.75±0.25)、(1.96±0.21)、(2.13±0.15)U/mg;腓肠肌线粒体ATP合成酶活力分别由对照组的(1.65±0.23)U/mg上升到(2.09±0.17)、(2.17±0.18)、(2.53±0.14)U/mg,ATP合成酶活力的提高与高F值玉米肽剂量呈线性依赖关系,其中高剂量高F值玉米肽组线粒体ATP合成酶活力与对照相比显著提高(P<0.05)。由此可知,高F值玉米肽可以通过提高ATP合成酶活力间接增加骨骼肌中的能量供应,从而降低运动疲劳发生几率。
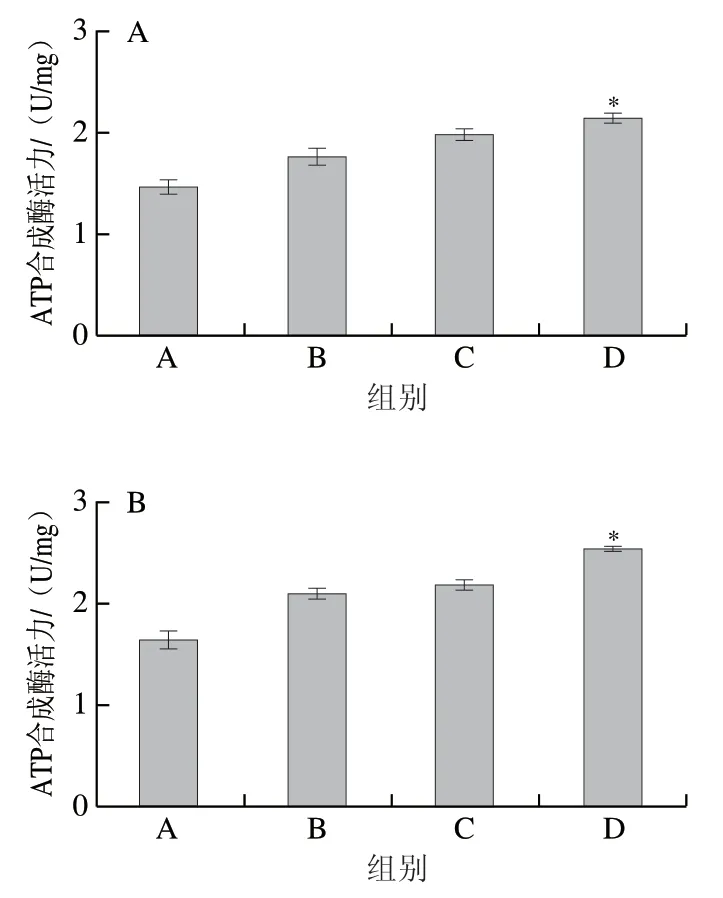
图3 高F值玉米肽对大鼠股四头肌(A)和腓肠肌(B)线粒体中ATP合成酶活力的影响Fig. 3 Effect of high F-value corn peptide on ATP synthase activity in mitochondria of rat Quadriceps (A) and Gastrocnemius (B) muscle
ATP水解酶是一种存在于组织细胞膜及细胞器膜上的蛋白酶,其在物质运送、能量转换以及信息传递中发挥重要作用。本研究考察不同剂量高F值玉米肽对实验大鼠腓肠肌及股四头肌线粒体中ATP水解酶活力的影响,如图4所示,服用低、中、高剂量高F值玉米肽实验大鼠股四头肌中ATP水解酶活力由对照组的(2.975±0.232)U/mg分别上升到(4.252±0.347)、(5.296±0.229)、(6.528±0.459)U/mg(P<0.05),同时腓肠肌中ATP水解酶活力由对照组的(2.157±0.259)U/mg分别上升到(3.512±0.364)、(5.327±0.415)、(6.716±0.548)U/mg(P<0.05)。经8 周游泳训练后,服用高剂量高F值玉米肽的大鼠腓肠肌和股四头肌线粒体中ATP水解酶活力均较低剂量组大鼠显著上升(P<0.05)。
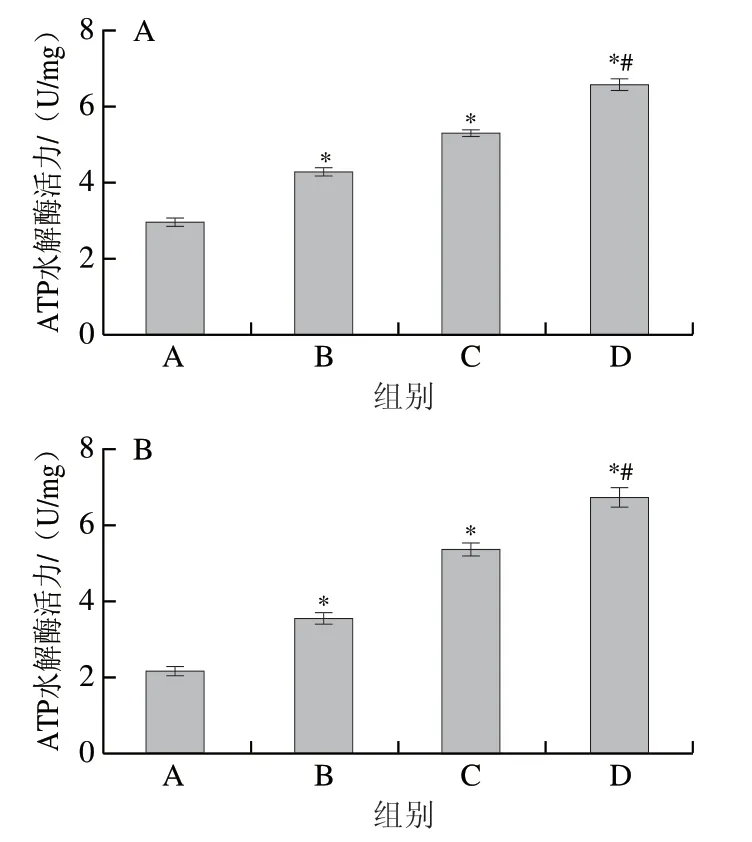
图4 高F值玉米肽对大鼠股四头肌(A)和腓肠肌(B)线粒体中ATP水解酶活力的影响Fig. 4 Effect of high F-value corn peptide on ATP hydrolase activity in mitochondria of rat Quadriceps (A) and Gastrocnemius (B) muscle
2.4 高F值玉米肽对大鼠运动疲劳所致骨骼肌氧化损伤的影响
大鼠在8 周游泳训练结合服用高F值玉米肽后进行一次性力竭运动,如图5A所示,对照组大鼠外周血中SOD活力为(10.43±1.53)U/g,而服用低、中、高剂量高F值玉米肽的大鼠外周血中SOD活力分别提高至(12.74±0.85)、(13.58±1.31)、(15.07±1.36)U/g,与对照组相比,高剂量高F值玉米肽组大鼠外周血中SOD活力显著提高(P<0.05)。
如图5B所示,8 周游泳训练结合服用低、中、高剂量高F值玉米肽的大鼠在一次性力竭运动后骨骼肌组织中MDA含量由对照组的(213.79±21.47)nmol/mg分别降低至(192.87±18.32)、(182.68±17.25)、(160.53±12.21)nmol/mg,且与对照组相比高剂量组MDA含量显著下降(P<0.05)。由此可见,相对于低、中剂量组,高剂量高F值玉米肽降低实验大鼠骨骼肌中MDA产生的作用更显著。
Nrf2是重要的抗氧化基因转录因子,服用高F值玉米肽能够使核内Nrf2和胞浆内游离Keap1的表达水平提高(图5C),表明高F值玉米肽可能促进了Nrf2-Keap1二聚体的分解,加速Nrf2进入并定位于核内,最终促进下游抗氧化基因的表达。
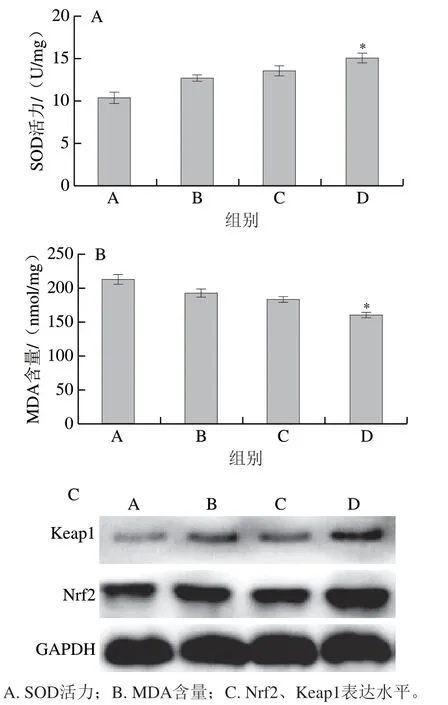
图5 高F值玉米肽对大鼠运动疲劳所致骨骼肌氧化损伤的影响Fig. 5 Effect of high F-value corn peptide on oxidative damage of skeletal muscle induced by exercise fatigue in rats
2.5 高F值玉米肽对大鼠骨骼肌中线粒体融合的影响
线粒体是合成ATP的重要场所,因此进一步考察长期服用高F值玉米肽对大鼠骨骼肌线粒体质量的影响。如图6所示,长期服用高F值玉米肽可以提高线粒体融合蛋白Mfn2的表达,降低裂解蛋白Drp1的表达,表明长期服用高F值玉米肽可能有利于促进线粒体融合,使处于非最佳状态的线粒体通过互相融合提高质量,从而最终提高合成ATP的能力。
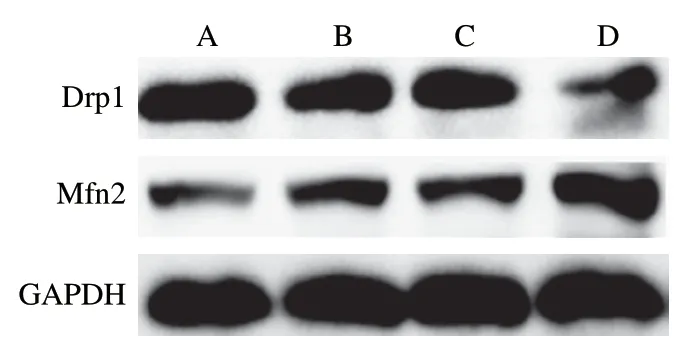
图6 高F值玉米肽对大鼠骨骼肌中线粒体融合的影响Fig. 6 Effect of high F-value corn peptide on mitochondrial fusion in rat skeletal muscle
3 讨 论
乳酸的积累是运动疲劳产生、运动能力下降的重要原因,也是评估运动疲劳水平的一项重要指标[11]。从本研究结果可以看出,与对照组相比,长期给予不同剂量高F值玉米肽能够显著降低力竭运动大鼠体内的血乳酸浓度,促进血乳酸代谢。同样地,昌友权[12]研究发现,玉米肽可以显著延长小鼠的游泳时间和爬杆时间,并证实服用玉米肽后小鼠血清尿素氮水平明显降低、肝糖原和肌糖原含量显著提高,提示玉米肽具有延缓运动疲劳的作用[12]。本研究结果提示高F值玉米肽能够通过降低机体血乳酸的产生对抗运动疲劳,提高运动能力。高F值玉米肽含有丰富的支链氨基酸,支链氨基酸可以直接改善骨骼肌线粒体功能,减轻疲劳[13],其在体内产生ATP的效率也高于其他氨基酸,并能减少运动过程中大脑5-羟色胺的积累,防止中枢神经疲劳[14]。在动物实验中,支链氨基酸可明显抑制大鼠急性运动后骨骼肌线粒体膜脂质过氧化物增加和膜流动性下降,保护线粒体膜脂质双层结构的稳定性和正常生物功能[15]。同时,补充支链氨基酸能降低线粒体内Ca2+、Mg+、K+的变化幅度,维持胞内钠浓度,改善骨骼肌线粒体功能,并调节血液中氨基酸平衡,降低蛋白质的分解,提高机体抗运动疲劳能力[16-17]。
本研究还发现,长期服用高F值玉米肽能够有效增加运动疲劳产生时骨骼肌组织中SOD活力,降低MDA含量,且存在剂量-效应关系。SOD是体内唯一以氧自由基为底物,能够清除机体自由基的重要抗过氧化酶,SOD活力是评价机体在运动过程中受氧自由基损伤程度的一项重要指标[18]。大量研究证实提高SOD活力增加氧自由基的清除在疲劳消除中发挥重要作用。李酉坤等[19]发现联合应用茶多酚、VE以及硒可以显著提高急性运动疲劳大鼠外周血中SOD活力,从而对抗疲劳产生。郝红梅等[20]也发现补中益气汤可以显著提高运动疲劳大鼠血清SOD活力,且呈剂量依赖性。MDA是脂质发生过氧化反应的终产物。氧自由基能与生物膜中的多不饱和脂肪酸发生脂质过氧化反应,进而造成细胞膜流动性降低,膜上的酶、受体及离子通道受损,三羧酸循环的电子传递遭到破坏等,最终导致运动疲劳的发生。已有研究证明,降低大强度运动后MDA的产生是对抗运动性疲劳的有效手段[21]。潘华山等[22]发现服用人参皂苷Rb1和Rg1能够显著降低运动疲劳模型小鼠MDA含量并发挥抗运动性疲劳效应。井宏颖等[23]也发现地黄饮子可以降低疲劳模型小鼠的MDA含量,保护线粒体结构,增强清除自由基和抑制氧化应激的能力,具有缓解运动疲劳的作用。
能量的直接供给来自ATP的水解,ATP水解酶能将ATP水解为二磷酸腺苷。ATP一旦被水解便立即由磷酸肌酸(phosphocreatine,PCr)和二磷酸腺苷重新合成,因此机体工作时产生的能量供应实际就是ATP的分解与合成[24]。ATP水解酶活力降低被认为是运动能力下降的重要原因,研究显示力竭运动小鼠肝脏组织中Na+-K+-ATPase、Ca2+-Mg2+-ATPase和总ATP酶活力均降低,这是因为ATP酶活力下降会导致神经元兴奋性异常,从而出现中枢疲劳。高压氧治疗后,ATP酶活力均升高,并且有效延长了小鼠的力竭运动游泳时间[25-27]。因此,提高ATP水解酶活力对缓解运动疲劳、提高运动能力具有积极作用。王蕾等[28]发现补中益气丸可显著提高疲劳模型小鼠脑组织中Na+-K+-ATPase和Ca2+-ATPase的活力,对运动疲劳造成的小鼠脑组织能量代谢紊乱具有保护作用。外源性PCr干预运动疲劳小鼠后,PCr提高了Ca2+-ATPase活力,保证ATP的供应,改善微循环,增加钙泵活力,从而发挥抗疲劳和提高运动能力作用[29]。李爽等[30]发现黄芪总苷能够有效提高运动性疲劳模型大鼠骨骼肌中ATP水解酶活力,进而提高运动能力。本研究也发现,长期服用高F值玉米肽可以有效增强运动疲劳大鼠股四头肌及腓肠肌线粒体中ATP水解酶活力,并且随剂量增加,ATP水解酶活力逐步提高。
Nrf2是细胞调节抗氧化应激的关键转录因子,受Keap1调控,通过与抗氧化反应元件(antioxidant response element,ARE)相互作用促进各抗氧化酶的表达。Nrf2高表达能够促进机体的抗氧化作用,降低机体的氧化应激反应[31]。Keap1是Nrf2的多区域抑制蛋白,是Nrf2的高度专一性受体。通常,Nrf2以非活性状态存在于胞浆中,与抑制蛋白Keap1高度结合并处于动态平衡,维持机体的氧化应激平衡[32]。当受到氧化应激或亲电子物质作用时,Keap1与Nrf2耦联作用减弱,Keap1被释放到胞浆,而游离的Nrf2进入细胞核,与核转录因子Maf结合后启动ARE,形成NRF2-Maf-ARE复合体,从而最终启动下游抗氧化基因的表达,增强机体的抗氧化应激能力[33]。当氧化应激产物减少时,胞浆内游离的Keap1又可以进入细胞核,重新与Nrf2结合形成非活性状态的Keap1-Nrf2二聚体形式。在本研究中,长期服用高F值玉米肽,特别是高剂量高F值玉米肽,能够明显上调细胞核内Nrf2表达量,同时胞浆内游离Keap1水平也增加;同样地,在服用高F值玉米肽后,运动疲劳模型大鼠骨骼肌中SOD活力明显增强,MDA含量减少。综上,认为当机体受到氧化应激信息刺激时,高F值玉米肽可以通过促进Keap1-Nrf2二聚体的解离,促进Nrf2入核结合ARE,从而在核内激活下游抗氧化基因的表达,最终发挥抗氧化功能。
线粒体是细胞内的重要细胞器,也是细胞产生ATP的场所,因此线粒体的数目与质量对于ATP的产生发挥重要作用。Mfn1/2是参与线粒体融合的线粒体外膜蛋白[34]。内质网-线粒体之间的联系对于线粒体的融合很关键,而Mfn2在内质网和线粒体交界处富集,对内质网与线粒体结合形成线粒体相关内质网膜具有重要影响[35]。Drp1是哺乳动物中线粒体分裂的必需蛋白,主要存在于胞浆,当线粒体分裂时才移位到线粒体表面。Drp1移位到线粒体外膜,并且集聚于线粒体潜在的分裂位点,通过水解三磷酸鸟苷(guanosine triphosphate,GTP)并逐渐压缩线粒体直至断裂,完成线粒体分裂。Drp1还可以调节线粒体微管的分布过程,从而维持线粒体的形态。Drp1主要通过3 种形式发挥其功能:其一,与GTP结合并将其分解为二磷酸鸟苷和磷酸,参与线粒体剪切;其二,发挥水解酶的功能,可能水解线粒体外膜脂质层;其三,与核酸特异性结合,调节核基因的功能[36]。本研究结果表明,长期服用高F值玉米肽可以上调骨骼肌组织中Mfn2表达,相反降低线粒体裂解蛋白Drp1的表达[37]。因此认为,高F值玉米肽可以促进线粒体的融合,抑制其分裂,从而有利于线粒体保持良好状态。
综上所述,高F值玉米肽能够加速实验大鼠血乳酸的清除,延长力竭运动时间,提高运动能力。其机制可能在于:一方面,高F值玉米肽通过激活Nrf2/Keap1信号通路,增强抗氧化基因表达,从而减少骨骼肌中MDA的产生,增强SOD活力,降低氧自由基积累对线粒体的破坏;另一方面,高F值玉米肽可以通过促进线粒体融合并抑制其裂解,维持线粒体功能稳定;此外还发现,高F值玉米肽可以增强ATP水解酶活力加速ATP分解,同时增强ATP合成酶活力促进ATP产生。
