人源乳杆菌联合菊粉对2型糖尿病小鼠的改善作用
2022-11-30牛晓辉李雨欣李祖明高丽萍武志超
牛晓辉,佟 童,李雨欣,张 弓,刘 佳,李祖明,*,高丽萍,刘 秀,夏 然,武志超
(1.北京联合大学生物化学工程学院,北京 100023;2.中加健康工程研究院(合肥)有限公司,安徽 合肥 230088;3.国贸食品科技(北京)有限公司,北京 102209;4.中国食品发酵工业研究院有限公司,北京 100015)
糖尿病是一种代谢疾病,分为1型糖尿病和2型糖尿病(type 2 diabetes mellitus,T2DM)。随着其发病率的增加和患者数量的不断上升,已经成为世界范围内的主要公共问题之一[1]。据统计,在2017年全球糖尿病患者数量约4.25亿,到2045年患者数量将上升到7亿[2-3]。我国糖尿病患者数量约有1亿,其中青年患者约占11.6%,而在所有糖尿病患者中T2DM患者约占90%[4]。T2DM是一种以高血糖、高血脂为特征的代谢疾病,主要由胰岛素抵抗或胰岛素分泌不足引起[5]。T2DM的治疗主要是通过控制饮食、适度运动、给予降血糖和降脂药物,但大多数药物会产生一些不良的副作用[6-7],因此开发无副作用的辅助降血糖保健食品十分必要。
益生菌对维持胃肠道平衡和能量平衡非常重要,并已被证明能够在预防和治疗代谢综合征,如肥胖、炎症、血脂异常和高血糖方面发挥积极作用[7-8]。高脂饮食和低剂量链脲佐菌素诱导的T2DM模型鼠摄入副干酪乳杆菌NL41后,血糖和胰高血糖素水平显著下降,胰岛、肝脏和肾脏的损伤明显改善,说明副干酪乳杆菌NL41能够预防由高脂饮食和低剂量链脲佐菌素诱导的T2DM[9]。发酵乳杆菌MCC2759、MCC2760通过改善葡萄糖和脂质状况,减少肝脏中的促炎症细胞因子水平,并改善肠道屏障功能和肌肉组织,在T2DM模型中显示出有益作用[10]。植物乳杆菌LRCC5314干预糖尿病模型小鼠后,葡萄糖转运相关基因Glut4和adiponectin的表达量升高,肿瘤坏死因子(tumor necrosis factor,TNF)-α和白细胞介素(interleukin,IL)-6的表达量降低[11]。植物乳杆菌C88可有效改善T2DM大鼠血糖和血脂代谢紊乱,显著降低血清中TNF-α、IL-6等炎症相关因子水平[12]。但是不同来源益生菌的作用及其功效并不完全相同,Vemuri等[13]研究发现相比于植物来源的植物乳杆菌UALp-05和乳制品来源的嗜热链球菌UASt-09,只有人源嗜酸乳杆菌DDS-1和动物双歧杆菌乳酸亚种(Bifidobacterium animalisssp.lactis)UABla-12能够诱导由脂多糖处理后的人结肠癌细胞分泌IL-10。
低聚果糖也称为果寡糖和双歧因子,是人体不能吸收的肠道益生菌增殖物。具有降低血清胆固醇含量、降低血糖浓度、分解致癌物的作用[14]。菊粉水解后能够产生低聚果糖[15]。据报道,菊粉可通过抑制炎症和调节肠道微生物群来改善超重和肥胖成人的胰岛素敏感性,从而延缓T2DM的发展[16-17]。
本研究选取4 株人源乳杆菌(2 株植物乳杆菌和2 株发酵乳杆菌)分别冻干后混合制成菌剂,考察其联合菊粉对T2DM模型小鼠血糖、血脂、结肠中炎症因子、肝脏中磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)和丝氨酸/苏氨酸激酶(serine/threonine kinase,AKT)相对表达水平以及肝脏、肾脏、胰岛组织形态等的影响,探究人源乳杆菌联合菊粉对T2DM小鼠的改善效果和机制。
1 材料与方法
1.1 菌株、动物、材料与试剂
植物乳杆菌ZLT22(CGMCC No. 18208)、植物乳杆菌ZLT25(CGMCC No. 18209)、发酵乳杆菌ZLT11(CGMCC No. 18206)、发酵乳杆菌ZLT305(CGMCC No. 18207)为本课题组前期从健康成人粪便中分离得到,现均保藏于中国微生物菌种保藏管理委员会普通微生物中心。
SPF级以C57BLKS/JNju为背景培育的6 周龄T2DM模型db/db小鼠和同窝wt/wt小鼠购自江苏集萃药康生物科技股份有限公司,实验动物生产许可证号:SCXK(苏)2020-0004,实验动物使用许可证号:SYXK(京)2017-0038。
动物饲料 江苏美迪森生物医药有限公司;菊粉柳州宏旭生物科技有限公司;MRS(De Man, Rogosa,Sharpe)肉汤、MRS琼脂培养基 北京陆桥技术股份有限公司;柠檬酸(pH 6.0)抗原修复液、RNA提取液、乙二胺四乙酸脱钙液、4%多聚甲醛、Servicebio®RT First Strand cDNA合成试剂盒、2×SYBR Green qPCR Master Mix(High ROX)、引物、抗体、磷酸化蛋白酶抑制剂、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量检测试剂盒、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶制备试剂盒、β-actin、HyPure TMMolecular Biology Grade Water、化学发光(enhanced chemiluminescence,ECL)检测试剂盒武汉塞维尔生物科技有限公司;HY60046糖化血清蛋白(glycosylated serum protein,GSP)试剂盒、HY-10069胰岛素放免试剂盒、葡萄糖试剂盒 北京华英生物科技有限公司。
1.2 仪器与设备
5840R型低温高速离心机 德国Eppendorf公司;AccU-Chekhov Active血糖仪 德国罗氏诊断公司;Selectra-E-Plus型全自动生化仪 深圳迈瑞生物医疗电子股份有限公司;酶标仪 瑞士Rayto公司;超微量分光光度计 德国Thermo公司;脱水机 意大利DIAPATH公司;包埋机 武汉俊杰电子有限公司;病理切片机上海徕卡仪器有限公司;LightCycler480型荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪瑞士Rotkreuz公司。
1.3 方法
1.3.1 动物分组及干预
12 只wt/wt小鼠和36 只db/db小鼠在北京联合大学应用文理学院保健食品功能检测中心SPF动物室饲养,环境温度20~22 ℃、相对湿度40%~60%,明暗交替12 h,适应性饲养1 周后分组,每组12 只。12 只wt/wt小鼠作为正常对照组(NC组),db/db小鼠随机分为模型组(MC组),人源乳杆菌灌胃组(L组)和人源乳杆菌灌胃联合菊粉饲养组(LI组),每组12 只。NC组、MC组和L组饲喂基础饲料(酪蛋白(80 目、20%(质量分数,下同))、玉米淀粉(39.75%)、麦芽糊精(葡萄糖当量值为10%)(13.20%)、蔗糖(10.00%)、纤维素(5.00%)、大豆油(7.00%)、复合矿物质(3.50%)、复合维生素(1.00%)),LI组饲喂含5%菊粉的基础饲料(委托江苏美迪森生物医药有限公司加工)。取等质量植物乳杆菌ZLT22、植物乳杆菌ZLT25、发酵乳杆菌ZLT11、发酵乳杆菌ZLT305冻干菌粉溶于去离子水,调整各菌液的活菌数约为1.0×109CFU/mL,得到人源乳杆菌菌剂。L组和LI组小鼠灌胃10 mL/(kgmb·d)人源乳杆菌菌剂。NC组、MC组灌胃10 mL/(kgmb·d)无菌生理盐水,连续灌胃12 周,小鼠自由取食和饮水。干预12 周后断食不断水12 h,眼眶取血后颈椎脱臼处死小鼠,解剖收集脏器。
1.3.2 小鼠体质量、摄食量与空腹血糖浓度测定
干预期间每周记录小鼠体质量,每周称量小鼠饲料质量以计算每只小鼠每周的摄食量。每周在小鼠禁食6 h后尾尖采血,采用快速血糖仪测定小鼠空腹血糖浓度。
1.3.3 口服葡萄糖耐量实验
在干预第10周末,小鼠禁食12 h后按照1 g/kgmb灌胃40%(质量分数)葡萄糖溶液。在灌胃后0、30、60、90、120 min依次进行尾尖采血,并用罗氏快速血糖仪测定血糖浓度。绘制时间-血糖浓度曲线,并按照式(1)计算曲线下面积(area under curve,AUC)以表示葡萄糖耐量。
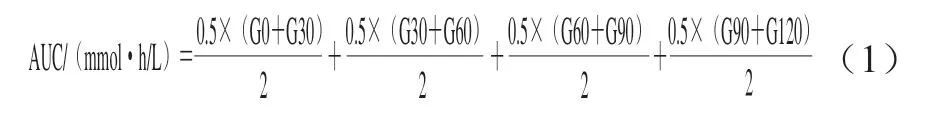
式中:G0/30/60/90/120分别表示灌胃后0、30、60、90、120 min时小鼠血糖浓度/(mmol/L);0.5表示测定时间间隔0.5 h。
1.3.4 胰岛素耐受实验
胰岛素耐受实验在小鼠干预第11周末进行。小鼠禁食6 h后,腹腔注射0.75 U/kgmb胰岛素。在注射后0、30、60、90、120 min依次进行尾尖采血,并用罗氏快速血糖仪测定血糖浓度。绘制时间-血糖浓度曲线,计算AUC以表征胰岛素抵抗程度。
1.3.5 血清生化指标测定
小鼠干预12 周后,取小鼠血液离心(4 ℃、4 000 r/min、10 min)后收集上清液。采用全自动生化仪测定血清中甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和总胆固醇(total cholesterol,TC)浓度。分别参考糖化血GSP试剂盒、葡萄糖试剂盒、胰岛素放免试剂盒测定说明书测定血清中GSP、血糖和胰岛素浓度,并按式(2)计算胰岛素抵抗指数(homeostasis model assessment-insulin resistance,HOMA-IR)。
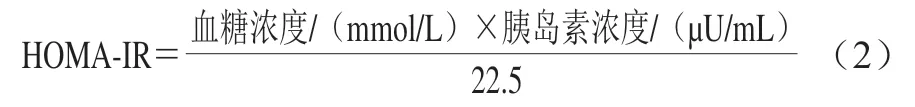
1.3.6 组织病理学观察
将小鼠的肝脏、肾脏和胰腺固定在4%(质量分数)多聚甲醛磷酸盐缓冲液中24 h,然后进行脱水、包埋、切片,最后用苏木精-伊红(hematoxylin-eosin,HE)染色,在显微镜下观察,放大倍数400 倍。
1.3.7 实时荧光定量PCR测定结肠组织炎症因子水平
在匀浆管中加入1 mL RNA提取液,冰上预冷。然后加入100 mg结肠组织研磨至无可见块状组织。离心(4 ℃、12 000 r/min、10 min)取上清液,获得总RNA。采用Servicebio®RT First Strand cDNA合成试剂盒进行逆转录:42 ℃保温60 min,然后70 ℃保温5 min。采用2×SYBR Green qPCR Master Mix(High ROX)试剂盒进行实时荧光定量PCR,扩增程序为预变性(95 ℃、10 min)、变性(95 ℃、15 s)、退火/延伸(60 ℃、60 s),40 个循环,溶解曲线60~95 ℃,每15 s温度提升0.3 ℃。以GAPDH作为内参,采用2-ΔΔCt法计算相对倍数变化。实时荧光定量引物序列如表1所示。
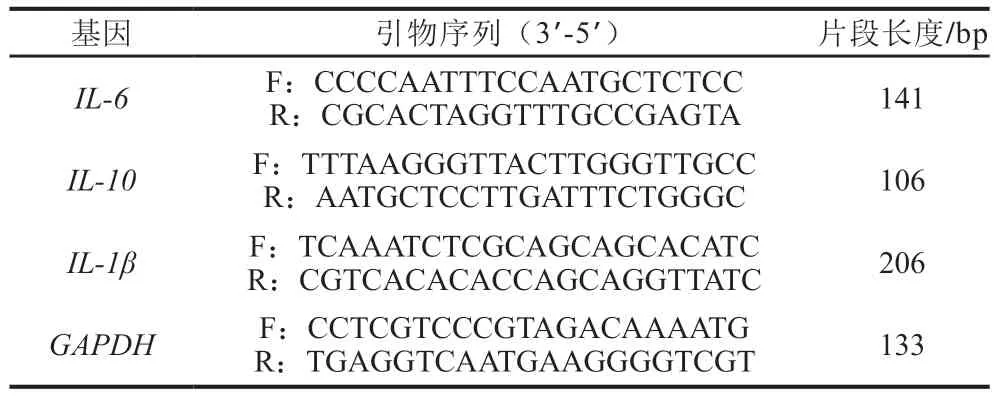
表1 用于实时荧光定量PCR的特定基因引物Table 1 Specific primers used for real-time quantitative PCR
1.3.8 Western blot分析肝脏中PI3K和AKT相对表达水平
取肝脏组织用PBS冲洗,然后加入RAPI裂解液提取蛋白质。参照BCA蛋白质量浓度测定试剂盒测定蛋白质量浓度。采用SDS-PAGE分离蛋白质,然后将其转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。用5%(质量分数)的脱脂牛奶在脱色摇床上室温封闭1 h。在4 ℃下将PVDF膜与一抗(稀释度1∶1 000)孵育12 h,随后将PVDF膜与二抗(稀释度1∶3 000)室温孵育30 min。采用ECL检测试剂盒显影,以β-actin作为内参,采用Image J软件测定目标蛋白条带灰度。
1.4 数据处理与分析
实验数据采用SPSS 19.0软件进行处理分析,结果以平均值±标准差表示。采用SPSS软件进行单因素方差分析,采用t检验进行显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著性。采用GraphPad Prism 8软件作图。
2 结果与分析
2.1 乳杆菌联合菊粉对小鼠体质量和摄食量的影响
干预期间小鼠体质量变化如图1A所示,糖尿病小鼠体质量明显高于正常小鼠。在干预开始时MC组和LI组小鼠体质量无明显差异。随着干预时间延长,MC组小鼠体质量不断增加,而LI组小鼠体质量变化不明显。实验结束时,L组和LI组小鼠体质量均低于MC组但无明显差异。结果表明乳杆菌联合菊粉可以抑制T2DM小鼠体质量增加,但效果不明显。
如图1B所示,干预期间MC组小鼠摄食量相比于NC组显著增加(P<0.05)。干预3 周后,与MC组相比,L组小鼠摄食量显著下降(P<0.05)。干预期间LI组小鼠摄食量显著低于MC组小鼠,说明食用添加5%菊粉的饲料和乳杆菌干预均可显著抑制糖尿病小鼠摄食量的增加(P<0.05),其中乳杆菌联合菊粉干预的抑制效果更明显。
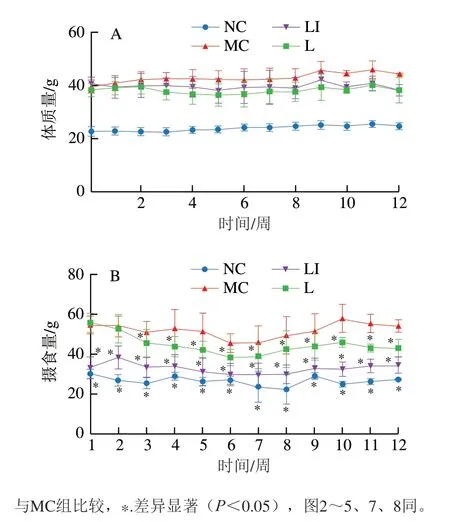
图1 小鼠体质量(A)和摄食量(B)变化Fig. 1 Changes in body mass (A) and food intake (B) in mice
2.2 乳杆菌联合菊粉对小鼠空腹血糖浓度的影响
各组小鼠干预期间空腹血糖浓度变化如图2A所示,MC组小鼠空腹血糖浓度显著高于正常小鼠(P<0.05)。MC组小鼠的空腹血糖浓度在干预前期呈增长趋势,干预5 周后一直保持较高水平。与MC组相比,L组和LI组小鼠的空腹血糖浓度也在干预前期呈总体增长趋势,但并未达到MC组的水平。且经过12 周干预后,L组和LI组小鼠空腹血糖浓度显著低于MC组(P<0.05)。各组小鼠GSP浓度变化如图2B所示,MC组小鼠GSP浓度极显著高于NC组(P<0.01);干预12 周后,L组和LI组小鼠GSP浓度显著低于MC组(P<0.05)。
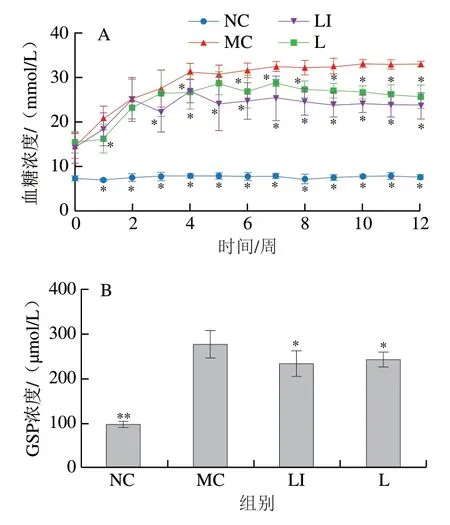
图2 小鼠空腹血糖浓度(A)和GSP浓度(B)的变化Fig. 2 Changes in fasting blood glucose (A) and GSP (B) levels in mice
2.3 乳杆菌联合菊粉对小鼠葡萄糖耐量的影响
如图3A所示,在灌胃葡萄糖后30 min,各组小鼠血糖浓度均达到最大值,然后逐渐下降。在120 min时,NC组小鼠血糖浓度与0 min时无明显差异;L组和LI组小鼠在120 min时的血糖浓度高于0 min,但低于MC组。如图3B所示,MC组AUC分别显著和极显著大于L组和LI组(P<0.05、P<0.01)。AUC越大表示糖耐受能力越弱。可见,MC组小鼠糖耐受能力极显著弱于NC组(P<0.01),LI组小鼠糖耐受能力极显著强于MC组(P<0.01);且LI组糖耐受能力强于L组,但无明显差异。
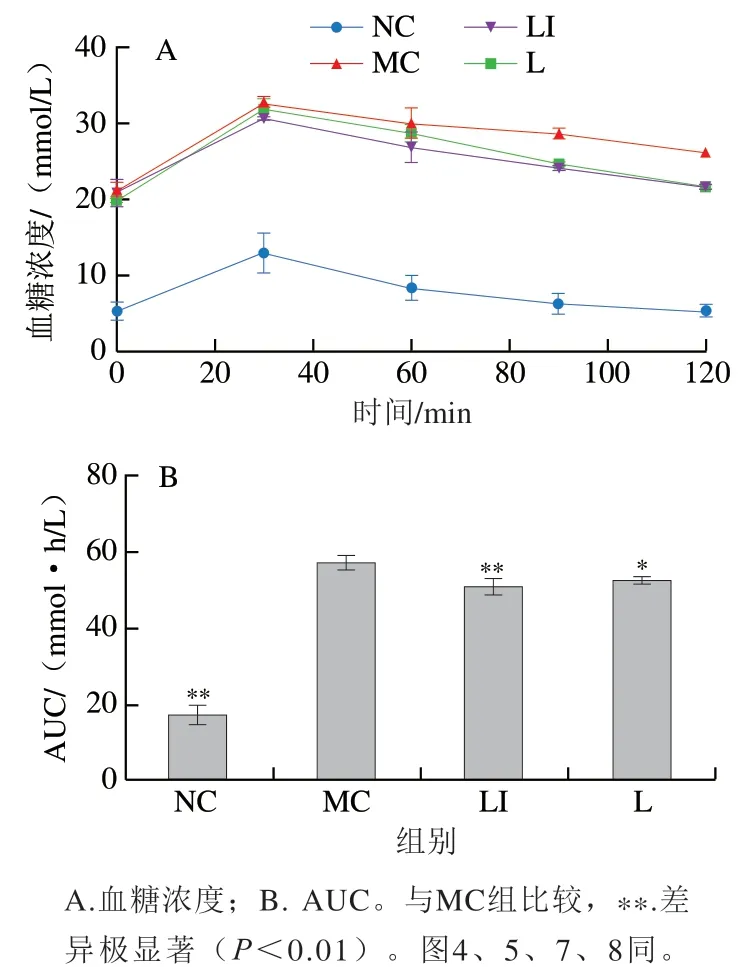
图3 小鼠葡萄糖耐量变化Fig. 3 Changes in glucose tolerance in mice
2.4 乳杆菌联合菊粉对小鼠胰岛素抵抗的影响
如图4A所示,NC组小鼠在注射胰岛素30 min后血糖浓度达到最小值,在120 min时略低于初始血糖浓度。MC组小鼠在注射胰岛素60 min后血糖浓度达到最小值,120 min时低于初始血糖浓度。L组和LI组小鼠血糖浓度在注射胰岛素30 min后达到最小值,随后逐渐上升,120 min时血糖浓度均低于MC组。如图4B所示,MC组AUC极显著大于L组和LI组(P<0.01),且LI组AUC极显著小于L组(P<0.01)。AUC越大表示胰岛素抵抗程度越强,因此MC组小鼠胰岛素抵抗程度极显著高于NC组,而LI组极显著低于MC组和L组(P<0.01)。各组小鼠干预后HOMA-IR的变化情况如图4C所示,与NC组相比,MC组、L组和LI组小鼠HOMA-IR明显升高;干预12 周后,与MC组相比,L组和LI组小鼠HOMA-IR显著降低(P<0.05、P<0.01)。与L组相比,LI组小鼠HOMA-IR显著降低(P<0.05),与胰岛素抵抗实验结果相印证。
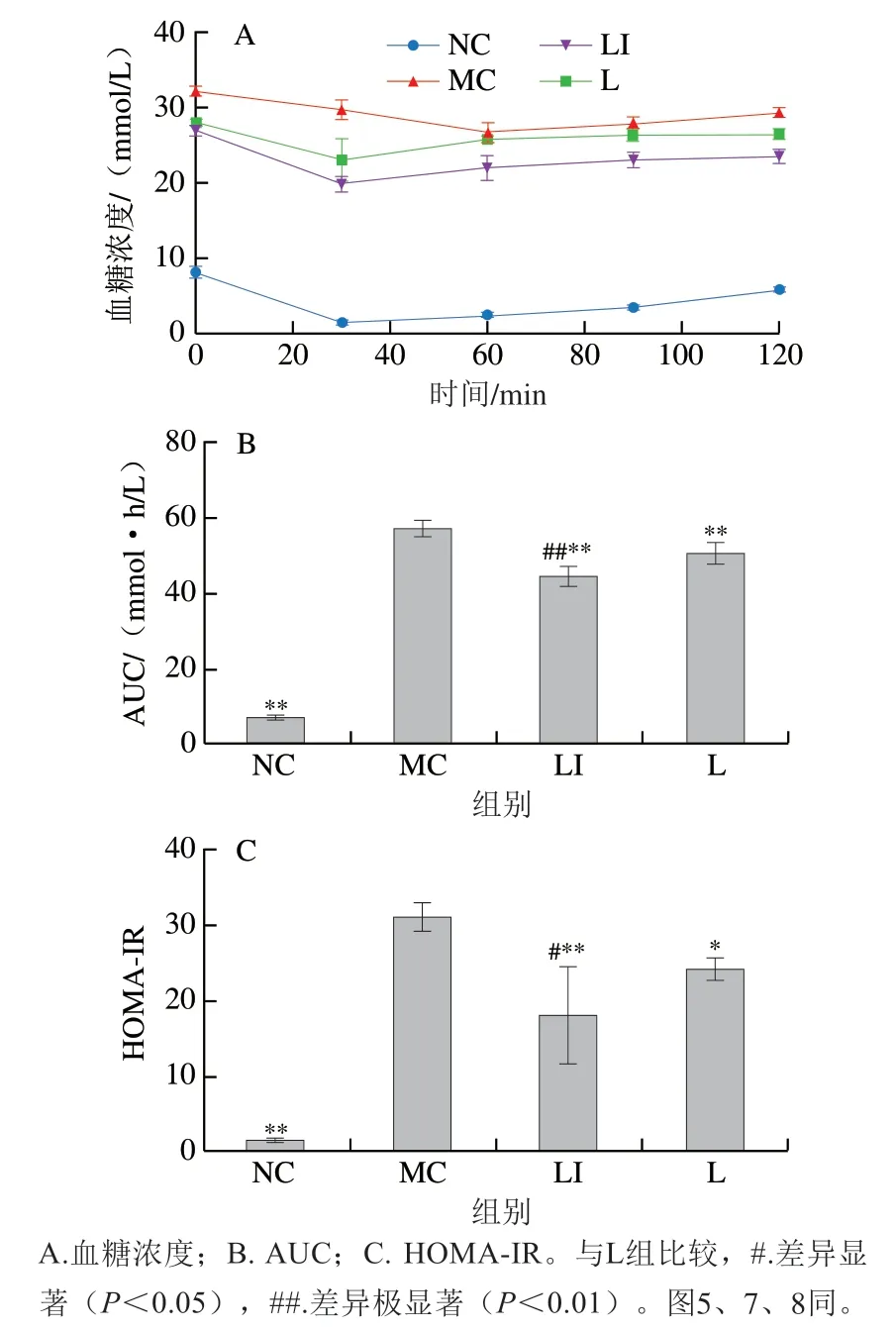
图4 胰岛素抵抗的变化Fig. 4 Changes in insulin resistance
2.5 乳杆菌联合菊粉对小鼠血清中血脂指标的影响
干预12 周后小鼠血清中血脂指标如图5所示。与NC组相比,MC组小鼠LDL-C、TG和TC浓度均明显升高;与MC组相比,L组和LI组小鼠这3 项指标显著或极显著下降(P<0.05、P<0.01)。与NC组相比,MC组小鼠HDL-C浓度极显著降低(P<0.01);与MC组相比,LI组小鼠HDL-C浓度极显著升高(P<0.01)。与L组相比,LI组小鼠LDL-C、TG浓度显著或极显著下降(P<0.05、P<0.01)。
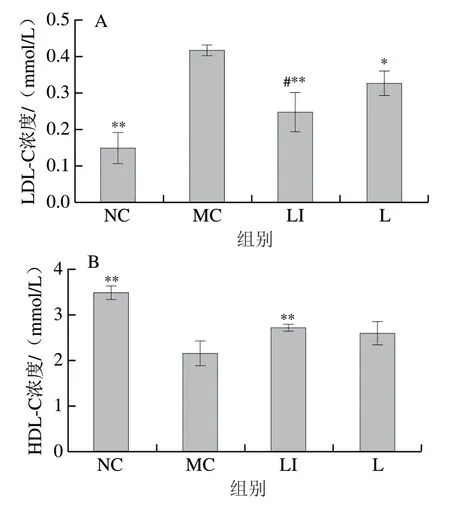
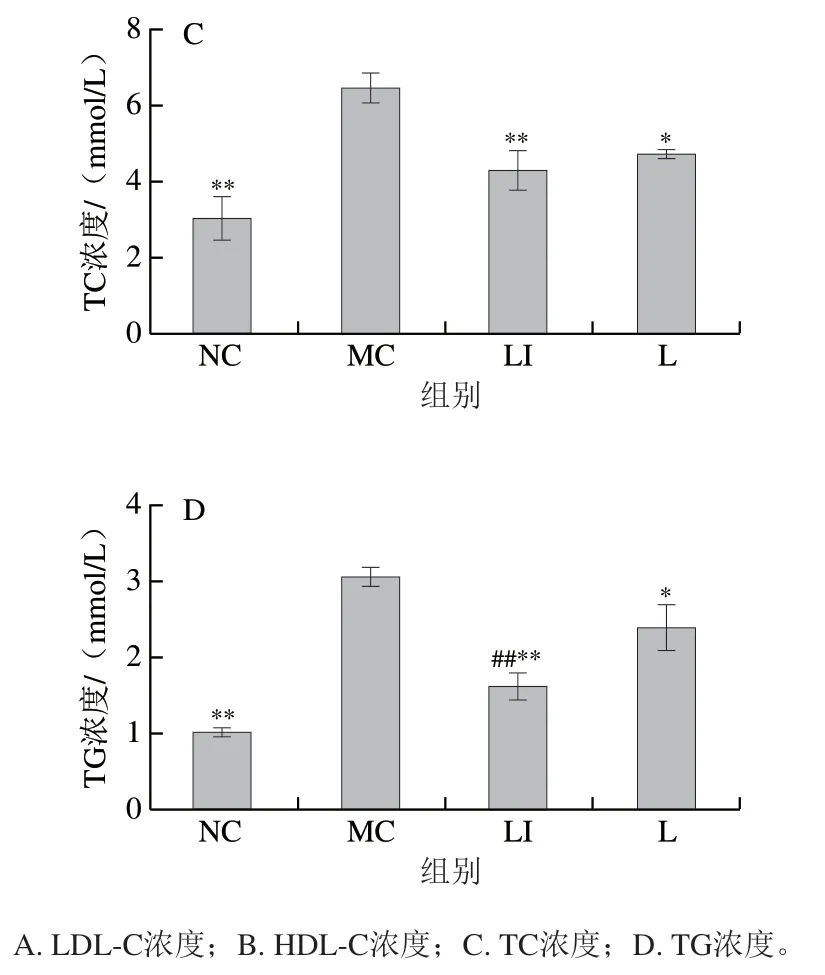
图5 血清中血脂指标的变化Fig. 5 Changes in serum lipid indexes
2.6 乳杆菌联合菊粉对小鼠肝脏、肾脏和胰腺组织的影响
干预12 周后小鼠脏器HE染色结果如图6所示,NC组小鼠肝脏、肾脏和胰腺组织结构清晰且完整。MC组小鼠肝脏细胞形态无规则、排列紊乱、产生许多空泡(如箭头处所示,其他脏器同);肾小球萎缩、肾小管排列松散、空泡数量增多;胰腺组织松散、组织细胞肿大、胰岛细胞萎缩不规则,由圆形变为扁平状,数量减少。与MC组相比,L组和LI组小鼠肝脏中不规则细胞和空泡数量减少;肾小球较饱满、空泡数量减少、肾小管排列紧密;虽然胰岛中还有一些不正常细胞,但是正常细胞数量有所增加。与L组相比,LI组小鼠肝脏中的空泡数量减少;肾小管排列更为紧密。
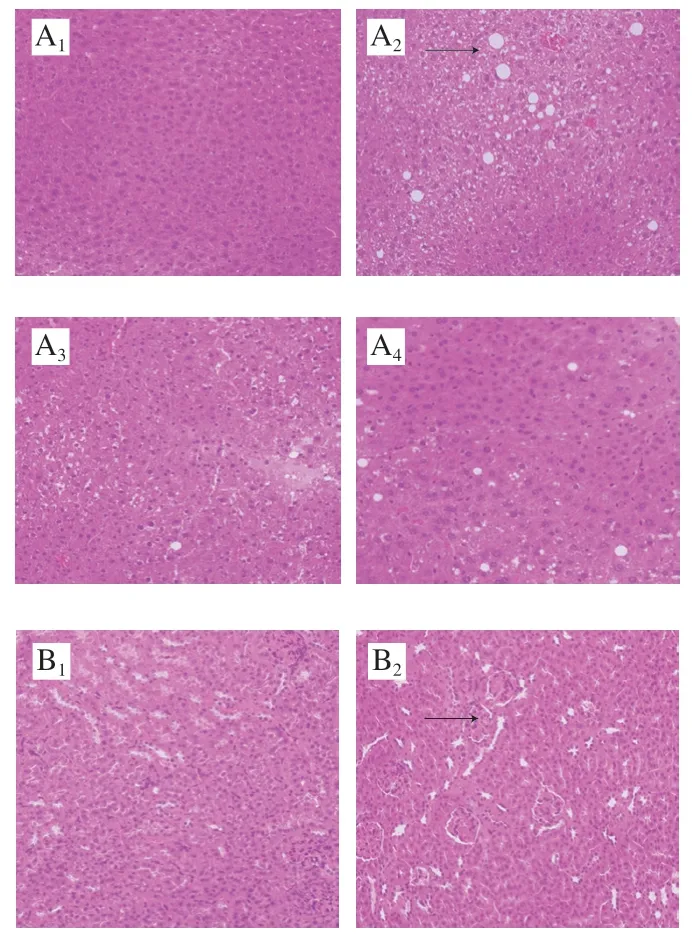
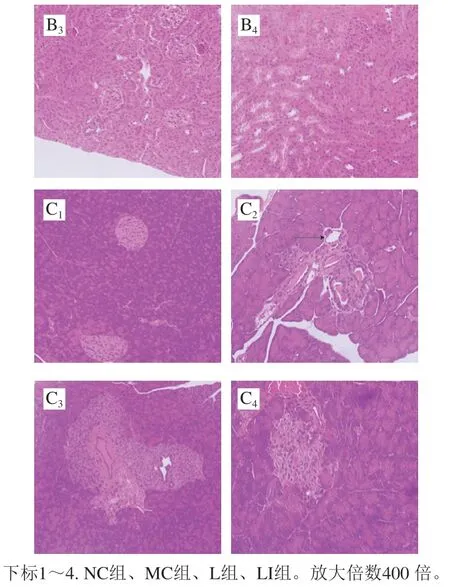
图6 小鼠肝脏(A)、肾脏(B)和胰腺(C)组织形态的变化Fig. 6 Histopathological changes in the liver (A), kidney (B) and pancreas (C) tissues of mice
2.7 乳杆菌联合菊粉对小鼠结肠中炎症因子mRNA相对表达水平的影响
如图7所示,与NC组相比,MC组小鼠IL-6、IL-1β的mRNA相对表达水平极显著增加(P<0.01),IL-10mRNA相对表达水平极显著降低(P<0.01);与MC组相比,L组IL-1β的mRNA相对表达水平极显著降低(P<0.01),IL-10相对表达水平极显著升高(P<0.05);与MC组相比,LI组小鼠IL-6和IL-1β的mRNA相对表达水平极显著降低(P<0.01),IL-10mRNA相对表达水平极显著升高(P<0.01)。与L组相比,LI组IL-1βmRNA相对表达水平显著下降(P<0.05),IL-10mRNA相对表达水平极显著上升(P<0.01)。
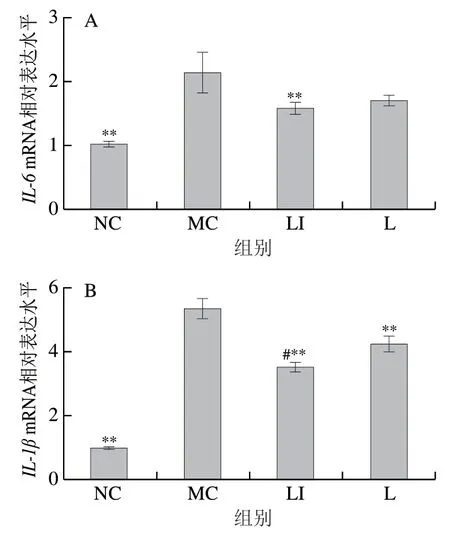
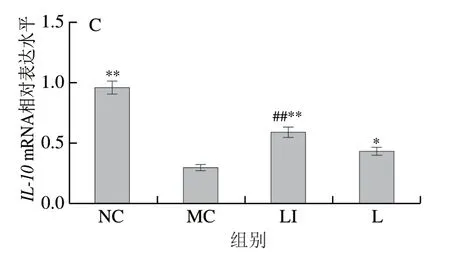
图7 结肠中炎症因子IL-6(A)、IL-1β(B)、IL-10(C)mRNA相对表达水平变化Fig. 7 Changes in mRNA relative expression levels of inflammatory factors IL-6 (A), IL-1β (B) and IL-10 (C) in colon
2.8 乳杆菌联合菊粉对小鼠PI3K和AKT相对表达水平的影响
肝脏中PI3K和AKT相对表达水平如图8所示。与NC组相比,MC组小鼠PI3K和AKT相对表达水平极显著降低(P<0.01);与MC组相比,L组AKT相对表达水平显著增加(P<0.05),LI组小鼠PI3K和AKT相对表达水平均显著增加(P<0.05)。与L组相比,LI组中PI3K相对表达水平显著增加(P<0.05)。
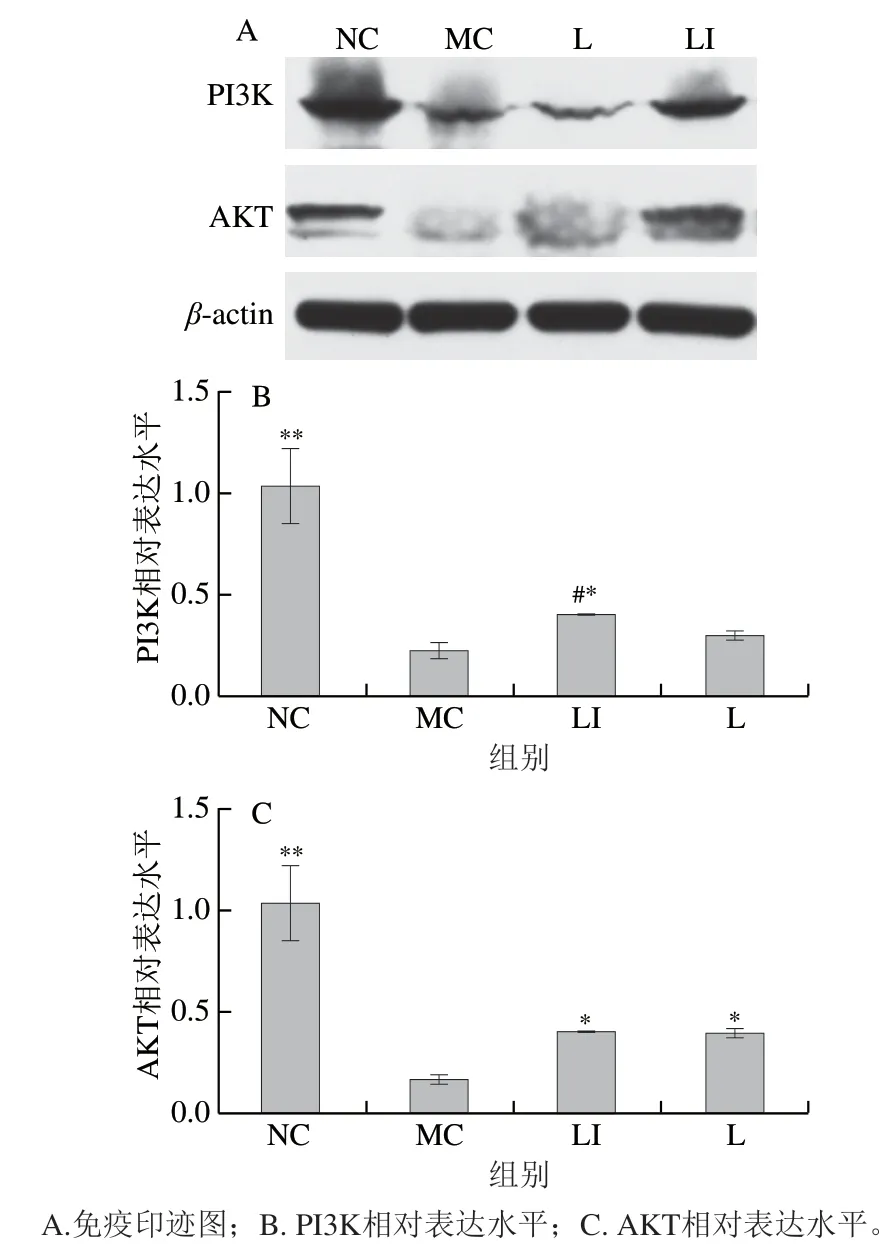
图8 PI3K、AKT相对表达水平Fig. 8 Relative expression levels of PI3K and AKT proteins
3 讨 论
T2DM的主要特征是胰岛β细胞受损,从而导致患者出现肥胖、高血糖、高脂血症等症状[18-19]。目前T2DM患者主要采用注射胰岛素的方法,但长期注射胰岛素可能会造成低血糖等并发症[20],因此开发无副作用的辅助降血糖保健食品具有重要意义。
糖尿病常见的症状有高血糖浓度,高血糖浓度可使患者出现昏迷、休克、意识丧失等病症,严重时甚至导致死亡[21-22]。可见控制血糖浓度在预防和治疗T2DM中尤为重要。本研究中,MC组小鼠血糖浓度最高可达到(33.11±0.89)mmol/L,且血糖浓度在实验过程中长期高于30 mmol/L,明显高于NC组小鼠血糖浓度(6.74~7.87 mmol/L);而人源乳杆菌联合菊粉干预12 周后,小鼠血糖浓度显著降低(P<0.05),说明人源乳杆菌联合菊粉干预具有降血糖作用。糖尿病的确诊可以口服葡萄糖耐量试验结果为依据[23-24]。胰岛素抵抗是指胰岛素靶细胞对胰岛素敏感性的降低,导致葡萄糖被组织吸收减少从而引起血糖升高[25],因此预防和治疗T2DM不但要降低血糖浓度,而且要改善胰岛素抵抗。在本研究中,口服葡萄糖耐量试验、胰岛素耐受试验和HOMA-IR的实验结果表明人源乳杆菌联合菊粉可以有效改善T2DM小鼠的葡萄糖耐量和胰岛素抵抗,极显著降低HOMA-IR(P<0.01);同时,人源乳杆菌联合菊粉对T2DM小鼠的GSP浓度也有显著改善效果(P<0.05)。Lee等[26]研究发现植物乳杆菌HAC01显著降低血糖和GSP水平,改善葡萄糖耐量和HOMA-IR,从而减缓糖尿病的发展,本研究结果与其相似。先前研究中鼠李糖乳杆菌GG不能降低HOMA-IR[27],本实验结果与其不同。
T2DM患者大多会伴随着血脂指标失衡的病状[28]。血脂异常一般表现为TC、TG、低密度脂蛋白和高密度脂蛋白水平异常[29]。糖脂代谢之间关系密切,控制血糖和控制血脂同等重要。本研究中MC组小鼠的TC、TG、LDL-C浓度与NC组相比均极显著增加(P<0.01),经过人源乳杆菌联合菊粉干预后这些指标均极显著降低(P<0.01);MC组小鼠的HDL-C浓度与NC相比极显著降低(P<0.01),而与MC组相比,人源乳杆菌联合菊粉干预极显著增加了小鼠血清HDL-C浓度(P<0.05)。研究发现,糖尿病大鼠灌胃植物乳杆菌A7(KC 355240)发酵的益生菌豆奶和草本精油的混合物后,TC和LDL-C水平均显著降低,HDL-C水平显著升高[30],本研究结果与之相似。以上结果表明人源乳杆菌联合菊粉干预对T2DM小鼠的血脂指标具有明显的改善效果。
糖代谢紊乱引起的高血糖可导致肝脏、肾脏和胰岛结构损伤[31-33]。肝脏在维持葡萄糖稳态方面起着重要的作用[34]。胰岛可以分泌对调整血糖非常重要的胰高血糖素和胰岛素。糖尿病常伴随着肾脏的损伤[35]。本研究中HE染色结果表明模型组小鼠肝脏、肾脏细胞出现萎缩;胰岛细胞数量大量减少,进而导致各种激素分泌不足,对糖代谢失去调控作用。而人源乳杆菌联合菊粉明显抑制了肝脏、肾脏和胰腺组织中细胞的损伤。Zeng Zhu等[9]研究发现副干酪乳杆菌NL41可以同时减轻肝脏、肾脏和胰腺细胞损伤,本实验结果与之相似。
炎症在糖尿病等代谢疾病中起到至关重要的作用[36]。肠道持续慢性炎症会引起胰岛素抵抗,进而诱发糖尿病[37]。本研究发现,与NC组相比,MC组小鼠促炎因子IL-6、IL-1β的mRNA表达水平极显著增加(P<0.01),而抑炎因子IL-10mRNA表达水平极显著降低(P<0.01);与MC组相比,人源乳杆菌联合菊粉干预极显著抑制IL-6、IL-1βmRNA表达(P<0.01),极显著促进IL-10mRNA表达(P<0.01)。Liu等[38]研究表明植物乳杆菌可以显著降低IL-6、IL-1β的mRNA水平从而缓解糖尿病,本研究结果与之相似。以上结果表明,人源乳杆菌联合菊粉干预通过抑制小鼠肠道炎症反应来缓解糖尿病症状。
PI3K/AKT是调节胰岛素的重要通路,其参与包括糖代谢在内许多重要的生命活动,是胰岛素调节血糖的关键通路之一,该通路的紊乱是糖尿病发生的重要原因[39]。本研究采用Western blot分析小鼠肝脏中PI3K和AKT的表达水平,结果表明,与MC组相比,人源乳杆菌联合菊粉干预能够显著上调PI3K和AKT相对表达水平(P<0.05)。相似地,Parichart等[40]研究表明副干酪乳杆菌HII01通过改善PI3K/AKT信号通路,提高糖尿病模型鼠的骨骼肌葡萄糖摄取率,从而降低血液中葡萄糖含量。以上结果表明,人源乳杆菌联合菊粉干预通过改善PI3K/AKT信号通路来缓解T2DM症状。
综上所述,人源乳杆菌联合菊粉干预通过改善葡萄糖耐受、恢复胰岛素敏感性、减轻组织损伤、改善血清炎症因子和血脂水平、调节PI3K/AKT信号通路表达等改善了T2DM模型鼠的高血糖浓度等症状。本研究可为人源乳杆菌联合菊粉作为辅助降血糖保健食品提供理论依据。
