铁皮石斛叶多糖对秀丽隐杆线虫体内抗衰老作用
2022-11-30黄少杰陈宏著钟淳菲朱思阳
黄少杰,陈宏著,钟淳菲,朱思阳,黎 攀,杜 冰,*
(1.华南农业大学食品学院,广东 广州 510642;2.花安堂生物科技集团有限公司,广东 广州 511434)
衰老是人体正常、不可逆的生理现象,伴随机体衰老,各种功能普遍衰退,抵抗外界环境伤害和恢复体内平衡能力减弱,从而导致疾病和死亡率的增高[1]。现代医学表明,随着年龄的增长,人体的代谢速度会变缓慢,体内会产生过量的活性氧(reactive oxygen species,ROS)[2]。而当机体内的ROS过量时,则会诱导机体发生氧化应激,从而对细胞结构和生物分子功能造成重大损伤,继而直接或间接导致多种疾病的产生[3]。因此,天然抗氧化产物的研发是目前抗氧化衰老研究的热点之一,已有大量文献报道植物多糖具有一定的抗氧化性[4],邱现创[5]的研究表明铁皮石斛多糖具有抗氧化活性,是一种天然的优质抗氧化剂;刘冰冰[6]以铁皮石斛为原材料提取得到铁皮石斛多糖,并以秀丽隐杆线虫(以下简称线虫)为模式生物,探讨了铁皮石斛多糖延长线虫寿命可能的作用机制,结果表明一定剂量的铁皮石斛多糖可以延长线虫寿命,其作用机制可能是通过胰岛素信号通路调控下游DAF-16基因完成对线虫的耐受能力的提高实现的。
铁皮石斛(Dendrobium officinale)为兰科石斛属草本植物,主产于安徽、浙江、福建、广西、四川、云南等地,铁皮石斛作为石斛中的珍贵品种,其功能性成分主要包括多糖类、黄酮类以及酚酸类等,具有提高免疫力、抗肿瘤、抗衰老、降血糖等药理活性[7],是我国著名的药食两用中药材。《中国药典》规定其药用部位为茎,叶为非药用部位[8],在铁皮石斛鲜条生产时,非药用部位——铁皮石斛叶往往作为副产品被直接丢弃,造成一定的资源浪费。铁皮石斛叶中含有丰富的铁皮石斛多糖,虽然其含量低于茎部,但在某些生物活性上具有一定优势[9],有研究发现铁皮石斛叶中多糖对羟自由基的清除率比茎部的更高[10],此外,铁皮石斛叶生物量占铁皮石斛总生物量比例较大,达到50%[11]。因此,对铁皮石斛叶进行研究开发,不仅能更充分地利用中药珍惜资源,践行绿色可持续发展理念,而且能进一步扩大铁皮石斛的使用部位及提高其附加值。然而,目前关于铁皮石斛叶多糖在抗衰老方面的研究甚少,且具体作用机制还不清楚。
线虫作为一种模式生物,其结构简单、生命周期短、基因组与人类基因保守性较高,因此在抗氧化和延缓衰老研究领域具有明显优势[12-13],广泛应用于抗衰老、药物筛选和神经系统疾病等各方面的研究[14]。而目前以线虫为模型研究铁皮石斛叶多糖抗衰老效果的报道较少,因此本实验选用铁皮石斛叶多糖饲喂N2野生型线虫,通过对其寿命、生殖能力、运动能力、应激实验、体内ROS及抗氧化酶活力等方面进行研究,探究铁皮石斛叶多糖在其体内的抗衰老作用及机理,以期为铁皮石斛叶进一步研究与开发利用提供参考,并为开发抗衰老、抗氧化的功能性食品提供依据。
1 材料与方法
1.1 动物、材料与试剂
N2野生型线虫(Caenorhabditis elegans)购于美国秀丽隐杆线虫遗传中心。
铁皮石斛叶 红河群鑫石斛种植有限公司;大肠埃希氏菌OP50(以下简称OP50) 上海南方模式生物科技股份有限公司;丙二醛(malondialdehyde,MDA)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒 南京建成生物工程研究所;其他试剂均购于广州齐湘生物科技有限公司。
1.2 仪器与设备
FA2204万分之一天平 上海舍岩仪器有限公司;SN-HWS250B恒温生化培养箱 甘易仪器设备(上海)有限公司;LD-SY96S多功能酶标仪 美谷分子仪器(上海)有限公司;MF53-N荧光显微镜 上海蔡康光学仪器有限公司;LC-LX-HR185C冷冻离心机 日本久保田仪器有限公司。
1.3 方法
1.3.1 铁皮石斛叶多糖的制备及含量测定
铁皮石斛叶切段粉碎后,参考文献[15]的方法,采用水溶醇提法提取铁皮石斛叶多糖,经Sevag法除去蛋白后,将溶液倒入透析袋透析,透析结束后采用DEAE阴离子交换柱进行分级层析,用去离子水洗脱。收集洗脱液采用Sephadex G-100进行葡聚糖凝胶柱层析,用去离子水洗脱,层析结束后进行透析、真空浓缩、冷冻干燥,得到纯化的铁皮石斛叶多糖样品。采用苯酚硫酸法[16]测定纯化后的样品多糖质量分数为(90.13±4.73)%。
1.3.2 线虫培养和同期化处理
采用涂布有100 μL OP50菌液(浓度为1×109CFU/mL,下同)的线虫生长培养基(nematode growth medium,NGM)于20 ℃下培养线虫。
采用高氯酸钠漂白法对线虫进行同期化处理:用1 mL M9缓冲溶液将产卵期的线虫成虫洗至无菌EP管中,加1 mL裂解液(含有0.5 mol/L NaOH、0.5%(质量分数)NaClO的M9缓冲液)裂解线虫,反复振荡5 min,然后3 000 r/min离心1 min,弃去上清液,再用M9缓冲液冲洗线虫2 次,3 000 r/min离心1 min,弃去上清液后用移液枪吸取线虫,滴于NGM的无菌区,在20 ℃培养箱中恒温培养约48 h后,裂解的线虫体内受精卵基本发育成L4期幼虫,完成同期化操作。
1.3.3 实验分组
实验分为5 组:将线虫分别转移至涂布100 μL含低(0.5 mg/mL)、中(1.0 mg/mL)、高(2.0 mg/mL)质量浓度铁皮石斛叶多糖OP50菌液的NGM,每天饲喂等体积相应OP50菌液,记为低(LD)、中(MD)、高(HD)质量浓度铁皮石斛叶多糖组;空白对照组(CD)初期涂布或每天饲喂等体积OP50菌液;虾青素(astaxanthin,AST)阳性对照组(YD)初期涂布或每天饲喂等体积含64 μmol/L AST的OP50菌液(准确称取0.001 91 g虾青素,用1 mL二甲基亚砜溶解后制成3.2 mmol/L AST母液,取0.1 mL AST母液与4.9 mL OP50菌液混匀)。
1.3.4 线虫寿命及运动能力测定
线虫寿命测定参考王晋等[17]的方法并稍作修改,分别挑取30 条1.3.3节L4期线虫幼虫转移至5 组涂布有100 μL不同OP50菌液的新鲜NGM,在20 ℃培养箱中恒温培养,此后每隔24 h转移1 次,每天观察线虫的存活情况,计算各组线虫存活率(观察时存活线虫数量占初始线虫总数的比例,下同)、寿命中位数、平均寿命、最长寿命。
参考文献[18]并略作修改测定线虫运动能力。每组选取线虫数量大于30 条,实验重复3 次,在培养第1、5、10、15天观察线虫的运动能力,记录3 个等级(A、B、C)运动能力的线虫数量并计算不同等级运动能力线虫的比例。运动能力判断标准:线虫自主活动自如定义为A等级,仅在挑针触碰头部或尾部后开始爬行定义为C等级,介于两者之间定义为B等级。
1.3.5 线虫生殖实验
随机挑取L4期线虫置于各组培养皿上,每组5 个培养皿,每个培养皿上放置1 条线虫,在产卵高峰期(L4期的前3 d)需每日转板,培养虫卵发育至成虫后记录各组每个培养皿上的线虫数量即为线虫的产卵量。后期每隔24 h将线虫转移至新的平板中,转移4~5 次,至线虫不再产卵时结束,计算线虫总产卵量。
1.3.6 线虫应激实验
1.3.6.1 热应激实验
热应激实验操作参考文献[19]并略作修改,将同期化后的线虫培养至L4期后,各组分别20 ℃干预5 d,随即挑取线虫转移到空白的新鲜NGM培养基中,并放置在35 ℃下培养,每2 h统计1 次存活情况,直至所有线虫全部死亡,计算线虫存活率并绘制线虫生存曲线。
1.3.6.2 急性氧化应激实验
在急性氧化应激实验中,同期化后的线虫生长到L4期后,各组分别干预2 d,之后将线虫暴露于含30 mmol/L双氧水的NGM培养基中,每板20 条,每30 min统计1 次存活情况,计算存活率直到线虫全部死亡为止,实验重复3 次。
1.3.7 线虫体内ROS相对水平测定
随机挑取L4期线虫在各组条件下分别干预4 d后,用M9缓冲溶液冲洗培养基3 次,转移到离心管中,3 000 r/min离心取上清液;吸取50 μL上清液和50 μL显色剂于96 孔板中避光混匀后,以显色剂为对照。将96 孔板放置于酶标仪中,在反应温度为25 ℃,激发波长485 nm、发射波长530 nm的荧光显微镜下每20 min进行一次荧光强度测定,连续测定120 min。ROS相对水平按下式计算。
1.3.8 线虫体内抗氧化酶活力和丙二醛含量的测定
参考文献[20]的方法并略作改动,同期化后的线虫生长到L4期后,将各组线虫转移到NGM上分别干预4 d后,用M9缓冲溶液冲洗培养皿并收集各平板上的成虫。冷冻研磨后离心,取上清液,使用相关试剂盒测定SOD、CAT活力和MDA含量,并以上清液蛋白浓度进行标准化。
1.4 数据统计与分析
实验均重复进行3 次,采用Excel 2016软件进行数据处理,结果以平均值±标准差表示。采用SPSS 18.0软件进行方差分析,采用t检验进行显著性分析,P<0.05表示差异显著。采用Origin 9.1软件和GraphPad软件作图。
2 结果与分析
2.1 铁皮石斛叶多糖对线虫寿命的影响
自然寿命是进行抗衰老研究分析的首选指标[21]。本实验以虾青素为阳性对照,测定了不同质量浓度条件下铁皮石斛叶多糖对线虫寿命的影响,线虫寿命中位数、平均寿命、最长寿命如图1、表1所示。多糖处理组线虫的平均寿命、最长寿命以及寿命中位数均高于CD组。MD与HD组线虫的平均寿命均极显著高于CD组(P<0.01),LD组线虫的平均寿命显著高于CD组(P<0.05),各实验组线虫的最长寿命均有一定程度的延长,其中MD组线虫最长寿命与CD组差异极显著(P<0.01),且高于YD组,表明其效果优于虾青素。以上结果说明铁皮石斛叶多糖对线虫存活率有一定影响,能够有效延长线虫的寿命。
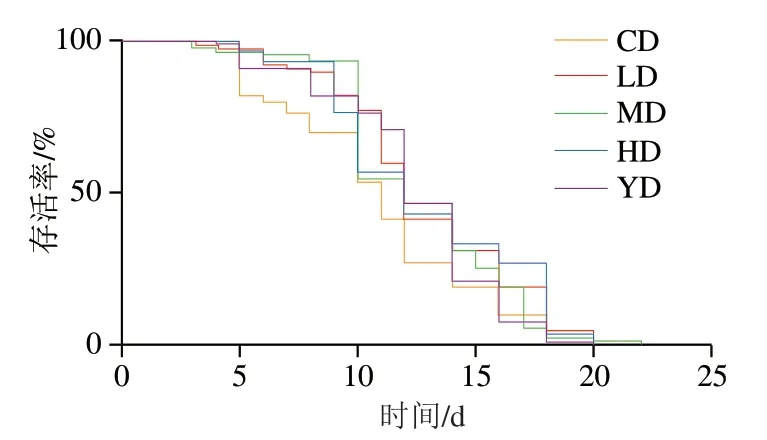
图1 铁皮石斛叶多糖对线虫寿命的影响Fig. 1 Effects of polysaccharide from D. officinale leaves on lifespan of C. elegans
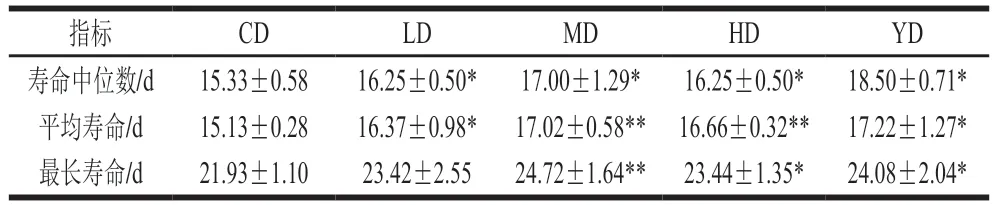
表1 铁皮石斛叶多糖对线虫平均寿命和最长寿命的影响Table 1 Effects of polysaccharide from D. officinale leaves on average and maximum lifespan of C. elegans
2.2 铁皮石斛叶多糖对线虫行动能力的影响
运动行为是反映线虫神经系统基本功能的指标,线虫运动能力与线虫寿命有直接关系,能够作为评价机体的衰老速度的重要指标[22]。
如图2所示,随着机体的衰老,线虫的运动能力逐渐下降。在培养前10 d,铁皮石斛叶多糖对线虫的运动状态影响并不显著(P>0.05);在培养15 d后,与CD组相比,不同质量浓度的铁皮石斛叶多糖均能提高线虫的蠕动能力,在培养到20 d时,CD组中线虫运动状态均为C等级,铁皮石斛叶多糖干预组部分线虫运动状态为B等级,表明铁皮石斛叶多糖可以显著提高线虫的运动能力(P<0.05),且MD、HD组线虫的运动能力略优于YD组,进一步说明铁皮石斛叶多糖还可以提高线虫运动行为能力。
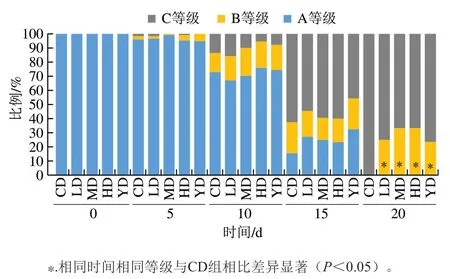
图2 不同质量浓度铁皮石斛叶多糖对线虫运动能力的影响Fig. 2 Effects of polysaccharide from D. officinale leaves on motility of C. elegans
2.3 铁皮石斛叶多糖对线虫产卵量的影响
有报道指出许多生物寿命的延长与生殖能力呈负相关[23],但也有报道指出白藜芦醇可以延长线虫寿命的同时不影响生殖能力[24]。如图3所示,本研究中各组总产卵量没有显著差异(P>0.05),表明铁皮石斛叶多糖可以延长线虫寿命的同时不影响其生殖能力。
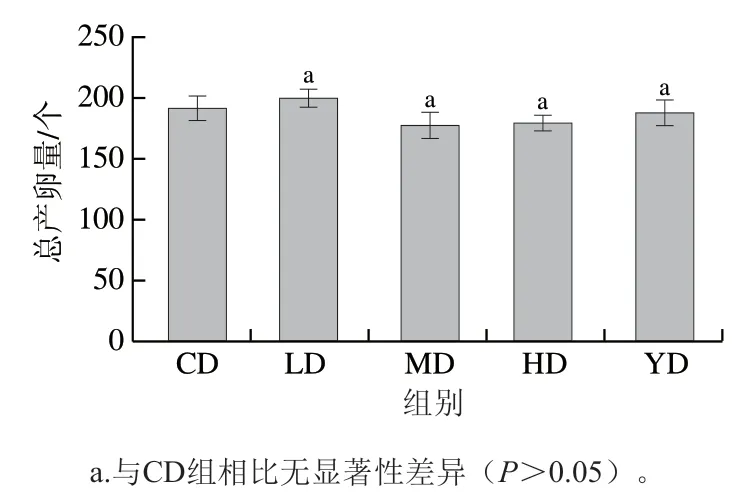
图3 铁皮石斛叶多糖对线虫总产卵量的影响Fig. 3 Effects of polysaccharide from D. officinale leaves on oviposition quantity of C. elegans
2.4 铁皮石斛叶多糖对线虫应激效应的影响
机体在压力环境下的抵抗能力被称作压力应激能力,寿命的延长与压力应激能力的提高具很强的关联性[25-26],高温会导致机体内部代谢紊乱、酶失活等,使机体内产生大量的ROS,引起氧化应激[27],因此通过热应激实验考察线虫对急性氧化损伤的抵抗能力。本研究探讨了35 ℃条件下不同质量浓度铁皮石斛叶多糖干预线虫抵抗热应激的能力。由图4A可知,与CD组相比,低、中、高剂量的铁皮石斛叶多糖对线虫的抗热应激能力均无明显的增强作用。
本实验选择过氧化氢作为强氧化剂,构建氧化损伤环境,将铁皮石斛叶多糖处理后的线虫转移至氧化应激环境中,通过测定线虫存活率来检测铁皮石斛叶多糖是否有助于机体抵御氧化损伤。由图4B可知,在培养前中期时,HD组中的线虫存活率明显高于CD组,说明当铁皮石斛叶多糖的质量浓度达到一定水平时,铁皮石斛叶多糖能增强线虫的抵抗氧化应激的能力;同时,与CD组相比,实验组线虫生存曲线右移,表明实验组中线虫抵御氧化应激的能力普遍提高。
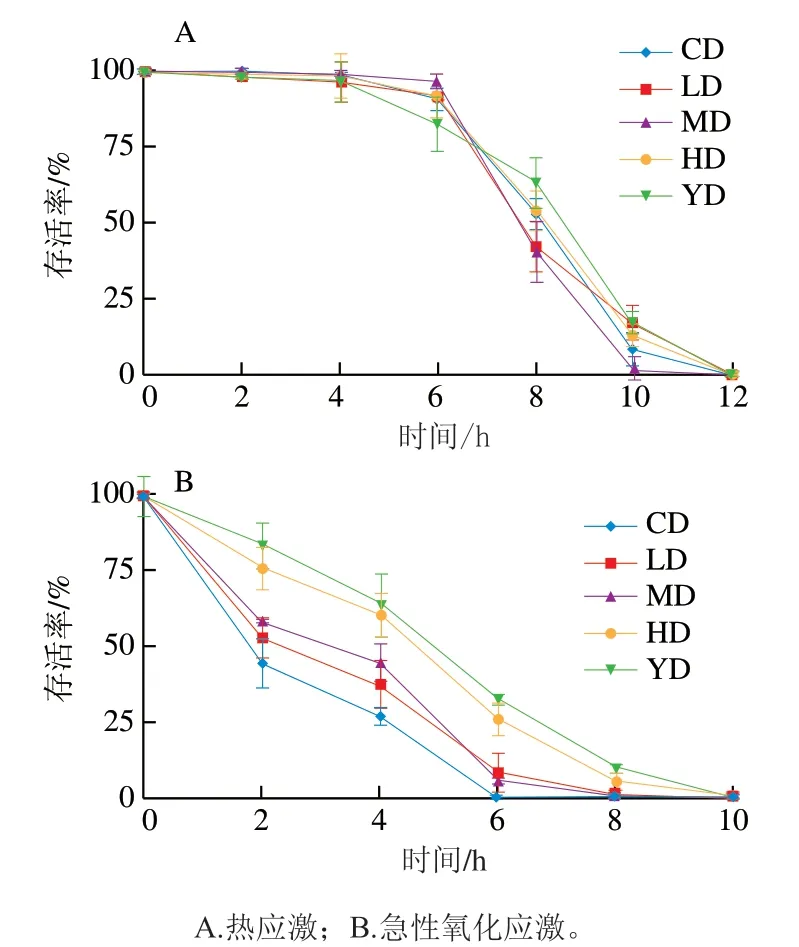
图4 铁皮石斛叶多糖对线虫应激能力的影响Fig. 4 Effects of polysaccharide from D. officinale leaves on stress resistance in C. elegans
2.5 铁皮石斛叶多糖对线虫活性氧相对水平的影响
自由基是衰老的重要引发因素之一,随着机体的衰老,其自由基调节能力下降,导致机体中的ROS的过量堆积,过量的ROS会引起机体氧化应激反应,导致细胞损伤或凋亡,从而引发动脉粥样硬化、癌症、心脑血管病症等多种疾病[28-29]。由图5可知,线虫体内的ROS相对水平随反应时间的延长而增加,处理120 min时,与CD组相比,铁皮石斛叶多糖干预后的线虫体内ROS相对水平都明显降低,LD、MD、HD组ROS相对水平分别降低了40.0、79.1、85.0 个百分点,具有剂量-效应关系。以上结果表明,铁皮石斛叶多糖能有效清除线虫体内的ROS,且HD组对ROS清除效果最为明显。
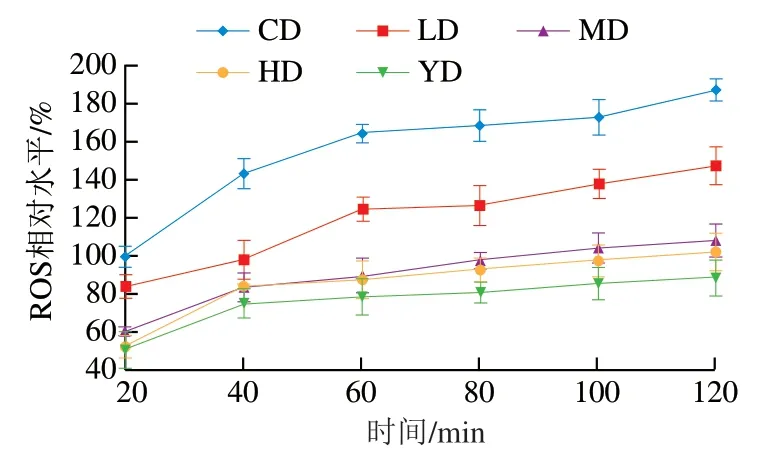
图5 铁皮石斛叶多糖对线虫ROS相对水平的影响Fig. 5 Effects of polysaccharide from D. officinale leaves on ROS levels in C. elegans
2.6 铁皮石斛叶多糖对线虫体内抗氧化酶活力和丙二醛含量的影响
CAT、SOD是线虫体内主要的抗氧化酶,提高抗氧化酶活力可以清除线虫体内多余的自由基,从而促进体内氧化平衡[30],相似研究指出提高线虫体内抗氧化酶活力(SOD、CAT)是延长线虫寿命的作用机制之一[31];MDA是生物体内脂质氧化的产物,被广泛用于脂质氧化水平评价[32]。SOD-1、SOD-3是SOD家族的组成成员,有研究发现SOD-1、SOD-3表达水平升高能减少线虫体内ROS的含量,从而延长线虫寿命[33-34],因此推测铁皮石斛叶多糖抗氧化衰老的作用机制与其提高机体内抗氧化酶活力、降低ROS相对水平有关。
由图6A、B可知,在本实验考察质量浓度范围内,与CD组相比,铁皮石斛叶多糖均可以提高线虫体内SOD和CAT活力,其中,SOD活力由(53.92±1.24)U/mg极显著提高到HD组的(90.02±3.35)U/mg(P<0.01),且存在剂量-效应关系;同时,与CD组相比,不同质量浓度的铁皮石斛叶多糖均能提高CAT活力,且HD组的提升效果显著(P<0.05);由图6C可知,铁皮石斛叶多糖干预组具有更低的MDA含量,与CD组相比,LD、MD、HD组中的MDA含量分别降低了25.24%、26.42%、31.86%,呈现剂量-效应关系。以上结果表明铁皮石斛叶多糖可在一定程度上能够提高线虫体内抗氧化能力,缓解氧化损伤及线虫衰老,具有激活线虫体内抗氧化防御系统的潜力。
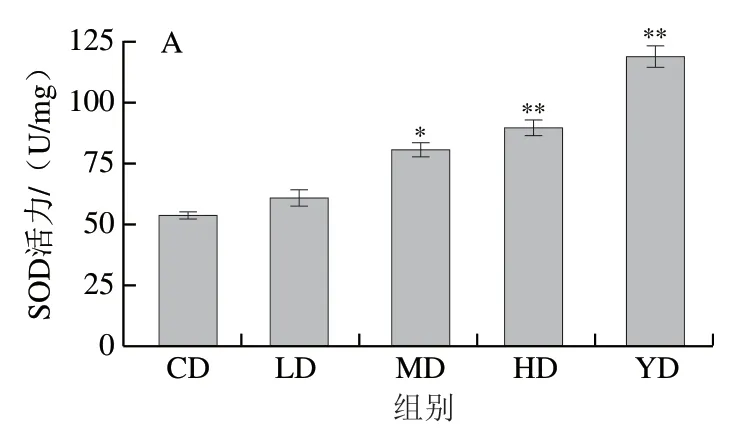
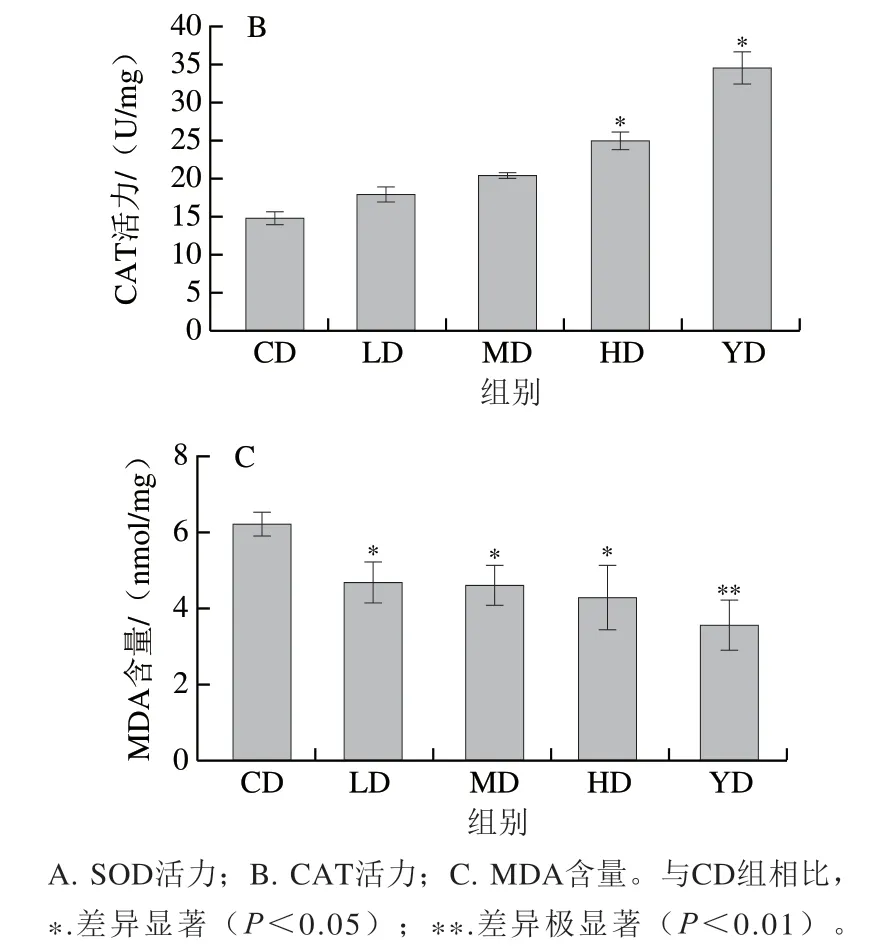
图6 铁皮石斛叶多糖对线虫体内抗氧化酶活力和MDA含量的影响Fig. 6 Effects of polysaccharide from D. officinale leaves on antioxidant enzyme activities and MDA levels in C. elegans
3 结 论
本实验引入模式生物线虫,评价了铁皮石斛叶多糖延缓线虫衰老的作用,并对其可能的作用机制进行了初步的探索。结果表明,与空白对照组线虫相比,铁皮石斛叶多糖能提高线虫的平均寿命和最大寿命,并且不以损害生殖能力为代价,能有效清除自由基和提高机体抗氧化应激能力,同时降低ROS相对水平。与空白对照组线虫相比,铁皮石斛叶多糖能有效提高线虫体内SOD和CAT活力,显著降低MDA含量(P<0.05),且应激条件下线虫的生存率增加。本实验结果表明铁皮石斛叶多糖具有抗氧化活性,可为以后铁皮石斛叶多糖的进一步研究提供参考,但其产生抗氧化作用的具体作用机制仍需进一步研究。
