生食三文鱼源活的非可培养状态副溶血弧菌诱导C57BL/6J小鼠肠道炎性损伤
2022-11-30王润东邓义佳张宇昊李学鹏孟玉琼励建荣
王润东,邓义佳,张宇昊,李学鹏,孟玉琼,马 睿,励建荣,*
(1.西南大学食品科学学院,重庆 400715;2.渤海大学食品科学与工程学院,辽宁 锦州 121013;3.青海大学生态环境工程学院,青海 西宁 810016)
生食三文鱼因具有营养物质丰富、无需煮熟、风味独特等特点而深受消费者的青睐。市场流通的三文鱼原料大多为冷链进口,其在生长水域、长途运输和存储加工等环节极易受到副溶血弧菌的污染[1-3]。为了消减副溶血弧菌等致病菌的威胁,生食三文鱼加工中会使用次氯酸钠对食品原料和生产环境进行消毒[4],但现有研究发现次氯酸钠能够诱导大肠杆菌[5]、沙门氏菌[6]、单核细胞增生李斯特菌[7]和副溶血弧菌[8]等应激转化为活的非可培养(viable but non-culturable,VBNC)状态,处于VBNC状态的微生物仍保持一定的新陈代谢活性,且保留毒力基因,常规方法无法培养,易造成漏检产品流入市场,一旦环境适宜生长,VBNC状态菌株会迅速复苏,成为生食三文鱼的新安全隐患[9-11]。
目前针对VBNC状态副溶血弧菌的研究主要集中在检测方法、诱导条件和复苏过程[12-14]方面,对VBNC状态菌株致病性的研究较少。Zhong Huamin等[15]采用叠氮溴化丙锭联合环介导等温核酸扩增法证明VBNC状态副溶血弧菌仍具有表达耐热相关溶血素(thermostable related hemolysin,trh)和肠毒素能力;Mougin等[16]也证实副溶血弧菌在VBNC状态下能够表达生物被膜相关基因,增加其黏附在食品及其器皿表面的机率;Wong等[17]研究指出,虽然VBNC状态副溶血弧菌产生毒性蛋白和黏附素的能力减弱,但仍能造成肠上皮细胞模型的组织擦拭性损伤。然而,以上研究都是通过毒力因子和体外实验评估副溶血弧菌VBNC状态的致病性,对于VBNC状态菌株在体内的真实危害尚不清楚。机体感染副溶血弧菌毒力株的典型症状是急性胃肠炎,病原菌进入宿主肠道后依靠菌体和毒力因子发挥致病力,菌体黏附在肠壁上具有侵袭力,破坏肠组织结构完整性,代谢产生的溶血毒素、脲酶和毒力蛋白具有细胞毒性,引发溶血和炎症反应,最终造成宿主肠道炎性损伤[18-19]。因此,VBNC状态副溶血弧菌是否通过上述途径感染机体尚待阐明。
本课题组前期从市售生食三文鱼中复苏分离得到一株副溶血弧菌VpRS1,该菌株耐热直接溶血素(thermostable direct hemolysin,tdh)基因阴性,trh基因和不耐热溶血素(thermolabile hemolysin,tlh)基因阳性,与标准毒力株ATCC17802携带相同的溶血毒素基因家族,具有致病性,但VBNC-VpRS1致病力尚不清楚。因此,本研究以生食三文鱼源VBNC-VpRS1菌株为研究对象,Vp17802为致病阳性对照株,分别构建副溶血弧菌诱导的C57BL/6J小鼠感染模型,观察小鼠临床症状,检测其回肠、盲肠和结肠内副溶血弧菌定植量、肠组织形态和病理变化、肠屏障功能、通透性及细胞因子等指标,探究副溶血弧菌VBNC-VpRS1菌株对小鼠的致病力,识别VBNC状态菌株侵袭的靶器官和特征性感染症状,旨在为精准评估生食三文鱼安全风险和感染病原菌后治疗提供理论参考。
1 材料与试剂
1.1 动物、材料与试剂
无特定病原菌级(SPF)7 周龄C57BL/6L小鼠30 只,体质量(18±2)g,购自北京斯贝福生物技术有限公司,生产许可证号:SCXK(京)2018-06073,动物房温度(22±3)℃、相对湿度(40±5)%,12 h日光灯明暗交替循环,自由进食和饮水,适应性饲养7 d。
副溶血弧菌:标准毒力株ATCC17802(Vp17802,tdh-/trh+/tlh+)和生食三文鱼分离株VpRS1(VpRS1,tdh-/trh+/tlh+)为渤海大学大宗水产品贮藏加工与安全控制团队保存。
硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(thiosulfate citrate bile salts sucrous,TCBS)、脑心浸液肉汤(brain heart infusion,BHI) 北京奥博星生物技术有限公司;萘啶酮酸 美国西格玛公司;pH 7.2磷酸盐缓冲溶液(phosphate buffered saline,PBS)、氯化钠(NaCl)、次氯酸钠(NaClO)、多聚甲醛 北京索莱宝科技有限公司;病理组织染色液、脂多糖测试盒、二胺氧化酶测试盒、D-乳酸试剂盒、免疫组化试剂盒、细胞因子酶联免疫吸附试验试剂盒 南京建成生物工程研究所;TRIzol RNA提取剂、cDNA反转录试剂盒、SYBR Green试剂盒 南京诺唯赞生物科技有限公司;化学试剂均为分析纯。
1.2 仪器与设备
DL-CJ-2N超级洁净工作台 北京市东联哈尔仪器制造有限公司;SPX-25生化培养箱 宁波海曙赛福实验仪器厂;5804R高速冷冻离心机、ABI stePone Plus聚合酶链式反应(polymerase chain reaction,PCR)仪 德国艾本德公司;GI54DS立式高压蒸汽灭菌锅 致微(厦门)仪器有限公司;Imark酶标仪、CFX96型荧光定量PCR仪 美国伯乐公司;生物组织自动包埋机、石蜡包埋机、KD-P组织摊片机、转轮式切片机 湖北贝诺医疗科技有限公司;Eclipse E100光学显微镜 日本尼康公司。
1.3 方法
1.3.1 菌株活化及菌悬液制备
挑取-80 ℃下冻干管保存的Vp17802和VpRS1菌株分别接种于3% NaCl-BHI培养基,37 ℃活化两次后,取对数生长期菌液3 000×g室温离心20 min,得到菌体沉淀用等体积无菌0.1 mol/L PBS洗涤2 次并重悬,测定菌悬液OD600nm。根据实验室已测定OD600nm与菌体浓度的相关性曲线,并用TCBS弧菌培养基平板计数验证实际菌量,将Vp17802和VpRS1浓度分别调整至106CFU/mL和108CFU/mL,其中Vp17802菌液16 ℃贮存备用,VpRS1菌液用于诱导VBNC状态VpRS1。
1.3.2 诱导副溶血弧菌VpRS1进入VBNC状态
根据文献[7]报道并结合前期研究利用NaClO诱导副溶血弧菌进入VBNC状态,并稍加改进。取10 mL培养至对数生长期的副溶血弧菌(约108CFU/mL)菌悬液,3 000×g常温离心20 min,弃上清液,用无菌PBS洗涤菌体2 次并重悬,随后与5 mL NaClO溶液混合使有效氯终质量浓度达35 μg/mL,避光室温孵育15 min,每隔5 min晃动1 次,3 000×g常温离心20 min,弃上清液,沉淀用等体积无菌PBS洗涤2 次并重悬。采用活菌直接计数法[20],对重悬液中VpRS1总活菌计数,利用TCBS弧菌计数平板对可培养VpRS1计数,两者差值为VBNC-VpRS1浓度,最后使用无菌PBS调整VBNC-VpRS1浓度至106CFU/mL,储备菌液用于动物实验。同时采用丙酮酸钠辅助热激处理复苏VBNC-VpRS1,检验调整后菌量是否达到预期值,取5 mL储备菌液与5 mL含20 mmol/L丙酮酸钠的PBS混合,45 ℃下热激处理15 s,随后转至37 ℃振荡培养箱(120 r/min)恒温孵育12 h后,通过TCBS弧菌计数平板观察并统计可培养菌落数,即为储备菌液中VBNC-VpRS1实际菌量。
1.3.3 动物实验
适应期结束后,将30 只雌雄各半小鼠随机分为3 组:对照组、标准毒力株感染组(Vp17802组)和VBNC感染组(VBNC-VpRS1组)。实验前12 h,各组小鼠禁食不禁水,对照组小鼠灌胃0.1 mL无菌PBS,标准毒力株感染组和VBNC感染组小鼠依据副溶血弧菌食物中毒剂量105CFU,分别灌胃0.1 mL上述保存的Vp17802和VBNC-VpRS1菌悬液,感染周期72 h。实验结束,采用二氧化碳麻醉小鼠,摘眼球取血,1 500×g、4 ℃离心10 min分离血清,采用颈椎脱臼法迅速处死小鼠,解剖收集回肠、盲肠和结肠组织及其内容物,用于检测肠道炎性损伤指标和病原菌定植量。所有程序遵循中国小动物保护协会的要求(CSAPA-3685)。
1.3.4 一般行为学指标检测
感染期间,观察并记录各组小鼠的活动、饮食、精神状况、粪便形态和体质量变化等指标,并在解剖后分析小鼠腹腔脏器差异。参考文献[21]中疾病活动指数(disease activity index,DAI)评价标准,结合体质量下降百分比、粪便形态和脏器出血3 项指标进行评分。
1.3.5 肠组织中副溶血弧菌定植量检测
分别将1 g回肠、盲肠或结肠内容物与9 mL无菌PBS混匀,采用10 倍稀释法,取3 个连续适宜稀释度(10-3、10-4、10-5)分别涂布于TCBS弧菌计数培养基,37 ℃恒温培养24 h后,统计菌落数。平板菌落计数实验重复3 次。
1.3.6 结肠组织形态学和病理学观察
各组小鼠解剖后,取距离肛门2 cm处结肠组织,将靠近盲肠端的肠组织用大头针固定于测量纸,结肠部分轻轻拉直,测量其长度。随后结肠组织置于质量分数4%多聚甲醛溶液中室温浸泡固定24 h,经酒精脱水和石蜡包埋后用转轮式切片机进行切片,厚度5 μm。常规脱蜡复水、经苏木素-伊红(hematoxylin eosin,HE)染色,中性树胶封片后于光学显微镜下观察结肠黏膜结构完整性。参照文献[22]采用盲法检查结肠组织溃烂程度、水肿和炎性细胞浸润范围,进行组织病理学评分。
1.3.7 结肠组织屏障功能检测
利用结肠组织紧密连接蛋白-1(zonula occluden-1,ZO-1)和闭合蛋白(Occludin)表达量,血清中脂多糖(lipopolysaccharide,LPS)、二胺氧化酶(diamine oxidase,DAO)和D-乳酸(D-lactic acid,D-LA)含量作为评价结肠屏障功能和通透性的指标。
采用免疫组化(immunohistochemistry,IHC)法检测紧密连接蛋白ZO-1和Occludin表达量,按照1.3.6节方法制备结肠石蜡切片。根据IHC试剂盒说明书操作,结肠石蜡切片经双氧水封闭、热原修复、质量分数5%胎牛血清封闭,滴加ZO-1和Occludin一抗(ZO-1稀释比例1∶500;Occuldin稀释比例1∶400),4 ℃过夜。次日PBS洗涤3 次,加入超敏兔鼠通用二抗,室温孵育50 min,PBS液洗涤,滴加新鲜配制DAB显色液,显微镜下观察,ZO-1和Occludin蛋白阳性表达为棕黄色,阴性为蓝色。
按照LPS、DAO和D-LA测试盒说明书操作,测定血清中各指标含量。
1.3.8 结肠组织和血清中细胞因子含量分析
采用TRIzol RNA提取法制备小鼠结肠组织总RNA,经RNA纯度和质量浓度检测后,保留高品质RNA样本。应用反转录试剂盒将RNA逆转录为cDNA,使用10 μL反转录体系,反转录条件为37 ℃、15 min;85 ℃、5 s。利用特异性引物进行实时荧光定量PCR扩增,以小鼠β-actin为内参基因,检测先天免疫受体4(toll-like reporter 4,TLR4)、核因子-κB(nuclear factor-kappa B,NF-κB)、白细胞介素(interleukin,IL)-1β、IL-6、IL-10和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)mRNA相对表达量。引物由上海生物工程有限公司合成,序列见表1。各基因相对表达量按照2-ΔΔCt方法计算。

表1 实时荧光定量PCR检测的基因引物序列Table 1 Sequences of primers used for RT-PCR
按照酶联免疫吸附试验试剂盒说明书检测血清IL-1β、IL-6、TNF-α和IL-10质量浓度。
1.4 数据处理与分析
Microsoft Excel软件整理原始数据,使用One-way ANOVA进行数据差异分析。根据Bartlett’s检验差异是否具有显著性,进而选择Dunnett’s或Tukey’s进行各组间的比较检验。结果用平均值±标准差表示,当P<0.05时,表示组间存在显著差异;采用GraphPad Prism 8.0软件作图,采用Image J 1.8.0软件统计分析紧密连接蛋白阳性成像图片的积分光密度值(integrated optical density,IOD)。
2 结果与分析
2.1 副溶血弧菌对小鼠一般行为学的影响
DAI是评价食源性致病菌诱导肠道损伤的典型指标之一[21]。C57BL/6J小鼠分别灌胃感染VBNC-VpRS1菌株和Vp17802菌株后的自发活动行为、腹腔脏器损伤情况和DAI评分如图1所示。感染4 h,Vp17802组小鼠出现明显的萎靡不振、震颤、被毛凌乱等临床症状,VBNCVpRS1组小鼠则在感染10 h出现类似症状,VBNC-VpRS1组小鼠较Vp17802组延迟6 h出现感染症状,但程度更剧烈。感染终点72 h,Vp17802组鼠笼中有少量黄色稀便,小鼠身体虚弱,经解剖发现肠系组织有黄色积液;VBNC-VpRS1组鼠笼中有大量脓便和一定量的血便,小鼠扎堆聚集,解剖观察肠组织有出血性积液,在此期间对照组小鼠未见任何异常。Vp17802组和VBNCVpRS1组DAI评分分别为6.78±0.43和8.99±0.35,均高度显著高于对照组(P<0.001),且VBNC-VpRS1组与Vp17802组组间存在显著差异(P<0.05)。传统观点认为,VBNC状态微生物的细胞受损,生理活性低,宿主的胃酸和缺氧环境会限制其生长,VBNC状态菌株只能在体外复苏,体内无致病力[23]。然而,本研究发现,虽然VBNC-VpRS1菌株在小鼠体内需要更长时间复苏并产生临床感染症状,但其造成的腹腔脏器损伤远比标准毒力菌株严重。Cappelie等[24]指出初代VBNC状态单核细胞增生李斯特菌无明显致病力,经卵黄培养后感染小鼠比标准菌致病性强,这与卵黄中卵磷脂营养素促进VBNC状态菌复苏产生更多溶血毒素密切相关。因此,VBNCVpRS1菌株在小鼠体内摄取足够营养和复苏后,可能代谢产生更多溶血毒素,进而造成比Vp17802菌株更剧烈的感染损伤。
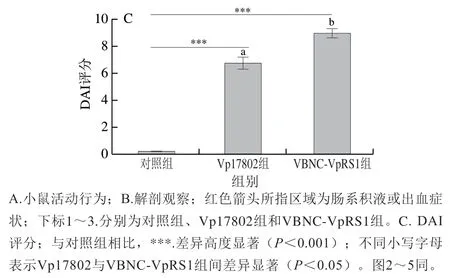
图1 副溶血弧菌对C57BL/6J小鼠活动、腹腔感染和疾病活动指数评分的影响Fig. 1 Effect of Vibrio parahemolyticus on behavior, abdominal infection and DAI score of C57BL/6J mice
2.2 副溶血弧菌对小鼠回肠、盲肠和结肠定植量的影响
胃肠道是副溶血弧菌侵染的主要部位,肠道中病原菌载量决定损伤的严重程度[25]。两株副溶血弧菌在C57BL/6J小鼠回肠、盲肠和结肠定植量如图2所示,对照组小鼠肠道内溶物未检出副溶血弧菌,Vp17802组和VBNCVpRS1组小鼠回肠和盲肠中副溶血弧菌检出量较低,结肠中菌量最高,分别为(3.31±0.10)(lg(CFU/g))和(4.98±0.14)(lg(CFU/g)),均极显著高于对照组(P<0.01)。VBNC-VpRS1菌株在小鼠结肠中定植量显著高于Vp17802菌株(P<0.05)。研究表明,VBNCVpRS1菌株和Vp17802菌株在小鼠回肠和盲肠的定植力弱,主要聚集在结肠内,VBNC状态菌株的结肠定植力强于标准毒力菌株。Gu Dan等[26]研究表明结肠内酸碱度近中性且含有少量氧气,适宜副溶血弧菌定植并发挥致病力。全局应答因子RNA聚合酶σ因子是细菌逆环境生存的关键蛋白,在微生物VBNC状态形成和复苏过程中发挥重要作用,VBNC状态菌株普遍存在RpoS因子过表达情况,且RpoS表达量与菌体黏附作用呈正相关[27]。因此,VBNC-VpRS1菌株比Vp17802菌株具有更强的结肠定植力,可能与其细胞内RpoS因子含量密切相关,未来需要对VBNC-VpRS1菌株的RpoS蛋白开展深入研究。
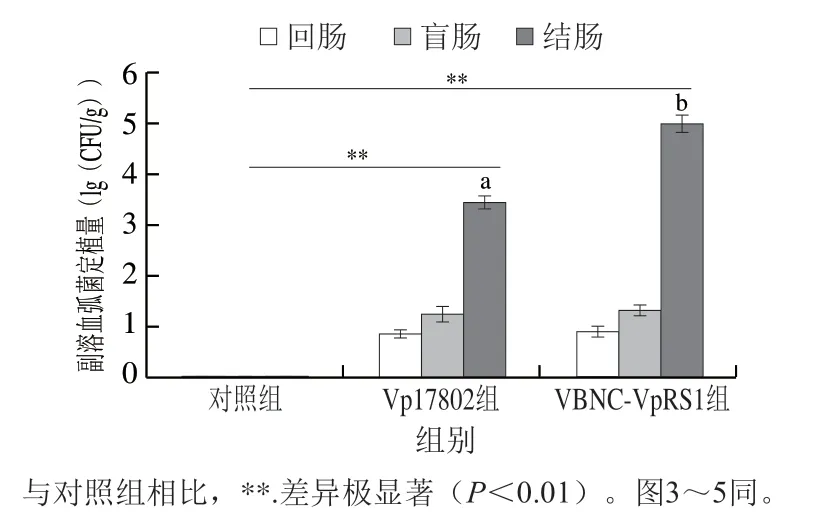
图2 副溶血弧菌在C57BL/6J小鼠回肠、盲肠和结肠定植量Fig. 2 Vibrio parahemolyticus loads in the ileum, cecum and colon of C57BL/6J mice
2.3 副溶血弧菌对小鼠结肠组织的影响
食源性致病菌具有破坏肠组织结构完整性,引发宿主全身感染的风险[28]。小鼠结肠组织形态学观察结果显示,Vp17802组和VBNC-VpRS1组小鼠结肠充血肿胀(图3A),结肠长度较对照组极显著或高度显著缩短(P<0.01、P<0.001)(图3B)。对结肠损伤情况定量分析,与对照组比较,Vp17802组和VBNC-VpRS1组小鼠结肠病理损伤评分高度显著升高(P<0.001)(图3C),其中VBNC-VpRS1组病理评分显著高于Vp17802组(P<0.05)。结肠组织病理学观察结果表明,对照组小鼠结肠黏膜结构完整、光滑,腺体清晰,未见糜烂和炎性细胞浸润,Vp17802组和VBNC-VpRS1组小鼠结肠黏膜上皮糜烂,腺体隐窝结构破坏,杯状细胞减少或消失,伴有大量中性粒细胞浸润,VBNCVpRS1组小鼠结肠组织结构缺损和中性粒细胞浸润区域多于Vp17802组(图3D)。结果表明,VBNC-VpRS1菌株与Vp17802菌株均可造成小鼠结肠组织形态损伤和病理评分增加,VBNC状态菌株比标准毒力菌株具有更强的结肠组织破坏力和诱导炎性细胞浸润。Yoon等[29]指出,小鼠肠道内复杂的微环境会促进VBNC状态弧菌感染,特别是肠内液体能够滋养VBNC状态弧菌,有利于其破坏肠系黏膜细胞。由此推测VBNC-VpRS1菌株借助肠积液增加对结肠黏膜层的侵袭,从而表现出比Vp17802菌株更强的结肠损伤效应。这一推论在小鼠腹腔脏器观察(图1)中得到证实,VBNC-VpRS1组小鼠结肠内出现大量血样积液,而Vp17802组小鼠结肠内积液量较少。
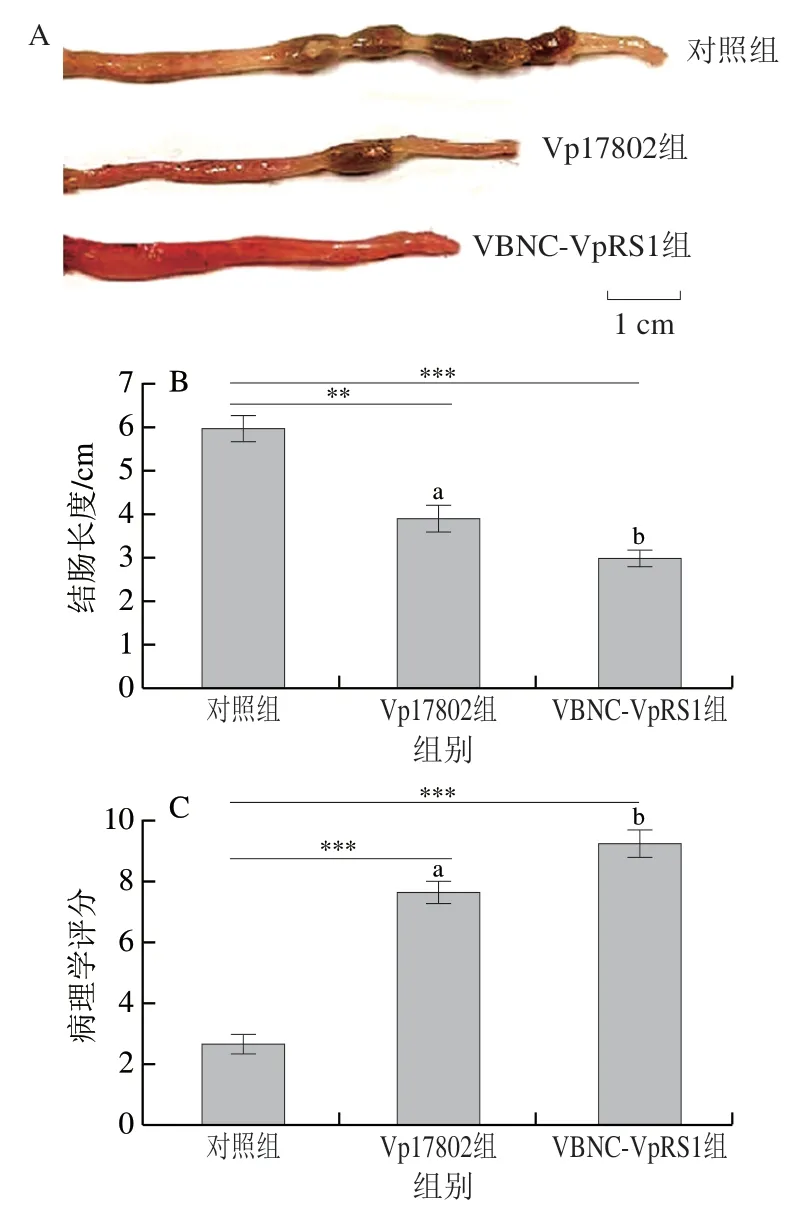
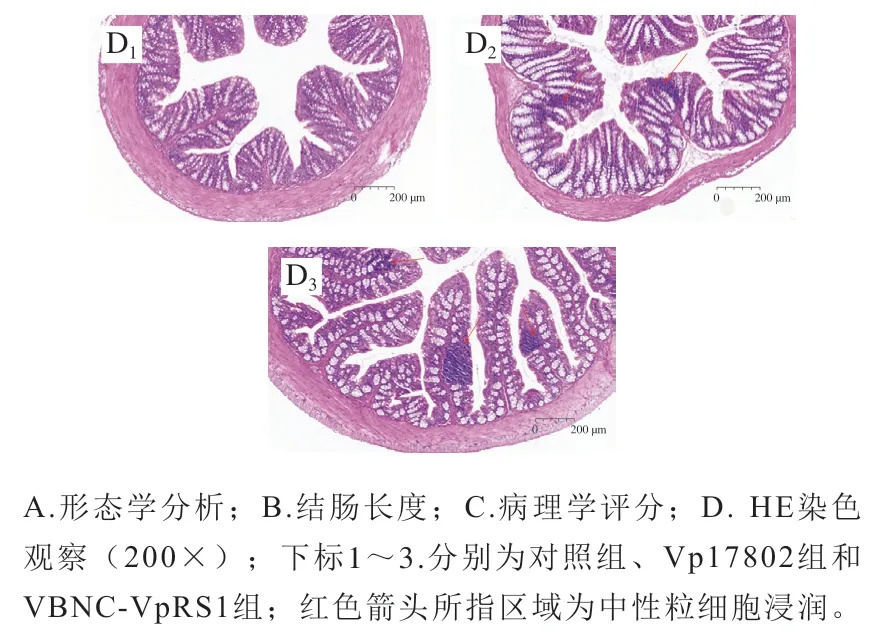
图3 副溶血弧菌诱导C57BL/6J小鼠结肠组织损伤Fig. 3 Morphological and histological changes in the colon of C57BL/6J mice induced by Vibrio parahemolyticus
2.4 副溶血弧菌对小鼠结肠屏障功能的影响
肠黏膜机械屏障是肠系屏障中最重要的部分,由黏膜上皮细胞和细胞间紧密连接构成,发挥调节肠壁通透性、阻止食源性致病菌感染扩张和内毒素外溢的作用[30]。如图4A所示,对照组中ZO-1和Occludin的阳性免疫反应产物位于细胞膜和/或细胞质中(红色箭头所示区域),呈棕黄色,而在Vp17802组和VBNC-VpRS1组中很少有阳性产物,呈蓝色。由图4B可知,对照组ZO-1和Occludin的IOD最高,表明小鼠处于健康水平;与对照组比较,Vp17802组和VBNC-VpRS1组ZO-1和Occludin的IOD均极显著或高度显著减少(P<0.01、P<0.001),且Vp17802组两种紧密连接蛋白IOD显著低于VBNCVpRS1组(P<0.05),说明两株副溶血弧菌感染均抑制小鼠结肠ZO-1和Occludin蛋白表达量,导致小鼠结肠组织紧密连接结构异常。血清检测结果显示,两组副溶血弧菌感染的小鼠血清LPS、DAO质量浓度和D-LA浓度显著高于对照组(P<0.001、P<0.05、P<0.01),Vp17802组的LPS、DAO质量浓度和D-LA浓度分别为对照组的1.7、1.2、1.4 倍,VBNC-VpRS1组分别是对照组的1.8、1.1、1.3 倍,Vp17802组和VBNC-VpRS1组组间无显著差异(P>0.05)(图4C)。综上说明,VBNCVpRS1菌株和Vp17802菌株破坏小鼠肠屏障功能异常,造成了肠通透性增加诱发内毒素移位,这也解释了感染组小鼠胃部、脾脏和肝脏有出血性损伤(图1)可能与副溶血弧菌菌体和LPS等有害物的扩散有关。Li Yan等[31]研究指出肠屏障功能发生障碍时,病原菌及其代谢物等可以侵入深层组织和血液,诱导肾脏和脾脏等腹腔脏器多位点损伤。虽然,VBNC-VpRS1菌株对结肠屏障功能破坏力弱于Vp17802菌株,但也会造成结肠通透性异常,增加全身感染的风险,其致病力不容忽视,提示食品安全监管部门应该把VBNC状态副溶血弧菌纳为常规检测项目,尤其在即食食品安全监控中。
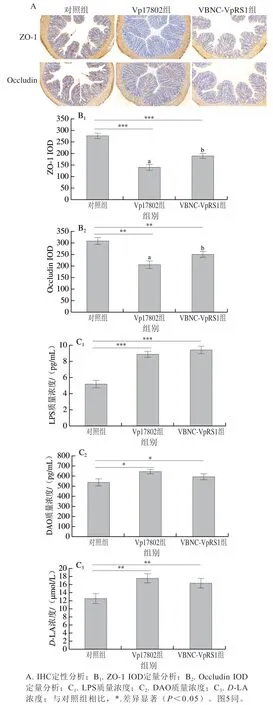
图4 副溶血弧菌诱导C57BL/6J小鼠结肠屏障功能异常Fig. 4 Colonic barrier dysfunction in C57BL/6J mice induced by Vibrio parahemolyticus
2.5 副溶血弧菌对小鼠结肠和血清细胞因子水平的影响
细胞因子包括促炎和抗炎因子,二者相互制约,在机体炎症反应平衡中发挥关键作用[32]。如图5A所示,与对照组相比,Vp17802组和VBNC-VpRS1组小鼠结肠组织TLR4和NF-κB的mRNA表达量高度显著升高(P<0.001),促炎因子IL-1β、IL-6和TNF-αmRNA相对表达量也高度显著增加(P<0.001);IL-10是典型的Th2型细胞因子,具有较强的抗炎作用,Vp17802组和VBNC-VpRS1组的转录表达量相较于对照组被高度显著抑制(P<0.001),分别为对照组的0.45 倍和0.66 倍(图5B)。小鼠血清细胞因子结果表明,Vp17802组和VBNC-VpRS1组血清IL-1β、IL-6、TNF-α质量浓度分别为(410.12±28.74)、(243.65±10.33)、(318.59±17.31)pg/mL和(341.45±18.35)、(210.02±8.89)、(269.12±12.99)pg/mL,均极显著高于对照组(IL-1β质量浓度(210.14±19.40)pg/mL、IL-6质量浓度(138.45±10.12)pg/mL、TNF-α质量浓度(110.23±7.62)pg/mL)(P<0.01)(图5C);Vp17802组和VBNC-VpRS1组血清IL-10质量浓度分别为(68.73±5.91)pg/mL和(73.21±9.28)pg/mL,均显著低于对照组((102.07±11.41)pg/mL)(P<0.05)(图5C)。Vp17802组促炎因子(IL-1β、IL-6和TNF-α)水平均显著高于VBNC-VpRS1组(P<0.05),而抑炎因子(IL-10)水平无明显差异(P>0.05)。肠道炎症反应受TLR4介导的信号转导通路调控,NF-κB作为TLR4信号通路下游重要的多功能核转录因子,激活后调控机体炎症水平、免疫反应和细胞凋亡[33]。活化的NF-κB可促进IL-1β、IL-6和TNF-α等炎性因子表达,进而反馈激活NF-κB表达,加剧炎症反应,炎性因子通常对病原菌无害,反而可以增加肠组织血液供应进而为致病菌提供额外的营养,有助于其竞争肠系生存空间[34]。因此,VBNC-VpRS1菌株和Vp17802菌株是通过激活结肠组织TLR4/NF-κB途径介导炎性因子IL-1β、IL-6和TNF-α转录表达,同时抑制抗炎因子IL-10活性,诱导结肠过度炎症反应,值得注意的是VBNC-VpRS1菌株致结肠炎症能力弱于Vp17802菌株,且在血清细胞因子中具有相同规律。综上,两株副溶血弧菌均能诱导小鼠结肠和系统性炎症反应,VBNC状态菌株的致炎性弱于标准毒力菌株。此外,VBNC状态弧菌胞内全局应答因子(RpoS)、重组组蛋白样类核结构蛋白和LuxR家族调控蛋白等参与致病菌的毒力形成[35]。在进一步研究中,挖掘具有调控VBNC状态副溶血弧菌致病力的关键因子是亟待解决的问题。
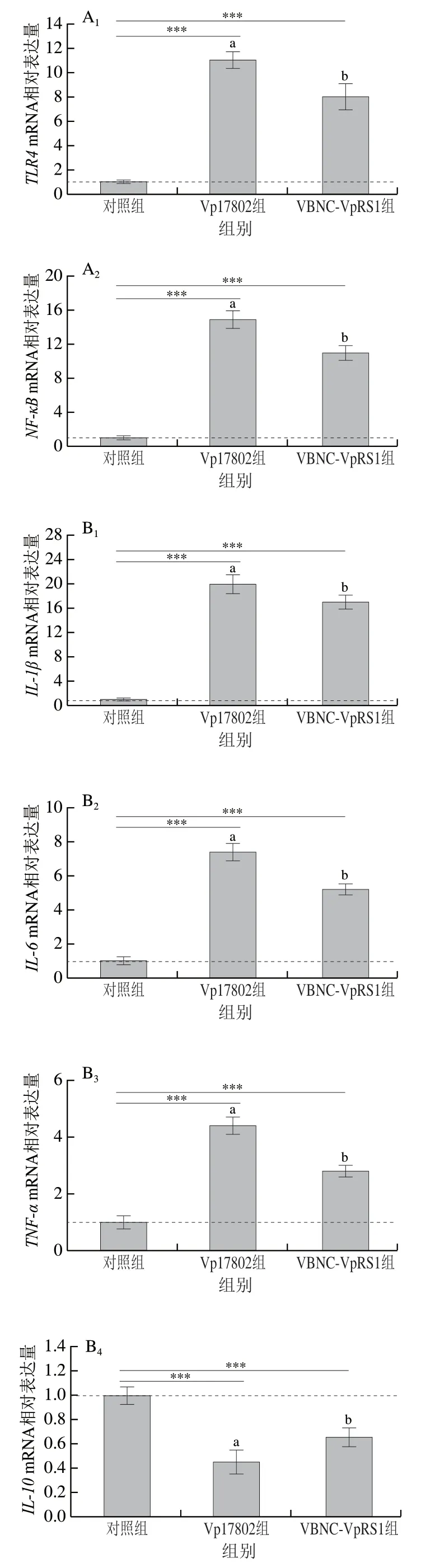
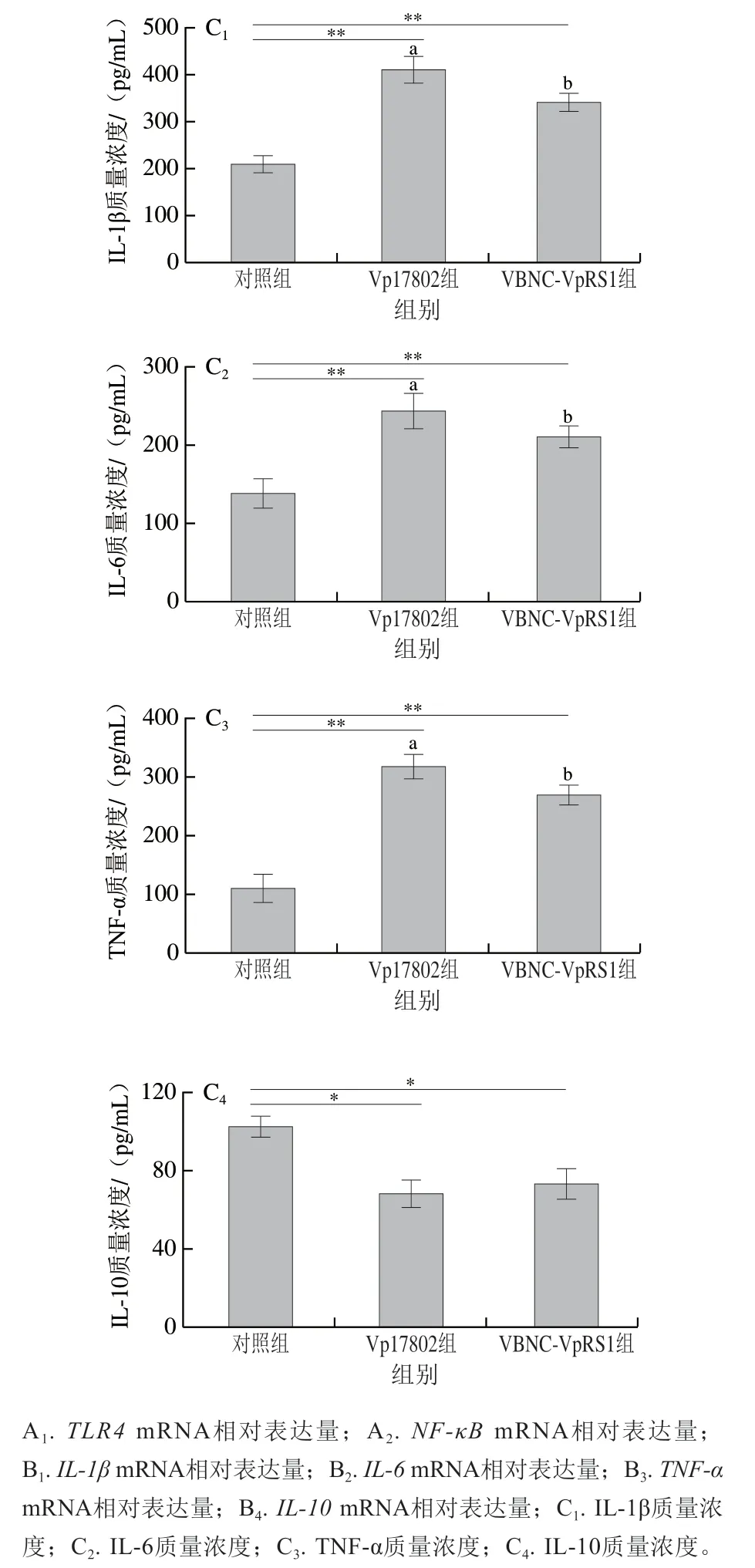
图5 副溶血弧菌诱导C57BL/6J小鼠结肠和血清炎症反应Fig. 5 Colonic and serum inflammatory responses in C57BL/6J mice induced by Vibrio parahemolyticus
3 结 论
生食三文鱼源VBNC-VpRS1菌株通过定植在C57BL/6J小鼠结肠,破坏肠黏膜组织结构完整性,抑制紧密连接蛋白ZO-1和Occludin表达,造成肠屏障功能障碍,LPS、DAO和D-LA等有害物趁机移位,激活TLR4/NF-κB途径及其调控的促炎因子过度释放,诱导小鼠肠道炎性损伤。虽然VBNC状态菌株引起临床感染症状较标准毒力株滞后,但其具有更强的结肠定植力和肠组织破坏性,且影响肠功能和促进炎症,威胁机体健康。食品中VBNC状态副溶血弧菌的致病力应当引起足够重视。由于VBNC状态菌株诱导的肠道损伤特征与标准毒力株不同,未来应该深入探究二者的致病力差异。
