基于不同消化阶段探究多酚对叶黄素吸收的促进作用
2022-11-30肖亚茹张钟元聂梅梅李大婧徐亚元戴竹青张国栋
肖亚茹,张钟元,*,聂梅梅,李大婧,徐亚元,戴竹青,冯 蕾,张国栋
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.江苏大学食品与生物工程学院,江苏 镇江 212001;3.江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地,江苏 南京 210014;4.江苏艾兰得营养品有限公司,江苏 靖江 214500)
类胡萝卜素是广泛存在于自然界中的色素,具有抗氧化、抗癌、预防心血管类疾病、预防眼部疾病等重要的生理功能[1]。其中,叶黄素和玉米黄质是存在于人眼视网膜黄斑的类胡萝卜素,可抵抗眼部氧化、光损伤,对眼睛起重要的保护作用[2-3]。但类胡萝卜素不易吸收,食用富含类胡萝卜素的食物和膳食补充剂并不意味着人体就能够吸收并利用大量的类胡萝卜素,已有报道表明食品基质中类胡萝卜素最终可被人体利用的比例低于5%。这是由于类胡萝卜素的吸收过程复杂。首先,类胡萝卜素从食物基质中释放出来,然后在消化过程中并入肠道的混合胶束中,通过被动扩散过程被肠道上皮细胞吸收,经淋巴循环运输至组织器官[4]。在整个吸收过程中,类胡萝卜素种类和结构、促进和拮抗因子等诸多因素显著影响类胡萝卜素生物利用度[5-6]。
在日常饮食中类胡萝卜素通常与蛋白质、脂肪等常量营养素及膳食纤维、矿物质、多酚等微量营养素一同被消化吸收,这些营养素与类胡萝卜素相互作用,能够影响后者在人体的吸收[6]。现有研究发现多酚可以调控类胡萝卜素肠道吸收、代谢过程。体外研究发现柑橘黄烷酮、花青素能有效地促进人结直肠腺癌细胞Caco-2细胞吸收β-胡萝卜素、叶黄素、β-隐黄质[7-9]。研究表明小鼠经槲皮素干预后β-胡萝卜素在小鼠肝脏中的积累增加[10];同时喂食橙皮苷(hesperidin, HES-G)和β-胡萝卜素显著增加了蒙古沙鼠血浆中视黄醇的含量[11]。但现有研究主要集中在多酚对类胡萝卜素吸收影响的宏观调控上,鲜有多酚调控类胡萝卜素吸收的机制研究。本团队前期研究发现柑橘黄烷酮通过活化细胞受体蛋白B类I型清道夫受体(scavenger receptor class B type I,SR-BI)、CD36的表达促进β-胡萝卜素细胞吸收[12],但多酚对叶黄素的吸收机制尚不明确。并且目前对类胡萝卜素吸收代谢的研究都是分析单一的某一个阶段,鲜有对类胡萝卜素吸收的各个阶段同时进行系统研究的报道。
本实验以课题组前期所进行的柑橘黄烷酮对β-胡萝卜素肠道吸收代谢研究为基础,对多酚在叶黄素不同消化阶段的影响进行详细研究,通过构建体外消化、细胞和小鼠模型,研究多酚对叶黄素体外消化、细胞吸收及体内吸收3 个阶段的影响,多阶段探究多酚对叶黄素吸收的影响,有利于全面阐明多酚对叶黄素吸收代谢的影响机制。
1 材料与方法
1.1 动物、材料与试剂
雄性C57BL/6小鼠(6~8 周)购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(浙)2019-0001;使用许可证号:SYXK(浙)2017-0007。
人结肠腺癌细胞株(Caco-2)购自中国科学院上海细胞库。
叶黄素(纯度≥80%)、表没食子儿茶素(epigallocatechin,EGC)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、姜黄素、花青素、槲皮素(纯度≥98%)、胃蛋白酶(3 000 U/mg)、胰酶(250 U/mg) 上海源叶科技有限公司;橙皮素(hesperetin,HES)、HES-G、黄腐酚(纯度≥98%) 美国Sigma公司;猪胆盐北京奥博星生物技术有限责任公司;DMEM高糖培养基、胎牛血清(fetal bovine serum,FBS)、磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.0、0.01 mol/L)、0.25%胰酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA) 美国Gibco Laboratories公司;T25细胞培养瓶、6 孔Transwell(聚碳酸酯膜)细胞培养板美国康宁公司;抗SR-BI抗体、抗β-actin抗体、抗尼曼-匹克C1型类蛋白(Niemann-Pick C1L1,NPC1L1)抗体、抗CD36抗体、二抗(辣根过氧化物酶标记的山羊抗兔免疫球蛋白G) 美国Cell Signaling Technology公司;胆固醇、油酸、甘油酯、亚油酸、正己烷、丙酮、无水乙醇、三氯甲烷均为国产分析纯。
1.2 仪器与设备
TG16-WS台式高速离心机 长沙湘仪离心机仪器有限公司;体外消化仪 澳大利亚NI公司;FE20 pH计梅特勒-托利多仪器(上海)有限公司;BS224S电子分析天平 北京赛多利斯科学仪器公司;DW-86L828型超低温冰箱 青岛海尔股份有限公司;RE52CS旋转蒸发仪、D10氮气吹扫仪 杭州奥盛仪器有限公司;组织研磨机、细胞培养箱、MZS90纳米粒度测定仪 英国马尔文仪器有限公司;XD-202倒置显微镜 南京江南永新光学有限公司;BHC-1300IIA/B2型生物洁净安全柜苏州净化设备有限公司;TDL-80-2C低速台式离心机上海安亭科学仪器厂;ERS-2上皮跨膜细胞电阻仪美国密理博公司;1260高效液相色谱仪 美国安捷伦科技有限公司。
1.3 方法
1.3.1 叶黄素胶束制备
叶黄素胶束的制备参考文献[12]的方法并略作修改。取56.8 mg叶黄素用甲醇溶解并定容至50 mL,制得2 mmol/L叶黄素贮备液。取一定体积的叶黄素贮备液与不同食物组分溶解于三氯甲烷,用氮气吹干有机溶剂后重悬于PBS中,涡旋10 min,超声30 min,得含有不同食物组分(终浓度2.5 mmol/L单油酰甘油、2.5 mmol/L油酸、12 mmol/L牛磺胆酸钠、0.5 mmol/L胆固醇、2.5 mmol/L亚油酸和1 mmol/L EGC、EGCG、黄腐酚、HES、HES-G、花青素、姜黄素、槲皮素)的叶黄素胶束,其中叶黄素的浓度为200 μmol/L。以未加入食物组分的叶黄素胶束为对照组。
1.3.2 叶黄素生物可及性测定
生物可及性是指在消化过程中从食物基质中释放出来的有可能被机体摄取和吸收的活性物质比例。如类胡萝卜素的生物可及性通常指摄入的类胡萝卜素占胶束的比例[13]。叶黄素生物可及性测定参考文献[14]的方法并略作修改。将装有5 mL 1.3.1节叶黄素胶束消化管置于体外消化仪中,采用自动进样器加入10 mL胃液(140 mmol/L NaCl、5 mmol/L KCl、10 mmol/L CaCl2·2H2O、3.5 mmol/L KH2PO4)和2 mL质量浓度3.2 mg/mL的胃蛋白酶溶液(用1 mol/L HCl溶液调节至pH 2),设置消化温度37 ℃、转速150 r/min、消化时间1 h,模拟胃消化阶段。
胃消化阶段结束后用1 mol/L NaHCO3溶液调节至pH 7,采用自动进样器加入20 mL肠液(含5 mg/mL胰酶、31.13 mg/mL胆盐的0.1 mol/L NaHCO3溶液),设置消化温度37 ℃、转速150 r/min、消化时间2 h,模拟肠消化阶段。
体外消化液叶黄素提取参考文献[15]并略作修改。取10 mL肠消化液,离心(8 000 r/min、10 min)取上清液,加入等体积正己烷-乙醇-丙酮溶液(体积比为2∶1∶1)萃取,轻微振荡,静置分层,反复萃取至下层无色,合并萃取液,用氮气吹扫仪吹干有机溶剂后甲醇复溶,采用高效液相色谱测定叶黄素质量浓度。
叶黄素的生物可及性按下式计算。
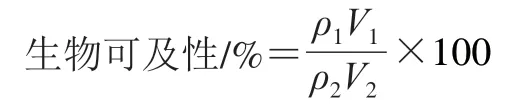
式中:ρ1为消化液中叶黄素质量浓度/(μg/mL);V1为消化液体积/mL;ρ2为初始叶黄素胶束质量浓度/(μg/mL);V2为初始叶黄素胶束体积/mL。
1.3.3 粒径、ζ-电位的测定
取1.3.1节制备的胶束溶液,用PBS稀释10 倍后利用纳米粒径测定仪于室温条件下测定平均粒径和ζ-电位。
1.3.4 细胞吸收叶黄素水平的测定
Caco-2细胞培养在含10%(体积分数)FBS的高糖DMEM完全培养基中,置于恒温培养箱(5%(体积分数)CO2、37 ℃,下同)培养至对数生长期,用含0.25%胰蛋白酶-EDTA溶液将贴壁细胞消化成单个细胞悬液后以2×105个/mL接种至含有0.5 mL完全培养基的Transwell的聚碳酸酯膜上,下层加入1.0 mL 高糖DMEM培养基,培养21 d后备用[16]。采用ERS-2上皮跨膜细胞电阻仪测定各孔细胞单层膜跨膜电阻(transepithelial electrical resistance,TEER)确定其完整性,当TEER大于500 Ω·cm2时可用于细胞吸收叶黄素水平的测定[17]。Caco-2细胞吸收叶黄素前,用PBS清洗2 遍,向细胞单层膜中分别加入SR-BI蛋白抑制剂BLT-1(block lipid transport-1)、NPC1L1蛋白抑制剂依泽替米贝(ezetimibe,EZT)、CD36蛋白抑制剂磺基-N-琥珀酰亚胺酯油酸(sulfo-N-succinimidyloleat,SSO),蛋白抑制剂浓度均为30 μmol/L,预处理30 min后,在上层加入0.5 mL叶黄素胶束,在下层加入1.0 mL高糖DMEM培养基,以不添加蛋白抑制剂为对照组,将Transwell置于培养箱孵育培养5 h[18]。本实验选择的培养时间代表正常生理状态下通过肠道吸收时间。孵育结束后吸弃上、下层培养液,用含有5 mmol/L牛黄胆酸钠PBS清洗细胞单层膜两遍,以去除附着在表面的叶黄素,用细胞刮子小心地刮取细胞,使细胞悬浮于1 mL PBS中。
叶黄素的提取[12]:取1 mL悬有细胞的PBS,加入等体积氯仿-甲醇(体积比2∶1)萃取剂轻微振荡,静置分层,反复萃取至下层(水相)无色,合并萃取液,用氮气吹扫仪吹干有机溶剂后用200 μL无水甲醇复溶,采用高效液相色谱法(high performance liquid chromatography,HPLC)分析叶黄素质量浓度水平以表征细胞吸收叶黄素水平。
1.3.5 蛋白免疫印迹
总蛋白的提取:取1.3.4节刮取的细胞样品,加入2 mL PBS重悬,离心(12 000 r/min、10 min)得细胞样品[19]。加入适量蛋白裂解液,置于冰上裂解细胞1 h,离心(12 000 r/min、10 min)后弃去上清液,得到总蛋白样品。参考二喹啉甲酸(bicinchoninic acid,BCA)试剂盒说明书测定样品中蛋白质量浓度。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)与转膜:上样量为20 μg进行SDS-PAGE;采用湿转法将凝胶上的蛋白转到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。将PVDF膜置于5%(质量分数)脱脂牛奶封闭液中,于37 ℃ 培养箱中封闭1.5 h,采用TBST清洗3 次,每次10 min。
抗体孵育:将PVDF膜置于一抗溶液(稀释比例均为1∶1 000)中孵育,4 ℃振荡12 h,用TBST洗涤3 次,每次10 min,然后置于二抗溶液(稀释比例为1∶2 000),室温孵育1 h,TBST洗涤3 次,每次10 min。
显色:加入1 mL增强型化学发光试剂(enhanced chemiluminescence,ECL)显色液,避光孵育4 min,置于化学发光成像仪曝光。采用Image J软件分析目标条带的灰度值,以目的蛋白和内参蛋白灰度值的比值作为目的蛋白的相对表达量。
1.3.6 动物实验及分组
将小鼠适应性饲喂7 d后随机分为10 组,每组10 只。各组小鼠按照100 μL/d分别灌胃1.3.1节不同叶黄素胶束,灌胃7 d后,最后1 次灌胃4 h后眼球取血并用抗凝管收集,然后立即处死小鼠并取肝脏组织[20],将盛有小鼠血液的抗凝管于冰上静置4 h,然后1 500 r/min离心15 min,取上清液得到血浆样品。取80 mg肝脏组织于离心管,加入0.8 mL生理盐水匀浆。向匀浆后的混合物中加入2 mL三氯甲烷-甲醇溶液(体积比2∶1),混匀后再加入1 mL正己烷溶液,涡旋混匀后3 000 r/min离心5 min,移取上层清液。取下层混合物重复上述提取步骤,合并两次上层清液,用N2吹干后加入150 μL无水甲醇复溶,待HPLC分析叶黄素水平。在装有200 μL血浆样品的离心管中加入1 mL的正己烷溶液,涡旋混匀后3 000 r/min离心5 min,移取上层清液。取下层混合物重复上述步骤,合并两次上层清液,N2吹干后加入150 μL无水甲醇复溶,待HPLC分析叶黄素质量浓度。
1.3.7 HPLC分析叶黄素水平
参考本实验室已建立的方法[21]测定叶黄素水平。色谱柱为YMC-C30色谱柱(4.6 mm×250 mm,5 μm);DAD检测器;检测波长450 nm;流速0.6 mL/min;进样量20 μL;柱温25 ℃。流动相A:水-甲基叔丁基醚-甲醇(体积比5∶25∶70);流动相B:水-甲基叔丁基醚-甲醇(体积比5∶85∶10);梯度洗脱程序:0~4.5 min(95%~80% A);4.5~12.5 min(80%~50% A);12.5~18 min(50%~25% A);18~24 min(25%~5% A);24~30 min(5% A)。
1.4 数据统计与分析
所有实验重复3 次,结果以平均值±标准差表示,采用Origin软件作图。采用SPSS 17.0软件进行单因素方差分析,采用Duncan’s多重比较检验进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 多酚对叶黄素生物可及性的影响
类胡萝卜素生物可及性是指类胡萝卜素摄入混合胶束中可被小肠吸收的类胡萝卜素比例[22]。本实验以亚油酸为阳性对照,首先研究了多酚对叶黄素生物可及性的影响。如图1所示,多酚处理对叶黄素生物可及性起到显著的提高作用,与单独叶黄素(CK)组相比,叶黄素生物可及性提高了3.3~7.0 倍(P<0.05),其中EGCG处理组效果最为显著,叶黄素生物可及性高达24.3%,较单独叶黄素组提高了7.0 倍(P<0.05),较亚油酸组提高了2.0 倍。

图1 多酚对叶黄素生物可及性的影响Fig. 1 Effects of polyphenols on the bioaccessibility of lutein
2.2 多酚对叶黄素胶束性能的影响
为了进一步研究上述体外消化形成的胶束性能,对形成的胶束的平均粒径、ζ-电位进行测定。平均粒径反映胶束颗粒尺寸,ζ-电位反映粒子表面电荷。本实验探究了多酚对叶黄素胶束性能的影响,结果如表1所示。与单一的叶黄素胶束相比,多酚的加入可使叶黄素胶束的平均粒径显著降低。此外,多酚的加入可使叶黄素胶束溶液ζ-电位绝对值增加。ζ-电位绝对值越高,表明液滴中同种电荷含量较高,可防止液滴中大分子物质聚集。因此,多酚处理组叶黄素胶束溶液较其他组稳定。
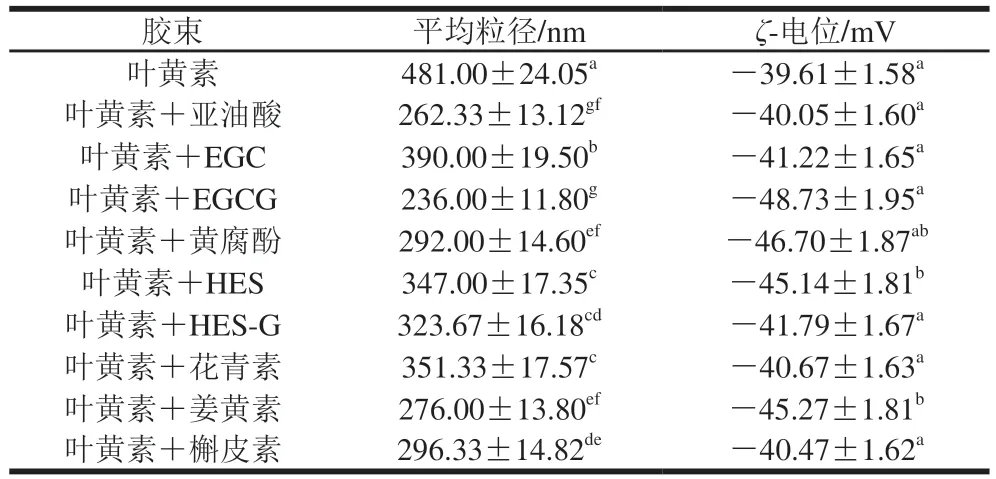
表1 多酚对叶黄素胶束性能的影响Table 1 Effects of polyphenols on properties of lutein micelles
2.3 多酚对细胞吸收叶黄素的影响
不同多酚对细胞吸收叶黄素的影响如表2所示,结果表明多酚可使细胞吸收的叶黄素水平提高3.2%~30.4%,其中EGC和EGCG等提高效果较为明显。细胞膜蛋白NPC1L1、SR-BI、CD36是参与类胡萝卜素细胞吸收的转运蛋白[23],本实验研究了NPC1L1、SR-BI、CD36蛋白抑制剂对细胞吸收叶黄素水平的影响,结果表明,加入NPC1L1、SR-BI、CD36蛋白抑制剂降低了细胞吸收叶黄素水平。与对照组相比,加入BLT-1可使细胞吸收叶黄素水平降低3.4%~24.6%;加入EZT使细胞吸收叶黄素水平降低2.7%~28.5%;加入SSO使细胞吸收叶黄素水平降低2.8%~23.7%。这表明3 种蛋白均参与多酚促进细胞吸收叶黄素过程,3 种蛋白的抑制剂使相应蛋白表达水平降低,进而使叶黄素转运通路受到影响。
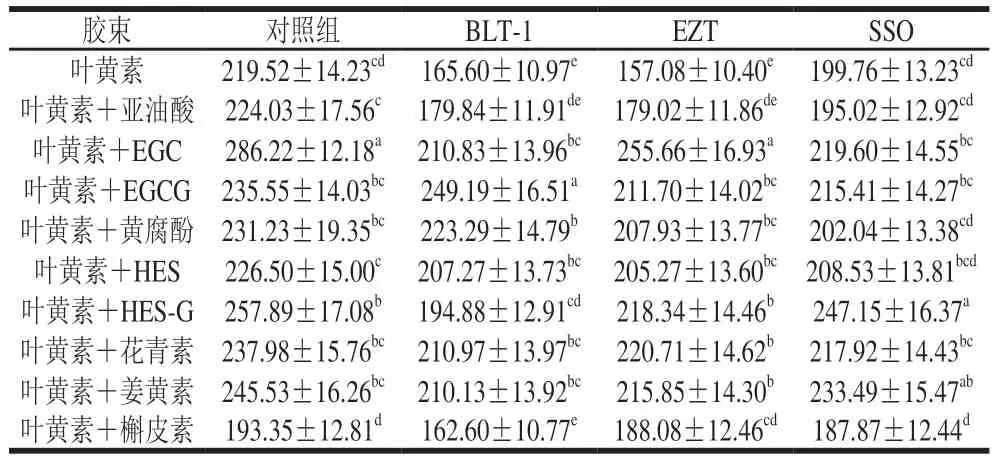
表2 多酚对细胞吸收叶黄素水平的影响Table 2 Effects of polyphenols on the cellular absorption of lutein μg/L
2.4 多酚对叶黄素转运蛋白表达的影响
进一步研究了多酚对细胞膜蛋白NPC1L1、SR-BI、CD36蛋白表达的影响,结果如图2所示。SR-BI是细胞吸收叶黄素的主要转运蛋白。与对照组相比,多酚处理组显著提高了NPC1L1、SR-BI、CD36 3 种转运蛋白的表达,这进一步表明3 种蛋白均参与多酚促进细胞吸收叶黄素过程,与2.3节3 种蛋白抑制剂作用下细胞吸收叶黄素的结果相互印证。其中CD36蛋白表达水平增加最多,较对照组提高4.12~7.64 倍(P<0.05),SR-BI蛋白次之,较对照组提高10.4%~139.6%,NPC1L1蛋白最次,较对照组提高1.2%~79.6%。不同种类多酚对于3 种转运蛋白的表达影响不同,姜黄素最利于促进NPC1L1蛋白、SR-BI蛋白的表达。
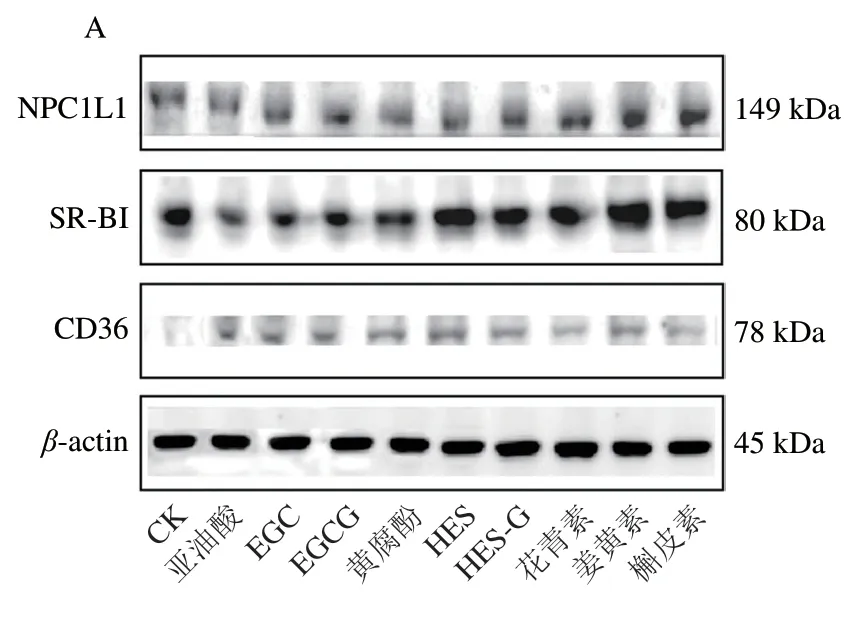
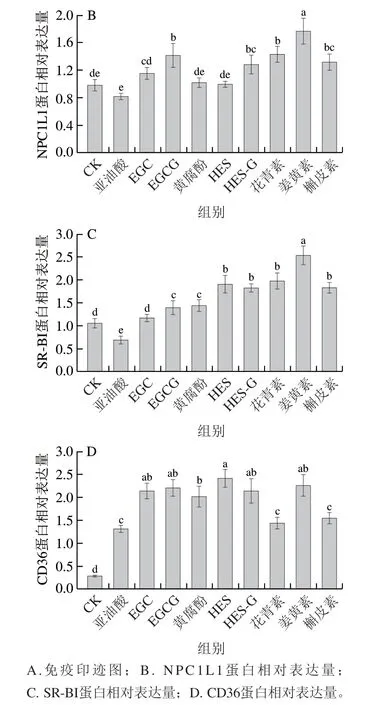
图2 多酚对叶黄素转运蛋白表达的影响Fig. 2 Effects of polyphenols on the expression of lutein transporter proteins
2.5 多酚对叶黄素小鼠体内代谢的影响
利用体外消化获得的叶黄素胶束溶液灌胃小鼠,研究不同多酚对叶黄素体内吸收的影响。如图3所示,加入不同种类多酚均可使小鼠肝脏、血浆中叶黄素水平显著增加(P<0.05)。与对照组相比,多酚处理组对叶黄素肝脏吸收的作用效果显著,与对照组相比提高2.36~7.27 倍,黄腐酚促进作用最为显著。与对照组相比,多酚处理组对血浆中叶黄素质量浓度的影响显著,与对照组相比提高11.1%~66.7%,其中黄腐酚的作用效果最明显,与亚油酸组相比提高54.5%(P<0.05)。
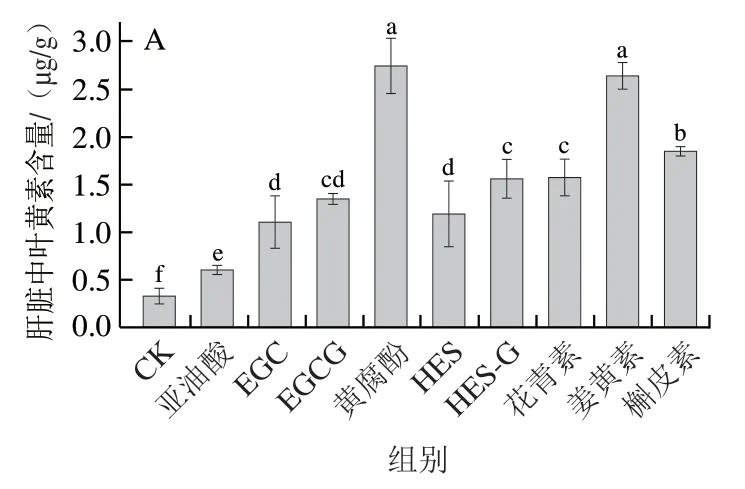
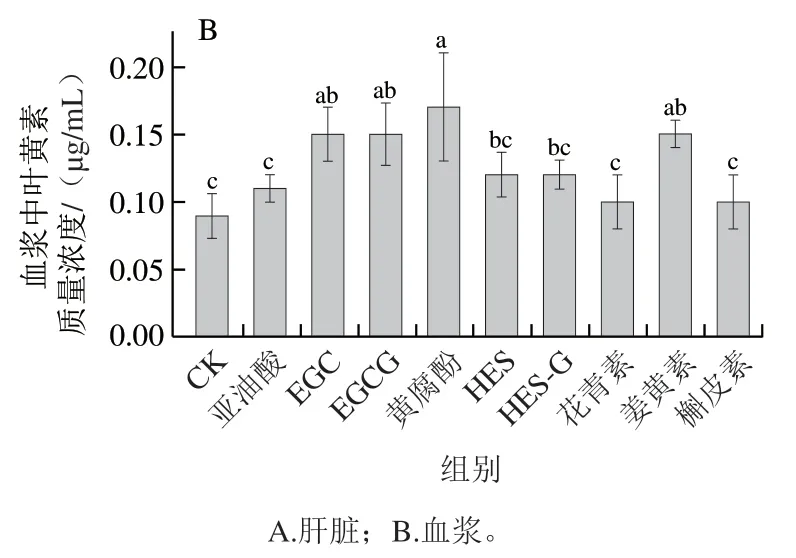
图3 多酚对叶黄素小鼠体内吸收的影响Fig. 3 Effect of polyphenols on the absorption of lutein in mice
3 讨 论
本研究发现多酚可以提高叶黄素的生物可及性,这与前期研究中柑橘黄烷酮可通过促进β-胡萝卜素样品脂滴水解来提高β-胡萝卜素生物可及性的结果[22]相一致。叶黄素生物可及性的提高可能与多酚促进脂滴水解有关。研究发现多酚可以作为液体中稳定脂滴的密集层,防止液滴收缩和合并[24],尺寸较小的脂滴比表面积大,使胰脂肪酶更容易附着,促进脂滴水解[12]。本研究中多酚通过吸附在脂滴表面,降低脂滴粒径,促进脂滴水解,进而有利于叶黄素掺入混合胶束。同时,本研究发现多酚可以减小叶黄素胶束的粒径和电位,使其更加稳定,避免其在胃肠环境中发生氧化降解,从而增加其在体外的生物可及性[25]。除此之外,消化液中的蛋白质可以和多酚形成共价复合物,这种共价复合物可以作为β-胡萝卜素的乳化剂来提高β-胡萝卜素乳化效果[26],促进胶束的形成。因此,含有酚羟基较多的EGC、EGCG、黄腐酚和HES在胃肠消化环境中更易与蛋白发生共价复合作用,进而增强了叶黄素的乳化效果,提高了叶黄素的生物可及性[27]。
本研究发现多酚可以显著提高细胞吸收叶黄素水平(表2),其中EGCG的作用效果较为明显,此结果与多酚诱导的叶黄素生物可及性的变化结果相一致(图1),这可能是由于多酚可以降低叶黄素胶束平均粒径(表1),这样也有利于叶黄素透过细胞。此外,多酚与细胞膜上的蛋白及脂质相互作用,激活靶蛋白调控细胞膜蛋白参与的信号通路[28]。通过本实验进一步研究发现,多酚可以促进NPC1L1、SR-BI、CD36叶黄素转运蛋白的表达,不同种类多酚对蛋白表达的影响不同,这可能是多酚结构的差异所导致。前期研究发现糖苷结构利于活化SR-BI蛋白[23]。本研究中EGCG、HES-G中具有糖苷键,这两种多酚对SR-BI的表达促进作用显著,与前期研究结果一致。本研究还发现黄腐酚和HES对SR-BI表达促进作用显著,可能是因为这两种多酚具有独特的甲氧基基团,有利于活化SR-BI蛋白。另外,多酚促进细胞吸收叶黄素还可能与多酚的抗氧化性有关,抗氧化性强可以抑制叶黄素的氧化变性,从而有利于细胞吸收叶黄素,而多酚的抗氧化性与酚羟基的数量呈正相关[29],本研究中EGCG的酚羟基数量最多,加入EGCG后叶黄素在细胞吸收过程氧化降解最少(图1),所以EGCG对叶黄素生物可及性影响最大。
最后,通过小鼠体内实验进行验证,结果表明多酚可以显著提高叶黄素体内吸收,黄腐酚对叶黄素体内吸收的作用效果提升最为显著。这可能是由于黄腐酚属于查耳酮类,在血浆中会被快速吸收,2 h左右达到最大血浆浓度,可以更快的发挥生理功能[30-31],促进小鼠吸收代谢叶黄素。本研究发现多酚促进叶黄素在小鼠体内吸收的结果与多酚促进叶黄素胶束化、细胞吸收的结果相一致,说明在多酚存在下,叶黄素乳化和肠道吸收都是调控叶黄素体内累积的重要环节,但是不同种类多酚之间的作用有所差异。
4 结 论
多酚可在消化的不同阶段促进叶黄素的吸收。在形成胶束阶段,多酚可以降低叶黄素溶液的平均粒径并提高ζ-电位绝对值,从而提高叶黄素的乳化效果和生物可及性;在肠道细胞吸收阶段,多酚可以提高SR-BI、NPC1L1和CD36蛋白的相对表达量,并促进Caco-2细胞对叶黄素的吸收;小鼠体内吸收代谢实验结果表明,多酚的加入可以使小鼠肝脏和血浆中叶黄素含量显著增加。本研究结果可为科学补充叶黄素提供一种新思路,亦可为开发叶黄素复配营养剂提供理论参考。
