2-羟丙基-β-环糊精/阿魏酸包合物对熏马肠中阴沟肠杆菌产酪胺的影响机制
2022-11-30黄亚丽李亚倬李蕊婷于红红卢士玲
黄亚丽,李亚倬,李蕊婷,于红红,卢士玲
(石河子大学食品学院,新疆 石河子 832003)
新疆熏马肠是一种自然发酵香肠,具有高蛋白水解活性和较长的成熟期,因此有利于微生物积累生物胺。酪胺是一种广泛存在于发酵肉制品中的生物胺[1],摄入过量可能会引起偏头痛、恶心、心血管疾病等[2-3]。欧洲食品安全局建议健康人群对酪胺的每日最大摄取量为600 mg,但服用经典单胺氧化酶抑制剂的人群每日最多可摄取酪胺6 mg[4]。食品中细菌通过酶解酪氨酸生成酪胺,已知肠杆菌、肠道球菌、乳酸杆菌等细菌在食品发酵过程中产生酪胺[5-6]。研究人员发现产生酪胺的基因由编码酪氨酸脱羧酶(tyrosine decarboxylase,tdcA)、酪氨酸/酪胺逆向转运体(tyrosine/tyramine antiporter,tyrP)、酪氨酸t-RNA合成酶(tyrosine t-RNA synthetases,tyrS)和Na+/H+逆向转运体(Na+/H+antiporter,nhaC)4 个基因组成[7],nhaC在酪胺生物合成中的作用仍未知[8]。
多酚作为一种抗菌剂具有潜在的应用价值,可提高肉制品的质量和安全性[9]。阿魏酸(ferulic acid,FA)是肉桂酸衍生物之一,是一种普遍存在于植物界的酚酸。Lemos等[10]证实,FA可以破坏蜡样芽孢杆菌的生物膜结构,从而抑制其生长。但FA水溶性差、光稳定性低从而影响其利用率[11]。研究表明包封技术能够有效保持多酚稳定性和利用率。Kfoury等[12]使用2-羟丙基-β-环糊精(2-hydroxypropyl-β-cyclodextrin,HP-β-CD)包埋苯丙烷类化合物,显著提高了其溶解度和光稳定性,分别为未包埋组的14 倍和44 倍。此外,Gong Liang等[13]研究HP-β-CD包埋丁香酚的抗真菌作用模式,发现包埋能够提高丁香酚在食品应用中的稳定性。然而,目前关于FA包合物HP-β-CD/FA对熏马肠产酪胺的抑制作用,及其对产酪胺基因表达影响的研究鲜见报道。
本实验研究HP-β-CD/FA包合物对阴沟肠杆菌(Enterobacter cloacae)L63生长、基因表达和酪胺积累的影响,明确HP-β-CD/FA包合物对新疆熏马肠中产酪胺途径机制的影响,以期提高熏马肠等发酵肉制品的安全性,为HP-β-CD/FA包合物应用于熏马肠及其他发酵肉制品提供一定理论依据。
1 材料与方法
1.1 材料与试剂
阴沟肠杆菌L63(GenBank登录号:MW386397)由石河子大学食品学院畜产品加工与安全控制中心实验室分离。
FA(反-4-羟基-3-甲氧基肉桂酸≥98%) 北京博鳌科技有限公司;HP-β-CD 上海麦克林生化试剂有限公司;丹磺酰氯、甲醇(色谱纯) 美国Sigma公司;乙腈(色谱纯) 赛默飞世尔科技(中国)有限公司;脑心浸液(brain heart infusion,BHI)、紫红胆盐葡萄糖琼脂(violet red bile glucose agar,VRBGA)、甘露醇盐琼脂(mannitol salt agar,MSA)和MRS(Man Rogosa Sharpe)琼脂培养基 青岛海博生物技术有限公司;TRIzol试剂(MagZolTMReagent) 美国Invitrogen公司;cDNA合成试剂盒 加拿大Applied Biological Materials公司;2×S6 Universal SYBR qPCR Mix 新贝(上海)生物科技有限公司;马肉、天然肠衣 新疆伊犁市伊卡孜有限公司。
1.2 仪器与设备
Beta 2-8 LD plus冷冻干燥机 德国Christ公司;IX71倒置荧光显微镜 日本奥林巴斯株式会社;Nicolet IS10傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)仪、ND-2000C超微量核酸测定仪 美国赛默飞世尔公司;H1M多功能酶标仪美国伯腾仪器有限公司;PHS-3C pH计 上海仪电有限公司;MX3000P实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪 美国安捷伦科技公司;LC-20AT高效液相色谱(high-performance liquid chromatography,HPLC)仪 日本岛津制作所;高速冷冻离心机 美国贝克曼公司;T25均质机 德国艾卡设备有限公司。
1.3 方法
1.3.1 HP-β-CD/FA包合物和物理混合物的制备
采用Hsu等[14]方法,准确称取0.58 g FA和4.6 g HP-β-CD分别溶解在10 mL无水乙醇和10 mL蒸馏水中,然后将FA溶液缓慢加入HP-β-CD溶液中,摇床室温(22~26 ℃)振荡24 h,将获得的澄清溶液4 ℃放置12 h。置于-80 ℃冰箱冷冻24 h,真空冷冻干燥12 h获得固体HP-β-CD/FA包合物。
物理混合物:FA和HP-β-CD按物质的量比1∶1置于研钵中研磨2 min,获得均匀的混合物。
1.3.2 HP-β-CD/FA包合物的表征
1.3.2.1 微观结构观察
取少量FA、HP-β-CD、HP-β-CD/FA包合物及其物理混合物分别放置在载玻片上,蒸馏水分散制成悬浊液并将盖玻片放置在顶部,使用倒置荧光显微镜观察并记录每个样品。
1.3.2.2 FT-IR分析
采用溴化钾压片法,取FA、HP-β-CD、HP-β-CD/FA包合物及其物理混合物与光谱级溴化钾混合(2 mg KBr/200 mg样品),每个样品粉末研磨5 min,在20 MPa下压制40 s,以获得1 mm透明颗粒,置于FT-IR光谱仪中扫描样品测定红外光谱吸收曲线。扫描范围4 000~400 cm-1,分辨率2 cm-1。
1.3.2.3 HP-β-CD/FA包合物和FA最低抑菌浓度的测定
使用微量肉汤稀释法[15],采用无菌96 孔板,每孔中加入100 μL BHI肉汤,同时制备质量浓度为100 mg/mL的HP-β-CD/FA包合物原液。将100 μL原液添加到第1行每孔中,然后从第1行每孔取100 μL与第2行相应孔中肉汤混合,再从第2行取100 μL与第3行相应孔肉汤混合,依次倍增稀释至第7行(第7行每孔中取100 μL弃用)。然后每孔中加入100 μL 106CFU/mL菌液,每组3 个复孔。使用仅含菌液培养基、仅含HP-β-CD/FA包合物原液培养基以及不含HP-β-CD/FA包合物和菌液培养基作为对照。96 孔板在37 ℃培养持续24 h。目测96 孔板孔中肉汤浊度未改变的质量浓度为最低抑菌浓度(minimal inhibitory concentration,MIC)。按相同方法测定FA的MIC。
1.3.2.4 阴沟肠杆菌L63生长量和pH值的测定
制备3 组菌液:L组:培养液中添加酪氨酸;L+MIC包合物组:培养液中添加酪氨酸和质量浓度为MIC的HP-β-CD/FA;L+FA组:培养液中添加酪氨酸和质量浓度为MIC的HP-β-CD/FA包合物中相同质量的FA;酪氨酸添加量均为0.2 g/100 mL。每组3 个重复,接入200 μL供试菌液在37 ℃下恒温培养,每组不添加供试菌作为阴性对照,48 h内每4 h采集样品一次(2 mL),测定OD600nm和pH值。
1.3.3 酪氨酸脱羧酶相关基因表达量的测定
1.3.3.1 RNA提取和cDNA合成
按照1.3.2.4节方法制备3 组培养物,接入供试菌后在37 ℃恒温培养48 h。根据于红红等[16]的方法激活酪氨酸脱羧酶(tyrosine decarboxylase,TDC)基因簇的转录,用MagZol试剂法从阴沟肠杆菌L63中提取总RNA。纯化的RNA样品在无RNA酶的水中重浮,分别在260 nm和280 nm波长处测定吸光度,以确定RNA浓度。采用1%琼脂糖凝胶电泳观察条带,以检测RNA完整性。然后根据cDNA合成试剂盒进行cDNA的合成。取2 μg符合要求的RNA加入2 μL AccuRT Reaction Mix(4×),加无酶水至终体积为8 μL,42 ℃孵育2 min,去除gDNA后加入2 μL AccuRT Reaction Stopper(5×),随后加入4 μL 5×All-in-One RT MasterMix和6 μL无酶水,反应终体积20 μL。20 ℃孵育10 min,42 ℃孵育15 min,85 ℃孵育5 min后终止反应,于冰上冷却。
1.3.3.2 实时荧光定量PCR检测基因表达
使用表1所列引物通过PCR分析cDNA样本。以引物对recA-F/recA-R和tuf-F/tuf-R作为参考。反应体系(总体积20 μL):2×S6 Universal SYBR qPCR Mix 10 μL,上、下游引物各0.4 μL和cDNA模板2 μL,加入无酶水补至20 μL。每次实验中未加cDNA模板作为阴性对照。根据公式R=2−ΔΔCt计算基因相对表达量[17]。

表1 实时荧光定量PCR所用引物Table 1 Primers used for real-time PCR
1.3.4 酪胺质量浓度的测定
参考Lu Shiling等[21]的方法并作修改,采用HPLC法测定样品中的酪胺质量浓度。准确称取酪胺标准品10 mg,加入0.4 mol/L高氯酸溶液定容至5 mL,分别稀释成质量浓度10、20、50、100、200、400 μg/mL的标准溶液备用。按照1.3.2.4节方法制备3 组菌液样品,并在48 h内每4 h采集2 mL菌液,然后12 000×g离心10 min,取1 mL上清液加入200 μL 2 mol/L NaOH溶液、300 μL饱和NaHCO3溶液和2 mL 5 mg/mL丹磺酰氯溶液,35 ℃暗反应45 min后加入100 μL氨水终止反应,然后乙腈定容至5 mL。过0.22 μm过滤器后进行HPLC分析。检测条件:Agilent C18柱(4.6 mm×250 mm),柱温30 ℃,上样体积20 μL,流动相A超纯水、流动相B乙腈;按照黄笠原等[22]的程序进行梯度洗脱。
1.3.5 HP-β-CD/FA包合物对熏马肠中酪胺积累影响的研究
1.3.5.1 熏马肠的制备
原料肉去除淋巴、血管、筋膜等组织,优质瘦肉、肥肉质量比80∶20。在肉块表面喷涂体积分数75%乙醇溶液灼烧,紫外灯照射30 min灭菌。将原料肉切成边长1~2 cm块状,以肉质量计,加入2.0%食盐、2.0%白糖、0.1%味精、0.2%姜粉、0.1%八角、0.1%胡椒粉、0.15%花椒粉、0.1%五香粉和0.01%亚硝酸钠充分混匀,再加入1%烟熏液搅拌均匀。4 ℃下腌制1 h,用灌肠机将已调味的肉粒灌入天然肠衣内,灌肠要求饱满,过程中用牙签扎孔,保证肠内无空气。
制备5 组熏马肠:A组:空白;B组:添加质量浓度为MIC的HP-β-CD/FA;C组:接种103CFU/mL阴沟肠杆菌L63;D组:接种103CFU/mL阴沟肠杆菌L63和质量浓度为MIC的HP-β-CD/FA;E组:接种103CFU/mL阴沟肠杆菌L63和质量浓度为MIC的HP-β-CD/FA包合物中相同质量的FA。以上菌株接种量均为3%(以熏马肠质量计),每组3 个重复。制作完成后于恒温恒湿培养箱中发酵,分别在0、3、7、14、21、28 d取样进行指标测定,每个处理平行测定3 次。发酵条件如表2所示。

表2 熏马肠的发酵条件Table 2 Fermentation conditions of smoked horsemeat sausage
1.3.5.2 微生物计数
在无菌条件下称取10 g熏马肠样品加入90 mL生理盐水,拍打机拍打20 min直至样液在无菌生理盐水中完全浑浊,按照Yu Honghong等[23]的方法采用平板计数法,连续稀释后在选择培养基上涂布,分别对肠杆菌科、肠球菌、乳酸菌(lactic acid bacteria,LAB)计数。
1.3.5.3 熏马肠pH值的测定
采用无菌拍打袋称取熏马肠样品10 g,加入90 mL生理盐水,拍打机拍打20 min使样液在无菌生理盐水中完全浑浊,静置沉淀后用pH计测定上清液pH值。
1.3.5.4 熏马肠生物胺质量浓度的测定
取5 g熏马肠样品加入0.4 mol/mL 20 mL高氯酸溶液后均质,于10 ℃、5 000 r/min均质10 min,取上清液;再次重复上述操作,将上清液用乙腈定容到50 mL。取1 mL处理好的样品液按1.3.4节方法测定酪胺质量浓度。
1.4 数据处理与分析
所有实验均重复3 次,结果以平均值±标准差表示。使用GraphPad Prism 9.0.0软件采用单因素方差分析和邓肯多范围检验进行组间显著性差异比较,P<0.05被认为具有统计学意义。
2 结果与分析
2.1 FA、HP-β-CD、HP-β-CD/FA包合物和物理混合物的微观形貌观察结果
经冷冻干燥法制备的HP-β-CD/FA包合物外观为淡粉色粉末,略有FA气味。如图1所示,FA为短柱状晶体,而HP-β-CD呈球形结构;FA和HP-β-CD的物理混合物保留了二者原始形态,物理混合后没有发生形态变化,表明物理混合仅为叠加;而HP-β-CD/FA包合物的表面形貌与FA和HP-β-CD均不同,呈不规则块状结构且变化明显,表明包合物形成。Zhong Yuanyuan等[24]也报道了类似结果,进一步证实HP-β-CD/FA包合物的形成。


图1 FA(A)、HP-β-CD(B)、物理混合物(C)和HP-β-CD/FA包合物(D)的微观图像Fig. 1 Micrographs of FA (A), HP-β-CD (B), physical mixture (C), and HP-β-CD/FA inclusion complex (D)
2.2 FA、HP-β-CD、HP-β-CD/FA包合物和物理混合物的FT-IR分析结果
如图2所示,FA在3 436 cm-1处存在O—H键的伸缩振动、1 620~1 433 cm-1处存在C—C键的伸缩振动[25];此外,1 691cm-1处为芳香共轭羰基特征峰,804 cm-1和851 cm-1处的锐带是由FA苯环上两个相邻氢原子引起[26]。HP-β-CD在2 931 cm-1处表现出明显的C—H伸缩振动吸收峰[27],在1 155 cm-1和1 033 cm-1处表现出显著的C—O伸缩振动吸收峰[24]。与单组分相比,物理混合物的FT-IR光谱没有显著变化,表现为FA和HP-β-CD特征峰的叠加。然而,HP-β-CD/FA包合物的FT-IR光谱与FA显著不同,由于羟基数量改变,HP-β-CD/FA包合物在3 436 cm-1附近的宽峰强度增加[28],位于FA上1 691、1 620、1 516 cm-1和851 cm-1的特征峰发生位移且强度减小,而位于1 433 cm-1和804 cm-1处的峰则完全被HP-β-CD的峰掩盖。表明FA成功进入HP-β-CD形成包合物,这与显微观察结果一致。
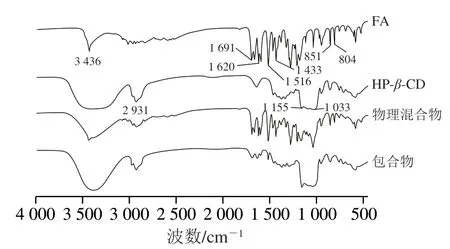
图2 FA、HP-β-CD、物理混合物和HP-β-CD/FA包合物FT-IR图Fig. 2 FT-IR spectra of FA, HP-β-CD, physical mixture and HP-β-CD/FA inclusion complex
2.3 HP-β-CD/FA包合物和FA对阴沟肠杆菌L63的MIC
研究表明FA对革兰氏阳性菌、革兰氏阴性菌和酵母菌具有较强的抗菌活性[29],并对一些人体胃肠道菌群表现出强烈的抑制作用,如大肠杆菌、肺炎克雷伯菌、产气肠杆菌、铜绿假单胞菌和幽门螺杆菌等[30]。如表3所示,HP-β-CD/FA包合物质量浓度不同对供试菌的抑制效果不同。FA对阴沟肠杆菌L63的MIC为0.781 mg/mL。此前,赵利利等[31]报道FA对大肠杆菌和蜡状芽孢杆菌的MIC分别为0.31 mg/mL和0.63 mg/mL,表明大肠杆菌和蜡状芽孢杆菌对FA的敏感度要高于阴沟肠杆菌L63。王丽平[32]研究发现,FA包合物对大肠杆菌、金黄色葡萄球菌和蜡状芽孢杆菌的MIC分别为1.25、5 mg/mL和2.5 mg/mL。本研究中HP-β-CD/FA包合物对阴沟肠杆菌L63的MIC为3.125 mg/mL。Chan等[33]研究发现,6 种酚类植物提取物对5 种常见食源性致病菌的MIC范围在0.31~2.5 mg/mL之间,低于本研究结果,这可能是因为酚类和供试菌的不同,也可能由于FA被β-CD包埋。
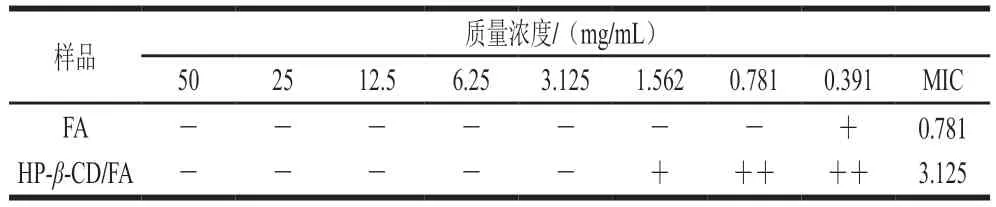
表3 HP-β-CD/FA包合物和FA对阴沟肠杆菌L63的MICTable 3 MICs of HP-β-CD/FA inclusion complex and FA against E. cloacae L63
2.4 HP-β-CD/FA包合物对阴沟肠杆菌L63生长量和pH值的影响
如图3A所示,供试菌OD600nm为L组>L+FA组>L+MIC包合物组,说明HP-β-CD/FA包合物对阴沟肠杆菌L63生长有一定的抑制作用。FA包埋后抑制效果更明显,这可能是因为FA包埋后释放缓慢,同时在介质中扩散性增强[10]。添加HP-β-CD/FA包合物延缓了供试菌的生长期和对数期,整个时期生长趋势没有改变,培养48 h,L+MIC包合物组OD600nm较L组降低了63.67%,这与Hsu等[14]的研究结果类似。
如图3B所示,培养48 h期间,L组pH值逐渐升高,这可能是由于酪氨酸在TDC作用下脱羧产生酪胺;L+FA和L+MIC包合物组的pH值先略下降,随后逐渐升高,这表明初期酸性物质的产生速率略高于酪胺的产生速率,与于红红等[16]研究结果一致。L+FA和L+MIC包合物组的pH值均低于L组,表明FA和HP-β-CD/FA包合物均抑制了阴沟肠杆菌L63的生长,进而减缓了酪胺积累,添加HP-β-CD/FA包合物的抑制效果更明显。Hu Yongjin等[34]报道混合发酵剂培养可快速降低pH值,并抑制酪胺的累积。部分学者认为,快速降低pH值有利于控制生物胺的产生[35]。
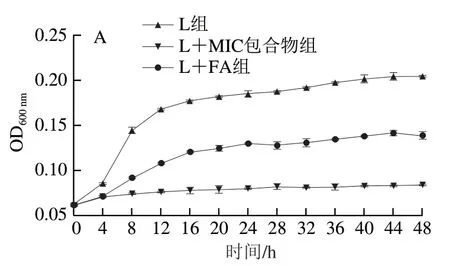
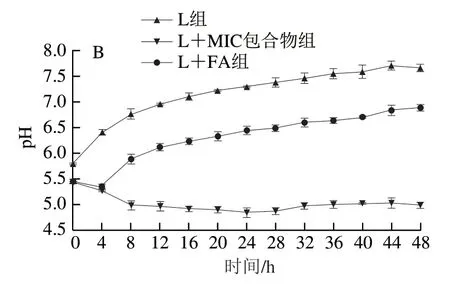
图3 HP-β-CD/FA包合物在48 h内对阴沟肠杆菌L63 OD600 nm(A)和pH值(B)的影响Fig. 3 Effects of HP-β-CD/FA inclusion complex on OD600 nm (A) and pH (B) of E. cloacae L63 during 48 h of culture
2.5 HP-β-CD/FA包合物对TDC簇中相关基因表达的影响
酪胺产生基因的排列顺序依次为tyrS、tdcA、tyrP、nhaC[36]。由图4A可知,与L组相比,添加L+MIC包合物显著抑制tdcA和tyrP基因在阴沟肠杆菌L63中的表达。相反,tyrS和nhaC的转录不受HP-β-CD/FA包合物的调控。L组中tdcA、tyrP和nhaC表达水平较高,tyrS的转录未显著表达。Linares等[37]观察到在大肠杆菌的TDC基因簇中tyrS表达取决于酸性pH和酪氨酸缺乏,tyrS的过表达不影响tdcA的表达。此外,tdcA和nhaC起始密码子的上游存在假定的启动子和终止子[38],tdcA和tyrP之间没有假定的启动子和终止子[39]。这表明tdcA和tyrP的表达可能是独立的,tyrS和nhaC在酪氨酸脱羧途径中不是必需的[40]。酪胺由tdcA和tyrP蛋白相互作用形成,tdcA依赖磷酸吡哆醛催化酪氨酸脱羧生成酪胺并释放CO2[41];tyrP作为一种特殊的膜逆向转运蛋白,不仅促进酪氨酸的摄取和酪胺的释放,还可以在没有酪胺交换的情况下将酪氨酸转运到细胞中,但速率较慢[18]。本研究中,与FA相比,HP-β-CD/FA包合物较FA更显著地抑制了阴沟肠杆菌L63中tdcA和tyrP的表达。通过降低pH值,HP-β-CD/FA包合物也可以间接影响tdcA和tyrp基因的转录表达,从而减少酪胺积累。
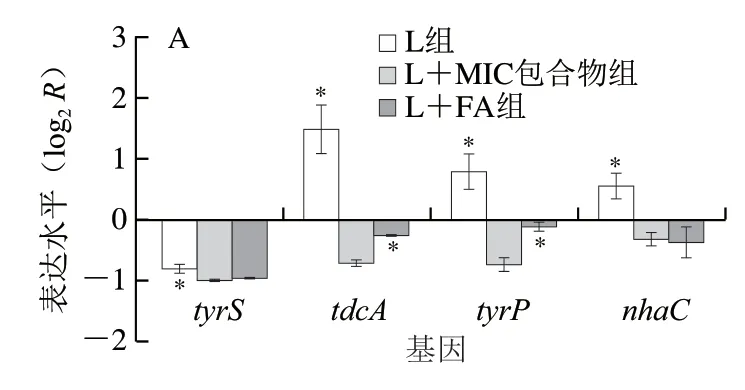
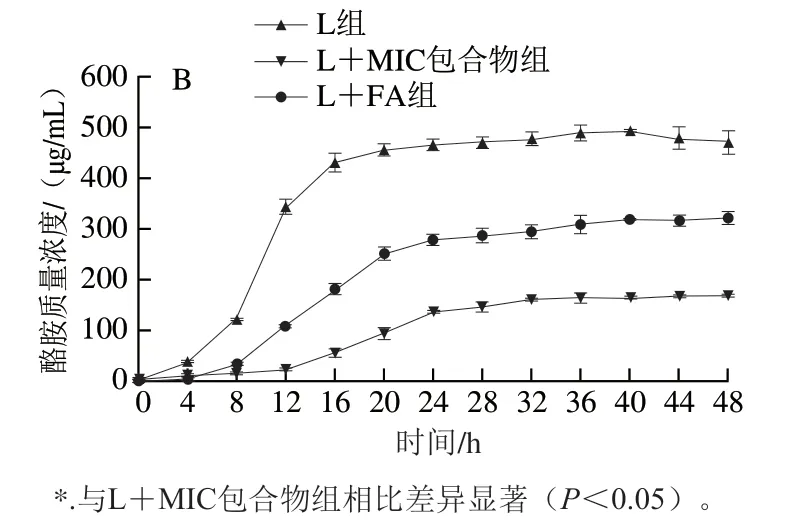
图4 HP-β-CD/FA包合物对阴沟肠杆菌L63中TDC相关基因表达(A)和酪胺积累(B)的影响Fig. 4 Effects of HP-β-CD/FA inclusion complex on the expression of TDC-related genes (A) and tyramine accumulation (B) in E. cloacae L63
2.6 HP-β-CD/FA包合物对阴沟肠杆菌L63酪胺积累的影响
如图4B所示,在8~20 h,酪胺质量浓度明显增加;稳定期酪胺积累速率明显减慢,质量浓度逐渐趋于稳定,48 h时L组中酪胺质量浓度为471.414 μg/mL。Zhang Qiuqin等[9]证明玫瑰多酚可抑制生物胺的形成和细菌腐败生长。于红红等[16]报道百里香微胶囊可以抑制摩根氏菌ND和变形杆菌R3的生长,分别有效减少了61.08%和55.89%的组胺积累。相同培养时间下,L+MIC包合物组酪胺质量浓度明显低于L+FA组,这说明FA包埋后抑制效果更好,培养48 h时,与L组相比,L+MIC包合物组酪胺积累减少了64.46%,优于之前研究中添加发酵剂的抑制效果[42-43]。结果证实HP-β-CD/FA包合物能显著抑制阴沟肠杆菌L63的生长和tdcA、tyrP基因的转录,有效减少酪胺的积累。
2.7 HP-β-CD/FA包合物对熏马肠中酪胺积累的影响
2.7.1 微生物分析
如表4所示,0~7 d肠球菌和LAB数量逐渐增加,第14天时略有降低。LAB为整个发酵期间的优势菌。第28天时,A、D、E组的LAB数量没有显著差异,B组的LAB数量显著高于A组(P<0.05),这说明HP-β-CD/FA包合物对LAB的生长可能有促进作用。此前,Zhao Danyue等[44]研究表明葡萄多酚可以促进LAB的生长。此外,HP-β-CD/FA包合物抑制了肠杆菌科的生长,但没有表现出明显的杀菌活性,Lu Shiling等[45]在不同植物提取物对熏马肠影响的研究中得到了类似结果。在第28天发酵成熟时,B、D组中肠杆菌科数量较A、C组显著降低,表明HP-β-CD/FA包合物能够抑制肠杆菌科微生物的生长。D组中肠杆菌科数量低于E组,表明HP-β-CD/FA包合物对肠杆菌的抑制效果较FA更显著。HP-β-CD/FA包合物通过干扰细胞膜磷脂,破坏其生物膜结构,导致细胞膜通透性增强,细胞质渗出,从而达到抑菌效果[46]。因此,HP-β-CD/FA包合物的高抗菌性能归因于FA的缓慢释放和更好的溶解性,使其具有更稳定的抑菌作用。
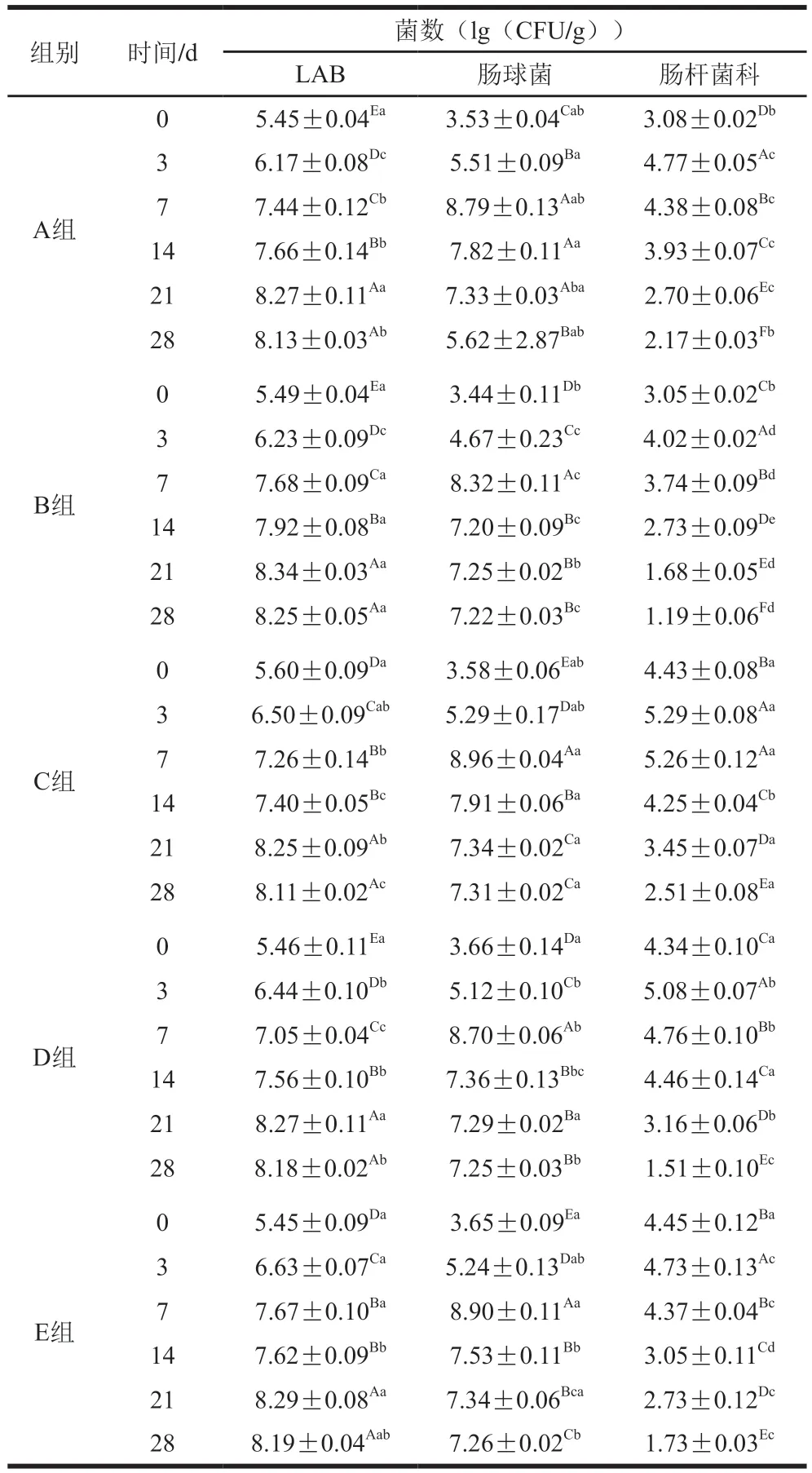
表4 熏马肠成熟过程中微生物计数Table 4 Microbial counts during ripening of smoked horsemeat sausage
2.7.2 熏马肠的pH值
pH值是影响肉制品中生物胺生成的一个重要因素。pH值对细菌污染、酵母菌生长以及发酵速率有抑制作用[45]。正常情况下,新鲜马肉的pH值为5.5~6.2。如图5A所示,5 组熏马肠的初始pH值在5.32~5.47之间。在0~3 d时pH值迅速下降,这是由于微生物分解碳水化合物为乳酸或发酵过程中氨基酸脱氨转化为有机酸[47]。在发酵7 d开始pH值缓慢回升,这可能是因为微生物发生脱羧或脱氨反应积累生物胺从而抵抗酸性环境。此外,B、D和E组的pH值低于A、C组,说明加入FA和HP-β-CD/FA包合物均能够有效降低熏马肠pH值,抑制腐败菌生长;此外,D组pH值低于E组,说明FA包埋后的抑制效果较FA更显著。
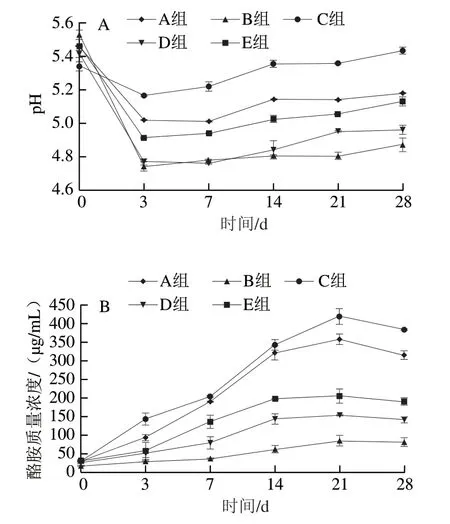
图5 熏马肠发酵期间pH值(A)和酪胺质量浓度(B)的变化Fig. 5 Changes in pH (A) and tyramine content (B) in smoked horsemeat sausage during fermentation
2.7.3 酪胺质量浓度
如图5B所示,在0~21 d酪胺质量浓度明显增加,第21天时A组和C组中检测到较高质量浓度的酪胺,第28天时略有下降,分别下降至315.94 μg/mL和384.19 μg/mL,这可能是因为熏马肠中某些微生物产生了生物胺氧化酶,降低了生物胺含量[48]。Zhao Lili等[49]证明,在发酵和成熟过程中,FA可以减少熏马肉中32.17%的组胺。薛林林等[50]报道FA分别减少了屎肠球菌和粪肠球菌中19.9%和27%的酪胺积累。第28天时,与C组相比,D组酪胺质量浓度减少了63.27%,E组酪胺质量浓度仅减少49.61%。这些结果表明,与FA相比,HP-β-CD/FA包合物在减少酪胺积累方面更有效。Li Lu[42]和Dias[51]等研究不同葡萄球菌和乳杆菌作为发酵剂对生物胺积累的影响,结果发现酪胺积累量仅减少了7.45%~29.24%。本研究中,发酵结束时B组酪胺积累量较A组减少74.34%。HP-β-CD/FA包合物抑制产酪胺相关基因以及tdcA和tyrP表达的细菌生长,从而减少酪胺形成。因此,添加HP-β-CD/FA包合物是抑制腐败菌(肠杆菌科)生长和减少酪胺积累的有效途径,有助于提高熏马肠的安全性。
3 结 论
添加HP-β-CD/FA包合物抑制肠杆菌效果好于FA,能够明显降低pH值,减少酪胺含量,以及TDC基因簇的表达。在纯菌体系中HP-β-CD/FA包合物对tyrS和nhaC基因表达影响不显著,但能显著抑制tdcA和tyrP基因的转录。在熏马肠中添加HP-β-CD/FA包合物能降低pH值,减少酪胺积累,添加MIC HP-β-CD/FA包合物与空白对照组相比酪胺积累减少74.34%。总之,HP-β-CD/FA包合物能够有效抑制酪胺积累和tdcA和tyrP基因表达,本实验可为提高传统新疆熏马肠和其他发酵肉制品的安全性提供一定理论依据。
