骨髓源肥大细胞通过甘露糖受体识别FMDV-VLPs的细胞因子应答
2022-11-29韩伟建张俊娟张义明王家鑫李丽敏
韩伟建,张俊娟,张义明,王家鑫,李丽敏
(河北农业大学动物医学院,保定 071000)
肥大细胞(mast cells,MCs)广泛分布于皮肤与黏膜等部位的结缔组织中,与树突状细胞和巨噬细胞共同构成机体抵御病原体的第一道防线,并构成固有免疫和适应性免疫应答之间的桥梁[1]。MCs可以快速识别入侵的病原体并协助启动免疫应答。一旦活化, MCs可以迅速释放大量的免疫介质,包括细胞因子、趋化因子、蛋白酶和抗菌肽[2],例如干扰素、TNF-α、IL-1α、IL-1β、IL-4、IL-6、IL-8、IL-10、IL-17、CCL2、CCL3、CCL5等[3]。这些介质可以激活免疫和非免疫细胞,并对其周围的细胞功能进行调节[4]。
MCs分泌细胞因子需要其表面的识别受体识别相应的配体。MCs可通过多种模式识别受体(pattern recognition receptors, PRRs)识别病原体,包括TLR样受体(toll-like receptors, TLRs)[5]、甘露糖受体(mannose receptors, MR)、NOD样受体(nod-like receptors, NLR)、清道夫受体(scavenger receptor, SR)和CD48等受体[6]。MCs可以通过TLRs和RIG-I受体识别病原体,分泌细胞因子发挥调节作用及抗病毒作用[7-8]。MR是C型凝集素受体家族重要成员之一,不仅可以识别病原体表面的甘露糖、岩藻糖等,还可以识别病毒的结构蛋白[9],从而诱导机体产生抗微生物免疫应答。有研究表明,MCs可以通过MR识别百日咳杆菌并分泌TNF-α、IL-6和IFN-γ[10]。MCs分泌的TNF-α 在细菌感染过程中可以招募DC及T细胞至引流淋巴结,从而促进抗原特异性免疫应答[4,11],而MCs分泌的IL-6以及MCs与B细胞的相互作用是机体分泌IgA的主要机制[12]。那么,MCs通过MR识别FMDV-VLPs 分泌的细胞因子表达情况如何?
口蹄疫病毒样颗粒(foot-and-mouth disease virus-like particles, FMDV-VLPs)目前已成为FMD的主要候选疫苗之一[13]。在FMDV衣壳的4个结构蛋白中,VP1可以刺激机体产生中和性抗体[14],而VP4是一种高度保守的结构蛋白,虽然位于病毒粒子的内部,但是在病毒的侵入过程中起了重要的作用[15],牛的多种单体型MHC分子都可以识别VP4蛋白的20-34位氨基酸序列[16]。因此,VP1和VP4被认为是研制通用型口蹄疫疫苗的理想后备抗原[17]。本实验室将VP1-VP4连接在HBcAg分子α螺旋上,构建了真核表达重组质粒pCMV-HA-HBcAg-VP1-VP4,并成功制备了FMDV-VLPs。因此,作为黏膜免疫主要成员的MCs识别FMDV-VLPs 分泌的细胞因子表达情况如何需要进行研究。
前期研究表明,重组FMDV VP1-VP4蛋白可以抑制腹腔肥大细胞(peritoneal mast cells, PMCs)分泌一系列细胞因子[18]。近年来,骨髓源肥大细胞(bone marrow-derived mast cells, BMMCs)被作为肥大细胞体外模型用于许多研究中,但BMMCs能否通过MR识别FMDV-VLPs产生免疫应答尚不清晰。所以,本研究用IL-3和SCF体外诱导得到高纯度的BMMCs,将其分为BMMCs组、MR抑制剂处理组,并负载FMDV-VLPs,利用蛋白芯片检测BMMCs上清中细胞因子表达,以揭示甘露糖受体在肥大细胞识别FMDV-VLPs 过程中发挥的作用,从而为新型口蹄疫疫苗研制提供新思路。
1 材料与方法
1.1 材料与主要试剂
CHO-K1细胞购自普诺赛生命科技有限公司;pCMV-HA质粒由河北农业大学动物医学院赵款老师提供;6~8周龄C57BL/6N小鼠购自维通利华实验动物技术有限公司; RPMI 1640购自美国Gibco公司;小鼠IL-3和SCF购自近岸蛋白质科技有限公司;非必需氨基酸、L-谷氨酰胺和甲苯胺蓝染液购自北京索莱宝科技有限公司;Mannan购自北京索莱宝科技有限公司;APC anti-mouse FcεRIα Antibody、APC Armenian Hamster IgG Isotype Ctrl Antibody、FITC anti-mouse CD117 (c-Kit) Antibody和FITC Rat IgG2b κ Isotype Ctrl Antibody购自美国BioLegend公司;Mouse Cytokine Array C6购自美国RayBiotech公司; T4 DNA Ligase购自美国Promega公司;PrimeSTAR®Max DNA Polymerase 2×、限制性内切酶EcoRⅠ和XhoⅠ购自日本TaKaRa公司;2×Es Taq MasterMix(Dye)购自北京康为世纪科技有限公司;Trans5α 购自北京全式金生物技术有限公司;胶体金标记羊抗兔IgG购自北京博奥森生物有限公司。
1.2 方法
1.2.1 重组质粒pCMV-HA-HBcAg-VP1-VP4的构建 以pcDNA3.1(+)-HBcAg-VP1-VP4为模板(该质粒为本实验室构建并保存,具体的构建策略请参见文献[19]),使用引物F:5′-CCGGAATTCACCATGGACATTGAC-3′,R:5′-CCGCTC-GAGTCAATGGTGATGGTG-3′,扩增目的片段HBcAg-VP1-VP4;用XhoⅠ和EcoRⅠ将扩增出的PCR产物进行酶切,使用T4 DNA Ligase将纯化后的酶切产物连接至pCMV-HA质粒(16 ℃连接过夜)。将重组质粒pCMV-HA-HBcAg-VP1-VP4转化到感受态细胞Trans5α,将PCR鉴定阳性的菌送至中科希林生物科技有限责任公司进行测序。
1.2.2 重组质粒pCMV-HA-HBcAg-VP1-VP4的表达与鉴定 按照重组质粒pCMV-HA-HBcAg-VP1-VP4与Lipofectamine 2000 Reagent(Invitrogen)的质量体积比为2∶1、1∶1、1∶2、1∶3配比,转染CHO-K1细胞后72、60、48和24 h,并以1∶10稀释的兔抗FMDV VP1-VP4多克隆抗体(以重组VP1-VP4蛋白制备的兔源多克隆抗体)为一抗37 ℃孵育1 h,PBS洗涤3次后,用1∶100稀释的FITC标记的山羊抗兔IgG 37 ℃孵育40 min,进行间接免疫荧光鉴定。
按照间接免疫荧光鉴定结果,使用重组质粒与Lipo 2000的质量体积比1∶1进行转染,收集转染后24、36、48和60 h的上清进行Western blot鉴定。聚丙烯酰胺凝胶电泳(SDS-PAGE)后转移至PVDF膜上;5% 脱脂牛奶4 ℃封闭过夜;使用1∶3 000稀释的His标签的单克隆抗体为一抗室温孵育3 h;TBST洗涤5次后,以1∶40 000稀释的山羊抗鼠IgG(辣根过氧化物酶标记)作为二抗,室温孵育1.5 h,TBST洗涤5次后,使用超敏ECL化学发光试剂盒室温避光显色3 min,使用化学发光凝胶成像仪进行成像。
1.2.3 FMDV-VLPs的表达与鉴定 按照重组质粒pCMV-HA-HBcAg-VP1-VP4与Lipo 2000的质量体积比为1∶1进行转染,48 h收集细胞上清,使用KTATMepure 蛋白纯化系统进行 Ni 柱亲合层析纯化重组蛋白。纯化后的FMDV-VLPs保存于-80 ℃备用。将蛋白变性后,进行SDS-PAGE电泳试验鉴定纯化效果。为了进一步验证纯化后的蛋白是否为目标蛋白,进行了Western blot鉴定:取纯化后的蛋白悬液 20 μL进行SDS-PAGE;转移至PVDF膜上,5% 脱脂牛奶4 ℃封闭过夜;使用1∶1 000稀释的兔抗FMDV VP1-VP4多克隆抗体为一抗室温孵育3 h;TBST洗涤5次后以1∶40 000稀释的HRP标记的山羊抗兔IgG作为二抗,室温孵育1.5 h,TBST洗涤5次后用DAB避光显色5 min。
对FMDV VLP进行胶体金免疫电镜鉴定,具体步骤如下:取0.5 mg·mL-1FMDV-VLPs 100 μL,加入100 μL 1∶1 000稀释的兔抗FMDV VP1-VP4 IgG, 37 ℃作用30 min; 加入0.01 mol·L-1PBS缓冲液1 mL,4 ℃,13 000 r·min-1离心20 min, 弃上清, 反复两次。最后一次离心弃去上清,用0.01 mol·L-1PBS缓冲液100 μL将沉淀重悬;悬液中加入50 μL 1∶50稀释的胶体金抗体,37 ℃孵育30 min;取0.01 mol·L-1PBS缓冲液1 mL加入混合物中,离心20 min,弃上清,重复此步骤一次,弃上清,用100 μL去离子水将沉淀重悬;将悬液加入到15 mL超滤管中,加12 mL去离子水混匀,4 000 r·min-1离心至500 μL,重复两次,最后一次离心至200 μL。将样品进行磷钨酸负染色,并在透射电子显微镜下观察。
1.2.4 小鼠BMMCs的制备及鉴定 小鼠BMMCs的收取及培养方法参照文献[18]进行:无菌条件下取骨髓细胞,用培养液(含10% FBS RPMI 1640培养基、0.1 mmol·L-1非必需氨基酸、2 mmol·L-1谷氨酰胺、10 ng·mL-1IL-3、20 ng·mL-1SCF)重悬细胞,调整细胞浓度为1×106个·mL-1,铺到直径10 cm细胞培养皿中,置于37 ℃、5% CO2培养箱中培养。每隔7 d更换培养液,每次收集上清中的细胞继续进行培养。
收集BMMCs悬液,调整细胞浓度为1×106个·mL-1,取20 μL的细胞悬液进行涂片;用4%多聚甲醛固定细胞3 min,然后用PBS(pH7.2)冲洗3次;滴1 mL 0.1%甲苯胺蓝染色30 s,用蒸馏水冲掉甲苯胺蓝溶液;300 mL·L-1乙醇-PBS(pH 7.2)分色至细胞质呈现蓝色,细胞核为紫红色,立即用蒸馏水冲洗;中性树脂封片,显微镜下观察。
取在体外培养了8周的BMMCs进行流式细胞术鉴定。将BMMCs调整细胞浓度为1×106个·mL-1。每个1.5 mL离心管中加入100 μL细胞悬液,加入含3% BSA的PBS稀释的抗体[终浓度为0.1 μg·mL-1的APC anti-mouse FcεRIα Antibody和FITC anti-mouse CD117 (c-Kit) Antibody,并用APC Armenian Hamster IgG Isotype Ctrl Antibody和FITC Rat IgG2b, κ Isotype Ctrl Antibody作同种型对照]。4 ℃避光孵育30 min。1 700 r·min-1离心5 min,弃掉上清,用含3% BSA、1%叠氮化钠的冰冷PBS溶液1 mL重悬,1 700 r·min-1离心5 min重复3次。使用流式细胞仪检测。
1.2.5 细胞因子芯片检测 将鉴定后的BMMCs按1×106·mL-1铺到24孔板中,每孔500 μL细胞悬液。将BMMCs分为3组,分别为MR抑制组(iMR-VLP组)、MR未抑制组(VLP组)和空白对照组(Control组),每组3个重复。MR抑制组的培养孔中加入终浓度为3 mg·mL-1的Mannan[19],2 h后,给MR体抑制组和MR未抑制组加入终浓度为20 μg·mL-1的FMDV-VLPs,空白对照组不做处理。将细胞培养板置于37 ℃,5% CO2培养箱中培养。24 h后收集细胞上清使用Mouse Cytokine Array C6试剂盒对细胞因子进行检测。
1.2.6 数据分析 使用Graphpad Prism 5对扫描数据进行One-way ANOVA统计学分析。P<0.05为差异显著,P<0.01为差异极显著,并做差异分析柱状图和热图。
2 结 果
2.1 重组质粒pCMV-HA-HBcAg-VP1-VP4表达与鉴定
2.1.1 表达与鉴定 将测序成功的重组质粒pCMV-HA-HBcAg-VP1-VP4按照不同条件染转染CHO-K1细胞,并进行间接免疫荧光和Western blot鉴定。结果显示:在转染后24 h,重组质粒与Lipo 2000质量体积比为1∶1的条件下重组质粒pCMV-HA-HBcAg-VP1-VP4的表达效率最高(图1);在48 h左右并且重组质粒与Lipo 2000质量体积比为1∶1的条件下,细胞上清中目的蛋白表达效率最高(图2)。
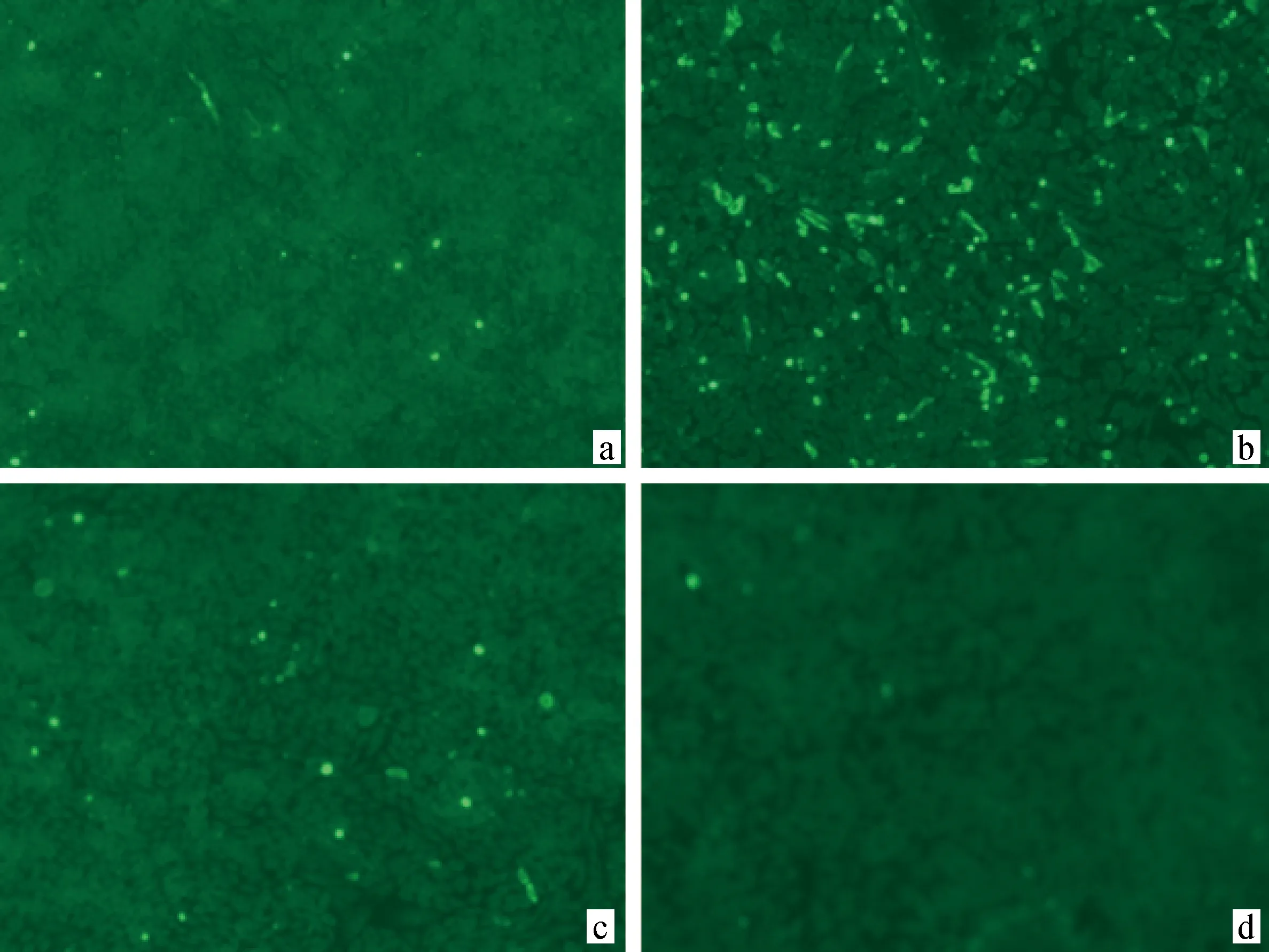
图1中a、b、c和d分别为质粒与Lipo 2000质量体积比为2∶1、1∶1、1∶2和1∶3的条件下,在24 h时细胞的间接免疫荧光鉴定结果

不同时相细胞上清的Western blot鉴定结果(重组质粒与Lipo 2000质量体积比为1∶1)。M.蛋白质相对分子质量标准;1、2、3、4分别为转染后24、36、48、60 h的细胞上清;5.未转染的细胞上清
2.1.2 纯化与鉴定 将重组质粒pCMV-HA-HBcAg-VP1-VP4按照与Lipo 2000质量体积比为1∶1转染CHO-K1细胞,在48 h收集细胞上清用镍柱进行纯化,然后进行SDS-PAGE鉴定和Western blot鉴定。SDS-PAGE的结果显示,在49.5 ku左右处出现了单一条带,与预期的大小相符,表明纯化效果较好(图3a);Western blot鉴定结果显示在49.5 ku左右处出现了一条特异性条带,提示纯化后的蛋白是目标条带(图3b)。为了鉴定重组质粒表达后是否自我组装成VLPs,进行了免疫透射电镜观察。结果显示,透射电镜下可以看到重组蛋白形成了颗粒,粒子直径大约为30 nm,并且在粒子周围,有直径10 nm左右胶体金颗粒附着(图3c),表明重组质粒成功组装成FMDV-VLPs。

a.SDS-PAGE鉴定结果(M.蛋白质相对分子质量标准;1.纯化前的细胞上清;2.纯化后的重组蛋白); b.Western blot鉴定结果(M.蛋白质相对分子质量标准;3.纯化后的重组蛋白);c.胶体金免疫电镜鉴定结果,黑色箭头为口蹄疫病毒样颗粒(约30 nm),红色箭头为胶体金颗粒(约10 nm)
2.2 小鼠BMMCs的甲苯胺蓝染色及流式细胞术鉴定
BMMCs通过甲苯胺蓝染色后,可见细胞质呈蓝色,细胞核呈紫红色,无脱颗粒现象(图4a);流式细胞术结果显示,FcεRIα和CD117双阳性的细胞占97.9%左右,表明制备的BMMCs纯度良好,符合试验要求(图4b)。
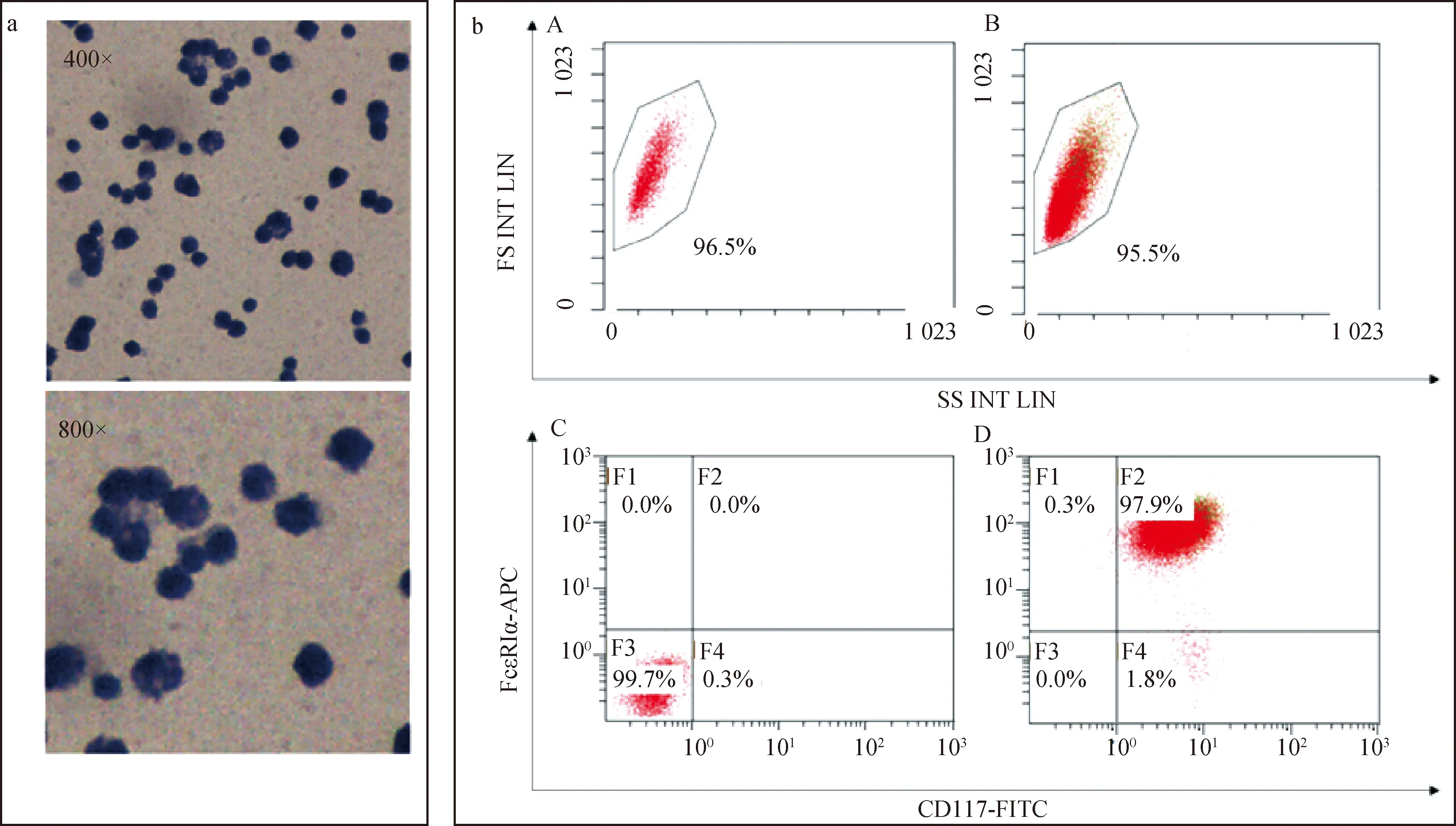
图4a为BMMCs甲苯胺蓝染色结果;图4b为BMMCs流式细胞术结果[A、B.使用FSC(正向散射)和SSC(侧散射)作为参数对BMMCs进行分析; C.使用APC Armenian Hamster IgG Isotype Ctrl 抗体和κ Isotype Ctrl 抗体作为同型对照;D.使用APC anti-mouse FcεRIα抗体和FITC anti-mouse CD117 (c-Kit) 抗体标记BMMCs,进行流式细胞术鉴定]
2.3 不同处理组BMMCs表达的细胞因子差异分析
为了分析细胞因子的差异变化,使用Image J软件对芯片检测结果进行灰度值(gray values)分析。结果显示,相比于control组,VLP组BMMCs分泌的CCL21、IL-9、IFN-γ、IL-2、IL-4、IL-15、IL-17A、IL-21、IL-12p70、TNF-α、IL-1α、CCL17和L-selectin显著上调(P<0.05);iMR-VLP组相比于VLP组,BMMCs分泌的IL-9、IL-10、CCL19和CCL21显著上调(P<0.05),而IFN-γ、IL-2、IL-4、IL-15、IL-21、IL-12 p70、IL-1α、CCL17和 TNF-α显著下调(P<0.05)(图5)。

*.P<0.05;**.P<0.01;***.P<0.001
2.4 不同处理组BMMCs的蛋白质表达谱检测结果
使用MeV软件对“2.3”得出的不同处理组BMMCs分泌的细胞因子的表达量进行聚类分析,作聚类热图(图6)。VLP组相比于Control组,IL-1、IL-2、TNF-α、IFN-γ和IL-12等Th1细胞因子以及IL-21、IL-4等Th2型细胞因子表达均发生了上调,而iMR-VLP组与VLP组相比,抑制MR后,IL-1、IL-2、TNF-α、IFN-γ和IL-12等Th1细胞因子以及IL-21、IL-4等Th2型细胞因子表达呈下调变化,CCL19、IL-9等却发生上调。结果表明,BMMCs的 MR受体在识别FMDV-VLPs过程中发挥着重要的调节作用。

图6 不同处理组BMMCs的蛋白质表达差异热图
3 讨 论
MR作为肥大细胞表面重要的模式识别受体,在肥大细胞执行其免疫调节功能中起着非常重要的作用[10,20]。因此,作者构建了重组pCMV-HA-HBcAg-VP1-VP4质粒,并且成功制备了FMDV-VLPs,用FMDV-VLPs负载经过甘露糖受体抑制剂处理的BMMCs,检测上清中细胞因子的表达,以此来阐释甘露糖受体在骨髓源肥大细胞识别FMDV-VLPs过程中的作用。
在抗FMDV感染的过程中,IFN-γ和TNF-α发挥重要的作用。IFN-γ负责调控FMDV感染的免疫应答和抑制FMDV的复制,而TNF-α能够促进固有免疫向适应性免疫的转变,可以通过Th1通路激活T细胞,促使细胞免疫应答的发生[21];IL-10是主要的抑制炎症的细胞因子,在FMDV感染的过程中,猪血清中的IL-10逐渐升高,在3、4 d达到顶峰,抑制T细胞和B细胞的增殖,因此,IL-10升高被认为与FMDV感染时的免疫抑制有关[22];IL-6是一种多效细胞因子,在激活和调节免疫反应中起重要的作用,研究表明,在FMDV感染的过程中,仔猪外周血IL-6会有明显的升高,推测其可能与不同年龄FMDV致病性差异有关[21]。
先前的研究表明, 重组FMDV VP1-VP4蛋白负载腹腔肥大细胞(PMCs)后CCL19、L-selectin、CCL17和TNF-α等34个蛋白的表达水平显著低于对照组(P<0.01);而抑制PMCs的MR后再负载VP1-VP4蛋白,TNF-α、IL-6、CCL19、IL-15、IL-9等功能分子的表达显著升高[18]。而本研究结果显示,负载VLPs后BMMCs分泌的TNF-α、IL-1、IL-4、IL-15、IFN-γ、IL-2、CCL17等细胞因子的表达显著高于对照组(图6),相比于负载FMDV-VLPs且MR未抑制组(VLP组),MR受体抑制组(iMR-VLP)的BMMCs分泌的TNF-α、IL-1、IL-4、IL-15、IFN-γ、IL-2等细胞因子均有明显下降的趋势,而IL-9、CCL19、CCL21等细胞因子的分泌则有明显上升的趋势(图5、6)。其中IL-1a、IL-2、INF-γ、TNF-α、IL-17、IL-15等Th1细胞因子,可促进炎症形成,并促进细胞免疫应答,有利于病原清除;IL-4和IL-10为Th2 细胞因子,可以抑制炎症形成并有助于B细胞的增殖与分化;CCL17、CCL19和CCL21为趋化因子,主要功能是在炎症和免疫应答过程中介导淋巴细胞的迁移。造成细胞因子分泌差异的可能原因:1)VLPs 在一定程度上可以缓解重组VP1-VP4蛋白带来的免疫抑制。2)可能与肥大细胞本身有关。骨髓干细胞在IL-3和SCF共同诱导下可以分化成均质较成熟的BMMCs,和PMCs均为结缔组织型肥大细胞[23-24]。而直接从腹腔细胞中利用Percoll分离液分离的腹腔肥大细胞虽然经甲苯胺蓝染色检测纯度较高,但是利用CD117及FcεRIα 抗体鉴定显示纯度较低(数据没有列出)。研究表明,与BMMCs相比,PMCs活化后不分泌或分泌少量的新合成的促炎因子,比如TNF-α和IL-6,但是IL-4、IL-10 和IFN-γ 两者之间没有差异[25]。并且,转录组学研究结果表明,IL-3诱导形成的BMMCs与成熟的PMCs的转录本在促炎因子方面,PMCs明显低于BMMCs[26]。本研究中不同处理是否会影响甘露糖受体在BMMCs的表达以及该受体在BMMCs 和PMCs上表达是否有差异有待进行深入研究。
目前,体外培养MCs是研究肥大细胞生物学作用的重要方法。一般分为从腹腔分离PMCs和从骨髓中分离不成熟的MCs前体细胞,体外分化为成熟的BMMCs[26]。Akula等[23]发现,虽然相比于BMMCs,PMCs中一些细胞因子或者细胞因子受体几乎不表达,包括IL-1β、IL-6、IL-10受体α链、IL-4受体α链、IL-2受体α链、TGF-β受体等,但是BMMCs与PMCs均表现出结缔组织型肥大细胞的特性。并且,使用IL-3和SCF联合诱导比IL-3单独诱导形成的BMMCs 成熟度更高[23,27]。PMCs可以从腹腔直接分离得到,但数目很低(约1×105个·只-1小鼠),不仅难满足试验需求,而且纯度变化大;腹腔细胞可以在体外继续培养8周,可以得到成熟的纯度较高的肥大细胞(PCMCs)[23]。骨髓干细胞在IL-3和SCF的诱导下可以分化成比较成熟BMMCs(5~8周),纯度很高且细胞数目可以满足试验需求。鉴于不同组织中的MCs在不同组织中甚至同一组织中不同部位的表型不完全相同,体外培养的 BMMCs 与体内的MCs存在的一定差异[23,28],并且不同的刺激亦影响MCs的表型,体外研究应该结合体内试验以得出更加科学的结论。
4 结 论
BMMCs可以通过MR识别FMDV-VLPs,促进IL-1α、IL-2、IL-4、IL-15、IL-17A、TNF-α、IFN-γ、CCL-17和L-Selectin表达,下调IL-9、IL-10、CCL19和CCL21的表达,表明FMDV-VLPs可能通过BMMCs的甘露糖受体增强Th1型细胞因子分泌、有效抑制能引起免疫抑制的IL-10的分泌,并降低介导T细胞再循环的CCL19和CCL21的形成。这为基于MCs的甘露糖受体应答效应的口蹄疫新型疫苗的研发提供了理论依据和新思路。
