牛坏死杆菌43K OMP基因缺失株生物学特性分析
2022-11-29赵鹏宇王天硕于思雯肖佳薇贺显晶郭东华
蒋 凯,赵鹏宇,王天硕,于思雯,毕 栏,肖佳薇,贺显晶,郭东华
(黑龙江八一农垦大学,大庆 163319)
坏死杆菌(Fusobacteriumnecrophorum)是一种无鞭毛、无芽孢、严格厌氧的多形性革兰阴性菌,其常驻于人类或动物的口腔、消化道和泌尿生殖道[1-2]。坏死杆菌作为机会主义病原可以引起反刍动物的腐蹄病、犊牛白喉、肉牛肝脓肿、奶牛乳腺炎和马的呼吸道感染等坏死性化脓性疾病,也会引起人化脓性血栓颈静脉炎为主的Lemierre’s综合征,同时可诱发结肠癌[3-5]。因此,坏死杆菌感染给畜牧业造成了巨大的经济损失并威胁人类的健康与安全,对其致病机制的研究具有重要现实意义。
坏死杆菌的毒力因子主要包括白细胞毒素、内毒素、黏附因子和一些胞外酶等。其中白细胞毒素被认为是坏死杆菌的主要毒力因子,它对中性粒细胞、巨噬细胞和肝细胞有毒害作用,并且对人和反刍动物的中性粒细胞具有特异性损伤[6-7]。但针对坏死杆菌白细胞毒素制备的亚单位疫苗保护效果不佳,有必要对坏死杆菌其他毒力因子或功能蛋白进行拓展性研究。黏附因子也是坏死杆菌的主要毒力因子之一,外膜蛋白(out membrane proteins, OMPs)在革兰阴性菌黏附过程中发挥重要作用,也参与营养介导、耐药性和生物被膜形成等生物过程[8]。2013年,Sun等[9]首次在牛坏死杆菌H05菌株上鉴定43K OMP,并发现其与同菌属的具核梭杆菌外膜蛋白FomA同源性达70.22%,且与其他梭菌属的OMPs具有高度保守性。对比坏死杆菌的Fnn亚种和Fnf亚种的主要OMPs,发现Fnn亚种OMPs显著性条带为40 ku,Fnf亚种OMPs则为37.5 ku,这也解释了Fnn亚种和Fnf亚种坏死杆菌毒性的差异[10-11]。同时,43K OMP在牛羊腐蹄病临床分离株中广泛存在[12]。利用抗体抑制试验和蛋白竞争试验发现,43K OMP在坏死杆菌黏附宿主细胞中可能发挥潜在作用,利用43K OMP截短表达制备的多抗,初步筛选了43K OMP的黏附功能区[13]。而有关于43K OMP在坏死杆菌致病中的其他生物学功能尚未可知,因此,本实验室通过构建牛坏死杆菌43K OMP缺失株,对比其与坏死杆菌亲本株的生物学特性,初步探究缺陷43K OMP后坏死杆菌的生物学特性的变化,从而确定43K OMP基因可能参与坏死杆菌致病的生物学功能,为牛坏死杆菌致病机制的研究提供理论基础。
1 材料与方法
1.1 菌株、细胞与试验动物
坏死杆菌A25菌株购自美国ATCC公司(Fusobacteriumnecrophorum,Fnn亚种,ATCC 25286),基因缺失株A25Δ43K OMP株通过同源重组技术制备获得(构建同源重组手臂并通过自杀质粒导入坏死杆菌内部,从而打断43K OMP基因)[14],小鼠单核巨噬细胞系(RAW264.7)与牛子宫内膜细胞系(BEND)由黑龙江八一农垦大学兽医分子病理学实验室保存;6周龄SPF级Balb/c雌性小鼠,体重18~22 g,购自长春亿斯实验动物技术有限责任公司。
1.2 主要试剂、仪器
苛养厌氧菌肉汤(FAB)培养基购自青岛海博生物技术有限公司,药敏纸片购自北京天坛生物制品股份有限公司,DMEM培养基和RPMI-1640培养基购自上海Sigma-Aldrich贸易有限公司,BeyoClickTMEdU-488细胞增殖检测试剂盒购自上海碧云天生物技术有限公司,厌氧培养箱购自上海龙跃仪器设备有限公司,荧光显微镜购自上海徕卡科技有限公司。
1.3 细菌培养
将牛坏死杆菌亲本株A25株与基因缺失株A25Δ43K OMP株甘油冻存菌复苏接种于FAB培养基中(其中基因缺失株A25Δ43K OMP株培养基含有2 μg·mL-1甲砜霉素),37 ℃厌氧培养,气体环境为:85% N2、10% H2和5% CO2,经革兰染色鉴定后,按照1∶50传代,传3~4代可用于试验。
1.4 细胞培养
RAW264.7细胞培养在含有10%胎牛血清的DMEM培养基中、BEND细胞培养在含有10%胎牛血清的RPMI-1640培养基中,当细胞密度达到80%即可进行传代培养,细胞均在37 ℃,5% CO2细胞培养箱内培养。
1.5 生长曲线测定
将两菌株按照1∶20比例分别接种到FAB液体培养基,于37 ℃厌氧培养,分别在培养0、2、4、6、8、10、12、18、24、30、36、42、48 h取菌液2 mL测定其600 nm的吸光度值,试验进行3次重复,每次重复设3个平行组,记录并绘制生长曲线。
1.6 药敏试验
根据CLSI标准,使用K-B纸片扩散法对两菌株进行药物敏感性试验[15]。取50 μL处于对数生长期的亲本株A25株和缺失株A25Δ43K OMP株菌液均匀涂布于固体培养基上,贴药敏纸片,37 ℃厌氧培养48~72 h,观察抑菌圈大小,测量抑菌圈直径并记录分析。
1.7 生物被膜形成能力测定
将亲本株A25株和缺失株A25Δ43K OMP株接种至FAB培养基中,过夜培养后,将菌液用FAB培养基进行100倍稀释,取200 μL菌液加入至96孔板内,37 ℃厌氧分别培养48、72和96 h,蒸馏水冲洗,随后用1%结晶紫溶液染色30 min,蒸馏水冲洗后加入200 μL 95%乙醇溶液溶解30 min,检测OD570 nm值[16],试验进行3次重复,每次重复设3个平行组。
1.8 细胞黏附试验
将亲本株A25株和缺失株A25Δ43K OMP株接种至FAB培养基中,37 ℃厌氧培养至OD600 nm=0.6~0.8,收集细菌于室温3 000×g离心5 min,无菌PBS洗3次,用RPMI-1640培养基重悬。同时将BEND细胞接种在12孔板中,每孔接种1×106个细胞,37 ℃,5% CO2细胞培养箱内培养12 h用于试验,按照感染复数MOI为1∶100的比例加入细菌,共同孵育1 h。随后用无菌PBS清洗3次除去未黏附的细菌,用1 mL无菌PBS收集细胞悬液并用连续10倍稀释,涂布于固体培养基上37 ℃厌氧培养36~48 h,计算细菌的黏附数[17],试验进行3次重复,每次重复设3个平行组。
1.9 细胞增殖抑制试验
收集亲本株A25株和缺失株A25Δ43K OMP株并分别用DMEM培养基重悬。同时将RAW264.7细胞接种在12孔板中,每孔接种1×106个细胞,37 ℃,5% CO2细胞培养箱内培养12 h用于试验,按照感染复数MOI为1∶100的比例加入细菌,分别孵育2、4和6 h后,按照BeyoClickTMEdU-488细胞增殖检测试剂盒说明书进行细胞增殖检测,用荧光显微镜以400倍视野观察,随机取5个视野进行数据统计[18]。
1.10 缺失株对小鼠的致病性试验
将6周龄Balb/c雌性小鼠平均分为3组,分别为:亲本株A25、缺失株A25Δ43K OMP和对照组,每组10只。将菌液用无菌PBS洗3遍后重悬,200 μL腹腔接种至小鼠体内(5×108CFU·只-1)来测定存活曲线,对照组注射等量无菌PBS。从接种后开始计时,连续观察14 d,并绘制小鼠的存活曲线。对死亡小鼠及存活14 d小鼠进行无菌剖检,将肝组织研磨后,用无菌PBS对组织匀浆进行倍比稀释,涂布于固体平板37 ℃厌氧培养48 h,平板计数并计算两菌株在Balb/c雌性小鼠每克肝组织中的载菌量。
1.11 数据分析
每组试验均重复3次,数据采用GraphPad Prism软件One-way ANOVA进行分析,以“平均数±标准差”表示,P<0.05时判定结果差异显著。
2 结 果
2.1 生长曲线
为了探究缺陷43K OMP基因是否会影响牛坏死杆菌的生长特性,分别检测了两菌株的生长曲线。结果如图1所示,亲本株A25株和缺失株A25Δ43K OMP株均在4~8 h进入对数生长期,12 h达到峰值,随后进入平台期,细菌密度逐渐减弱。结果显示,缺陷43K OMP基因后牛坏死杆菌的生长特性没有明显差异(P>0.05)。

图1 A25株和A25Δ43K OMP株生长曲线
2.2 药敏试验结果
为了探究缺陷43K OMP基因是否会对牛坏死杆菌的耐药性产生影响,选用25种抗菌药物对亲本株A25株和缺失株A25Δ43K OMP株进行药敏试验。结果如表1所示,两菌株对链霉素、杆菌肽和氟苯尼考高度耐药,未出现抑菌圈。在缺陷牛坏死杆菌43K OMP基因后,缺失株A25Δ43K OMP株对氨苄西林、红霉素、大观霉素、磺胺甲噁唑和痢特灵产生的抑菌圈变小,表现出耐药性增强;对克拉霉素、卡那霉素、新霉素、阿米卡星、奈替米星、呋喃妥因、多黏菌素B、利福平和环丙沙星产生的抑菌圈变大,表现出耐药性减弱。
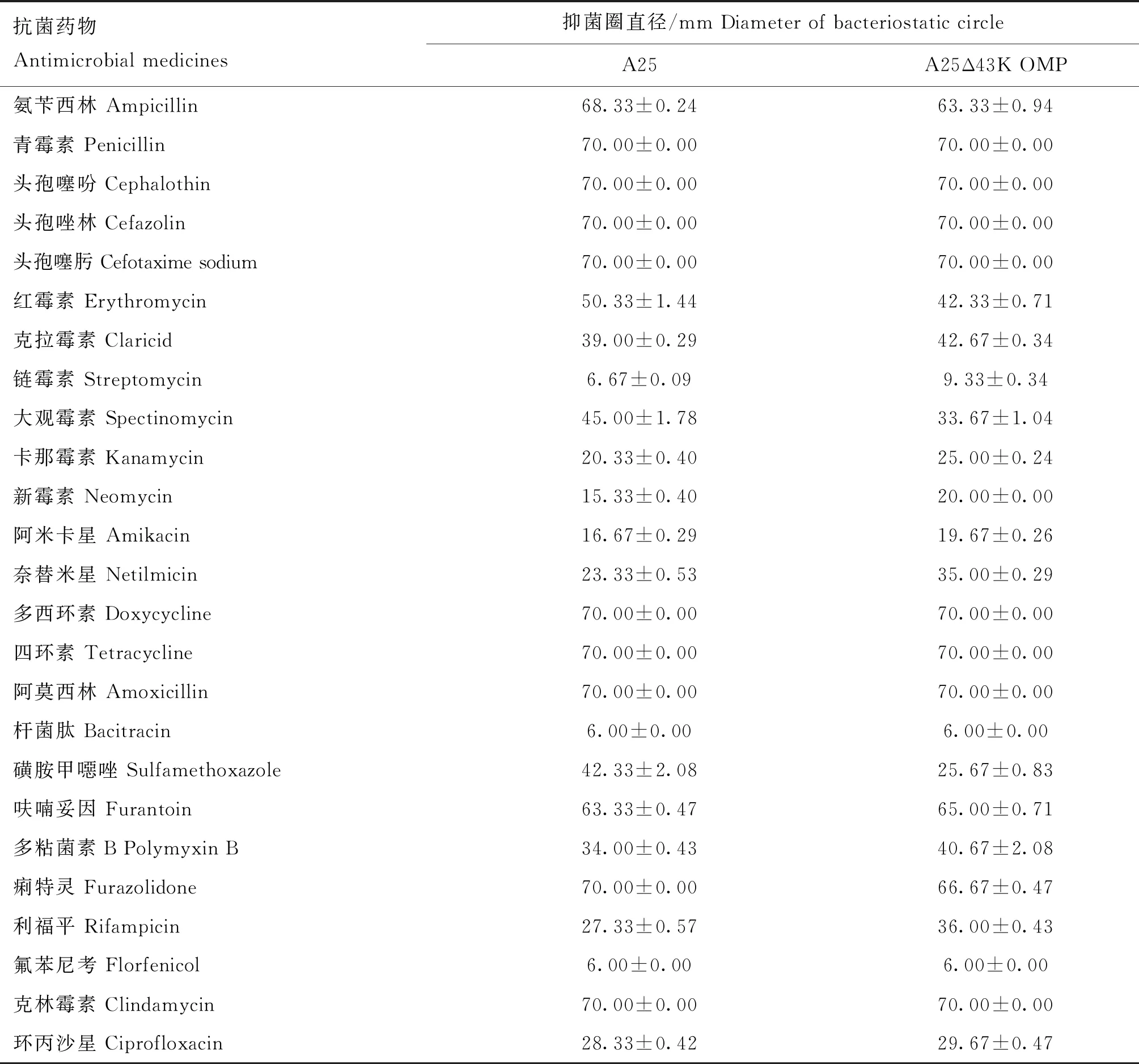
表1 A25和A25Δ43K OMP药敏试验结果
2.3 生物被膜检测结果
为了探究缺陷43K OMP基因是否对牛坏死杆菌的生物被膜形成能力产生影响,用结晶紫染色法分别对两菌株进行生物被膜测定。结果如图2所示,接种48、72和96 h时,对照组OD570 nm分别为0.10、0.08和0.09,亲本株A25 OD570 nm分别为0.40、0.49和0.50,缺失株A25Δ43K OMP OD570 nm分别为0.57、3.30和1.57。均表现为ODA25Δ43K OMP>ODA25>2×OD570 nm。结果显示,两菌株生物被膜形成能力均较强,且缺陷43K OMP基因后,牛坏死杆菌的生物被膜形成能力显著增强。
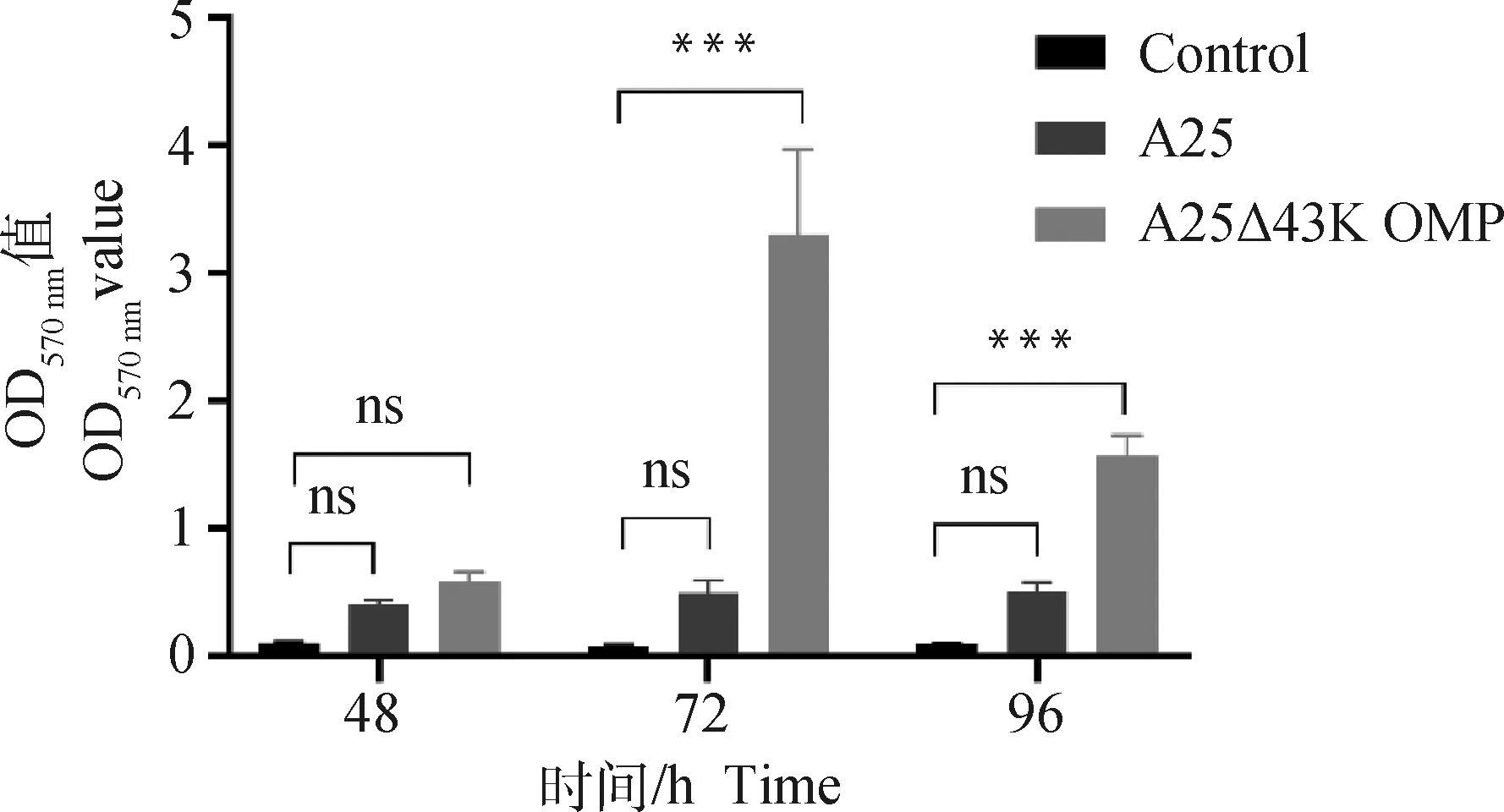
ns. P>0.05; ***. P<0.000 5。下同
2.4 细胞黏附能力测定结果
为了探究缺陷43K OMP基因是否对牛坏死杆菌的黏附能力产生影响,测定了两菌株对BEND细胞的黏附能力。结果如图3所示,亲本株与缺失株在BEND细胞上黏附的细菌量分别为6.48×105和0.33×105CFU·mL-1。结果显示,缺陷43K OMP基因后,可显著降低牛坏死杆菌与BEND细胞的黏附。
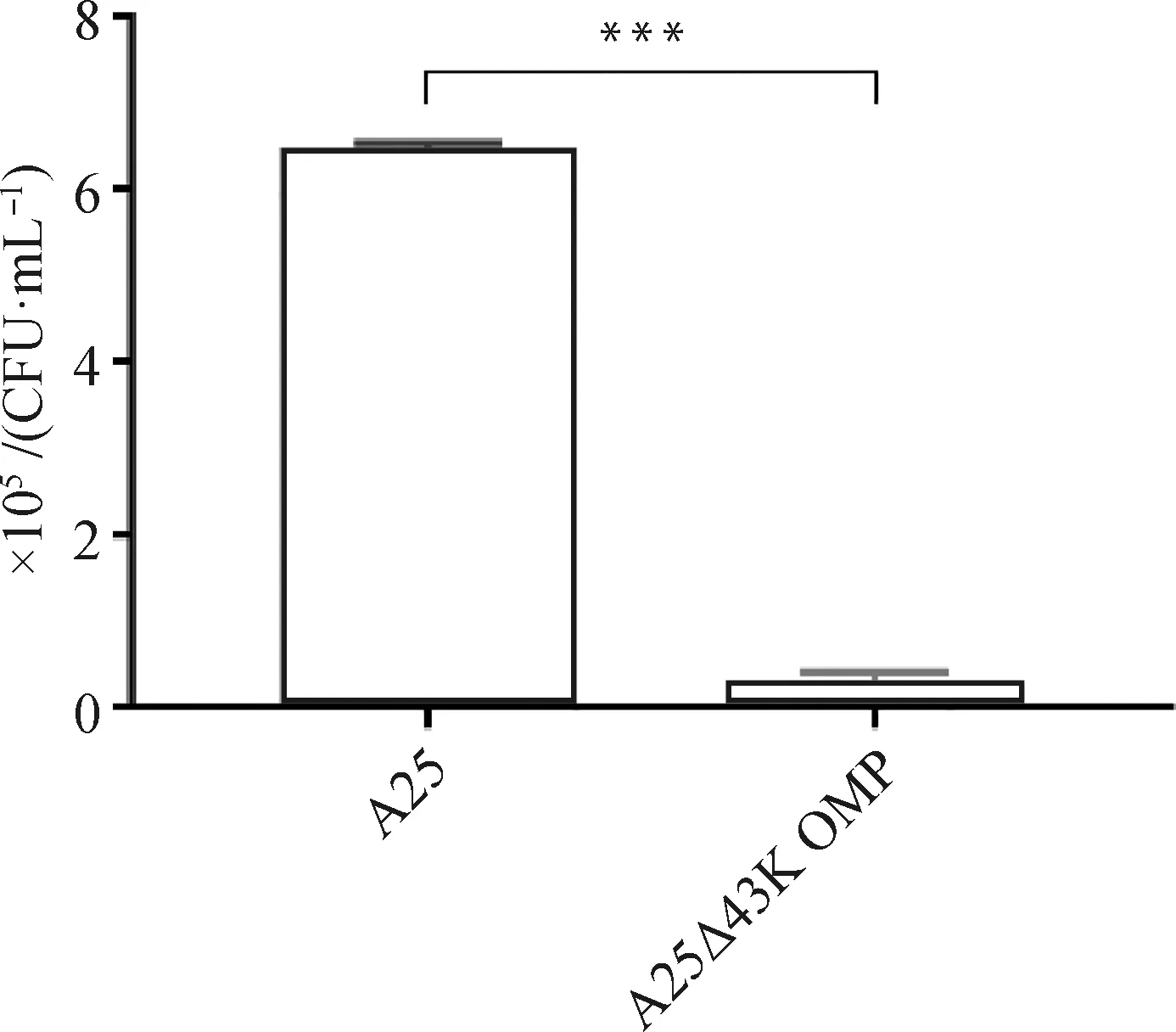
图3 A25株和A25Δ43K OMP株对BEND细胞黏附能力
2.5 细胞毒性检测结果
为了探究缺陷43K OMP基因是否对牛坏死杆菌的毒性产生影响,在体外分别测定两菌株对RAW264.7细胞的增殖抑制能力。结果如图4所示,对照组、亲本株组和缺失株组的细胞增殖率在2 h分别为0.40、0.31和0.37,在4 h时分别为0.38、0.22和0.18,在6 h时分别为0.39、0.07和0.06(图4B)。结果显示,缺陷43K OMP基因,牛坏死杆菌对RAW264.7细胞毒性无显著差异(P>0.05)。
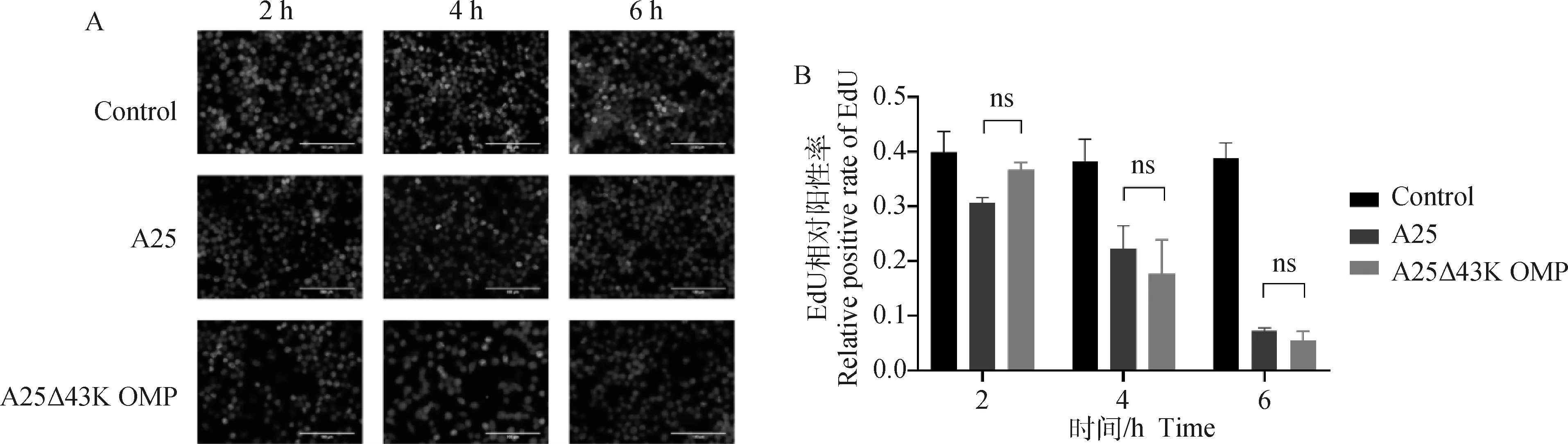
A. 从各组中随机选择视野并合并9张图像(400×);B. 从荧光图像中获得EdU阳性细胞数,计算EdU相对阳性率
2.6 对Balb/c雌性小鼠致病力的影响
为了探究缺陷43K OMP基因后,牛坏死杆菌对Balb/c雌性小鼠的致病力是否会发生改变,将两菌株用无菌PBS稀释后腹腔注射试验组小鼠,每只接种5×108CFU细菌,对照组小鼠腹腔注射等量无菌PBS溶液,观察小鼠死亡时间情况及全身病理变化情况。结果如图5所示,亲本株A25株和缺失株A25Δ43K OMP株对Balb/c雌性小鼠的致死率分别为100%和80%。感染亲本株A25株的小鼠死亡时间主要集中在前3 d,感染缺失株A25Δ43K OMP株的小鼠主要集中在5~7 d(图5A)。对小鼠无菌解剖发现,感染A25株小鼠脏器无明显变化,感染A25Δ43K OMP株小鼠心、肾无明显变化,肺充血,脾充血肿大,肝表面出现散在的米粒大小的黄白色坏死灶,部分出现黄白色大片干酪样坏死并与腹膜黏连。对Balb/c雌性小鼠肝组织进行细菌载量计数发现,亲本株A25株与缺失株A25Δ43K OMP株的肝细菌载量分别为2.29×105和1.72×105CFU·g-1,缺失株A25Δ43K OMP株定植在肝的细菌数量显著低于亲本株A25株(P<0.05,图5B)。结果表明,缺陷43K OMP基因后,牛坏死杆菌对Balb/c雌性小鼠的致病力降低。

A. 各菌株对小鼠的存活曲线;B. 各菌株在小鼠肝组织的细菌载量。*. P<0.05
3 讨 论
近年来,坏死杆菌感染引起的牛肝脓肿、腐蹄病、乳腺炎和子宫内膜炎等坏死杆菌疾病,对我国畜牧养殖业造成了严重的经济损失,严重制约养牛业发展;坏死杆菌病不仅影响经济动物还威胁到人类的生命安全,多地均报道过人类感染坏死杆菌的病例[19-21]。坏死杆菌如何感染动物机体并导致动物发病的机制研究尚未明确。
OMPs作为革兰阴性细菌的重要组成部分,在细菌致病中发挥重要作用。43K OMP作为坏死杆菌的重要OMPs,前期研究发现其与细菌黏附功能有关。当坏死杆菌与43K OMP多抗孵育或43K OMP与细胞孵育后,坏死杆菌黏附宿主细胞能力降低[10];同时将43K OMP基因克隆到pFLAG-CTS载体中,随后在大肠杆菌BL21 DE3表达后,大肠杆菌的黏附能力增强[22]。这些结果显示,43K OMP在坏死杆菌黏附宿主细胞中具有重要作用,但坏死杆菌黏附是否与43K OMP基因具有直接作用尚不可知。因此,本研究对比43K OMP基因缺失株和牛坏死杆菌亲本株对BEND细胞的黏附能力,发现缺陷43K OMP的牛坏死杆菌对BEND细胞的黏附能力显著降低,这与之前的研究结果相一致。表明43K OMP基因直接介导坏死杆菌对细胞的黏附功能。
生物被膜是细菌抵抗外界不利环境的一种生存形式,主要由细菌、蛋白质、胞外多糖和胞外DNA构成,是细菌产生耐药性和造成动物疾病持续感染的重要机制。Ye等[23]研究发现,阪崎氏菌(Cronobactersakazakii)缺失OmpW后,阪崎氏菌的生物被膜含量显著增强。Yonezawa等[24]研究发现,缺失幽门螺杆菌的外膜蛋白AlpB导致幽门螺杆菌形成生物被膜含量显著下降。牛坏死杆菌缺陷43K OMP基因后,其生物被膜形成能力显著增强,显示牛坏死杆菌43K OMP基因介导生物被膜的产生,而43K OMP基因引起的生物被膜形成能力的变化是与抵抗外界不利因素有关还是直接参与到生物被膜的形成还需进一步研究。
细菌的耐药机制有很多种,如外排泵排出、细胞膜通透性改变、药物靶点基因突变等,外排泵多由孔状外膜蛋白构成,而外排泵系统也是介导细菌固有耐药和获得耐药的重要机制[25]。Jeanteur等[26]将大肠杆菌的OmpF突变后,大肠杆菌对头孢菌素的耐药性降低;权衡等[27]敲除鸭疫里默氏杆菌的rant基因后,该菌对四环素的耐药性降低。牛坏死杆菌43K OMP是由β-折叠平行排列构成的桶装蛋白,其中包含9个跨膜区域,与梭菌属的多种外膜成孔蛋白具有较高的相似性[9]。本研究中,坏死杆菌缺陷43K OMP基因导致其对部分抗菌药物耐药性发生变化,说明43K OMP基因参与到细菌的耐药功能中,但其究竟是以外排泵的形式还是以改变细胞膜通透性或介导改变药物靶基因突变从而导致耐药性发生变化还需进一步研究。
4 结 论
牛坏死杆菌43K OMP基因被缺陷后,牛坏死杆菌的黏附能力显著下降,生物被膜形成能力显著提升,耐药性产生变化,对小鼠致病力显著下降。
