脂溢性皮炎临床诊治的研究进展
2022-11-29李沅鸿李姝润任伟陈燕超
张 凡,李沅鸿,李姝润,任伟,陈燕超
(1.北京积水潭医院毛发医学研究中心、皮肤性病科,北京,100035;2.北京大学医学部临床医学院,北京,100191)
脂溢性皮炎(seborrheic dermatitis,SD)是一种常见于婴儿、青春期及成人的慢性、复发性、炎症性皮肤病[1][2]。SD 的病因及发病机制尚不明确,可能与马拉色菌感染、脂质分泌异常、免疫因素、遗传因素、皮肤屏障受损等多种内外源因素共同作用有关。本文就近年对SD 病因、发病机制、临床表现和治疗的相关研究进行总结,以期指导后续对该疾病的探索。
1 病因
SD 的病因目前尚不明确,一般认为是内在因素和外在因素共同作用的结果[3]。目前的研究认为SD的发病主要与马拉色菌感染、脂质代谢、免疫因素、遗传因素、皮肤屏障受损等有关。
1.1 马拉色菌感染
自1846年马拉色菌被认识后,其命名及分类一直比较混乱。通过对各菌种形态学和生理生化学特性的研究以及随机扩增多态性DNA分析等的应用,该菌被分为7个种[4‐6]:(1)厚皮马拉色菌(M.pachydermatis):1935年由Doase 命名,主要存在于人类和动物皮肤。(2)糠秕马拉色菌(M.furfur):1989年由Baillon 命名,可长出菌丝,分为圆形、卵圆形、椭圆形糠秕孢子菌,其中有是引起SD的主要菌种。(3)合轴马拉色菌(M.sympodialis):1990年由Simnmn 和Gueho 命名,是皮肤上最常见的一种。(4)斯洛菲马拉色菌(M.slooffiae):1996年由Midgley 和Gueho 命名,最初在一些动物中分离,也存在于人身上。(5)钝形马拉色菌(M.obtusa):1996年由Midgley、Gueho和Guillot 命名,该种较为少见。(6)球形马拉色菌(M.globosa):1996年由Blidgley、Gueho和Guillot 命名,常存在于花斑癣和SD 中。(7)限制马拉色菌(M.restricta):1996年由Midgley、Gheho和Guillot 命名,常存在于面部和头皮。后来,通过rRNA 基因序列分析和限制性片段长度多态性(restriction fragment length polymorphism,RFLP)等技术发现了其他7个新种:皮肤马拉色菌(M.dermatis)、大和马拉色菌(M.yamatoensis)、日本马拉色菌(M.japonica)、纳娜马拉色菌(M.nana)、羊马拉色菌(M.caprae)、马马拉色菌(M.equina)和兔马拉色菌(M.cuniculi)[5]。这14种马拉色菌中由11种参与构成人体皮肤微生态[6]。
Meginley 等发现SD 患者头皮屑中卵圆形糠孢子菌占头皮屑中全部微生物的74%,而在非SD患者中这一数字仅为46%,这说明卵圆形糠孢子菌可能是导致SD的病因或是其加重的因素。这一理论得到许多学者的支持[7]。在印度和中国进行的三项研究表明,限制分枝杆菌和球分枝杆菌是SD 患者皮肤上最常见的两种菌种[8、9]。目前尚不清楚为什么这些生物体仅在选定的个体中致病,这可能是由于皮脂腺功能、脂质成分和免疫功能的个体差异[10][11]。最近,Li等[12]发现通过抗真菌治疗减马拉色菌菌丝有助于缓解SD患者的临床症状,这说明马拉色菌的菌丝形式可能是致病因素之一。
1.2 脂质代谢
SD 的好发于3个月以内的婴儿、青少年和中年人,男性多见[2]。新生儿皮脂细胞的雄激素受体可在从母体来的雄激素的影响下激活,皮脂腺排泄皮脂多[13]。青春期时皮脂腺再次受到雄激素影响,功能活跃,皮脂排泄增多,在40岁以内保持稳定[3]。女性绝经期后皮脂腺数量急剧减少,男性则在70岁以后减少。各年龄组中,男性皮脂分泌率高于女性[14]。Suchonwanit 等[15]发现头皮SD 的严重程度与平均皮肤表面脂质呈显著正相关。这说明SD 与皮脂腺活动具有很强的相关性。但是,SD 患者的皮脂分泌可能正常,而皮脂分泌多的人不一定会发生SD,这说明单纯皮脂腺活动活跃不是SD 发生的决定性因素[3]。脂质成分的异常主要通过为马拉色菌生长提供有利环境而致病[3][16]。
1.3 免疫因素
免疫抑制的患者,如器官移植受者和HIV/AIDS患者表现出对SD更高易感性[17]。SD在普通人群发病率为5%[18],而在HIV 感染者中发病率为高达30%~83%[19],且CD4+T 淋巴细胞计数为200~500个/mm3时,最易发生SD[20]。随着CD4+T淋巴细胞减少,SD 发病率增加,皮损程度加重,这提示SD的发病与机体免疫功能缺陷有关。
此外,一项研究发现SD 患者总血清中IgA和IgG抗体水平升高[21]。但是,抗马拉色菌抗体没有增加检测,这表明马拉色菌直接引起的是细胞免疫而非体液免疫,免疫球蛋白的产生增加是对其代谢物的体液免疫反应[22]。淋巴细胞活性的具体作用仍存在争议[22][23]。
1.4 遗传因素
目前对SD 遗传易感性的研究一直很有限,但最近的研究表明,遗传易感性可能发挥作用,因为某些人类白细胞抗原(HLA)亚型往往会增加患SD的风险[24]。研究发现SD患者中HLA‐AW30、HLA‐AW31、HLA‐A32、HLA‐B12和HLA‐B18水平升高[25]、[26]。2018年,Mills等[27]提出了一组称为“不健康皮肤特征”的基因簇,研究发现SD、银屑病、特应性皮炎和痤疮和其他许多皮肤疾病中该基因簇功能失调。在这个基因簇中,与免疫反应相关的基因被上调,而控制Wnt/ B‐连环蛋白途径和基于肌动蛋白丝的过程的基因被下调。目前已确定11种基因突变或蛋白质缺陷直接导致人类或实验小鼠模型中的SD或SD样表型,这些突变在Karakadze 等人在2017年进行的综述中进行了总结[28]。
1.5 皮肤屏障受损
角质层是表皮的无核外层,可防止水分流失、防止微生物和有害物质从环境中进入。其最基本的功能是防止水分散失,即称为表皮渗透屏障(epidermal permeability barrier,EPB)。层状脂质成分、角质细胞大小或形状、角质桥粒数量的任何变化都可能导致表皮渗透屏障功能的改变[3]。Warner 等[29]在电镜下观察到SD 患者头皮角质层存在角化不全的核滞留、角化细胞结构不规则、细胞内的脂质颗粒以及脂质层结构破坏。Harding 等[30]发现在SD 患者头皮表皮渗透屏障在有效脂质水平明显降低。这表明角质层屏障结构的破坏与SD有关。
1.6 与内科疾病
SD 常伴有多种内科疾患,其症状可能因为内科疾病而加重。帕金森病中可看到头皮的严重SD,表现为大量蜡样鳞屑。人免疫缺陷病毒(human immunodeficiency virus,HIV)感染者SD发病率显著增加,如出现泛发及严重的头皮SD应考虑HIV感染可能。糖尿病、腹泻、营养吸收不良、癫痫、能诱发帕金森病的神经精神类药物如氟哌啶醇等可引起SD样损害。
SD 在帕金森病患者中发病率达60%,这与帕金森患者体内促黑素细胞激素水平升高有关[24]。家族性淀粉样多发性神经病和唐氏综合征也与SD相关[31][32]。精神压力会诱发或加重SD,可能与神经免疫受影响有关[33]。肠道肢端皮炎患者缺锌、核黄素、吡哆醇和烟酸缺乏可出现SD样皮疹[34]。日晒可改善SD症状,冬季SD 会加重,但有报道银屑病患者采用补骨脂素长波紫外线光化学疗法(photochemotherapy with psoralens and ultraviolet,PUVA)引发面部SD[2][3]。SD患者病灶部位葡萄球菌水平升高,其相对丰度与表皮屏障损伤瘙痒和鳞屑评分呈正相关[18],这说明葡萄球菌感染与SD 发病有关。
总之,SD 的发病原因复杂。马拉色菌的存在和丰度、宿主表皮状况和皮脂腺分泌,再加上各种其他因素,以及这些因素之间的相互作用,最终导致SD的出现。
2 发病机制
目前SD 发病机制尚未完全明确,但越来越多的证据证明其与下列因素相关:马拉色菌、皮脂腺分泌脂质、潜在的免疫系统易感性和表皮屏障的破坏。
SD 发病机制大体可分为五个阶段[24]:①皮脂腺将脂质分泌到皮肤表面;②马拉色菌定植于覆盖有脂质的区域;③马拉色菌分泌脂肪酶,产生游离脂肪酸和脂质过氧化物,从而激活炎症反应;④免疫系统产生细胞因子如白细胞介素IL‐1α,IL‐1β,IL‐6,IL‐8和肿瘤坏死因子(TNF)‐α,刺激角质形成细胞增殖和分化[17];⑤皮肤屏障破坏,临床上表现出明显的红斑、瘙痒和脱屑。
2.1 菌群失调
马拉色菌是人类健康皮肤最常见的真菌属,目前共发现14种马拉色菌亚型,其中11种参与构成了皮肤微生态,而在头皮SD 患者中,球形马拉色菌(M.globosa )以及限制马拉色菌(M.restricta )是优势株[35]。如前所述,马拉色菌通过分泌脂肪酶和活性磷脂酶分解皮脂腺分泌的皮脂以定植在皮肤表面。皮脂腺分泌的皮脂为三酰甘油和酯类,它们在马拉色菌的作用下被分解为二酰甘油、一酰甘油和游离脂肪酸,如油酸和花生四烯酸,这些代谢物会引起角化形成细胞异常分化,导致角质层异常,这会引起局部的炎症反应。
细菌群落主要以痤疮丙酸杆菌(Propionibacterium acnes)为主,钟彩梅等[36]发现与健康人群相比,SD患者细菌α ‐多样性改变,即细菌种类发生改变,同时β‐多样性也发生改变,即细菌含量发生改变,其中,SD 患者皮肤细菌的相对丰度较健康人群减少,以P.acnes 减少最为明显,当P.acnes 的相对含量<80%,提示SD 皮损处出现了菌群失调,同时,金黄色葡萄球菌(S.aureus、)表皮链球菌(S.Epidermidis )、溶血性链球菌(S.Haemolyticus )、S.flexneri、肺炎支原体(Mycoplasma hyorhinis )、腾冲嗜热厌氧菌(Thermoanaerobacter tengcongensis )和嗜热厌氧杆菌(Thermus thermophilus )等细菌的相对含量升高。
2.2 免疫相关机制
皮肤表面具有抗菌因子,用来抵御病原微生物的入侵。但是,在皮肤屏障损伤的情况下,马拉色菌可以穿透皮肤组织并由吞噬细胞(嗜中性粒细胞,巨噬细胞和树突状细胞组成)吞噬。先天免疫是第一道防线,其免疫反应由种系编码模式识别受体(PRRs)介导,包括Toll样受体(TLR),NOD样受体(NLR),RIG样受体(RLR)和C 型凝集素受体(CLRs)。某些NLR(包括NLRP1、NLRP3、NLRC4和AIM2)与适配器蛋白ASC 和效应蛋白半胱天冬酶‐1,是称为炎症小体的多分子细胞内蛋白复合物的一部分。在炎症小体形成时,蛋白酶半胱天冬酶‐1被激活并切割无生物活性的proIL‐1 β形成活性IL‐1 β。活性IL‐1 β是强大的促炎细胞因子,参与诱导炎症反应[37]。值得注意的是,TLRs 的激活是炎症小体激活的重要先决条件,因为它诱导某些炎症小体蛋白(例如NLRP3)或其下游靶标proIL‐1 β的表达。
Magdalena Kistowska[38]等人研究发现马拉色菌可以通过Syk偶联受体Dectin‐1介导的信号激活上文中提到的NLRP3炎症小体的激活,进一步促进IL‐1 β的大量释放,从而引起炎症反应。此外,马拉色菌,特别是M.globosa 和M.restricta,能够通过TLR2诱导角质形成细胞分泌IL‐8,进一步加强了马拉色菌在SD/D发病机制中的促炎作用[39]。
2.3 遗传相关机制
与SD 相关的基因突变所编码的蛋白质大多与免疫或表皮分化有关[27]。
2.4 表皮屏障功能破坏
表皮角质层屏障结构,主要成分是角质形成细胞及其角化包膜和细胞间的脂质双分子层,这些脂类主要成分是神经酰胺(50%)、胆固醇(25%)和游离脂肪酸(10%~20%)。在SD 患者的头皮中,上述表皮屏障脂质水平明显降低。而SD 患者屏障功能破坏表现为对局部刺激的高敏感性。屏障破坏使SD患者更易受到微生物及其毒素以及油酸等头皮脂质代谢产物的影响,从而更加剧了屏障的破坏[29]。
3 临床表现
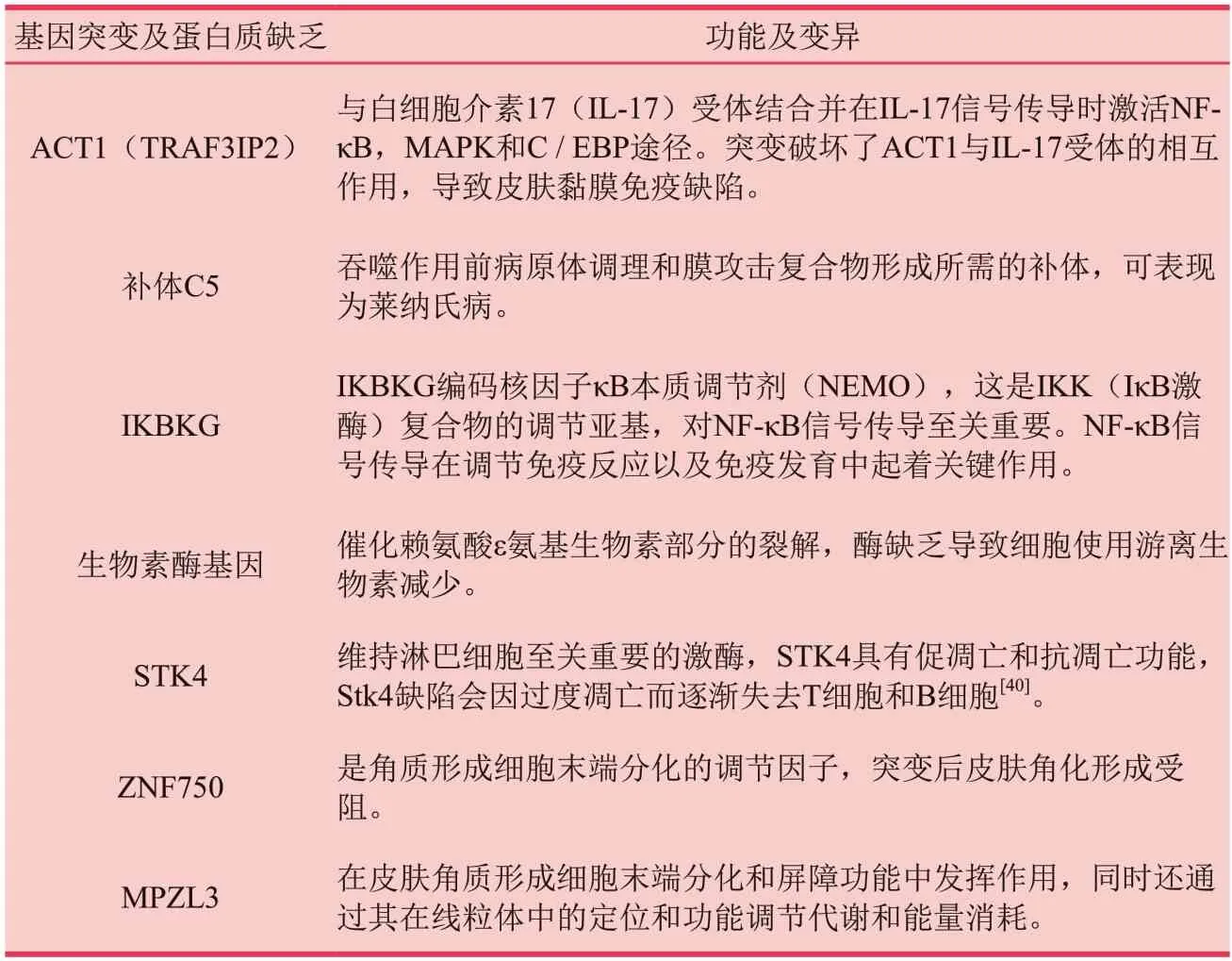
表1 脂溢性皮炎相关基因突变及蛋白质缺乏类型
3.1 SD 的流行病学特点
SD 在人群中的发病率为2%‐5%,其中70.3%发生在头部,为头皮脂溢性皮炎(scalp seborrheic dermatitis,SSD)。SD 多发生于皮脂腺活跃时期,其发病率在三个年龄段达到高峰——出生后的前三个月、青春期和成年期,在40至60岁时达到顶峰。具有季节性,症状在冬季多见,夏季改善[3]。
3.2 SD 的临床特征
SD 往往局限,初发于头部,加重者可向面部、耳后、腋窝、上胸部、肩胛间部、腋窝、外阴部及腹股沟等处发展[41]。
SD 的临床表现可分为非炎症性和炎症性。非炎症性表现为头皮轻重不等的小片灰白色糠秕状脱屑,没有明显的红斑或刺激反应。炎症性表现为油腻性鳞屑性斑片,基底潮红[35]。以后逐渐扩展、融合成边界清楚的地图状大斑片,严重者累及大部分皮肤,覆有油腻性厚痂,可有渗出,伴有腥臭味[41]。
SD 初发皮损多表现为毛囊周围炎症性丘疹,随病情发展,丘疹融合成大小不等的黄红色斑片,边界清楚。红斑基底上附有糠样或斑片状鳞屑,鳞片通常有黄色、油腻的外观。水疱或结痂少见,多数是刺激导致(如过度治疗)。伴有不同程度瘙痒,由于瘙痒而搔抓,可以引起继发性感染。外用药不当可引起接触性皮炎或湿疹样改变,严重者可发展为红皮病[35]。
SD 患者的头皮皮肤对刺激敏感,暴露于日光或高温、发热性疾病及过度的局部治疗可能引起皮疹突然加重或播散,受刺激后可以变为鲜红色或出现糜烂。可以并发糠秕孢子菌性毛囊炎,其特点为瘙痒的红斑性毛囊性丘疹,有时为脓疱,常见于免疫受抑的个体[42]。
3.3 SSD 的分类
SSD 在婴儿和成人中的表现稍有不同:
3.3.1 婴儿SSD
常在生后1周左右出现,可持续数月,症状轻微,为自限性疾病,多数在第一年内会自发消退。最初表现为轻度油腻性鳞屑附着于头顶及前囟区,可以扩散到整个头皮,严重者伴有糜烂渗出,最终可形成覆盖大部分头皮的白色、黄色或棕色鳞屑及黏着性厚痂,这种表现被称为“摇篮帽”。特别的是,有色人种的儿童通常无典型的“摇篮帽”,但有红斑,表皮剥落和色素减退的表现[41]。
3.3.2 成人SSD
成人的病程为慢性复发性。可表现为头皮单纯糠疹(头皮屑)、炎症、瘙痒、脱发。头顶和顶骨区最常受累,表现为较弥漫的皮损。在前额,红斑和鳞屑与正常未受累皮肤分界清楚,皮损边界一般在发际处或稍超出发际。瘙痒一般为中度,也可以比较强烈,尤其在伴发早期男性型脱发的患者。
深色皮肤的成年人可能会有特殊的表现,包括典型受损区域的色素减退、较难识别的潜在红斑。这一人群也可看到弓状或花瓣状斑块,称为瓣状SD,表现为粉红色或低色素的小范围多环合并环。相关的色素减退通常在治疗后得到改善[41]。
3.4 SD 的评价标准
病情的严重程度和病程因人而异,其严重程度在临床上有不同的评价标准:
3.4.1 SSD评分
(1)四点量表评分
将SSD 病例分为轻度、中度和重度,根据红斑对头皮进行评分(0=无红斑,1=淡粉色,2=粉红色,3=红色),头皮屑(0=无头皮屑,1=仅报废,2=明显脱屑,3=明显片状)和皮损范围(0=无皮损,1=1‐30%头皮面积,2=头皮面积的31‐70%,3=头皮面积的71‐100%)。根据分数总和,可分为轻度(1‐3)、中度(4‐6)或重度SD (7‐9)[15]。
(2)头皮黏附鳞屑评分(adherent scalp flaking score,ASFS )和评价瘙痒的调查者全球评估(Investigators’ global assessment,IGA )
为了对头皮屑的严重程度进行分级,将头皮分成8个部分。使用梳子将每个区域的头发分开,以便清晰地观察头皮。每个切片使用0 ‐ 10量表评估黏附在头皮皮肤上的头皮屑的存在,0级为无头屑,1‐2级为小片粉状灰白粗糙鳞屑,3‐4级为小至中等屑片,5‐6级为与头皮疏松相连的大而薄的屑片,7‐8级为黏着性碎片,9‐10级为与头皮紧密附着的白至黄色的较厚鳞屑。在分级中不考虑头发中的松散薄片。最终的ASFS 是所有8个头皮切片评分的总和,评分范围为0‐80。
此外,瘙痒由IGA评为0‐5分(完全清除、极好、良好、一般、较差和不可评估)[43]、[44]。
3.4.2 面部SD评分
面部SD 评分主要参考Kim 标准评分法,即对面部四个不同的部位(前额/眉毛、鼻唇沟、口唇/下巴、耳后)的红斑、鳞屑和瘙痒用四点量表法进行临床评估(0‐无,1‐轻,2‐中,3‐重)[45]。
4 治疗
目前中西医治疗SD 的方法很多。中医方面,以辨证论治为基础,包括内服和外治疗法;西医方面,主要采用抗真菌药、角质溶解剂、抗炎药(局部皮质类固醇和钙调神经磷酸酶抑制剂)等,均有较好疗效。
4.1 中医治疗
中医辨证论治认为,SD 主要为血热风燥证、脾胃湿热证、血虚风燥证等[46],故其内服治疗宜清热凉血、疏风止痒等为主,并可根据患者个体特点增减药物,可达到较好疗效[47]。一些中成药,如润燥止痒胶囊,其成分包括何首乌、生地黄、桑叶、苦参、红活麻等,可以起到养血滋阴、清热消肿、润肠通便的功效,在痤疮等其他皮肤病治疗有较好疗效[48]。当归苦参丸有凉血、清热、祛湿的功效,谢骅采用当归苦参丸联合他克莫司治疗SD,取得较好疗效[49]。
中医外治法剂型多样,包括中药煎液、药粉、酊剂、搽剂、软膏等治疗,如冰黄肤乐软膏、姜黄消痤搽剂等涂搽,颠倒散、复方黄柏溶液涂剂、脂溢洗方、皮肤康洗液等药浴。姜黄消痤搽剂为中药酒精制剂,具有去脂、消炎、止痒作用,彭光辉等应用姜黄消痤搽剂治疗SD有较好疗效[50]。复方黄柏液组分包括黄柏、千里光、地肤子等,为一种外用中成药,可清热解毒、祛风止痒,使用较为安全,治疗头部SD有效率较高[51]。脂溢洗方组分包括苍耳子、王不留行、苦参、明矾等,具有收敛止痒作用,可有效减轻SD 症状[52]。皮肤康洗液的主要成分包括金银花、蛇床子、龙胆草、土茯苓、蒲公英等,可以凉血除湿、清热解毒、杀虫止痒,王慧娟等应用皮肤康洗液治疗头部SD,取得较好疗效[53]。此外,其他疗法如穴位埋线[54]、针刺加梅花针[55]临床效果也较满意。
4.2 西医治疗
4.2.1 角质溶解剂
包括括煤焦油、水杨酸和吡啶硫酮洗发水等。煤焦油具有止痒、角质溶解作用,季淑玲研究表明新型1%煤焦油洗剂治疗头皮SD 效果满意,使用方便,无明显副作用[56]。水杨酸具有抗炎、调理角质、抗菌作用,胡杏林等的观察研究表明含水杨酸的去屑护发露可有效改善头皮SD 症状,且无明显不良反应[57]。吡硫酮锌具有非特异性角化和抗真菌特性[58],每周使用2‐3次,使用时涂抹于头皮或非头皮区域,5‐10分钟后洗去。但由于缺乏相关安全性和有效性的数据,在婴儿SD 的治疗中应谨慎使用[59]。
4.2.2 抗真菌治疗
目前研究认为,马拉色菌在SD 的发病中具有重要作用,故抗真菌药物治疗在SD 的治疗中占有重要地位。常用药物包括:酮康唑、舍他康唑、环吡司胺凝胶、2.5%硫化硒洗剂、口服伊曲康唑等。局部咪唑类药物,如酮康唑、克霉唑、咪康唑已被证明对SD治疗有效,主要通过抑制真菌细胞壁合成发挥作用[60]。已发表的文献证明,应用2%酮康唑洗发水可以有效治疗头皮SD[61]。并且,2%酮康唑缓解率与类固醇药物相似,但酮康唑治疗组的不良反应发生率较类固醇治疗组低44%[62]。一项研究表明,2%咪康唑洗发水治疗头皮SD 的有效性和安全性不逊色于酮康唑洗发水[59]。1%环吡咯胺(乳膏、洗发水、凝胶)是一种广谱抗真菌药物,已被证明对SD 有效,其作用机制涉及抑制真菌细胞内具有抗炎活性的金属依赖性酶[63]。一项研究表明,环吡咯胺治疗第三周和第四周后头皮SD改善达到75%以上[64]。
4.2.3 抗炎药物
①糖皮质激素药物:局部使用低效皮质类固醇可以有效清除SD 相关的症状和体征,主要为外用制剂,如氢化可的松乳膏、二丙酸倍他米松乳液、地奈德乳膏等。外用糖皮质激素可以单独或与抗真菌药物联合使用,但由于其副作用,如毛细血管扩张、多毛、萎缩和口周皮炎等,不建议长期使用。②钙调神经磷酸酶抑制剂:主要通过抑制钙调神经磷酸酶来治疗SD 。钙调神经磷酸酶是T 细胞活化和促炎细胞因子产生所必需的钙依赖性磷酸酶,除了产生抗炎作用外,它还可能对糠秕马拉色菌/卵圆形糠孢子菌有抗真菌作用[60]。主要包括他克莫司、吡美莫司等,不良反应较少,能有效控制红斑、脱屑等症状[65]。使用0.1%他克莫司软膏治疗SD 的主要不良反应是在使用部位出现烧灼、刺痛感、瘙痒等[66],这些症状通常发生使用最初几天,并随时间的推移逐渐消退[67]。一个丹麦专家小组建议采用局部抗真菌药物作为SD的一线治疗,局部皮质类固醇和钙调神经磷酸酶抑制剂只应用于症状明显和中度至重度患者的病情控制[68]。
4.2.4 其他药物
此外,还有一些新型药物如透明质酸凝胶、烟酰胺、吡啶硫锌气雾剂等,如祝行行等用透明质酸凝胶治疗面部SD,取得较好疗效[69]。但相关文献报道仍较少,其疗效及不良反应仍有待进一步证明。近年来,国内外关于天然提取物治疗SD 的研究也逐渐兴起,例如提取自澳大利亚本土灌木的茶树油洗发水治疗头皮SD,也取得了不错的疗效[70]。
4.2.5 物理治疗
包括强脉冲光(intense pulse light,IPL)、窄谱中波紫外线(narrow band ultraviolet,NB‐UVB )、光动力疗法(photodynamic therapy,PDT)、射频(radio frequency,RF)等。IPL 可作用于特定病变组织发挥作用,国内外有研究报道采用不同波长强脉冲光治疗SD,如陈艳等证实540nm和570nm IPL 治疗面部SD 可以抑制皮脂分泌[71],王瑞华等采用420nm IPL治疗SD 取得较好疗效[72]。吴泳等采用5‐盐酸氨酮戊酸(ALA )配合红光照射治疗(简称艾拉光动力治疗)治疗SD,表明该疗法可以降低头皮油脂分泌,为光动力疗法治疗SD提供依据[73]。但总体来说,物理治疗方面临床证据仍相对不足,仍有待进一步研究。
4.2.6 合并内科疾病的治疗
在合并艾滋病的患者中,抗逆转录病毒治疗常常改善SD[60]。在合并帕金森病患者中,应用左旋多巴治疗可能改善其SD,并有一些已发表的小型研究表明,SD 的改善可能与使用左旋多巴的总剂量呈相关性[74]。
中医与西医在治疗SD 方面各有优势,中西医结合治疗是目前临床上常用方法。伊珍采用中药联合酮康唑洗剂治疗头皮SD,较对照组单纯使用酮康唑洗剂有效率高,具有统计学意义[75]。可见中西医配合治疗可以有效提高治疗效果,减少不良反应。
5 讨论
SD 是一种常见于婴儿、青春期及成人的慢性、复发性、炎症性皮肤病。其病因及发病机制尚不明确,当前研究认为,该病的发生发展主要与马拉色菌感染、脂质分泌异常、免疫因素、遗传因素、皮肤屏障受损等多种内外源因素共同作用有关。头面、躯干位置的皮脂腺较为丰富,因而成为SD 的高发部位。SD 的病生理机制主要为:皮肤脂质成分增多有利于马拉色菌定植和生长,分解皮脂腺分泌的皮脂,其代谢产物激活局部炎症反应,破坏皮肤屏障,继而导致一系列临床症状。同时,也有研究表明SD患者皮损处存在菌群失调[36]。目前已发现许多相关基因位点对SD 的发病也有一定影响[28]。针对脂质分泌异常这一因素,有研究表明,监测角质层水合(SCH)、经皮失水量(TEWL )和皮肤表面脂质有助于评估头皮SD的严重程度和评价治疗结果[15]。近年来,分子生物技术的发展为SD 发病机制的研究,尤其是各种细胞因子的作用机制的研究提供了更可靠的手段,更多的生物标记物有望被识别出来,提供更多的信息,有助于为SD 的早期诊断及新的治疗研究提供理论依据[17]。
SD 的临床表现为头皮脱屑、红斑、可伴不同程度的瘙痒等,婴儿和成人表现稍有不同。根据这些临床症状的严重程度,许多临床医生总结了不同的严重程度评级。其中最常见的有四点量表评分(红斑、头皮屑、皮损面积)、黏着性头皮屑十级评分法(ASFS)[76]、瘙痒的IGA 评分以及面部SD的Kim标准评分法等。张凡医生团队在总结了多版国内外学者使用的评价体系的基础上,形成了“16分法”,即从“鳞屑、红斑面积、瘙痒”三个维度评价头皮SD,有助于更快速有效地确定患者病情,明确治疗方案以及观察和评价后续治疗效果。
目前中西医在SD 的治疗方面均有不错的效果。中医治疗方面,包括基本辨证论治、中成药(如大蒜肠溶胶囊、润燥止痒胶囊等)口服疗法,中药涂搽、药浴(如皮肤康洗液等)等外治疗法,以及梅花针等非药物疗法。而西医方面,也包括外用和口服治疗两部分,临床主要采用去脂、止痒、抗炎、抗真菌、免疫调节为主的治疗方法,此外,还有一些新型药物如透明质酸凝胶等也有不错的疗效,但目前文献报道较少,仍有待更多研究。物理疗法也有一定效果,但其作用机制尚不明确。目前,中西医结合治疗综合了二者的优点,取得了较好的临床治疗效果。如何针对患者具体的病情特点,更好地配合运用中医和西医,制定个体化治疗方案,使其达到最优效果,是现阶段我们仍需努力探索的。
