两种产灵菌红素菌株对东海原甲藻和强壮前沟藻的溶藻活性
2022-11-28崔玉栋陈凤娇曹常明莫翠钧刘福川
崔玉栋,陈凤娇,曹常明,莫翠钧,刘福川
(泉州师范学院 海洋与食品学院, 福建 泉州 362000)
近年来,赤潮的频繁爆发给海洋生态系统和海洋经济带来了巨大损失,引发了越来越多民众对赤潮治理的关注[1].微生物防治藻华被认为是环保、高效且最有潜力的控藻方法之一.其中,溶藻细菌(Algicidal bacteria)可通过直接溶藻或者间接溶藻的方式来抑制或杀死藻细胞,导致藻细胞溶解,以达到防治藻类水华的目的[2].直接溶藻指的是溶藻细菌通过直接接触藻细胞或者进入到藻细胞内的方式进攻藻类[3].间接溶藻指溶藻细菌分泌具有溶藻效应的次级代谢物质来溶解藻细胞或者通过与其竞争营养物质从而抑制藻细胞的生长[4].目前,已有确认具有溶藻活性的多种化合物被分离纯化,包括抗生素、蛋白质、多肽类、哈尔碱(Harmane)及含氮化合物等[5].
灵菌红素是化学结构中包含甲氧基吡咯骨架结构的一类天然红色素的总称,是一种由细菌产生的次级代谢产物[6-7].灵菌红素不仅具有抗细菌、抗真菌、抗疟疾和抗肿瘤等活性,而且针对一些微藻赤潮物种具有良好的溶藻效应[8-10].其中,一种由黏质沙雷氏菌发酵生产并纯化之后的灵菌红素,在浓度为5.0 μg/mL的条件下,在24 h内对新月菱形藻、中肋骨条藻、水华鱼腥藻和微小平列藻的杀藻率高达100%[8].另外,霍氏菌属(Hahella)KA22菌株所产生的灵菌红素对球形棕囊藻(Phaeocystisglobosa)的半抑制浓度为2.24 μg/mL,并且对赤潮异弯藻(Heterosigmaakashiwo)同样具有杀灭作用[9].灵菌红素在高温和酸性环境下可保持化学稳定性,然而,在自然光和碱性环境中则可被降解.在光强为 30 000 lx的光照下,5.0 μg/mL 黏质沙雷氏菌所产灵菌红素能够在36 h内完全分解[8-9].
甲藻是海洋生态系统中最重要的真核浮游植物类群之一,是海洋中仅次于硅藻的初级生产力贡献者,也是引发有害藻华及合成海洋毒素的主要类群[11].其中,东海原甲藻(Prorocentrumdonghaiense)是中国近海海域最重要的赤潮甲藻物种之一.21世纪以来,在我国近海海域几乎每年都会爆发大规模赤潮,给我国海洋生态环境及海洋经济带来了巨大损失[12].强壮前沟藻(Amphidiniumcarterae)属裸甲藻目,是一种以岩藻黄素为主要辅助色素的甲藻,能产生溶血性毒素,是一种世界性分布的有害赤潮藻种[13-14].KA22菌株所产生的灵菌红素对东海原甲藻同样具有杀灭作用[9],另外弧菌属(Vibrio)菌株S-9801所产生的灵菌红素(C20H25N3O)对东海原甲藻、链状亚历山大藻和锥状斯氏藻等几种甲藻具有一定抑制作用,但对甲藻的抑制作用远小于对其他门类如定鞭藻、针胞藻和硅藻的抑制作用[15].除此以外,关于产灵菌红素细菌及灵菌红素对典型甲藻赤潮物种溶藻活性的研究非常有限.
红色邻米草菌(Spartinivicinusruber)S2-4-1H为一株从泉州湾所分离的新型产灵菌红素菌株,可产生环庚基灵菌红素(cycloheptylprodigiosin,C22H27N3O)S-1和及庚基灵菌红素(heptylprodigiosin,C22H29N3O)S-2两种灵菌红素[16].而ZooshikellaganghwensisKCTC12044是一株从韩国江华岛滩涂沉积物样品中分离的以灵菌红素为主要次级代谢产物的细菌[17].本项目将以两种产灵菌红素菌株为对象,研究其对于东海原甲藻和强壮前沟藻的溶藻效应,为高效溶藻菌剂的开发提供理论基础.
1 材料与方法
1.1 实验材料
实验所用东海原甲藻和强壮前沟藻由厦门大学海洋生态基因组学实验室提供.藻细胞采用f/2培养基培养,培养温度为20℃,光暗周期为12 h∶12 h.
实验所用S.ruberS2-4-1H、Z.ganghwensisKCTC12044菌株及S2-4-1H产生的两种灵菌红素S-1(纯度≥95%)和S-2(纯度≥95%)由泉州师范学院海洋与食品学院应用微生物团队提供.细菌培养使用的培养基为2216E海洋肉汤(marine broth,MB)培养基.
1.2 实验方法
1.2.1 藻细胞密度及溶藻率测定 将藻细胞培养体系混合均匀,在超净工作台中抽取1 mL藻液,用海水稀释至适当密度,然后加入10 μL Lugol’s碘液,混合均匀后取100 μL样品加至浮游植物计数板,在显微镜下进行细胞计数,然后根据计数结果和稀释倍数计算细胞密度.溶藻率或者藻细胞的死亡率,根据不同条件下细胞密度的结果计算得出,其计算公式为溶藻率=[(NC-NT)/NC]×100%.其中:NC为对照组细胞密度;NT为实验组密度.
1.2.2 藻细胞光合系统II最大光合效率(Fv/Fm)的测量方法Fv/Fm是光合系统II最大光化学量子产量,反映了植物的潜在最大光合能力[18].非胁迫条件下该参数的变化极小,不受物种和生长条件的影响;胁迫条件下该参数明显下降.Fv/Fm的计算公式为Fv/Fm=(Fm-F0)/Fm.其中:F0是在暗处理后在测量光下获得的最小荧光值,Fm是暗处理后的藻细胞经过一个短暂而强烈的强光曝光后获得的最大荧光值,Fv为Fm与F0的差值.取藻细胞样品稀释至密度为2×104~3×104个/mL,暗处理20 min,之后使用水样荧光仪(Water-PAM)对Fm和F0值进行测量.
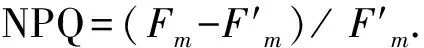
1.2.4 溶藻活性的研究方法 将藻细胞置于光照培养箱中培养,使其进入到指数生长期,取该时期生长状态良好的藻细胞进行溶藻活性实验.将活性良好的藻细胞置于24孔板中,分别加入终浓度为10、20、40 μmol/L的S-1和S-2,每个条件设置3个平行样品.分别于0、24、48 h取样进行藻细胞密度的测定,并计算溶藻率.
将在固体平板上活化培养后的单克隆细菌菌落接种至液体培养基,在30 ℃下摇菌培养48 h后获得细菌菌液,以不同体积比添加至藻类培养体系中进行混合培养实验,同时添加相应浓度MB培养基以排除MB本身对藻细胞生长的影响.在KCTC12044与东海原甲藻混合培养的实验中,制备细菌悬液进行添加以完全避免MB培养基对细胞生长的影响.取适量新鲜细菌菌液于50 mL无菌塑料离心管中,高速离心20 min,转速为12 000 r/min.之后将上清去掉,加入与之前菌液相同体积的无菌海水,将沉淀的细菌细胞重新悬浮起来,获得细菌悬液.将细菌菌液或悬液以不同的体积比加入培养至对数生长期的藻细胞培养体系中,每个条件设置3个平行样,置于光照培养箱中培养.每隔12 h对藻细胞密度进行测定,并计算溶藻率,同时测定藻细胞的Fv/Fm值.S2-4-1H与藻细胞混合培养实验中,每隔24 h对藻细胞进行NPQ的测定.
1.2.5 数据统计性分析 使用 PASW Statistics 18 软件进行单因素方差分析(analysis of variance, ANOVA),以此来评估不同实验条件下的统计学差异的显著性.图表中显示的数据为3个平行处理组的平均值,误差线为计算得出的标准方差.
2 结果与讨论
2.1 灵菌红素S-1及S-2对东海原甲藻的溶藻活性
灵菌红素S-1与东海原甲藻细胞混合培养的实验结果见图1(a)(c).在24 h内,添加3种浓度S-1的实验组中藻细胞浓度均显著下降(P<0.01),之后藻细胞浓度持续下降(图1(a));48 h时,3种浓度S-1对藻细胞的溶藻率均可达到90%以上,其中10 μmol/L S-1的溶藻率可高达95%(图1(c)).然而,另外2种更高浓度的处理条件并未带来更高的溶藻率,3种条件的藻细胞数目在48 h时并无明显差异(P>0.05).表明在10 μmol/L下,S-1对东海原甲藻即可达到很好的溶藻效果,但是提高浓度并不能进一步提高其对东海原甲藻的抑制和杀灭作用.

图1 不同浓度灵菌红素S1、S2与东海原甲藻混合培养时藻细胞密度和溶藻率的变化
灵菌红素S-2与东海原甲藻细胞混合培养的结果见图1(b)(d).在24 h时,3种浓度S-2均未对东海原甲藻细胞产生有效的抑制作用(P>0.05);48 h时,3种不同浓度S-2条件下藻细胞浓度均显著低于对照组(P< 0.01),但3种条件之间藻细胞密度并无明显差异(P>0.05).且48 h内3种浓度的S-2对东海原甲藻细胞的溶藻率均低于60%,表明S-2对东海原甲藻细胞的抑制效果并不理想(图1(d)).
Hahellasp.KA22所产生的一种戊基灵菌红素的溶藻实验表明,当其添加浓度为5 μg/mL(15.5 μmol/L)时,72 h时对东海原甲藻的溶藻率为73.8%[9].而从Vibriosp.S-9801中提取的一种结构相同的灵菌红素以4 μg/mL(12.4 μmol/L)添加至东海原甲藻培养体系时,30 h内溶藻率未超过60%[15].相比之下,本实验中所用的庚基灵菌红素S-2与戊基灵菌红素对东海原甲藻细胞的溶藻率处于类似的水平,但环庚基灵菌红素S-1具有明显更高的溶藻率.S-1和S-2的C原子个数相同,其不同点在于在3个三吡咯环母核以外结构中S-1的长链烷基与其中一个吡咯环中的两个碳原子形成邻位环化,组成一个八碳的环状结构,而S-2吡咯环以外的碳原子则为链状结构[16].S-2(C22H29N3O)与以往报道的戊基灵菌红素(C20H25N3O)结构类似,唯一不同在于在吡咯环以外的链状烷基上,S-2多了两个碳原子.本实验的结果表明,环庚基灵菌红素S-1对东海原甲藻细胞的抑制作用却明显高于庚基灵菌红素S-2和已报道过的戊基灵菌红素[9,15].对两种灵菌红素的抑菌效果研究表明,相对于S-2,S-1对白色念珠菌(CandidaalbicansATCC 10231)和大肠杆菌(EscherichiacoliJCM 1649)同样具有更高的抑制活性,但S-1和S-2对金黄色葡萄球菌(StaphylococcusaureusCMCC 26003)和枯草芽孢杆菌(BacillussubtilisMCCC1A00693)的抑菌活性差别不大[16].以上研究结合两种灵菌红素的溶藻实验,表明环庚基灵菌红素相对庚基灵菌红素针对某些物种具有更高的抑制活性,包括溶藻活性和抑菌活性.灵菌红素的结构与其生物活性,比如抗肿瘤及免疫抑制活性等有着紧密的关系,尤其是其B吡咯环上的甲氧基与细胞毒性的强弱有着重要影响[20].另外,长链烷基在吡咯环C12、C14位形成间位环化的间环灵菌红素(Metacyloprodigiosin)为所有天然灵菌红素中抗疟疾活性最强的一类化合物.然而,并未有报道表明环状结构灵菌红素的生物活性必然强于链状结构灵菌红素,但不可否认的是灵菌红素的结构必然影响其生物活性,其结构与活性的关系有待于更多不同结构类型灵菌红素被发现和研究.
2.2 灵菌红素S-1及S-2对强壮前沟藻的溶藻活性
不同浓度灵菌红素S1、S2分别与强壮前沟藻混合培养时藻细胞密度和溶藻率的变化如图2所示.
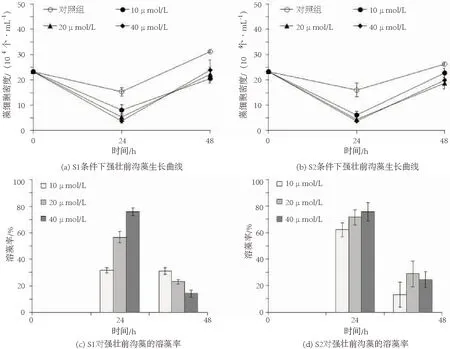
图2 不同浓度灵菌红素S1、S2分别与强壮前沟藻混合培养时藻细胞密度和溶藻率的变化
将灵菌红素S-1以3种浓度添加至强壮前沟藻培养体系中,24 h时对照组藻细胞密度亦有小幅下降,可能是因为该甲藻没有细胞壁,在转接过程中造成部分细胞损伤及死亡;而东海原甲藻具有细胞壁,因此转接操作对其影响较小,细胞在24 h内即适应并快速增长.而3种条件下的藻细胞密度均显著低于对照组(P<0.01),然而在24~48 h,细胞密度反而呈增高趋势,表明强壮前沟藻细胞的生长并未被有效抑制(图2(a)).同样,S-1对藻细胞的溶藻率也是呈先升高后下降的趋势,在48 h时,3种条件下的溶藻率均不超过35%(图2(c)),表明浓度40 μmol/L以内的S-1不能对强壮前沟藻细胞产生有效的抑制作用.与S-1类似,将不同浓度的S-2添加至强壮前沟藻细胞培养体系后,藻细胞同样呈现先降后升的现象(图2(b));与之相对应,溶藻率也呈现先升高后下降的趋势,且3种浓度条件下的溶藻率在24 h和48 h均未有显著差别(P>0.05),表明浓度40 μmol/L以内的S-2同样不能有效抑制对强壮前沟藻细胞的生长.
综上所述,S1和S2均能在24 h内对藻细胞造成一定的杀灭作用,但在后期抑制效果明显减弱.其原因可能为强壮前沟藻细胞具有某种针对灵菌红素造成损伤的修复机制,从而抵制了灵菌红素的伤害.同时,所加的灵菌红素在光照作用下被部分分解,也引起了其对藻细胞抑制作用的减弱.
2.3 S. ruber S2-4-1H菌液对东海原甲藻的溶藻活性
由于大部分已报道的灵菌红素都具有光解性质[8-9],且其提取需要额外成本,因此尝试探究在用于赤潮防治时,产灵菌红素菌株本身是否同样有效.如此可降低成本,且菌株在环境中可更为持久的分泌灵菌红素用于抑藻.将S.ruberS2-4-1H菌液以不同体积比添加至东海原甲藻培养体系中,结果见图3,与对照组相比,1%、2%、5%菌液条件下藻细胞密度均明显降低(图3(a));72 h时,1%和5%下藻细胞密度类似(P>0.05),均在70%以上.相应的,3种条件下的溶藻率在72 h内均呈上升趋势(图3(b)).

图3 添加不同体积比的红色邻米草菌菌液与东海原甲藻混合培养时生代参数测定结果
光合系统参数的测定结果表明,从24 h开始,3种条件下东海原甲藻细胞的Fv/Fm均显著下降并趋近于零(图3(c)),并且NPQ也处于极低水平,表明在S2-4-1H菌液添加条件下,东海原甲藻细胞的光合系统遭受了很大的破坏,几乎丧失光合作用及光保护能力.这与以往灵菌红素导致微藻细胞光合效率下降的研究结果是一致的[10].只是在本实验中,Fv/Fm下降的程度更高,基本为零.综上所述,S2-4-1H菌液直接添加可显著破坏东海原甲藻细胞的光合系统,包括光合作用系统及光保护系统,对藻细胞产生有效的抑制作用.
2.4 Z. ganghwensis KCTC12044对东海原甲藻和强壮前沟藻的溶藻活性
为排除实验中MB对藻细胞生长的影响,制作细胞悬液以除去MB,用于Z.ganghwensisKCTC12044对东海原甲藻的溶藻实验.将KCTC12044的细菌悬液分别以1%,5%,10%的体积比加入到对数生长期的东海原甲藻培养体系中,结果见图4.
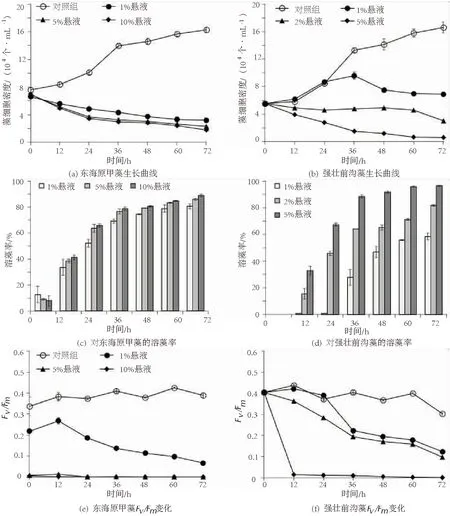
图4 添加不同体积比的Zooshikella ganghwensis细菌悬液或菌液与东海原甲藻和强壮前沟藻混合培养时藻细胞密度、溶藻率及Fv/Fm的变化
结果表明,3个体积比条件下,细胞密度均明显下降(P<0.01),72 h时的溶藻率分别达到80.5%,85.9%和89%(图4(a)(c)).Fv/Fm测定结果显示,1%悬液条件下,藻细胞的Fv/Fm被明显抑制,且12 h后呈持续下降趋势;而5%和10%悬液条件下,Fv/Fm自悬液添加之后就已经接近于零,且在24 h后保持在零(图4(e)),表明5%的悬液就足以使藻细胞在24 h内完全丧失光合作用能力.因此,KCTC12044细菌悬液在3种体积比条件下均可有效抑制东海原甲藻细胞的生长,使其基本丧失光合作用能力,产生良好的溶藻活性.
预实验结果表明,KCTC12044的1%、5%及10%细菌悬液均不能有效抑制强壮前沟藻细胞的生长,且5%MB本身对强壮前沟藻细胞生长并没有抑制作用,因此在KCTC12044对强壮前沟藻的溶藻活性实验中,仍采用细菌菌液进行溶藻实验.将细菌菌液分别以1%,2%,5%的体积比加入到强壮前沟藻培养体系中,并对其藻细胞密度、Fv/Fm及溶藻率进行测定,结果见图4(b)(d)(f).结果显示,添加菌液的处理组,藻细胞密度和Fv/Fm均明显低于对照组;且菌液浓度越高,藻细胞密度和Fv/Fm越低,表明菌液中的灵菌红素对藻细胞的生长和光合作用产生了明显的抑制效果.其中,5%菌液处理组中藻细胞的Fv/Fm在48 h时就已降低至零,溶藻率已高达91.6%.72 h时,1%,2%,5%菌液条件下的溶藻率分别达到58.5%,81.7%和96.4%,表明在实验所用3个体积比中,1%菌液处理组的抑藻效果并不理想,而2%和5%两个体积比条件下,均取得80%以上的溶藻率,且5%条件下的溶藻效果最为理想.表明KCTC12044在较高浓度条件下对强壮前沟藻细胞具备有效的杀灭作用.
上述结果表明,同一种产灵菌红素菌株或灵菌红素对两种甲藻物种的溶藻活性是不同的,其中KCTC12044细菌悬液及S1对强壮前沟藻均不具备良好的溶藻活性,但对东海原甲藻却产生了有效的抑制作用.表明不同甲藻对灵菌红素的耐受性是不一样的,这与以往研究中灵菌红素对不同甲藻具有不同的半抑制浓度和溶藻效率的研究结果是类似的,并且灵菌红素对不同门类的藻类同样具有不同的溶藻活性[9,15].一般来说,甲藻门物种相对其他门类的物种对灵菌红素具有更强的耐受性.
3 结论
S2-4-1H所分泌的环庚基灵菌红素S-1对东海原甲藻具有良好的抑制作用,10 μmol/L的S-1在48 h内对东海原甲藻的溶藻率可高达95%以上,但S-1和S-2均不能有效抑制强壮前沟藻细胞的生长.S2-4-1H菌液亦可在24 h内使东海原甲藻细胞基本丧失光合作用和光保护能力,对其生长产生有效抑制.而另一种产灵菌红素菌株KCTC12044对东海原甲藻和强壮前沟藻均能产生有效抑制作用.其中,5%细菌悬液可在24 h使东海原甲藻细胞光合效率降至零,但对强壮前沟藻没有有效抑制作用;而5%菌液可在72 h内对强壮前沟藻可产生95%以上的溶藻率.综上所述,不同产灵菌红素菌株及不同类型灵菌红素对两种甲藻细胞的溶藻活性不同,东海原甲藻和强壮前沟藻对同一种产灵菌红素菌株或者灵菌红素的耐受性也有所不同,其中适宜浓度的S.ruberS2-4-1H和Z.ganghwensisKCTC12044及环庚基灵菌红素S-1对东海原甲藻均具有良好的溶藻活性,为其用于东海原甲藻赤潮防治提供了理论依据.
