福建武夷山地区土壤可培养放线菌多样性分析
2022-11-28吴宝川陈小尘黄兆斌周艳黄卫红郑晓婷薛喜枚张秋芳
吴宝川,陈小尘,黄兆斌,周艳,黄卫红,郑晓婷,薛喜枚,张秋芳*
(1.泉州师范学院 海洋与食品学院,福建 泉州 362000;2.福建农林大学 食品科学学院,福建 福州 350007;3.武夷山国家公园科研监测中心,福建 武夷山 354300;4.中国科学院城市环境研究所,福建 厦门 361021)
放线菌是微生物的重要组成部分,在土壤有机物矿化、物质循环、环境治理和生态修复等过程中起着主导作用,对维持生态系统稳定性和可持续性具有重要意义[1-3].自然界中与人类密切相关的微生物次生代谢产物70%以上来源于放线菌,其中大约三分之二的抗生素具有临床意义[4].土壤放线菌现今仍然是新医药和新农药研制的重要源头,是一类具有广阔应用前景和经济效益的宝贵微生物资源[4-7],因此,对土壤中可培养放线菌多样性的研究具有重要意义.
武夷山国家公园位于福建省西北部与江西省交界处(117°27′~117°51′E,27°35’~27°54′N),气候温暖湿润,是世界上同纬度带现存面积最大、保存最完整和生物资源最为丰富的生态系统[8],是中国东南部生物多样性保护中唯一的和最具有关键意义的区域[9],是我国首批正式设立的五大国家公园之一.多元化的土壤和植被类型使得该地区的土壤微生物群落组成丰富多样.近年来,关于武夷山地区微生物多样性研究已相继被报道,如李巍等[10]应用高通量测序技术(HTS)研究了武夷山土壤微生物群落的季节动态;吴则焰等[11]应用运用磷脂脂肪酸标记法(PLFA)研究武夷山不同海拔植被带土壤微生物群落结构特征.但前人主要研究了武夷山地区整体微生物的群落组成多样性,关于该地区土壤可培养放线菌种类及其组成多样性的相关研究尚未见详细报道.
本研究对位于福建的武夷山国家公园内24个长期定位观测点的土壤放线菌进行培养、分离和纯化,并结合分子生物学方法,将获得的菌株进行16S rRNA基因鉴定和系统发育分析.通过对该地区重要点位土壤可培养放线菌种类和群落多样性分布特征分析,为合理开发和利用该地区的放线菌资源提供科学依据.
1 材料与方法
1.1 研究区域概况
武夷山地区沿海拔交错分布了竹林、古树群、茶园、马尾松林、针阔混交林、岩生植物、乌冈栎林和野生茶园等不同植被类型.对地质、地貌和植被类型进行长期监测后,最终确定以沿海拔的植被分布为采样依据.为了尽可能使采样点能够覆盖前期的观测区域,选取了不同海拔和植被类型的24个观测样地作为采样点(117°74′~117° 96′E,27°60′~27° 77′N),采样地详细信息见表1.
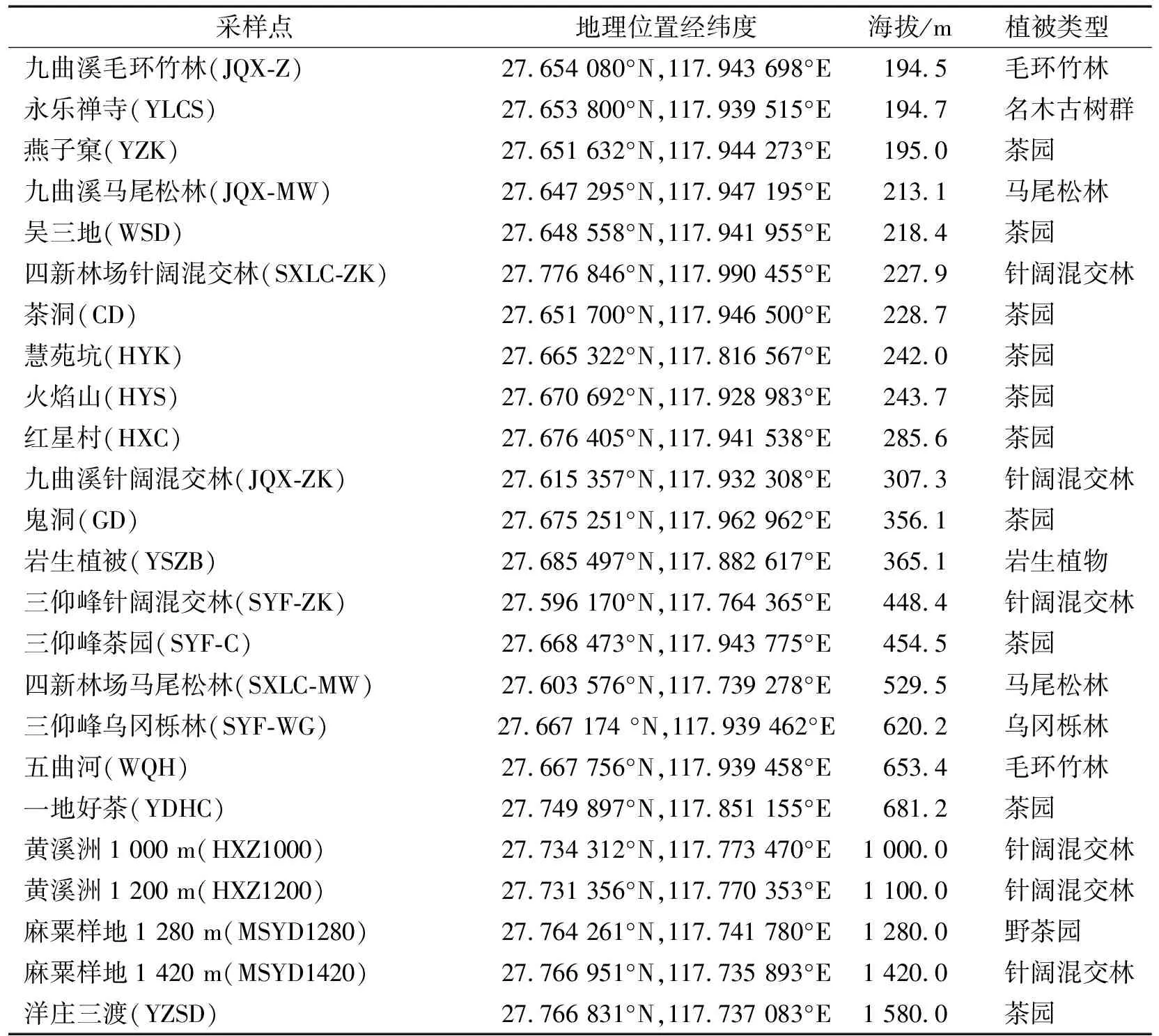
表1 武夷山国家公园土壤样品采集点信息
1.2 研究方法
1.2.1 土壤样品采集 于2018年和2019年连续采集了福建武夷山地区24个采样点的土壤样品,每个采样点选取3个区域,设为重复3次,根据“S”形分布多点采样.采样时,先将地表以上2 cm的枯枝落叶去除,在不破坏土壤各层结构情况下,用消毒后的不锈钢铲采集0~30 cm深度的土壤样品[12].取300 g土壤样品混合均匀后装于无菌自封袋,在低温下运回实验室,用于放线菌的分离、培养和纯化.
1.2.2 放线菌的分离培养 将每个采样点采集的3份新鲜土壤样品分别去除根系和石砾等杂质,充分混匀后称取1 g新鲜土壤,采用10倍梯度稀释法[13],取稀释倍数为104、105和106的3个梯度浓度的稀释液,均匀涂布在高氏一号固体培养基(GA)上,于28 ℃培养3~5 d[14].待菌落长出后,挑选形态、大小和颜色不同的单菌落,用三区划线法进行转接和纯化3次后,将单菌落于4 ℃低温保存用于鉴定.
1.2.3 放线菌的鉴定 将1.2.2中分离获得的菌株用高氏一号液体培养基培养,经离心和清洗后的菌体用细菌基因组DNA提取试剂盒(上海赛百盛基因技术有限公司)提取基因组DNA,提取过程参照说明书进行.以提取的DNA为模板,用细菌16S rRNA基因通用引物Eub27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增[15].PCR反应程序为:94 ℃ 预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min(30个循环);最后72 ℃下延伸10 min.取部分PCR产物经1%琼脂糖凝胶电泳在自动凝胶成像仪上进行观察检测后,将具明亮条带的PCR产物样品送至厦门铂瑞生物科技有限公司,于ABI3730I测序仪进行DNA测序.

2 结果与分析
2.1 武夷山地区可培养放线菌类群分布
采用高氏一号培养基对武夷山24个样地中的土壤放线菌进行分离培养,共获得109株纯培养放线菌,根据16S rRNA基因序列分析和比对后,鉴定表明这109株菌分别属于5个目、6个科、10个属,结果如图1和表2所示.
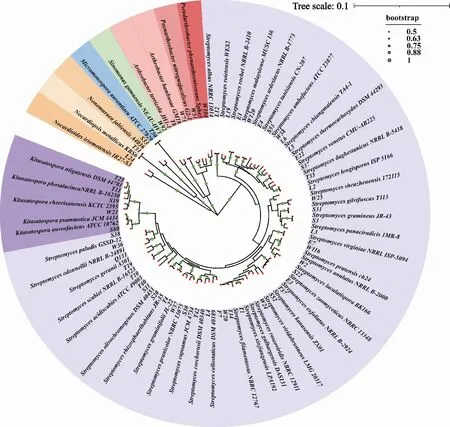
图1 武夷山土壤可培养放线菌的16S rRNA基因N-J系统发育树
10个属分别为链霉菌属(Streptomyces)、节杆菌属(Arthrobacter)、假节杆菌属(Pseudarthrobacter)、类节杆菌属(Paenarthrobacter)、北里孢菌属(Kitsatospora)、小单孢菌属(Micromonospora)、中国单胞菌属(Sinomonas)、拟诺卡氏菌属(Nocardiopsis)、类诺卡氏菌属(Nocardiodies)和野野村菌属(Nonomuraea).其中,链霉菌属和北里孢菌属的数量分别有79株和17株,占总放线菌总数的72.48%和15.60%,其次是中国单胞菌属和节杆菌属,分别占放线菌总数的3.67%和2.75%,而其他属都只分离到1株.所分离到的109株放线菌菌株中包含57种不同的放线菌,结果如表2所示.其中,42种为链霉菌,5种为北里孢菌,2种为节杆菌,其余7个属的放线菌只含有1个种.嗜热一氧化碳链霉菌(Streptomycesthermocarboxydus)是链霉菌属的优势种,占链霉菌属菌种总数的8.86%;其次是维吉尼亚链霉菌(Streptomycesvirginiae),占链霉菌属菌种总数的6.33%,而其他链霉菌属种类数量较少.北里孢菌属中,Kitasatosporaxanthocidica和光气北里孢菌(Kitasatosporaphosalacinea)是优势种,占全部放线菌总数的7.40%和5.50%.

表2 武夷山土壤可培养放线菌菌株鉴定结果
放线菌物种数量的分布结果见表3.表中显示,低海拔样地土壤分离到的放线菌数量总体高于高海拔样地,表明武夷山低海拔地区温和的气候条件更适合土壤放线菌生存.茶园土壤中的放线菌数量明显高于其他样地土壤,在茶园土壤中共分离到55株放线菌,占所有放线菌的50.46%,包含8个属的36种不同放线菌.针阔混交林、毛环竹林、乌冈栎林土壤中分离得到了包括链霉菌属、北里孢菌属、拟诺卡氏菌属和假节杆菌属4个不同属.马尾松林、名木古树群和岩生植被土壤中只分离到链霉菌属.由此可见,不同植被类型土壤中的可培养放线菌类群具有明显差异,其中茶园土壤更有利于多种可培养放线菌类群共存,而仅有链霉菌属能够适应马尾松林、名木古树群和岩生植被的独特土壤环境.

表3 武夷山土壤可培养放线菌的多样性指数
2.2 武夷山土壤放线菌群落多样性分析
由表3可知,不同样地土壤中可培养放线菌属水平下的多样性指数存在差异.Simpson指数最高和Shannon指数最高的均为鬼洞(GD)和黄溪洲1 200 m(HXZ1200)样地,分别为0.667和1.099.所有样地Pielou指数在0.223~1.000.除了燕子窠(YZK)外,低海拔茶园样地放线菌的多样性指数相对较高,而随着海拔升高,除了一地好茶(YDHC)外,其他茶园样地的放线菌多样性指数降低,三仰峰茶园(SYF-C)、麻粟样地1 280 m(MSYD1280)和洋庄三渡(YZSD)的放线菌多样性指数均为0.茶园作为经济作物,武夷山地区的茶农会经常对其进行追肥,外来有机肥增加了土壤有机质含量,进而提高了低海拔茶园土壤放线菌的多样性.高海拔的低温环境限制了土壤放线菌对外来有机肥和茶树凋落物形成的单一类型有机质的利用,这可能是导致高海拔茶园土壤放线菌的多样性降低的原因.然而,高海拔的一地好茶(YDHC)样地的放线菌多样性指数并不为0,这可能和一地好茶(YDHC)茶园四周分布着大量的针阔混交林有关,针阔混交林形成的凋落物落入茶园后与茶树凋落物形成了丰富多样的有机质,能够被更多不同的土壤放线菌利用,因此促进了一地好茶(YDHC)样地的放线菌多样性.其他植被类型的低海拔样地如永乐禅寺(YLCS)、九曲溪马尾松林(JQX-MW)、四新林场针阔混交林(SXLC-ZK)和岩生植被(YSZB)等,多样性指数均为0.这些样地的海拔均低于400 m,是武夷山景区游客频繁旅游的区域,大量的人为活动可能是导致这些区域放线菌多样性低于其他区域的重要原因.高海拔的四新林场马尾松林(SXLC-MW)和五曲河(WQH)的多样性指数同样为0,这2个样地单一植被类型形成的单一类型土壤有机质在高海拔的高寒气候条件下并不利于被土壤放线菌降解.除了茶园样地外,其他土壤放线菌多样性指数较高的多为海拔较低或是具有混合植被类型的土壤样地,低海拔的温和气候有利于土壤放线菌分解有机质,而混合植被类型凋落物形成的丰富有机质能够为放线菌提供更多的养分.通过对比可培养放线菌物种数量分布和多样性差异,表明海拔梯度、植被类型,以及人为活动共同影响了武夷山地区土壤可培养放线菌的多样性和分布.
3 讨论
本研究对福建省内武夷山国家公园内定位观测的重要点位土壤中可培养放线菌资源进行了分离、培养和鉴定,共获得了含盖5个目、6个科、10个属的109株可培养放线菌菌株,其中有5个属共17种放线菌菌株的16S rRNA基因序列与其模式菌株相似性低于99%,可能是属于潜在的新种[19-20].在获得的可培养放线菌菌株中,链霉菌属(Streptomyces)的物种数量最多,种类最丰富,占可培养的放线菌总数量的72.48%,说明链霉菌属是福建武夷山地区土壤中可培养放线菌的优势菌群.刘闯等[21]从河南省不同地区的潮土、黄棕壤、水稻土、褐土、盐碱土5种土壤中共分离了17个属的955株放线菌,其中链霉菌属株751株,占比达到78.64%,这与本研究的72.48%相近;17个属中,放线菌属(Actinomycete)、马杜拉放线菌(Actinomadura)、不动杆菌属(Acinetobacter)、拟无枝菌酸菌(Amycolatopsis)、分枝杆菌属(Mycobacterium)、原小单孢菌属Promicromonaspora)、链孢囊菌属(Streptosporangium)、链孢子囊菌属(Streptosporangiaceae)、红球菌属(Rhodococcus)、丝菌属(Saccharothrix)、嗜酸链霉菌属(Streptacidiphilus)11个属本研究未分离获得,但不包括本研究分离的节杆菌属、假节杆菌属、类节杆菌属、中华单胞菌属、拟诺卡氏菌属.在贵州省多地的不同土壤中分离获得的4属共48种可培养放线菌中,链霉菌属占比高达85.42%,小单孢菌属占比 6.25%,诺卡氏菌属和类诺卡氏菌属皆占比4.17%[22].而在广西北仑河口红树林根际土壤中获得的链霉菌属则是该地区的第二优势放线菌属,占比为24.50%,低于占总放线菌数量50.00%的小单孢菌属[23].表明可培养链霉菌属广泛分布于不同地区的独特土壤类型中,对土壤环境具有高度适应性,但其在土壤中的含量可能还受到例如植被根际凋落物等外部环境的影响.而土壤中的可培养稀有放线菌属的分布则因地域和土壤环境而异,在跨度不同的地域土壤中可培养稀有放线菌属具有明显差异.多样性分析结果表明武夷山不同样地的放线菌含量和多样性差异明显.通常,海拔梯度、植被类型和有机质等土壤性质的组成被认为是影响放线菌分布的重要因素,不同海拔的植被类型能够通过调节土壤结构和有机质组成来间接影响土壤微生物群落多样性[24-28].追加有机肥的茶园土壤和具有混交植被类型的土壤中充足和多样的土壤有机质组成促进了这些样地的可培养放线菌多样性,而单一植被类型形成的单一类型土壤有机质的样地中可培养放线菌多样性较低[28].除了一些受人为活动影响较大的土壤样地外,大部分低海拔样地土壤中可培养放线菌的多样性均高于高海拔样地.因为低海拔的温和气候条件更有利于土壤放线菌降解和利用土壤有机质,而高海拔地区高湿低温的环境会抑制土壤放线菌的有机质降解活性,不利于土壤放线菌生存[27].然而,人为活动较为频繁的低海拔样地中的可培养放线菌多样性降低的原因可能和生态环境被破坏有关.
不同放线菌物种具有功能多样性.与已有报道的菌株进行比对后,发现本研究中获得的放线菌菌株可能也具有多种不同的潜在功能.如永乐禅寺(YLCS)名木古树根际土壤中分离到的与产水链霉菌(Streptomyceshydrogenans)相似的T1菌株,可能具有促进植物生长、增强光合色素和生物防治等潜在功能[29];而在该样地土壤中获得的另外一株菌株E7则与维吉尼亚链霉菌(Streptomycesvirginiae)NRRL ISP-5094相近,可能会产生对革兰氏阳性菌有抑制作用的维吉尼亚霉素[30];于洋庄三渡(YZSD)土壤中分离到的S52菌株与StreptomyceskanasensisZX01[31]和无环链霉菌(Streptomycesanulatus)NRRL B-2000[32]等菌株相近,可能会产生对病毒等具有较强抗性的次生代谢物;五曲河(WQH)附近分离到的L12菌株与白色链霉菌(Streptomycesalbus)NBRC13014相近,可能会产生类似于阿维诺内酯的具活性的丁烯内酯化合物[33];三仰峰针阔混交林(SYF-ZK)土壤中获得的与产二素链霉菌(Streptomycesambofaciens)ATCC 23877相近的W38菌株,可能具有治疗和预防各种人体病原菌感染的功能[34];在燕子窠(YZK)茶园土壤获得的与突尼斯链霉菌(Streptomycestunisiensis)CN-207[35]相近的S53菌株可能是一种新代谢物的来源.除链霉菌外,在福建武夷山地区分离得到的其他土壤放线菌可能同样具有重要的价值,如获得的部分类诺卡氏菌属菌株可能具有降解异戊二烯等的功能的完整异戊二烯单加氧酶基因簇[36].此外,激活链霉菌沉默生物合成基因簇,可望对获得的未知功能菌株中所含有潜在抗性等功能基因进行研究和应用,也是当下放线菌研究的热点[37].因此,本次分离到的菌株可能具有成为重要微生物资源的潜在价值,但其功能和用途还有待进一步研究和探讨.
传统的纯培养方法在微生物研究中仍然是一种非常重要的技术手段,它可直接获得菌种资源及微生物的形态、生理特性和代谢功能等信息,但纯培养方法具有一定的局限性,可能无法完全地反映出地域或生境之间微生物群落结构和多样性的差异[38-40].此外,不同环境来源的放线菌可能会对不同的培养基具有选择性.因此,为最大化获取不同环境的可培养放线菌物种,对分离所用的培养基等培养条件还有待于进一步地优化.同时,本次研究点位有限,菌株的培养分离、筛选和鉴定工作量大,土壤中可能还有菌株未能通过纯培养分离获得.因此,为更全面了解土壤中放线菌物种,还有待于对培养条件的优化并结合现代分子生物学技术如高通量测序分析等作进一步较全面的分析.
