甲藻甾醇在海洋和湖泊古环境重建中的应用
2024-06-03游洋李婧婧张恩楼
游洋 李婧婧 张恩楼


游洋,李婧婧,張恩楼.甲藻甾醇在海洋和湖泊古环境重建中的应用.吉林大学学报(地球科学版),2024,54(3):752772. doi:10.13278/j.cnki.jjuese.20230163.
You Yang,Li Jingjing,Zhang Enlou. Application of Dinosterol in Marine and Lacustrine Environments: Implication for Paleoenvironment Reconstruction. Journal of Jilin University(Earth Science Edition), 2024,54(3):752772. doi:10.13278/j.cnki.jjuese.20230163.
摘要:
甲藻甾醇(dinosterol)是甲藻(dinoflagellate)细胞膜脂的重要组分,作为甲藻的生物标志物,它具有来源特异性、结构稳定、抗降解能力强等特点,广泛分布于海洋、湖泊等各类沉积载体中,有效记录不同地质历史时期古环境的信息。目前,利用甲藻甾醇质量分数及其单体氢同位素组成开展重建早期生态环境变化的研究,为理解早期气候和环境变化、生态系统响应提供新视角,因此甲藻甾醇是近年来海洋和湖泊古环境重建研究的热点生物标志物之一。基于此,本文首先介绍甲藻甾醇的结构、生物来源及其在海洋、湖泊等环境的分布特征,简要概述且对比甲藻甾醇的几种纯化方法,并在阐述其重建古环境、古气候原理的基础上,进一步总结甲藻甾醇的古环境指示意义,特别是其质量分数在古生产力重建以及甲藻甾醇单体氢同位素组成在盐度、降水重建上的研究进展。据此,我们提出甲藻甾醇在古环境重建研究中应注意的问题,如甲藻甾醇的具体生物来源、环境因子对甲藻甾醇的影响等。
关键词:
甲藻甾醇;古环境;单体氢同位素;生物标志物;海洋;湖泊
doi:10.13278/j.cnki.jjuese.20230163
中图分类号:P531;Q 946.48
文献标志码:A
收稿日期:20230705
作者简介:游洋(1999—),女,硕士研究生,主要从事湖泊沉积与环境演化方面的研究,E-mail:youyang21@mails.ucas.ac.cn
通信作者:李婧婧(1984—),女,助理研究员,博士,主要从事湖泊沉积与环境演化方面的研究,E-mail:jjli@niglas.ac.cn
基金项目:国家自然科学基金项目(42025707,41977384);中国科学院南京地理与湖泊研究所青年人才托举项目(NIGLAS2022TJ04);流域关键带演化湖北省重点实验室开放基金项目(CEZ2022F01)
Supported by the National Natural Science Foundation of China (42025707,41977384),the Science and Technology Planning Project of Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences (NIGLAS2022TJ04) and the Open Foundation of Hubei Key Laboratory of Critical Zone Evolution, China University of Geosciences (CZE2022F01)
Application of Dinosterol in Marine and Lacustrine Environments: Implication for Paleoenvironment Reconstruction
You Yang1,2,Li Jingjing1,Zhang Enlou1
1.
Nanjing Institute of Geography and Limnology,Chinese Academy of Sciences/State Key Laboratory of Lake Science and Environment,Nanjing 210008,China
2. College of Resources and Environment,University of Chinese Academy of Sciences,Beijing 100049,China
Abstract:
Dinosterol, also known as dinoflagellate sterol, is an important component of cell membrane lipids of dinoflagellate. As a biomarker of dinoflagellate, dinosterol is featured by high source specificity, structural stability, and resistance to degradation. It widely distributed in various sedimentary environments, such as oceans and lakes as well as peat, and this compound effectively records paleoenvironmental information from different geological periods. Currently, dinosterol and its hydrogen isotope composition have been used to reconstruct past ecological and environmental changes. The application of dinosterol provides a new perspective for understanding past climate and environmental changes and ecosystem responses. Therefore, dinosterol has become one of the key biomarkers in marine and lake paleoenvironmental reconstruction studies in recent years. Based on this, this paper first introduced the structure, biological sources, and distribution characteristics of dinosterol in marine and lake environments. It briefly outlined and compared several purification methods of dinosterol, and then explained the principles underlying its use in reconstructing paleoenvironments and paleoclimates. Furthermore, the paper summarized the paleoenvironmental implications of dinosterol, particularly its content in reconstructing paleoproductivity and its hydrogen isotope ratios in reconstructing salinity and precipitation. Accordingly, the paper also presented future considerations for dinosterol in paleoenvironmental reconstruction studies, such as the specific biological sources of dinosterol and the impact of environmental factors on dinosterol.
Key words:
dinosterol; paleoenvironment; compound-specific hydrogen isotope composition; lipids biomarkers; ocean; lake
0 引言
甲藻甾醇(dinosterol)是一类主要来源于甲藻(dinoflagellate)细胞膜脂的甾类化合物,广泛分布在海洋、湖泊等自然环境中[1]。由于甲藻甾醇结构稳定、不易降解,在不同类型沉积载体中能够长期稳定地保存,并对多种环境因子(温度、营养盐)响应敏感[2],在古环境重建研究中具有良好的应用价值[34]。目前,甲藻甾醇在古环境重建中的应用主要基于其质量分数以及单体氢同位素组成这两类指标。一方面,保存在沉积物中的甲藻甾醇质量分数与甲藻生物量具有良好的相关性[5],因此能有效示踪甲藻生物量在不同地质历史时期的时空变化[69],并且与传统生物化石指标甲藻孢囊相比,甲藻甾醇在短时间尺度的现代沉积物研究中降解率更低,能更准确地反演甲藻的生物量[10]。另一方面,随着单体同位素分析测试技术的进步,甲藻甾醇的单体氢同位素组成(δD)可以溯源环境水源的δD信息,为定量重建古水文变化,特别是盐度与降水的研究提供新方法[1119]。例如,来自美国东部切萨皮克海湾(Chesapeake bay)的研究表明,海水的δD与盐度之间具有较好的正相关关系,而海水悬浮颗粒物和表层沉积物中甲藻甾醇的δD均能有效记录海水盐度的变化,与盐度之间呈显著正相关关系,是指示表层海水盐度变化的有效代用指标[20]。此外,在降水重建研究中,来自南太平洋热带辐合带(SPCZ)区域湖泊的沉积记录显示,湖泊表层沉积物中甲藻甾醇δD与降水量之间呈现显著负相关,据此成功定量重建该区域的年均降水量信息[17]。因此,甲藻甾醇是近年来海洋和湖泊古环境重建研究的热点生物标志物之一,受到了广泛关注。基于此,本文首先介绍甲藻甾醇的结构特征、生物来源及其在不同类型沉积载体中的分布特征,简要概述且对比甲藻甾醇的几种纯化方法,最后重点阐述甲藻甾醇在古生产力、降水以及盐度重建方面的研究进展。
1 甲藻甾醇的结构、生物来源与分布
1.1 甲藻甾醇的结构
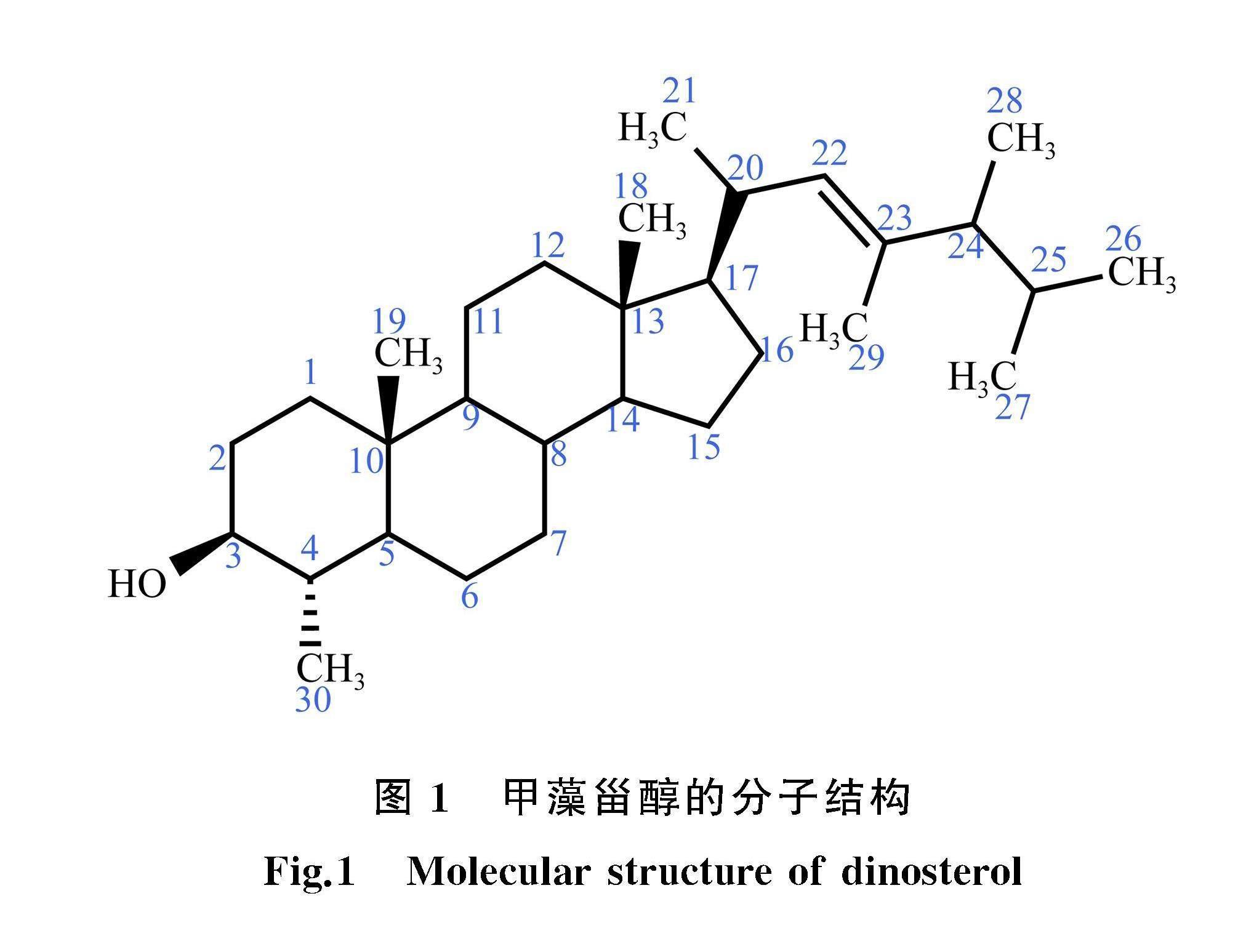
甲藻甾醇主要来源于甲藻细胞膜,是甲藻特征脂类4α甲基甾醇中的一类常见甾醇,其扁平状的构型以及稳定的甾醇骨架,能够有效增强甲藻细胞膜的韧性[3,21]。甲藻甾醇最早从膝沟藻Gonyaulax tamarinsis(Alexandrium tamarensis)的单藻培养细胞中分离并鉴定[22],其分子式为C30H52O,携带3个六元环和1个五元环,属于四环三萜类化合物(图1)。质谱结果显示其在六元环C4上有1个甲基,并在侧链C22上携带双键,但尚无法确定该双键的立体化学结构以及C24处的构型[22]。随后来自X射线的分析结果确定甲藻甾醇的具体结构为(22E,24R)4α,23,24Rtrimethyl5αcholest22Een3βol[23](图1)。此外,甲藻甾醇的五元环和六元环结构中均不携带双键,具有4α单甲基饱和环系统[24],同时其侧链上存在特殊的C23,24双甲基烷基化结构,这种侧链结构仅发现于硅藻以及定鞭金藻合成的4去甲基甾醇中[3]。以上这些特征结构均表明甲藻甾醇明显有别于甲藻合成的其他4α甲基甾醇。
1.2 甲藻甾醇的生物来源
与其他具有广泛生物来源的生物标志物,如正构烷烃、脂肪酸等相比,甲藻甾醇的生物来源更为明确。来自全球范围的室内培养实验及野外调查结果显示,海洋环境甲藻甾醇主要来源于多种海洋甲藻,绝大多数高等植物无法合成,因此具有明确的生物指示意义(表1)。虽然有前人报道海洋无脊椎动物体内检测出甲藻甾醇,但后续研究显示这有可能来源于无脊椎动物摄食或共生的甲藻[59]。1976年,有学者通过研究北大西洋海岸膝沟藻Gonyaulax tamarensis的甾醇组分,首次从该生物体的单藻培养细胞中获取并分离甲藻甾醇[22]。随后越来越多的海洋甲藻培养实验结果显示,除膝沟藻Gonyaulax spp.外,隐甲藻Crypthecodinium spp.、薄甲藻Glenodinium spp.、异帽藻Heterocapsa spp.等也能合成甲藻甾醇[24,28,30,35,4748]。众多野外研究工作也陆续报道海洋沉积物中甲藻甾醇质量分数与甲藻残体或孢囊之间存在较好的对应关系,进一步證实甲藻是甲藻甾醇的生物来源[6061]。例如,Boon等[62]发现黑海沉积物中甾醇质量分数占优势的甲藻甾醇,与沉积物中丰富的甲藻孢囊证据相吻合,并据此将甲藻甾醇作为指示海洋甲藻赤潮暴发的生物标志物。然而需要注意的是,海洋硅藻舟形藻Navicula sp.也能合成少量甲藻甾醇,因此在缺乏甲藻残体或孢囊等证据的环境中,无法确定甲藻是甲藻甾醇的唯一生物来源,硅藻也有可能贡献甲藻甾醇[6365]。
相较之下,关于湖泊环境甲藻甾醇生物来源的研究较少。研究者在英国Priest Pot湖通过对比分别来自于表层沉积物和多甲藻Peridinium lomnickii的脂质组分,发现两类载体中的甾类组分,主要包括4α甲基甾醇和4α甲基甾酮,且其在相对质量分数及比例上一致,而甲藻甾醇是4α甲基甾醇中的一种特殊甾醇,首次揭示湖泊环境中的甲藻甾醇来源于多甲藻P. lomnickii的贡献[53]。这与后续在淡水湖埃尔洪科湖(EI Junco)中对沉积物甾醇分布特征的研究结果一致,多甲藻属中的某种甲藻是甲藻甾醇的主要来源[66]。随后,室内培养实验也陆续揭示淡水甲藻种,如冠状网甲藻Woloszynskia coronata、腰带多甲藻Peridinium cinctum等也能合成甲藻甾醇(表1)。然而,有学者在湖泊沉水植物——狸藻Utricularia neglecta的脂质组成中也检测出甲藻甾醇的分布,据此推测狸藻很有可能是湖泊沉积物中甲藻甾醇的重要来源[58]。
大量研究表明,绝大多数甲藻都能在其生命周期的任何阶段合成甲藻甾醇,是甲藻的甾醇组成中常见的优势组分之一,如膝沟藻Gonyaulacales spp.、裸甲藻Gymnodiniales spp.、多甲藻Peridiniales spp.、和原甲藻Prorocentrales spp.(表1)。早期有研究统计,甲藻甾醇是曾檢测过甾醇组成的18种甲藻中11种甲藻的主要甾醇成分[21]。随后有学者通过数据挖掘方法分析甲藻的甾醇成分与其进化历史的关系,发现在102种甲藻中约有2/3的甲藻种可以合成甲藻甾醇[67]。然而合成甲藻甾醇的不同甲藻属、同一甲藻属的不同甲藻种之间,往往会出现甲藻甾醇差异性分布的现象。例如,一项对我国沿海地区甲藻赤潮的甾醇分布特征研究显示,甲藻甾醇在亚历山大藻Alexandrium属和原甲藻Prorocentrum属中质量分数较低,而斯氏藻Scrippsiella属中质量分数则高得多[25]。有研究者对原甲藻Prorocentrum属4种甲藻的甾醇组成分析发现,在波罗的海原甲藻Prorocentrum balticum培养的同一菌株间隔数月的两次分析检测中甾醇组成极为相似且甲藻甾醇相对质量分数均占优势(46.2%和42.2%),在微型原甲藻P. minimum中甲藻甾醇是次优势组分(28.4%),而在海洋原甲藻P. micans、墨西哥原甲藻P. mexicanum中甲藻甾醇在甾醇组分中的优势并不明显[55]。
值得注意的是,不是所有甲藻都能合成甲藻甾醇。例如,海洋环境的前沟藻Amphidinium carterae和A. corpulentum,湖泊环境的角藻Ceratium furcoides均无法合成此类化合物[55]。一项对海洋甲藻特征甾醇的调查表明,主要来自裸甲藻Gymnodinium、卡尔藻Karlodinium、凯伦藻Karenia、原甲藻Prorocentrum等属的43种甲藻,超过一半可以检测到甲藻甾醇[37]。因此,有研究指出甲藻甾醇无法全面代表甲藻纲的信息,仅可作为指示部分甲藻科/属的生物标志物[29]。例如,甲藻甾醇是膝沟藻Gonyaulax的优势甾醇,可以作为膝沟藻的生物标志物[24]。因此,尽管在部分甲藻种中甲藻甾醇是一种次要成分,甚至完全不存在,但甲藻甾醇仍是当前古环境重建研究中最具代表性的甲藻生物标志物。
1.3 甲藻甾醇的分布
海洋和湖泊沉积物中富含有机质,其生物标志物的种类和质量分数均较为丰富,为发展和应用甲藻甾醇指标提供了良好的环境条件。目前,在全球范围内基于甲藻甾醇指标已开展众多研究(图2)。如图2所示,甲藻甾醇在海洋环境中的研究分布广泛,主要集中在加利福尼亚大陆西缘、地中海、黑海以及中国的边缘海区域[6,8,25,62,6873]。相较之下,湖泊环境甲藻甾醇的研究大多局限在热带太平洋岛屿、非洲大陆以及北美洲大陆的湖泊[15,66,7374],但缺乏其他地区不同类型湖泊的系统研究。此外,在北美的池塘、华盛顿岛的泥炭中也检出过甲藻甾醇[18,75]。
2 甲藻甾醇的纯化方法
甲藻甾醇氢同位素组成具有指示过去水文环境变化的潜力,随着单体氢测试技术的逐步发展与完善[76],利用甲藻甾醇δD重建古环境的研究受到越来越多的关注[77]。海洋和湖泊沉积物中蕴含多种包括甲藻甾醇在内的甾醇类化合物,这些化合物往往与甲藻甾醇具有相似的分子量、极性和挥发性,在气相色谱分离过程中保留时间相近,容易形成难以分离的甾醇峰[78]。然而通过气相色谱同位素比值稳定同位素质谱仪(gas chromatography-isotope ratio mass spectrometry,GC-IRMS)对单体化合物进行准确且精确的单体氢同位素测定,需满足一定的仪器分析要求。首先,为最大限度地降低记忆效应(又称残留效应,即前一个色谱峰会影响后续色谱峰同位素组成的测定)的影响,目标化合物应与邻近化合物有较高的基线分离度[7980]。此外,由于在
GC-IRMS氢同位素测定过程中单体化合物所需进样量较高(200~400 ng),使单个色谱峰出现变宽、拖尾的现象,因此导致分辨率降低,分离效果变差[81]。然而传统的脂类生标纯化方法,如柱色谱、尿素络合、AgNO3络合硅胶薄层色谱等[82],均无法实现甾醇类化合物之间的有效分离,进而影响后续甲藻甾醇δD的测定。近年来,为了从复杂的甾醇/醇组分中分离并富集高纯度的甲藻甾醇,利用制备型高效液相色谱(preparative high performance liquid chromatography,Prep-HPLC)的分离方法已被相继开发和应用于甲藻甾醇的纯化研究(表2)。
制备液相色谱通过制备色谱柱将目标单体化合物从混合物中分离提取并富集,主要由梯度泵、进样系统、液相色谱柱和馏分收集器组成(图3)。早在2007年,Smittenberg等[80]首次研发一种正相液相色谱(normal phase-HPLC,NP-HPLC)制备方法(表2中方法①),成功将甲藻甾醇从高等植物来源的五环三萜醇中有效分离。在NP-HPLC纯化过程中,甾醇类化合物极性头基的立体化学结构是决定其保留时间的主控因素,从而影响它们在极性固定相与非极性流动相之间的分配,因此该方法能有效分离4α甲基甾醇和4去甲基甾醇,却无法将甲藻甾醇从其他4α甲基甾醇中纯化。然而海洋和湖泊沉积物中通常分布高质量分数的多类型4α甲基甾醇,因此在后续利用GC-IRMS分析甲藻甾醇δD的过程中,会出现与甲藻甾醇共溢出的现象,影响其准确测定。在此基础上,为去除其他4α甲基甾醇的干扰,Atwood等[78]开发了两种纯化方法(方法②和③),首先利用反相液相色谱(reversed phase-HPLC,RP-HPLC)制备方法(方法②),实现4α甲基甾醇类化合物之间有效分离。在RP-HPLC纯化过程中采用非极性固定相与极性流动相结合,分析物的非极性部分控制保留时间,而4α甲基甾醇类化合物结构的多样性主要存在于侧链非极性部分,因此可以通过RP-HPLC实现较好分离。然而,经此方法纯化后的甲藻甾醇组分中往往含有部分4去甲基甾醇,通过开发NP-HPLC和RP-HPLC相结合的两步纯化方法(方法③),即先将甲藻甾醇与4去甲基甾醇分离,再实现甲藻甾醇与其他4α甲基甾醇的分离。与方法①和②相比,两步纯化法③实现了甲藻甾醇的最佳分离效果。然而需要指出的是,这些纯化方法都是将甲藻甾醇提纯为游离甾醇,而甲藻甾醇分子中的活性/可交换氢会影响δD的测定,因此在利用GC-IRMS开展单体氢同位素分析之前,需要将其衍生化,用已知氢同位素组成的氢替代活性/可交换氢并改善色谱分离效果,这些过程往往复杂繁琐且对技术要求高。因此,Nelson等[81]提出一种改进的纯化方法(方法④),即在HPLC分析之前将样品进行衍生化(乙酰化)处理,同时使用半制备构型的馏分收集器以实现进样和组分收集自动化。此方法通过对衍生化步骤和组分收集设置的改进,避免了每个组分在分离之后的二次取样衍生化步骤,有效减少了样品损失和时间成本,并减少了导致氢同位素分馏的潜在过程。
值得注意的是,在液相色谱制备过程中常常发生明显的氢同位素分馏效应,所以目标化合物的不完整收集会使δD的最终结果相对准确值出现较大偏差[84]。因此,为获取可靠而精准的δD值,需对含有目标化合物的组分进行收集确认之后重新组合,以确保目标化合物馏分的完整。当所有包含目标化合物的馏分被组合完整之后,δD值的偏差在可接受誤差范围之内[78]。此外,甲藻甾醇单体同位素测定所需样品量较高,因此高回收率的纯化方法显得尤为重要。据统计,目前液相制备方法中,NP-HPLC的平均回收率最高可达90%,RP-HPLC的平均回收率次之,约为80%,两步纯化法的平均回收率只有60%,而改善的RP-HPLC的平均回收率高达90%[78]。因此,在实际操作过程中应根据沉积物中甾醇组成、回收率、同位素分馏效应等因素综合权衡,以选择合适的甲藻甾醇纯化方法。经总结,当前甲藻甾醇液相色谱制备方法的对比如表2所示。其中,柱前衍生反相液相色谱制备方法(方法④)具有回收率高、快速易操作、分离效果稳定和低同位素分馏效应等优势,是当前甲藻甾醇纯化的主流方法,并已成功应用于甲藻甾醇δD的古环境重建研究[15,1718,73]。目前,我国已有实验室通过该方法成功提纯甲藻甾醇,并应用于我国边缘海(黄海)[83]。
3 甲藻甾醇在海洋和湖泊环境中的应用
3.1 甲藻甾醇在生产力重建和富营养化研究中的应用
3.1.1 甲藻甾醇指示甲藻生产力及群落结构
甲藻甾醇作为指示甲藻的生物标志物,其化学性质稳定、不易降解,在地质环境中可长期保存,因此,沉积物中的甲藻甾醇质量分数具有指示甲藻生产力的潜力。大量的实地研究表明,海洋和湖泊沉积物中甲藻甾醇质量分数可以指示甲藻生产力(表3)。同时,研究者发现虽然表层沉积物中甲藻甾醇质量分数与现场调查数据存在差异,但两者的空间变化趋势一致,并与其他古生产力替代指标对比,验证了甲藻甾醇指示甲藻生产力的准确性与适用性[108]。例如,在我国东海[108]、南海[109]、黄海[110]、南极普里兹湾[111]等诸多海域均开展了相关研究,这些研究进一步为通过甲藻甾醇质量分数重建历史时期甲藻生物量或生产力变化提供了理论依据。目前,甲藻甾醇质量分数已被广泛用于重建不同地区甲藻生产力的变化研究,且其质量分数与其他藻类生物标志物的比值对浮游植物群落结构变化具有重要指示意义[4,112113]。
当前古环境重建研究中,甲藻甾醇质量分数在不同地质历史尺度上的变化为研究气候与环境的变化提供了有效信息。研究表明,甲藻甾醇质量分数的变化在冰期、间冰期转化过程中存在地域性差异,说明甲藻生产力在不同地区对冰期间冰期交替的气候环境响应不同。例如,在南大洋和大西洋冰期时,甲藻生产力高于间冰期,而在日本海、加利福利亚大陆边缘则是冰消期和间冰期更高[68,95,114]。再者,甲藻甾醇对一些气候突变事件也能敏感响应,其质量分数发生显著变化。例如,在新仙女木(Younger Dryas,YD)时期,甲藻生产力在不同纬度地区响应明显不同,其中来自日本海30 ka的岩心记录显示,YD期间甲藻甾醇的质量累积速率明显增加[115],而低纬地区卡里亚科盆地的研究表明,甲藻甾醇的质量累积速率在全新世期间持续低于200 μg/cm2/a,却在YD事件中达到峰值(900 μg/cm2/a),作者认为这是气候变冷引起富含营养物质的上升流强度增加,进而改变甲藻初级生产力的结果[87]。但是,在高纬地区,如挪威北部大陆架沉积岩心中,甲藻甾醇记录显示YD时期质量分数持续偏低,而在Allerd时期出现显著峰值,表明甲藻能更好地适应大西洋海水的入侵、海表温度的高度变化和水柱分层[88]。此外,有研究将甲藻甾醇质量分数作为指示厄尔尼诺或似厄尔尼诺现象的指标,来自秘鲁边缘16 ka的沉积岩心记录显示,甲藻甾醇质量分数的增加与厄尔尼诺南方涛动增强一致[116]。同样,在湖泊环境甲藻甾醇的质量分数也能有效记录气候变迁的信号/信息。例如,来自土耳其东部凡湖的沉积记录显示,在过去130~250 ka(MIS 6和MIS 7)期间,甲藻甾醇在相对温暖湿润的MIS 7时期质量分数较高,而在寒冷干燥的MIS 6时期质量分数明显偏低,说明甲藻更适合在温暖湿润的气候条件下生长繁殖[107]。
甲藻甾醇作为指示甲藻生产力的指标,常与其他多种藻类生物标志物联合使用,共同指示藻类生物群落结构的变化(表3),从而进一步揭示海洋、湖泊生态系统演变机制。例如,菜子甾醇常被用来指示硅藻,长链烯酮反映颗石藻,这些藻类生物标志物与甲藻甾醇具有类似的化学性质,因而具有相似的降解速率,它们在水体中的比例可以被记录在沉积物中,能较好地反映浮游植物生产力输出的比例,从
而成为指示浮游植物群落结构变化的替代指标[112]。在此基础上,多种生物标志物相结合的方法已应用于全球不同海域和湖泊(表3)。目前的研究显示,浮游植物群落结构变化主要有两种模式:一种是保持稳定,基本不变;另一种则是发生显著变化。例如,阿拉伯海近200 ka的沉积钻孔记录揭示,尽管其海洋初级生产力变化很大,但是甲藻甾醇、菜子甾醇和长链烯酮之间的相对质量分数在千年尺度上保持基本稳定,表明浮游植物群落结构并无明显变化[6]。类似的结果也显现在我国南海东部和北部,研究利用菜子甾醇、甲藻甾醇、长链烯酮和C30 diols重建该地区浮游植物群落结构,虽然冰期浮游植物生产力较高,但群落结构相对稳定,作者推测生产力增加可能与东亚冬季风的加剧有关[9798]。然而众多研究显示,受气候变化和人类活动的影响,海洋和湖泊环境中浮游植物群落结构不稳定,主要初级生产者会发生转变。例如,在台湾以东黑潮主流区海域,Wang等[117]通过沉积钻孔中各种生物标志物重建该区域近千年的古生产力和浮游植物群落结构变化,其中菜子甾醇与甲藻甾醇质量分数比值的变化表明,自公元1 500年以来,浮游植物群落由甲藻主导转变为硅藻主导,这主要受控于气候变化条件下台湾东部河流输入的变化。同样,湖泊环境浮游植物群落结构也会在气候变化的影响下发生改变。例如,来自意大利中部阿尔巴诺湖的藻类生物标志物记录表明,甲藻是全新世早、晚期的主要初级生产者,而硅藻则是全新世中期的主要贡献者,全新世期间浮游植物群落结构改变可能与气候变化引起的水柱分层、颗粒分布以及营养盐变化等水生系统的改变有关[106]。然而在百年尺度上,浮游植物群落结构变化往往更容易遭受人类活动的影响。有研究通过利用甲藻甾醇与硅藻生物标志物(24methylcholesta5,24(28)dien3βol)的比值评估我国抚仙湖150 a以来甲藻对硅藻的相对优势,结果表明,自1986年以来该值明显增长,这与当地人为输入营养物质(如污水、化肥等)有关[103]。
3.1.2 甲藻甾醇指示富营养化
富营养化是全球多数水体正面临的一个严峻的生态环境问题,富营养化可有效改变原始水体生态系统,导致初级生产力提高、藻类生物量增加以及浮游植物群落结构的改变[118]。其中,甲藻作为海洋和淡水浮游植物的重要组成部分,其生物量对水体富营养化敏感,是造成海洋赤潮和湖泊水华的主要藻类之一。研究显示,利用沉积物中甲藻甾醇的质量分数或质量积累速率能有效反演上层水体中甲藻生物量的历史演变[7,70,90,119]。因此,甲藻甾醇在指示甲藻生产力及群落结构变化的基础上,还常被用来指示海洋和湖泊环境中的一些周期性甲藻暴发事件,从而进一步揭示富营养化历史[25,62,120]。例如,在美国东、南部和阿拉伯及大西洋中部等海湾地区,高质量分数的甲藻甾醇(峰值)往往与甲藻赤潮的发生时间相对应,指示甲藻的大量繁盛[121123]。来自中国沿海地区的证据,更是从定量角度揭示了甲藻甾醇质量分数与有害赤潮种锥状斯式藻Scrippsiella trochoidea的生物量存在高度线性相关关系,相关性高达0.99,表明甲藻甾醇质量分数能表征甲藻生物量,是指示海洋甲藻赤潮的重要指标之一[25]。
近几十年来,人类活动所引起的水体富营养化往往是导致海洋甲藻赤潮和淡水甲藻水华的重要因素。例如,美国东部海湾近代沉积物中甲藻甾醇质量分数的增加与当地甲藻赤潮发生的时间一致,而这与人类活动增加所导致的流域大量营养盐的输入有关[122]。来自巴西东南部海湾的钻孔记录显示,自1990年代以来,甲藻甾醇质量分数显著上升,这与自1980年代末以来的里约热内卢城市人口增加以及海湾富营养化水平加剧有关,而且甲藻甾醇质量分数的上升趋势较好地对应着处于较低水平的碳/氮比值(C/N),指示此时沉积物中有机质来源以海洋自生输入为主[124]。对中国南海北部甲藻甾醇等藻类生物标志物沉积记录的研究揭示1925—2000期间,人类活动加剧引起沿岸水域富营养化是导致硅藻和甲藻生产力增加的主要原因[125]。在湖泊环境中,沉积记录中甲藻甾醇质量分数上升通常也与淡水甲藻水华事件相对应,如日本中部的中营养湖(Kizaki湖)甲藻甾醇质量分数在1988年达到峰值,对应于1988—1994年间暴发的甲藻水华[126]。此外,甲藻甾醇与指示硅藻的菜子甾醇质量分数的比值能指示湖泊的营养状况,在富营养化水体中比值较低[122,127]。例如,在受人类活动显著影响的我国长江中下游湖泊,表层沉积物中甲藻甾醇的质量分数和甲藻甾醇/菜子甾醇的比值分别随着水体总磷和总氮浓度的增加而下降,其中过量磷输入导致甲藻甾醇质量分数下降,这与对太湖沉积物的分析結果一致,贫营养的东湾甲藻甾醇质量分数远高于富营养的梅梁湾与竺山湾[128]。此外,气候变化影响藻类演替,湖泊沉积钻孔中甲藻甾醇质量分数的变化趋势能反映甲藻对气候变化的响应。例如,南美喀喀湖(Titicaca Lake)的研究结果表明,全新世中期,区域干旱导致湖泊水位下降,进而改变湖泊的物理化学条件(如温度和盐度),并导致甲藻甾醇急剧增加,湖泊生态系统由此发生变化,从以绿藻或蓝绿藻占优势转变为以多甲藻属为主体,可能暴发甲藻水华[120]。因此,甲藻甾醇质量分数和甲藻甾醇与菜子甾醇的比值可以用作评估湖泊富营养化程度以及营养盐输入的指标。
3.2 甲藻甾醇单体氢在古降水和古盐度重建中的应用
水生藻类脂质中氢的初始来源为其生活水体,因此从理论上讲,环境水的氢同位素组成(δDwater)能够直接控制藻类脂质的氢同位素组成(δDlipid)。事实上,众多藻类培养实验和野外调查结果均表明藻类δDlipid与其环境水体δDwater密切相关,相关性通常为判定系数R2>0.9[77,129131]。前期在海洋和淡水环境中开展的研究表明,表层沉积物中藻类甾醇δD与其环境水体δD高度相关,利用藻类甾醇δD重建环境水的δD误差仅为10‰[75]。其中,甲藻甾醇是藻类甾醇中的一种常见生物标志物,与脂肪酸、烯酮等其他藻类生物标志物相比,其生物来源相对单一,几乎只来源于甲藻,因此甲藻甾醇能有效避免因藻类生物标志物母源不同,而造成同一生物标志物氢同位素组成δD和氢同位素分馏系数α存在明显差异的情况[130],所以开展甲藻甾醇的氢同位素组成(δDdino)研究具有独特优势。随后研究发现,无论是在盐度变化较大的海湾河口地区,还是在热带富营养化的淡水湖泊,甲藻甾醇δD均与环境水δD存在稳定良好的线性关系,因此利用甲藻甾醇δD重建古水文具有巨大的应用潜力[20,132]。
3.2.1 甲藻甾醇单体氢重建古降水
海洋和湖泊表层水的氢同位素组成受水循环蒸发和降水过程中发生的氢同位素分馏的制约,而甲藻甾醇氢同位素组成与环境水体δD之间具有较好的线性关系,能真实记录其生长水体的δD。因此,理论上通过测量海洋或湖泊沉积物中的甲藻甾醇δD,可以重建对应时期水体氢同位素的变化。当前,越来越多的研究成功利用δDdino重建过去降水和水文条件的变化[133]。
甲藻甾醇δD对热带气候显示出高度敏感性,已被广泛用于重建全新世期间与热带辐合带(ITCZ)位置纬度变化有关的降水变化[1112,1516]。Sachs等[11]首先在太平洋西部帕劳的咸水幽灵湖(Spooky Lake)(7°N,134°E),利用湖泊钻孔中的甲藻甾醇δD重建过去千年来降水量的变化,记录显示δDdino在小冰期(1 400~1 850 A.D.)偏正,表明当时处于相对干旱时期,并结合来自基里巴斯北线群岛(5°N,160°W)的蓝藻脂质δD的偏正记录和Galápagos群岛(1°S,89°W)淡水湖中由葡萄藻合成的生物标志物葡萄藻烯(botryococcene)δD的偏负记录,推断ITCZ受太阳辐射强度变化的影响,相对现代位置南移500 km。随后,在帕劳地区基于甲藻甾醇δD记录的研究显示,小冰期时δDdino偏正,指示气候相对干燥,进一步证实ITCZ位置的南移[12,15]。同样,在Galápagos群岛的半咸水湖和淡水湖研究基于甲藻甾醇δD的变化,记录显示小冰期时甲藻甾醇δD偏负,Galápagos地区降水增多,这一现象与ITCZ的南移一致[1314]。更有研究利用帕劳地区湖泊沉积物中的甲藻甾醇氢同位素,重建热带太平洋全新世期间的水文气候变化,结果表明在7.7~4.5 ka BP期间,δDdino上升50‰,指示该区域降水减少,这
一现象与北半球季风减弱、南半球季风加强呈现一致性,这可能与受太阳辐射影响而引起的热带雨带南移有关[16]。
随后在赤道中部北太平洋地区,通过测定湖泊和泥炭沉积物中多种三萜脂类的δD,重建了热带北太平洋中部华盛顿岛过去千年的水文气候变化,其中甲藻甾醇δD记录显示,在950~1 250 A.D.期间,其值呈上升趋势,表明华盛顿岛在中世纪暖期具有干燥趋势[18]。不难看出,以上应用主要是利用甲藻甾醇δD定性或半定量地重建过去的水文气候变化趋势,无法反映降水变化的具体程度。目前,定量化的古降水重建研究还处于兴起阶段,研究成果较少。Maloney等[17]首次基于现代湖泊沉积物中甲藻甾醇的δD,开发并验证了一种定量重建南太平洋辐合带区域降水量的方法。该研究发现δDdino与降水量的空间变异性高度相关,已成功利用δDdino重建该区域的年平均降水量,其不确定性仅比该地区目前可用的最佳气候降雨估计值大两倍。
3.2.2 甲藻甾醇单体氢重建古盐度
水体盐度是重要的环境指标,对有机质保存具有显著影响,因而对研究区域气候环境演变记录和水文循环过程具有重要的指示意义。然而,古盐度重建一直是当前古环境研究中的难点,缺乏可靠、定量的指标,研究进展相对缓慢[134]。近年来,培养实验和实地研究均表明藻类脂质与环境水体氢同位素组成呈显著线性相关。细胞内生物合成过程中的分馏作用,造成藻类脂质分子δD比环境水体δD明显偏轻[76,130]。其中,盐度(S)对生物合成脂质分子中的氢同位素具有控制作用,从而影响藻类脂质与环境水体之间的氢同位素分馏系数,因此藻类生物标志物氢同位素组成作为盐度替代指标的研究受到越来越多的关注。事实上,大量研究结果表明,藻类生物标志物δD和分馏系数α与盐度均显示出良好的线性关系,验证了藻类生物标志物δD具有成为古盐度计的潜力,而甲藻甾醇作为藻类生物标志物的一种,其δD已逐渐成为古盐度重建的热点指标之一。
众多研究表明,海洋环境中水体盐度上升导致藻类脂质与环境水之间D/H分馏降低,即氢同位素分馏比αlipid-water(α=[D/Hlipid]/[D/Hwater]=[1000+δDlipid]/[1000+δDwater])上升[131,135]。来自美国东部切萨皮克海湾河口的研究结果表明,甲藻甾醇氢同位素分馏比(αdino-water)与盐度之间也呈现类似关系,即在盐度变化范围为10‰~29‰的河口地区,盐度每上升一个单位,悬浮颗粒物和表层沉积物中的甲藻甾醇与环境水之间的氢同位素分馏比αdino-water会分别上升(0.99±0.23)‰、(1.70±0.32)‰(表4)。需要指出的是,这与太平洋圣诞岛盐湖中蓝藻脂类氢同位素分馏比和盐度的线性关系具有相似的斜率,但两者的截距不同[135]。这一研究结果进一步证实在盐度变化梯度较大的地区,甲藻甾醇δD是指示海水盐度变化的有效指标。同开阔而相对稳定的海洋环境相比,湖泊由于水容量较小,其物理化学性质往往变化较大,因而对区域的水文变化更加敏感。Nelson等[73]通过调查全球范围内盐湖和高盐湖中甲藻甾醇的δD和环境水的δD来揭示αdino-water与盐度的关系,结果表明盐度是影响盐湖和高盐湖环境中甲藻甾醇生物合成中D/H分馏的主要因素,并综合美国高盐池塘的数据拟合出两者之间的回归方程αdino-water=0.0010S+0.665;此外汇集热带海岸带的湖泊悬浮颗粒物获取类似回归方程αdino-water=0.0008S+0.694(表4)。因此,从全球范围来看,在高、低纬度地区,海洋以及陆地湖泊或者池塘环境,甲藻甾醇分馏系数α和δD值与盐度具有普遍相似的相关关系和分馏变化。尽管目前对不同盐度环境下控制氢同位素分馏的确切机制尚不明确,但由于甲藻甾醇D/H分馏对盐度变化具有一致的响应以及类似的变化幅度。因此,可以利用甲藻甾醇δD或分馏系数α对水体盐度进行定性或半定量的重建。
4 甲藻甾醇在古环境重建应用中存在的问题与展望
4.1 存在的问题
近年来,甲藻甾醇作为研究区域历史环境的良好指标,其质量分数及氢同位素组成为研究生态系统及气候环境演化提供了重要的解决思路,具有非常广阔的应用前景,但现阶段仍存在一定的问题亟待解决。具体来说,主要来自以下几个方面:
1)甲藻甾醇的生物来源问题
首先,尽管当前研究认为甲藻甾醇是最具代表性的甲藻生物标志物,然而,值得注意的是,并非所有甲藻种均能合成甲藻甾醇,此外部分硅藻和水生植物也能合成甲藻甾醇,关于是否存在其他生物产生甲藻甾醇尚不明确。其次,合成甲藻甾醇的甲藻中存在明显属种差异。一方面,合成甲藻甾醇的甲藻中存在甲藻甾醇质量分数的差异性分布,并非所有甲藻均含有高质量分数的甲藻甾醇。例如,研究发现异养甲藻种甲藻甾醇的质量分数是自养甲藻种的4~12倍,异养甲藻可能是沉积物中甲藻甾醇的重要来源,沉积物中甲藻甾醇质量分數不能完全代表甲藻的初级生产力[41]。另一方面,有研究指出因母源生物属种差异,造成同一生物标志物的氢同位
素组成存在显著变化。例如,淡水绿藻的实验室培养结果表明,相同脂类的氢同位素组成在不同属间的差异可达100‰,同属不同种类间也有10‰ ~15‰的差异[130]。因此,从理论上讲,甲藻甾醇δD可能也存在类似的物种效应。此外,异养甲藻和自养甲藻均能合成甲藻甾醇,有研究指出异养生物比自养生物合成脂质富含重氢同位素[136]。目前,缺乏相关的甲藻培养实验以确定甲藻物种特有的同位素效应。
2)多个环境因子对甲藻甾醇的影响与校正问题
在甲藻合成甲藻甾醇的过程中,多种环境因子及甲藻生理因素往往会影响甲藻甾醇质量分数及其氢同位素组成,因此在具体古环境重建研究应用中,应注意多个环境因子的校正问题。一方面,现代培养实验研究发现,甲藻中甲藻甾醇质量分数受到温度、光照、营养盐等环境因素的影响,且在不同生长阶段存在明显的差异[2]。另一方面,在甲藻甾醇氢同位素组成上,除盐度外,辐照度、温度、营养盐等环境因子以及藻类生理因素,如生长速率和生长阶段均会对细胞合成脂类的D/H分馏过程产生不同程度的影响[130131,137],这增加了利用δDdino重建古降水和古盐度的难度。例如,在热带分层湖泊的沉积物中的甲藻甾醇δD,除对湖泊水δD敏感外,还对沉积环境敏感,甲藻甾醇δD偏正可能反映湖泊的富营养化加剧[132]。
3)沉積物中甲藻甾醇的降解与保存问题
甲藻甾醇在沉积过程中易受到环境因素的影响,发生不同程度的生物化学降解作用,这些作用往往会导致甲藻甾醇的脱水、双键的饱和,形成一系列成岩转换产物,如甲藻甾酮、甲藻甾烷酮和甲藻甾烷等。因此,在古环境重建研究中,甲藻甾醇质量分数不能直接指示甲藻生物量的绝对质量分数,只能半定量或定性地重建甲藻生产力在地质历史时期的变化趋势[105]。更有研究认为甲藻甾醇及其成岩转换产物的总质量分数(∑“dinosterols”)比单一的甲藻甾醇质量分数能更为准确地指示甲藻生产力[5]。此外,这些降解、成岩过程常伴随着甲藻甾醇中氢元素的交换,致使其氢同位素组成发生改变。因此,随着沉积物样品的热成熟度升高,δDdino蕴含的信息会逐渐丢失。
综上,诸多因子都会影响沉积物中甲藻甾醇的质量分数和氢同位素组成。因而在古环境重建研究中,需结合实际沉积环境,确定甲藻甾醇的具体生物来源,谨慎考虑其他环境因子、沉积物样品的热成熟度等以更好地揭示甲藻甾醇的环境指示意义。
4.2 展望
甲藻甾醇作为一类来源相对单一的甾醇类生物标志物,在海洋沉积物、湖泊沉积物、海洋甲藻及淡水甲藻的培养实验中均有报道检出该类化合物。在生物来源方面,目前认为甲藻甾醇是甲藻的专属生物标志物,此外在部分硅藻及水生植物中也检出少量甲藻甾醇。在古环境重建研究中,甲藻甾醇在海洋和湖泊沉积物中的质量分数可以指示甲藻生物量,进而重建甲藻生产力。在此基础上,甲藻甾醇质量分数可以反映水体的营养状况,进而揭示富营养化历史。同时,甲藻甾醇还能联合其他藻类生物标志物,重建浮游植物群落结构的时空变化,进一步揭示藻类生态系统对自然和人类活动的响应机制。随着单体氢测试技术的发展,其单体氢同位素组成在古环境重建研究中越来越受到关注。目前,可通过制备型高效液相色谱获取高纯度、高回收率的甲藻甾醇,这为其单体氢的研究与应用带来机会和发展前景。当前,全球范围内甲藻甾醇单体氢在降雨量和盐度的定性或定量重建研究中已取得一定成果,建立了部分经验方程。
然而,如前文所述,甲藻甾醇在古环境重建研究中的应用仍存在一定问题与挑战,未来需进行深入探索。基于此,我们认为甲藻甾醇未来研究方向需重点关注以下几个方面。
1)加强验证甲藻甾醇作为甲藻生物标志物的可靠性。未来需进一步明确沉积环境中甲藻甾醇的具体生物来源、其质量分数和分布的控制因素及各种代用指标的适用性。
2)开展更多关于甲藻甾醇影响因素的现代控制培养实验。探究多种环境因子及藻类生理因素影响甲藻甾醇质量分数及其氢同位素组成的具体生物学过程与机制,这将有助于深入了解甲藻在海洋和湖泊生态系统中的生物地球化学作用和生态功能。
3)促进基于甲藻甾醇质量分数指标对甲藻生产力变化的定量研究。由于母源细胞对甲藻甾醇产生量的关系和甲藻甾醇在沉积物中的降解速率还未有定量分析,因而利用甲藻甾醇质量分数未能实现对甲藻生产力的准确定量估算。今后需对甲藻合成甲藻甾醇的细胞体积分数、保存效率建立经验公式,同时结合高精度的检测技术,以达到准确定量重建甲藻古生产力的目的。
4)优化甲藻甾醇氢同位素组成与古降水和古盐度的经验方程,建立适合具体环境的特定公式。在今后的工作中,建立更为精确的、适用于特定区域的转换函数,进一步提高定量重建的准确性。
5)推进陆相沉积中甲藻甾醇指标的应用。当前,甲藻甾醇在海洋环境中的应用较为广泛,缺乏来自陆地环境的沉积记录。我国湖泊众多,气候类型多样,许多湖泊由于其特殊的地理位置成为记录区域气候和人类活动演化的良好载体。例如,位于西部干旱区与东亚季风湿润区过渡地带的湖泊,在全球变化的研究中具有重要地位,应拓展甲藻甾醇指标在该区域的应用,验证其在不同类型湖泊环境、不同时间尺度的适用性。
甲藻甾醇的应用虽有一定的局限性,但作为重建古水文信息且已在国际研究中取得重要进展的直接指标,仍对当前古环境的研究工作具有重要的参考价值。当前,甲藻甾醇的古环境意义愈加丰富,也将继续在未来的古环境重建研究中发挥巨大作用,其在我国湖泊领域的应用也值得期待。
参考文献(References):
[1] Volkman J K, Barrett S M, Blackburn S I, et al. Microalgal Biomarkers: A Review of Recent Research Developments[J]. Organic Geochemistry, 1998, 29(5): 11631179.
[2] Chen M N, Bi R, Chen X, et al. Stoichiometric and Sterol Responses of Dinoflagellates to Changes in Temperature, Nutrient Supply and Growth Phase[J]. Algal Research, 2019, 42: 101609.
[3] Volkman J. Sterols in Microorganisms[J]. Applied Microbiology and Biotechnology, 2003, 60: 495506.
[4] Castaeda I S, Schouten S. A Review of Molecular Organic Proxies for Examining Modern and Ancient Lacustrine Environments[J]. Quaternary Science Reviews, 2011, 30(21): 28512891.
[5] Mouradian M, Panetta R J, De Vernal A, et al. Dinosterols or Dinocysts to Estimate Dinoflagellate Contributions to Marine Sedimentary Organic Matter?[J]. Limnology and Oceanography, 2007, 52(6): 25692581.
[6] Schubert C J, Villanueva J, Calvert S E, et al. Stable Phytoplankton Community Structure in the Arabian Sea over the Past 200 000 Years[J]. Nature, 1998, 394: 563566.
[7] Xing L, Zhang R D, Liu Y G, et al. Biomarker Records of Phytoplankton Productivity and Community Structure Changes in the Japan Sea over the Last 166 Kyr[J]. Quaternary Science Reviews, 2011, 30(19): 26662675.
[8] Wu P, Bi R, Duan S S, et al. Spatiotemporal Variations of Phytoplankton in the East China Sea and the Yellow Sea Revealed by Lipid Biomarkers[J]. Journal of Geophysical Research: Biogeosciences, 2016, 121(1): 109125.
[9] Bi R, Chen X, Zhang J, et al. Water Mass Control on Phytoplankton Spatiotemporal Variations in the Northeastern East China Sea and the Western Tsushima Strait Revealed by Lipid Biomarkers[J]. Journal of Geophysical Research: Biogeosciences, 2018, 123(4): 13181332.
[10] 劉东艳, 邸宝平, 石雅君, 等. 不同藻类生态参数在反演沉积物环境中的应用比较[J]. 海洋学报, 2013, 35(2): 154160.
Liu Dongyan, Di Baoping, Shi Yajun, et al. Comparison of Ecological Parameters in the Sediment Using Multi-Proxy Approaches to Indicate Environmental Changes[J].Acta Oceanologic Sinica, 2013, 35(2): 154160.
[11] Sachs J P, Sachse D, Smittenberg R H, et al. Southward Movement of the Pacific Intertropical Convergence Zone AD
?偆f1 4001 850[J]. Nature Geoscience, 2009, 2(7): 519525.
[12] Smittenberg R H, Saenger C, Dawson M N, et al. Compound-Specific D/H Ratios of the Marine Lakes of Palau as Proxies for West Pacific Warm Pool Hydrologic Variability[J]. Quaternary Science Reviews, 2011, 30(7): 921933.
[13] Atwood A R, Sachs J P. Separating ITCZ- and ENSO-Related Rainfall Changes in the Galápagos Over the Last 3 Kyr Using D/H Ratios of Multiple Lipid Biomarkers[J]. Earth and Planetary Science Letters, 2014, 404: 408419.
[14] Nelson D B, Sachs J P. Galápagos Hydroclimate of the Common Era from Paired Microalgal and Mangrove Biomarker 2H/1H Values[J]. Proceedings of the National Academy of Sciences, 2016, 113(13): 34763481.
[15] Richey J N, Sachs J P. Precipitation Changes in the Western Tropical Pacific over the Past Millennium[J]. Geology, 2016, 44(8): 671674.
[16] Sachs J P, Blois J L, McGee T, et al. Southward Shift of the Pacific ITCZ During the Holocene[J]. Paleoceanography and Paleoclimatology, 2018, 33(12): 13831395.
[17] Maloney A E, Nelson D B, Richey J N, et al. Reconstructing Precipitation in the Tropical South Pacific from Dinosterol 2H/1H Ratios in Lake Sediment[J]. Geochimica et Cosmochimica Acta, 2019, 245: 190206.
[18] Sachs J P, Mügler I, Sachse D, et al. Last Millennium Hydroclimate in the Central Equatorial North Pacific (5°N, 160°W)[J]. Quaternary Science Reviews, 2021, 259: 106906.
[19] Maloney A E, Richey J N, Nelson D B, et al. Contrasting Common Era Climate and Hydrology Sensitivities from Paired Lake Sediment Dinosterol Hydrogen Isotope Records in the South Pacific Convergence Zone[J]. Quaternary Science Reviews, 2022, 281: 107421.
[20] Sachs J P, Schwab V F. Hydrogen Isotopes in Dinosterol from the Chesapeake Bay Estuary[J]. Geochimica et Cosmochimica Acta, 2011, 75(2): 444459.
[21] Withers N. Dinoflagellate Sterols[M]//Scheuer P J. Marine Natural Products: Chemical and Biological Perspectives, Volume V. New York: Academic Press, 1983: 87130.
[22] Shimizu Y, Alam M, Kobayashi A. Dinosterol, the Major Sterol with a Unique Side Chain in the Toxic Dinoflagellate, Gonyaulax Tamarensis[J]. Journal of the American Chemical Society, 1976, 98(4): 10591060.
[23] Finer J, Clardy J, Kobayashi A, et al. Identity of the Stereochemistry of Dinosterol and Gorgosterol Side Chain[J]. The Journal of Organic Chemistry, 1978, 43(10): 19901992.
[24] Alam M, Sansing T B, Busby E L, et al. Dinoflagellate Sterols I: Sterol Composition of the Dinoflagellates of Gonyaulax Species[J]. Steroids, 1979, 33(2): 197203.
[25] Geng H X, Yu R C, Chen Z F, et al. Analysis of Sterols in Selected Bloom-Forming Algae in China[J]. Harmful Algae, 2017, 66: 2939.
[26] Piretti M V, Pagliuca G, Boni L, et al. Investigation of 4Methyl Sterols from Cultured Dinoflagellate Algal Strains[J]. Journal of Phycology, 1997, 33(1): 6167.
[27] 徐繼林, 严小军, 周成旭, 等. 甾醇在海洋微藻中的分布研究[J]. 海洋学报, 2007,29(6): 93100.
Xu Jilin,Yan Xiaojun, Zhou Chengxu,et al. Studies on Sterol Distribution in Marine Microalgae[J]. Acta Oceanologic Sinica, 2007, 29(6): 93100.
[28] Wengrovitz P S, Sanduja R, Alam M. Dinoflagellate Sterols3: Sterol Composition of the Dinoflagellate Gonyaulax monilata[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1981, 69(3): 535539.
[29] Dahmen J L, Leblond J D. Free Sterol Composition of Species in the Dinoflagellate Genus Pyrocystis: A Spectrum of Sterol Diversity[J]. Journal of Eukaryotic Microbiology, 2011, 58(6): 475479.
[30] Mansour M P, Volkman J K, Jackson A E, et al. The Fatty Acid and Sterol Composition of Five Marine Dinoflagellates[J]. Journal of Phycology, 1999, 35(4): 710720.
[31] Alam M, Martin G E, Ray S M. Dinoflagellate Sterols. 2. Isolation and Structure of 4Methylgorgostanol from the Dinoflagellate Glenodinium foliaceum[J]. The Journal of Organic Chemistry, 1979, 44(24): 44664467.
[32] Volkman J K, Gagosian R B, Wakeham S G. Free and Esterified Sterols of the Marine Dinoflagellate Gonyaulax polygramma[J]. Lipids, 1984, 19(6): 457465.
[33] Kokinos J P, Eglinton T I, Goi M A, et al. Characterization of a Highly Resistant Biomacromolecular Material in the Cell Wall of a Marine Dinoflagellate Resting Cyst[J]. Organic Geochemistry, 1998, 28(5): 265288.
[34] Withers N W, Tuttle R C, Holz G G, et al. Dehydrodinosterol, Dinosterone and Related Sterols of a Non-Photosynthetic Dinoflagellate, Crypthecodinium Cohnii[J]. Phytochemistry, 1978, 17(11): 19871989.
[35] Withers N W, Tuttle R C, Goad L J, et al. Dinosterol Side Chain Biosynthesis in a Marine Dinoflagellate, Crypthecodinium Cohnii[J]. Phytochemistry, 1979, 18(1): 7173.
[36] Houle H M, Lopez C B, Leblond J D. Sterols of the Toxic Marine Dinoflagellate, Pyrodinium bahamense[J]. The Journal of Eukaryotic Microbiology, 2019, 66(3): 528532.
[37] Leblond J D, Chapman P J. A Survey of the Sterol Composition of the Marine Dinoflagellates Karenia brevis, Karenia mikimotoi, and Karlodinium micrum: Distribution of Sterols Within Other Members of the Class Dinophyceae1[J]. Journal of Phycology, 2002, 38(4): 670682.
[38] Nichols P D, Jones G J, De Leeuw J W, et al. The Fatty Acid and Sterol Composition of Two Marine Dinoflagellates[J]. Phytochemistry, 1984, 23(5): 10431047.
[39] Hallegraeff G M, Nichols P D, Volkman J K, et al. Pigments, Fatty Acids, and Sterols of the Toxic Dinoflagellate Gymnodinium catenatum [J]. Journal of Phycology, 1991, 27(5): 591599.
[40] Chu F L E, Lund E D, Littreal P R, et al. Sterol Production and Phytosterol Bioconversion in Two Species of Heterotrophic Protists, Oxyrrhis Marina and Gyrodinium Dominans[J]. Marine Biology, 2008, 156(2): 155169.
[41] Amo M, Suzuki N, Kawamura H, et al. Sterol Composition of Dinoflagellates: Different Abundance and Composition in Heterotrophic Species and Resting Cysts[J]. Geochemical Journal, 2010, 44(3): 225231.
[42] Mansour M P, Volkman J K, Blackburn S I. The Effect of Growth Phase on the Lipid Class, Fatty Acid and Sterol Composition in the Marine Dinoflagellate, Gymnodinium sp. in Batch Culture[J]. Phytochemistry, 2003, 63(2): 145153.
[43] Giner J L, Ceballos H, Tang Y Z, et al. Sterols and Fatty Acids of the Harmful Dinoflagellate Cochlodinium polykrikoides[J]. Chemistry & Biodiversity, 2016, 13(2): 249252.
[44] Leblond J D, Lasiter A D. Sterols of the Green-Pigmented, Aberrant Plastid Dinoflagellate, Lepidodinium chlorophorum (Dinophyceae)[J]. Protist, 2012, 163(1): 3846.
[45] Robinson N, Cranwell P A, Eglinton G, et al. Lipids of Four Species of Freshwater Dinoflagellates[J]. Phytochemistry, 1987, 26(2): 411421.
[46] Ding Y, Bi R, Sachs J, et al. Lipid Biomarker Production by Marine Phytoplankton Under Different Nutrient and Temperature Regimes[J]. Organic Geochemistry, 2019, 131: 3449.
[47] Kokke W C M C, Fenical W, Djerassi C. Sterols with Unusual Nuclear Unsaturation from Three Cultured Marine Dinoflagellates[J]. Phytochemistry, 1981, 20(1): 127134.
[48] Alam M, Sanduja R, Watson D A, et al. Sterol Distribution in the Genus Heterocapsa(Pyrrhophyta)1[J]. Journal of Phycology, 1984, 20(3): 331335.
[49] Kaku K, Hiraga Y. Sterol Composition of a Cultured Marine Dinoflagellate, Heterocapsa circularisquama[J]. Natural Product Research, 2003, 17(4): 263267.
[50] Robinson N, Cranwell P A, Eglinton G, et al. Lipid Geochemistry of Lake Kinneret[J]. Organic Geochemistry, 1986, 10(4): 733742.
[51] Harvey H R, Bradshaw S A, OHara S C M, et al. Lipid Composition of the Marine Dinoflagellate Scrippsiella trochoidea[J]. Phytochemistry, 1988, 27(6): 17231729.
[52] Vandergrift S L, Elkins L C, Alves-de-Souza C, et al. First Examination of Sterols in the Marine Dinoflagellate Genus Vulcanodinium[J]. Journal of Eukaryotic Microbiology, 2021, 68(6): e12863.
[53] Robinson N, Eglinton G, Brassell S C, et al. Dinoflagellate Origin for Sedimentary 4αMethylsteroids and 5α(H)Stanols[J]. Nature, 1984, 308: 419422.
[54] Leblond J D, Chapman P J. Sterols of the Heterotrophic Dinoflagellate, Pfiesteria piscicida (Dinophyceae): Is There a Lipid Biomarker?[J]. Journal of Phycology, 2004, 40(1): 104111.
[55] Volkman J K, Rijpstra W I C, De Leeuw J W, et al. Sterols of Four Dinoflagellates from the Genus Prorocentrum[J]. Phytochemistry, 1999, 52(4): 659668.
[56] Leblond J D, Sengco M R, Sickman J O, et al. Sterols of the Syndinian Dinoflagellate Amoebophrya sp., a Parasite of the Dinoflagellate Alexandrium tamarense (Dinophyceae)[J]. Journal of Eukaryotic Microbiology, 2006, 53(3):211216.
[57] Volkman J K, Barrett S M, Dunstan G A, et al. Geochemical Significance of the Occurrence of Dinosterol and Other 4Methyl Sterols in a Marine Diatom[J]. Organic Geochemistry, 1993, 20(1): 715.
[58] Klink G, Dreier F, Buchs A, et al. A New Source for 4Methyl Sterols in Freshwater Sediments: Utricularia neglecta L. (Lentibulariaceae)[J]. Organic Geochemistry, 1992, 18(6): 757763.
[59] Schmitz F J. Uncommon Marine Steroids[M]//Scheuer P J. Marine Natural Products. New York: Academic Press, 1978: 241297.
[60] Summons R E, Thomas J, Maxwell J R, et al. Secular and Environmental Constraints on the Occurrence of Dinosterane in Sediments[J]. Geochimica et Cosmochimica Acta, 1992, 56(6): 24372444.
[61] Venkatesan M I, Ruth E, Kaplan I R. Coprostanols in Antarctic Marine Sediments: A Biomarker for Marine Mammals and Not Human Pollution[J]. Marine Pollution Bulletin, 1986, 17(12): 554557.
[62] Boon J J, Rijpstra W I C, De Lange F, et al. Black Sea Sterol:A Molecular Fossil for Dinoflagellate Blooms[J]. Nature, 1979, 277: 125127.
[63] Smith D, Eglinton G, Morris R, et al. Aspects of the Steroid Geochemistry of a Recent Diatomaceous Sediment from the Namibian Shelf[J]. Oceanologica Acta, 1982, 5: 365378.
[64] Smith D, Eglinton G, Morris R, et al. Aspects of the Steroid Geochemistry of an Interfacial Sediment from the Peruvian Upwelling[J]. Oceanologica Acta, 1983, 6(2): 211219.
[65] Volkman J K, Farrington J W, Gagosian R B. Marine and Terrigenous Lipids in Coastal Sediments from the Peru Upwelling Region at 15°S: Sterols and Triterpene Alcohols[J]. Organic Geochemistry, 1987, 11(6): 463477.
[66] Atwood A R, Volkman J K, Sachs J P. Characterization of Unusual Sterols and Long Chain Diols, Triols, Keto-Ols and N-Alkenols in El Junco Lake, Galápagos[J]. Organic Geochemistry, 2014, 66: 8089.
[67] Leblond J D, Lasiter A D, Li C, et al. A Data Mining Approach to Dinoflagellate Clustering According to Sterol Composition: Correlations with Evolutionary History[J]. International Journal of Data Mining and Bioinformatics, 2010, 4(4): 431451.
[68] Mangelsdorf K, Güntner U, Rullktter J. Climatic and Oceanographic Variations on the California Continental Margin During the Last 160 Kyr[J]. Organic Geochemistry, 2000, 31(9): 829846.
[69] Wakeham S G, Peterson M L, Hedges J I, et al. Lipid Biomarker Fluxes in the Arabian Sea, with a Comparison to the Equatorial Pacific Ocean[J]. Deep Sea Research Part II: Topical Studies in Oceanography, 2002, 49(12): 22652301.
[70] Menzel D, Van Bergen P F, Schouten S, et al. Reconstruction of Changes in Export Productivity During Pliocene Sapropel Deposition: A Biomarker Approach[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2003, 190: 273287.
[71] Xing L, Zhang H L, Yuan Z N, et al. Terrestrial and Marine Biomarker Estimates of Organic Matter Sources and Distributions in Surface Sediments from the East China Sea Shelf[J]. Continental Shelf Research, 2011, 31(10): 11061115.
[72] Lee C, Gagosian R B, Farrington J W. Geochemistry of Sterols in Sediments from Black Sea and the Southwest African Shelf and Slope[J]. Organic Geochemistry, 1980, 2(2): 103113.
[73] Nelson D B, Sachs J P. The Influence of Salinity on D/H Fractionation in Dinosterol and Brassicasterol from Globally Distributed Saline and Hypersaline Lakes[J]. Geochimica et Cosmochimica Acta, 2014, 133: 325339.
[74] Xu Y P, Jaffé R. Biomarker-Based Paleo-Record of Environmental Change for an Eutrophic, Tropical Freshwater Lake, Lake Valencia, Venezuela[J]. Journal of Paleolimnology, 2008, 40(1): 179194.
[75] Sauer P E, Eglinton T I, Hayes J M, et al. Compound-Specific D/H Ratios of Lipid Biomarkers from Sediments as a Proxy for Environmental and Climatic Conditions[J]. Geochimica et Cosmochimica Acta, 2001, 65(2): 213222.
[76] Sessions A L, Burgoyne T W, Schimmelmann A, et al. Fractionation of Hydrogen Isotopes in Lipid Biosynthesis[J]. Organic Geochemistry, 1999, 30(9): 11931200.
[77] Sachse D, Billault I, Bowen G J, et al. Molecular Paleohydrology: Interpreting the Hydrogen-Isotopic Composition of Lipid Biomarkers from Photosynthesizing Organisms[J]. Annual Review of Earth and Planetary Sciences, 2012, 40(1): 221249.
[78] Atwood A R, Sachs J P. Purification of Dinosterol from Complex Mixtures of Sedimentary Lipids for Hydrogen Isotope Analysis[J]. Organic Geochemistry, 2012, 48: 3746.
[79] Wang Y, Sessions A L. Memory Effects in Compound-Specific D/H Analysis by Gas Chromatography/Pyrolysis/Isotope-Ratio Mass Spectrometry[J]. Analytical Chemistry, 2008, 80(23): 91629170.
[80] Smittenberg R H, Sachs J P. Purification of Dinosterol for Hydrogen Isotopic Analysis Using High-Performance Liquid Chromatography-Mass Spectrometry[J]. Journal of Chromatography A, 2007, 1169(1): 7076.
[81] Nelson D B, Sachs J P. Concurrent Purification of Sterols, Triterpenols and Alkenones from Sediments for Hydrogen Isotope Analysis Using High Performance Liquid Chromatography[J]. Organic Geochemistry, 2013, 64: 1928.
[82] 王曉华, 石丽明, 刘美美, 等. 古气候古环境研究中类脂化合物单体同位素分析[J]. 岩矿测试, 2008, 27 (6): 435440.
Wang Xiaohua, Shi Liming, Liu Meimei,et al. Specific Isotope Analysis of Lipid Biomarker Compounds Applied in Paleoclimate and Paleoenvironment Reconstruction[J]. Rock and Mineral Analysis, 2008, 27(6): 435440.
[83] 李莉, 于蒙, 赵美训. 甾醇类单体化合物纯化分析技术及其同位素应用的研究进展[J]. 地球科学进展, 2022, 37(12): 12231231.
Li Li, Yu Meng, Zhao Meixun. A Review of Techniques of Purification of Source-Specific Sterols for Compound-Specific Isotope Analysis and Applications[J]. Advances in Earth Science, 2022, 37(12): 12231231.
[84] Schwab V F, Sachs J P. The Measurement of D/H Ratio in Alkenones and Their Isotopic Heterogeneity[J]. Organic Geochemistry, 2009, 40(1): 111118.
[85] Li Y, Lin J, Xu X P, et al. Multiple Biomarkers for Indicating Changes of the Organic Matter Source over the Last Decades in the Min-Zhe Sediment Zone, the East China Sea[J]. Ecological Indicators, 2022, 139: 108917.
[86] Wang Z C, Xiao X T, Yuan Z N, et al. Air-Sea Interactive Forcing on Phytoplankton Productivity and Community Structure Changes in the East China Sea During the Holocene[J]. Global and Planetary Change, 2019, 179: 8091.
[87] Werne J P, Hollander D J, Lyons T W, et al. Climate-Induced Variations in Productivity and Planktonic Ecosystem Structure from the Younger Dryas to Holocene in the Cariaco Basin, Venezuela[J]. Paleoceanography, 2000, 15(1): 1929.
[88] Knies J. Climate-Induced Changes in Sedimentary Regimes for Organic Matter Supply on the Continental Shelf off Northern Norway[J]. Geochimica et Cosmochimica Acta, 2005, 69(19): 46314647.
[89] Xing L, Zhao M X, Zhang H L, et al. Biomarker Reconstruction of Phytoplankton Productivity and Community Structure Changes in the Middle Okinawa Trough During the Last 15 ka[J]. Chinese Science Bulletin, 2008, 53(16): 25522559.
[90] Ohkouchi N, Kawamura K, Taira A. Fluctuations of Terrestrial and Marine Biomarkers in the Western Tropical Pacific During the Last 23 300 Years[J]. Paleoceanography, 1997, 12(4): 623630.
[91] Seki O, Ikehara M, Kawamura K, et al. Reconstruction of Paleoproductivity in the Sea of Okhotsk over the Last 30 Kyr[J]. Paleoceanography, 2004, 19(1) : PA1016.
[92] Hu J F, Peng P A, Jia G D, et al. Biological Markers and Their Carbon Isotopes as an Approach to the Paleoenvironmental Reconstruction of Nansha Area, South China Sea, During the Last 30 ka[J]. Organic Geochemistry, 2002, 33(10): 11971204.
[93] Schulte S, Rostek F, Bard E, et al. Variations of Oxygen-Minimum and Primary Productivity Recorded in Sediments of the Arabian Sea[J]. Earth and Planetary Science Letters, 1999, 173(3): 205221.
[94] Hinrichs K U, Schneider R R, Müller P J, et al. A Biomarker Perspective on Paleoproductivity Variations in Two Late Quaternary Sediment Sections from the Southeast Atlantic Ocean[J]. Organic Geochemistry, 1999, 30(5): 341366.
[95] Ikehara M, Kawamura K, Ohkouchi N, et al. Variations of Terrestrial Input and Marine Productivity in the Southern Ocean (48°S) During the Last Two Deglaciations[J]. Paleoceanography, 2000, 15(2): 170180.
[96] Zhao M X, Mercer J L, Eglinton G, et al. Comparative Molecular Biomarker Assessment of Phytoplankton Paleoproductivity for the Last 160 Kyr off Cap Blanc, NW Africa[J]. Organic Geochemistry, 2006, 37(1): 7297.
[97] Li D W, Zhao M X, Chen M T. East Asian Winter Monsoon Controlling Phytoplankton Productivity and Community Structure Changes in the Southeastern South China Sea over the Last 185 Kyr[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2014, 414: 233242.
[98] He J, Zhao M X, Wang P X, et al. Changes in Phytoplankton Productivity and Community Structure in the Northern South China Sea During the Past 260 ka[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2013, 392: 312323.
[99] Calvo E, Pelejero C, Logan G A, et al. Dust-Induced Changes in Phytoplankton Composition in the Tasman Sea During the Last Four Glacial Cycles[J]. Paleoceanography, 2004, 19(2) : PA2020.
[100] Mei X, Li R H, Zhang X H, et al. Reconstruction of Phytoplankton Productivity and Community Structure in the South Yellow Sea[J]. China Geology, 2019, 2(3): 315324.
[101] Zhang Y D, Su Y L, Liu Z W, et al. Fatty Acid and Alcohol Compositions in Lacustrine Sediments as Indicators of Environment and Ecosystem of Lakes in Eastern China[J]. Ecological Indicators, 2019, 97: 290300.
[102] Xu Y P, Jaffé R. Geochemical Record of Anthropogenic Impacts on Lake Valencia, Venezuela[J]. Applied Geochemistry, 2009, 24(3): 411418.
[103] Zhang Y D, Su Y L,Liu Z W, et al. Sediment Lipid Biomarkers Record Increased Eutrophication in Lake Fuxian (China) During the Past 150 Years[J]. Journal of Great Lakes Research, 2015, 41(1): 3040.
[104] Zhang Y D, Su Y L, Liu Z W, et al. A Sediment Record of Environmental Change in and Around Lake Lugu, SW China, During the Past Two Centuries[J]. Journal of Paleolimnology, 2016, 55(3): 259271.
[105] Castaeda I S, Werne J P, Johnson T C, et al. Organic Geochemical Records from Lake Malawi (East Africa) of the Last 700 Years, Part II: Biomarker Evidence for Recent Changes in Primary Productivity[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2011, 303(1): 140154.
[106] Hanisch S, Ariztegui D, Püttmann W. The Biomarker Record of Lake Albano, Central Italy:Implications for Holocene Aquatic System Response to Environmental Change[J]. Organic Geochemistry, 2003, 34(9): 12231235.
[107] Guillemot T, Stockhecke M, Bechtel A, et al. Paleoenvironmental and Paleoclimatic Variations Around Lake Van (Eastern Turkey) Recorded by Sedimentary Source Specific Biomarkers 250–130 ka (MIS7 and MIS6)[J]. Quaternary Science Reviews, 2019, 225: 105997.
[108] 张海龙, 邢磊, 赵美训, 等. 东海和黄海表层沉积物生物标志物的分布特征及古生态重建潜力[J]. 中国海洋大学学报(自然科学版), 2008, 38(6): 992996.
Zhang Hailong, Xing Lei, Zhao Meixun, et al. Distribution of Biomarkers in Surface Sediments of the East China and Yellow Seas and Its Potential for Paleoecology Reconstruction[J].Periodical of Ocean University of China, 2008, 38(6): 992996.
[109] 赵美训, 赵晓晨, 陈建芳, 等. 南海表层沉积物生物标志物的分布特征及古生产力重建意义[J]. 热带海洋学报, 2009, 28(3): 4553.
Zhao Meixun, Zhao Xiaochen, Chen Jianfang, et al. Distribution of Phytoplankton Biomarkers in Surface Sediments from the South China Sea and Its Implication for Paleoproductivity[J]. Tropic Oceanography,2009, 28(3):4553.
[110] Xing L, Tao S O, Zhang H, et al. Distributions and Origins of Lipid Biomarkers in Surface Sediments from the Southern Yellow Sea[J]. Applied Geochemistry, 2011, 26(8): 15841593.
[111] 于培松, 张海生, 扈传昱, 等. 利用沉积生物标志物分析南极普里兹灣浮游植物群落结构变化[J]. 极地研究, 2012, 24(2): 143150.
Yu Peisong, Zhang Haisheng, Hu Chuanyu,et al. Using Biomarkers in Sediments as Indicators to Rebuild the Phytoplankton Community in Prydz Bay, Antarctica[J]. Chinese Journal of Polar Research, 2012, 24(2): 143150.
[112] 丁玲, 邢磊, 赵美训. 生物标志物重建浮游植物生产力及群落结构研究进展[J]. 地球科学进展, 2010, 25(9): 981989.
Ding Ling, Xing Lei, Zhao Meixun. Applications of Biomarkers for Reconstructing Phytoplankton Productivity and Community Structure Changes[J]. Advances in Earth Science, 2010, 25(9): 981989.
[113] 凌媛, 王永, 王淑贤, 等. 生物标志物在海洋和湖泊古生态系统和生产力重建中的应用[J]. 地学前缘, 2022, 29(2): 327342.
Ling Yuan, Wang Yong, Wang Shuxian,et al. Application of Biomarkers in Reconstructing Marine and Lacustrine Paleoecosystems and Paleoproductivity: A Review[J]. Earth Science Frontiers, 2022, 29(2): 327342.
[114] Henriksson A S, Sarnthein M, Eglinton G, et al. Dimethylsulfide Production Variations over the Past 200 ky in the Equatorial Atlantic: A First Estimate[J]. Geology, 2000, 28(6): 499.
[115] Ishiwatari R, Yamada K, Matsumoto K, et al. Organic Molecular and Carbon Isotopic Records of the Japan Sea over the Past 30 Kyr[J]. Paleoceanography and Paleoclimatology, 1999, 14(2): 260270.
[116] Makou M C, Eglinton T I, Oppo D W, et al. Postglacial Changes in El Nio and La Nia Behavior[J]. Geology, 2010, 38(1): 4346.
[117] Wang Y O, Song J M, Duan L Q, et al. Paleoproductivity and Climate Evolution in the Kuroshio Mainstream Area Over the Past Millennium[J]. Ecological Indicators, 2021, 121: 107035.
[118] 鄭国栋, 孟庆涛, 刘招君. 松辽盆地北部青一段油页岩地球化学特征及其记录的古湖泊学信息[J]. 吉林大学学报(地球科学版), 2020, 50(2): 392404.
Zheng Guodong,Meng Qingtao, Liu Zhaojun. Geochemical Characteristics and Paleolimnological Information of Oil Shale in 1st Member of Qingshankou Formation in Northern Songliao Basin[J]. Journal of Jilin University (Earth Science Edition), 2020,50(2): 392404.
[119] Prahl F G, Muehlhausen L A, Lyle M. An Organic Geochemical Assessment of Oceanographic Conditions at Manop Site C Over the Past 26 000 Years[J]. Paleoceanography, 1989, 4(5): 495510.
[120] Theissen K M, Zinniker D A, Moldowan J M, et al. Pronounced Occurrence of Long-Chain Alkenones and Dinosterol in a 25 000Year Lipid Molecular Fossil Record from Lake Titicaca, South America[J]. Geochimica et Cosmochimica Acta, 2005, 69(3): 623636.
[121] Kennedy J A, Brassell S C. Molecular Stratigraphy of the Santa Barbara Basin: Comparison with Historical Records of Annual Climate Change[J]. Organic Geochemistry, 1992, 19(1): 235244.
[122] Zimmerman A R, Canuel E A. Sediment Geochemical Records of Eutrophication in the Mesohaline Chesapeake Bay[J]. Limnology and Oceanography, 2002, 47(4): 10841093.
[123] Sowakiewicz M, Whitaker F, Thomas L, et al. Biogeochemistry of Intertidal Microbial Mats from Qatar: New Insights from Organic Matter Characterisation[J]. Organic Geochemistry, 2016, 102: 1429.
[124] Lazzari L, Wagener A L R, Boyle E A, et al. Sedimentary Record of Hydrocarbons and Sewage Inputs from a Highly Populated Region in South-Eastern Brazil[J]. Marine Pollution Bulletin, 2019, 149: 110565.
[125] Hu J F, Zhang G, Li K C, et al. Increased Eutrophication Offshore Hong Kong, China During the Past 75 Years: Evidence from High-Resolution Sedimentary Records[J]. Marine Chemistry, 2008, 110(1): 717.
[126] Ito T. Preservation Potential of Seasonal Laminated Deposits as a Useful Tool for Environmental Analysis in Mesotrophic Lake Kizaki, Central Japan[J]. Journal of Asian Earth Sciences, 2013, 73: 139148.
[127] Zhang Y D, Su Y L, Liu Z W, et al. Sedimentary Lipid Biomarker Record of Human-Induced Environmental Change During the Past Century in Lake Changdang, Lake Taihu Basin, Eastern China[J]. Science of the Total Environment, 2018, 613/614: 907918.
[128] Zhang Y D, Su Y L, Liu Z W, et al. Lipid Biomarker Evidence for Determining the Origin and Distribution of Organic Matter in Surface Sediments of Lake Taihu, Eastern China[J]. Ecological Indicators, 2017, 77: 397408.
[129] Englebrecht A C, Sachs J P. Determination of Sediment Provenance at Drift Sites Using Hydrogen Isotopes and Unsaturation Ratios in Alkenones[J]. Geochimica et Cosmochimica Acta, 2005, 69(17): 42534265.
[130] Zhang Z H, Sachs J P. Hydrogen Isotope Fractionation in Freshwater Algae: I. Variations Among Lipids and Species[J]. Organic Geochemistry, 2007, 38(4): 582608.
[131] Schouten S, Ossebaar J, Schreiber K, et al. The Effect of Temperature, Salinity and Growth Rate on the Stable Hydrogen Isotopic Composition of Long Chain Alkenones Produced by Emiliania Huxleyi and Gephyrocapsa Oceanica[J]. Biogeosciences, 2006, 3(1): 113119.
[132] Schwab V F, Garcin Y, Sachse D, et al. Dinosterol δD Values in Stratified Tropical Lakes (Cameroon) Are Affected by Eutrophication[J]. Organic Geochemistry, 2015, 88: 3549.
[133] 袁子能, 邢磊, 張海龙, 等. 生物标志物稳定氢同位素研究进展及在海洋古环境重建中的应用[J]. 地球科学进展, 2012, 27(3): 276283.
Yuan Zineng, Xing Lei, Zhang Hailong,et al. Progress of Biomarker Stable Hydrogen Isotope and Its Application to Marine Paleoenvironmental Reconstruction[J]. Advances in Earth Science, 2012, 27(3): 276283.
[134] 王安, 胡明毅, 高家俊, 等. 松南长岭凹陷青山口组一段泥页岩元素地球化学特征及古环境意义[J].吉林大学学报(地球科学版),2024,54. doi:10.13278/j.cnki.jjuese.20230225.
Wang An, Hu Mingyi, Gao Jiajun, et al. Element Geochemical Characteristics and Paleoenvironmental Significance of Mud Shale in the First Member of Qingshankou Formation of Changling Sag in Southern Songliao Basin[J].Journal of Jilin University (Earth Science Edition),2024,54. doi:10.13278/j.cnki.jjuese.20230225.
[135] Sachse D, Sachs J P. Inverse Relationship Between D/H Fractionation in Cyanobacterial Lipids and Salinity in Christmas Island Saline Ponds[J]. Geochimica et Cosmochimica Acta, 2008, 72(3): 793806.
[136] Zhang X N, Gillespie A L, Sessions A L. Large D/H Variations in Bacterial Lipids Reflect Central Metabolic Pathways[J]. Proceedings of the National Academy of Sciences, 2009, 106(31): 1258012586.
[137] Wolfshorndl M, Danford R, Sachs J P. 2H/1H Fractionation in Microalgal Lipids from the North Pacific Ocean: Growth Rate and Irradiance Effects[J]. Geochimica et Cosmochimica Acta, 2019, 246: 317338.
