基于健脾法和网络药理学探讨 “茯苓-白术”药对治疗非酒精性脂肪性肝病的作用机制*
2022-11-28黄锦桢王宇新童光东黄芙蓉赖剑萍陈团团
黄锦桢 王宇新 曾 华 童光东,△ 黄芙蓉 赖剑萍 陈团团
1.广州中医药大学第四临床医学院 (广东 深圳, 518033) 2.南京中医药大学附属深圳市中医院 3.深圳市中医院肝病科
非酒精性脂肪性肝病(NAFLD)与遗传易感性和胰岛素抵抗密切相关[1,2]。在中国大陆,18岁以上人群NAFLD患病率为20.09%,发病率为63.0/1 000人/年,全世界25%的人口被认为患有NAFLD[3-5]。NAFLD在中医属于“胁痛”“痞满”等范畴,基本病机以肝失疏泄,脾气亏虚为本,病位主要在肝脾肾[6]。根据五行理论,肝属木,脾属土,当肝脏受邪,往往可见与脾胃相关的症状[7,8]。《金匮要略》曰:“见肝之病,知肝传脾,当先实脾”。因此,临床在治疗NAFLD时往往需要顾及脾胃。 “茯苓-白术”药对(FB)始见于《伤寒杂病论》,是治疗脾胃气虚常用药对[9]。根据参考文献[6],胃苓汤和逍遥散分别作为“湿浊内停型”和“肝郁脾虚型”的推荐用方,这两方中都含有茯苓、白术。此外,用药规律分析研究亦挖掘到FB是治疗NAFLD的主要药物[10-12]。现代药理学研究表明茯苓具有保肝、抗衰老、抗炎等作用[13],白术具有免疫调节、抗炎、抑制脂肪形成等作用[14]。但目前的研究多针对单味药,对该药对的研究较少。本研究将借助网络药理学的方法探讨FB治疗NAFLD的作用机制,为下一步研究提供基础。
1 资料与方法
1.1 FB活性成分及相关靶点筛选 通过TCMSP(http://lsp.nwu.edu.cn/tcmsp.php)检索茯苓、白术的活性成分,以口服利用度(OB)≥30%且类药性(DL)≥0.18进行筛选,将获得的成分在TCMSP上匹配对应的蛋白质靶点[15]。少数未能匹配到靶点的成分,将利用PubChem(http://pubchem.ncbi.nlm.nih.gov/)平台及Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/)进行靶点预测;最后借助Uniprot数据库(http://www.uniprot.org)标准化蛋白质靶点信息。
1.2 NAFLD相关靶点筛选 在GeneCards(http://www.genecards.org/)和DisGeNET(http://www.disgenet.org/2019版v6.0)数据中以“non-alcoholic fatty liver disease”或“NAFLD”为关键词挖掘疾病靶点,将得到的靶点合并、去重得到NAFLD的潜在靶点。
1.3 蛋白相互作用(PPI)网络构建 对药物与疾病的靶点绘制韦恩图,将交集靶点上传至STRING11.0数据库(http://string-db.org),将生物种类设定为“Homo sapiens”,选取minimum required interaction score>0.700,隐藏游离节点,其余为默认设置,得到PPI网络。
1.4 GO和 KEGG分析 在DAVID6.7数据库(http://david.ncifcrf.gov/)中上传交集靶点,选定物种为“Homo sapiens”,进行GO(生物过程BP、分子功能MF、和细胞组成CC)和KEGG富集分析,以P<0.05初步筛选。利用Sangerbox平台(http://www.sangerbox.com/Tool)对P值前10的GO及前20的通路结果可视化。
1.5 药对成分-异常靶点-通路网络图的构建 挖掘KEGG前20条通路上各自富集的靶点,并根据1.1的结果匹配对应的化学成分。借助CytoScape3.7.2构建 “药对成分-异常靶点-通路网络图”,利用软件功能分析成分及靶点的网络拓扑参数,包括连接度、介度及紧密度等,根据上述参数筛选核心靶点及核心活性成分。
1.6 分子对接验证 对1.5获得的核心靶点及成分进行分子对接。借助RSCB PDB(http://www.rcsb.org/)及ZINC(http://zinc.docking.org/)数据库分别获取靶点蛋白3D及成分2D结构。应用Autodock Tolls软件进行除水、加极性氢等处理, Autodock Vina实现分子对接,以结合能≤-5.0 kcal/mol作为有效结合的筛选依据;最后利用Pymol软件对结果可视化。
2 结果
2.1 FB活性成分及相关靶点的获取 初步筛选后得到化学成分茯苓14种、白术7种;剔除少许未匹配到靶点的活性成分,最终得到重要活性成分茯苓15种、白术5种,见表1。通过数据库预测补充,共得到成分作用靶点:茯苓198个、白术68个,删除重复靶点后得到FB靶点206个。
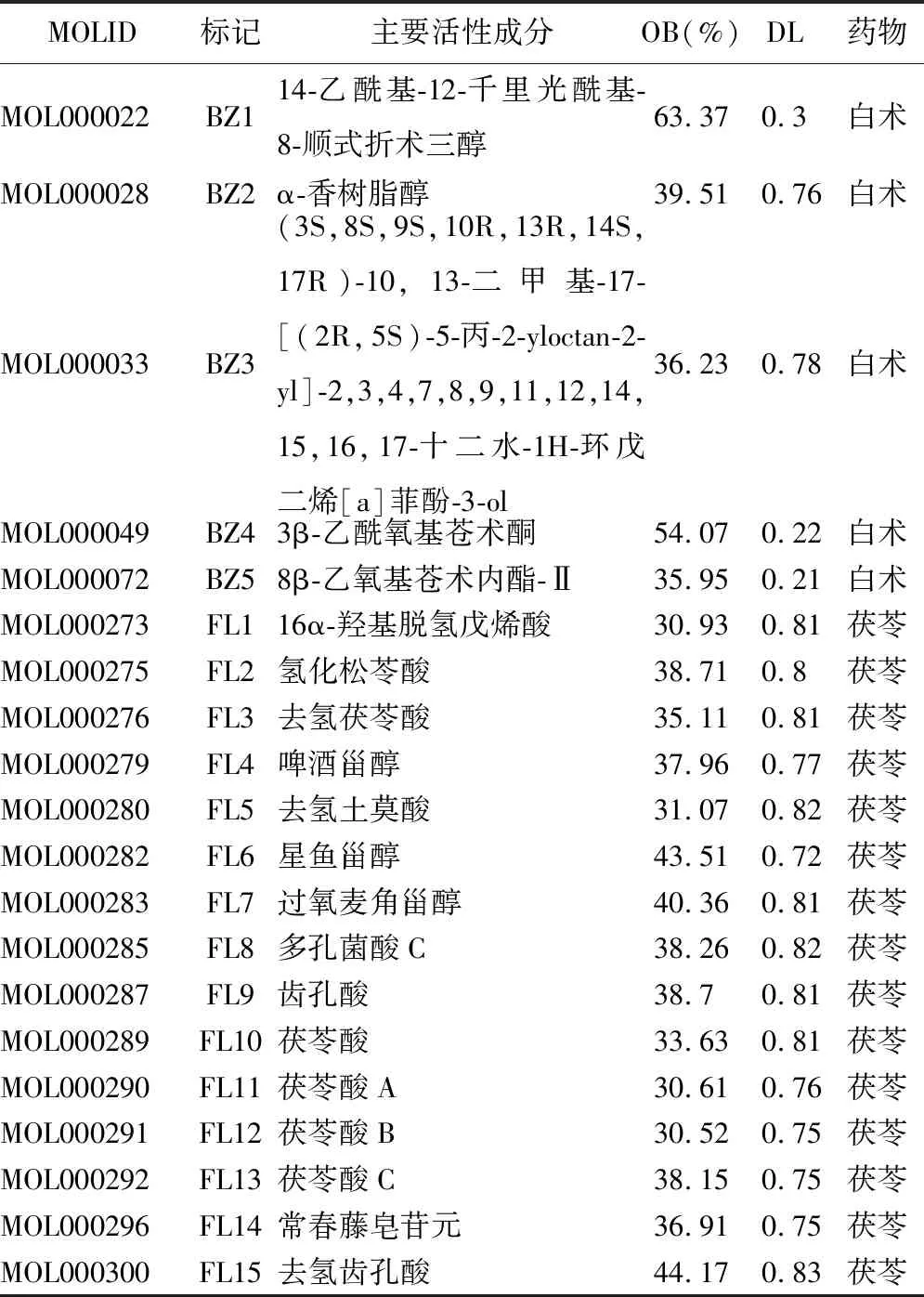
表1 茯苓-白术药对活性成分基本信息
2.2 NAFLD靶点的获取 通过Genecards和DisGeNET数据库检索,分别得到疾病靶点1 532个、1 058个,汇总并删除重复值,最终得到靶点2 088个。
2.3 PPI网络构建 药物与疾病交集靶点为88个,见图1。交集靶点PPI见图2。结果显示PPI网络图中共有83个节点,228条边,平均节点度值5.49。
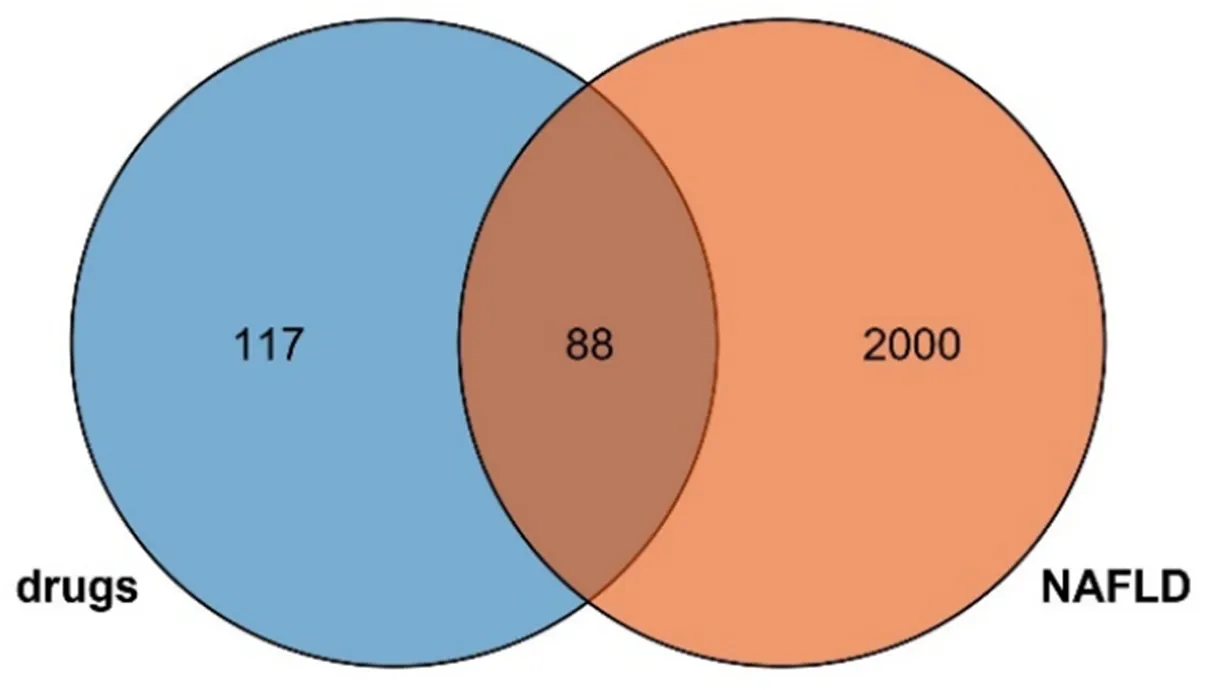
图1 茯苓-白术药对与NAFLD靶点韦恩图
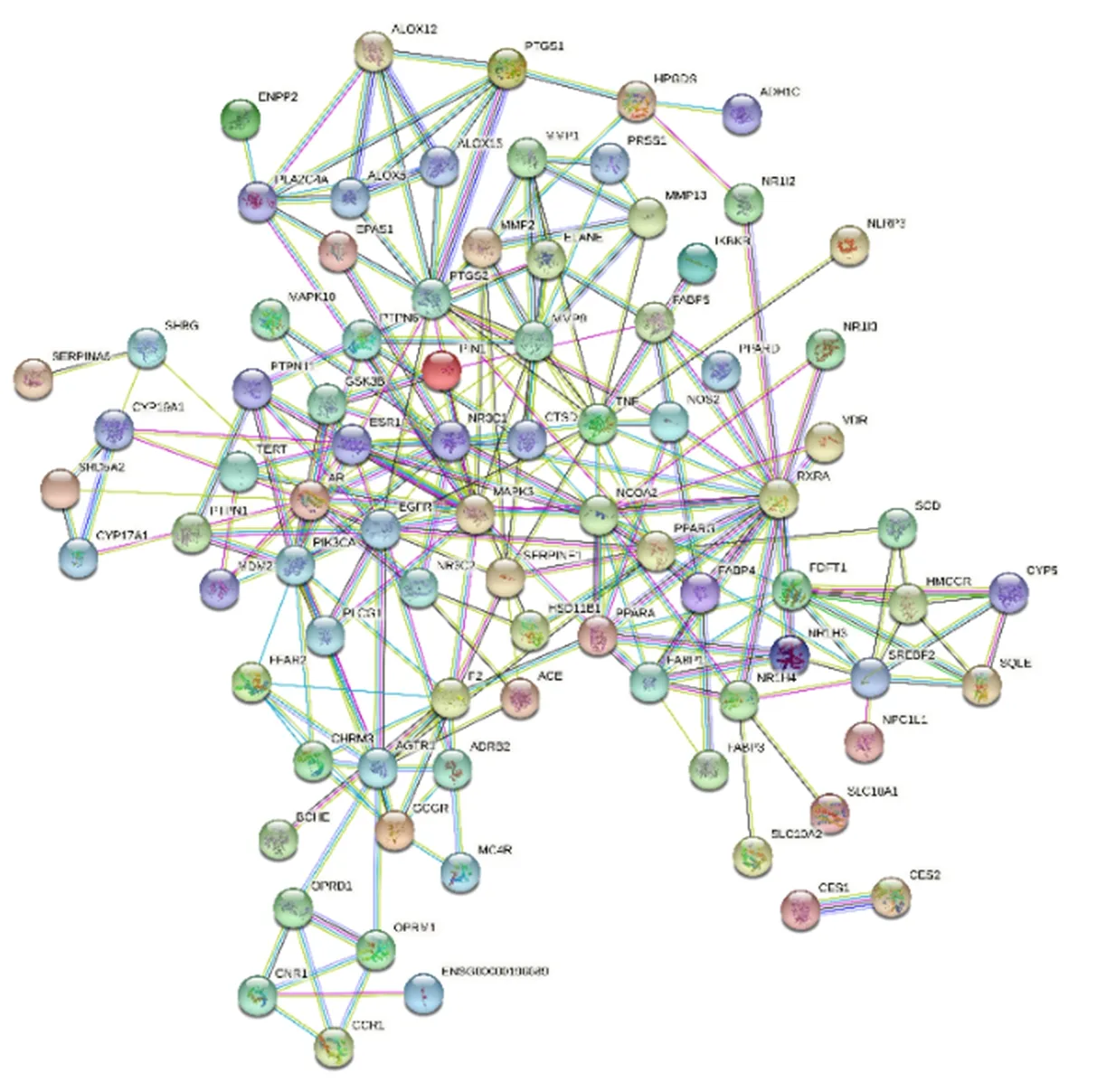
图2 PPI网络图
2.4 GO和KEGG分析 结果显示GO中涉及生物过程的有152条,如类固醇激素介导的信号通路、RNA聚合酶II对转录的正调控等。涉及分子功能的有53条,如类固醇激素受体活性类固醇结合等。涉及细胞组成的有18条,如膜筏、内质网膜等,见图3。
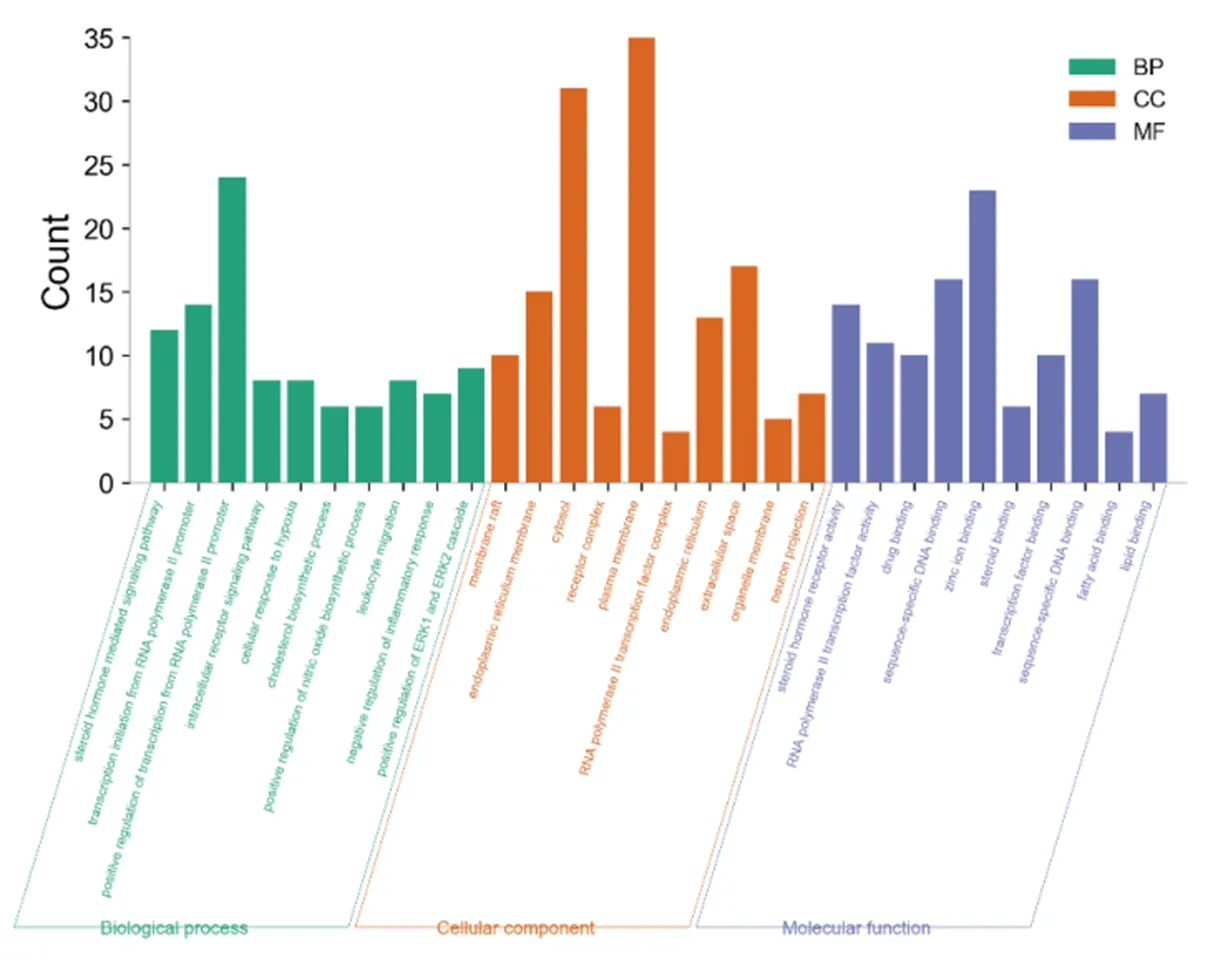
图3 BP、CC、MF三合一柱状图
KEGG得到信号通路62条,显著性较高的前20条通路见图4。结合文献检索,筛选出可能与NAFLD有关的通道,并补充相关性较高但P值排名靠后的通道。结果显示:相关信号通路涉及胰岛素信号通路(hsa04910)、PPAR信号通道(hsa03320)、胰岛素抵抗(hsa04931)、花生四烯酸代谢(hsa00590)、T细胞受体信号通道(hsa04660)、脂肪细胞因子信号通路(hsa04920)、TNF信号通路(hsa04668)、NOD样受体信号通道(hsa04621)、HIF-1信号通道(hsa04066)。

图4 KEGG前20条通路气泡图
2.5 药对成分-NAFLD异常靶点-通路网络图的构建 运用软件构建网络图,见图5。结果表明齿孔酸、多孔菌酸C、茯苓酸C、去氢齿孔酸的连接度、介度和紧密度为前四,故预测这4个成分为核心活性成分,见表2。同理,靶点中前4位的为TNF、MAPK3、PIK3CA、NR1H3,预测这4个为核心靶点,见表3。
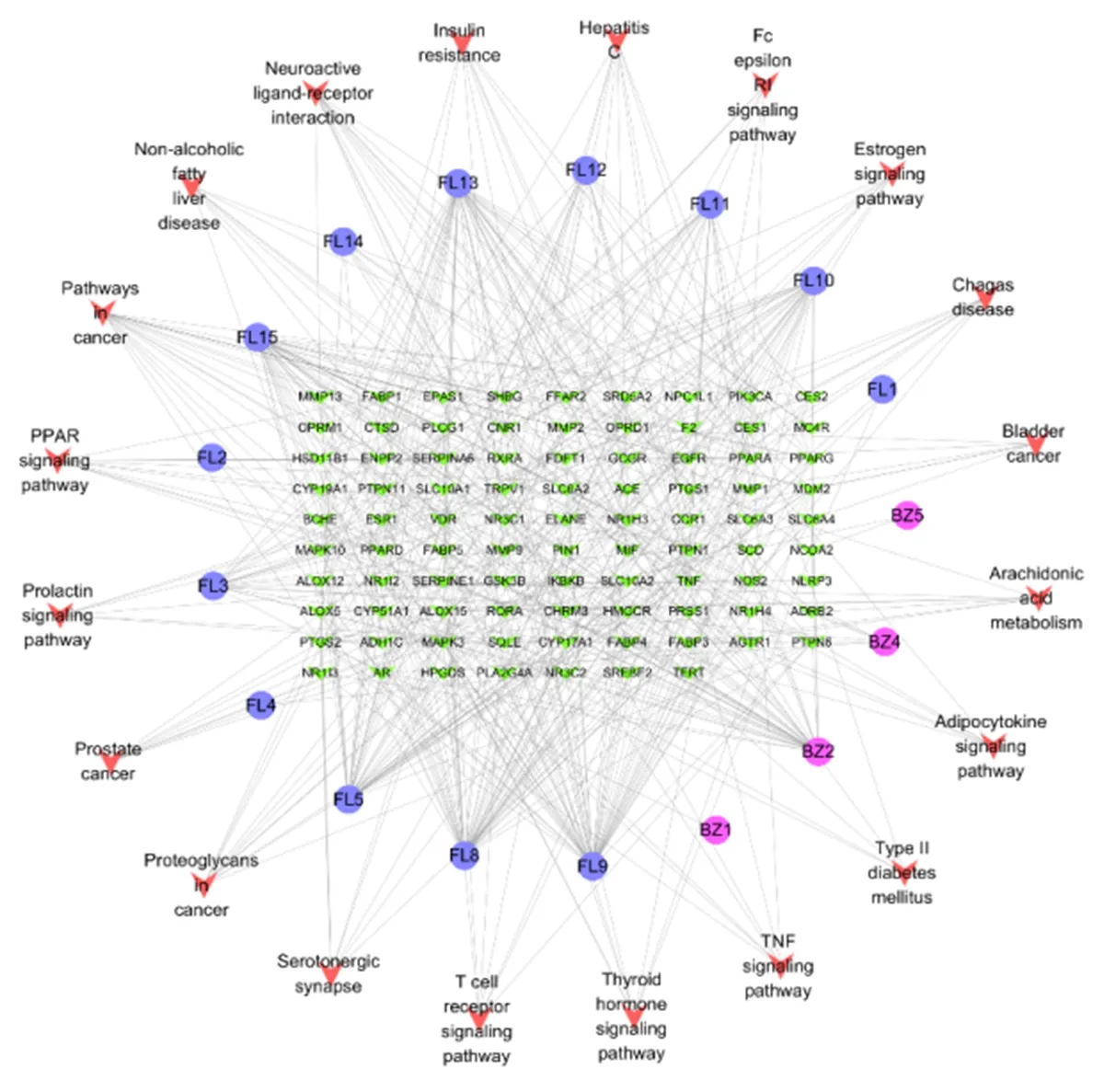
图5 药对成分-NAFLD异常靶点-生物通路网络图
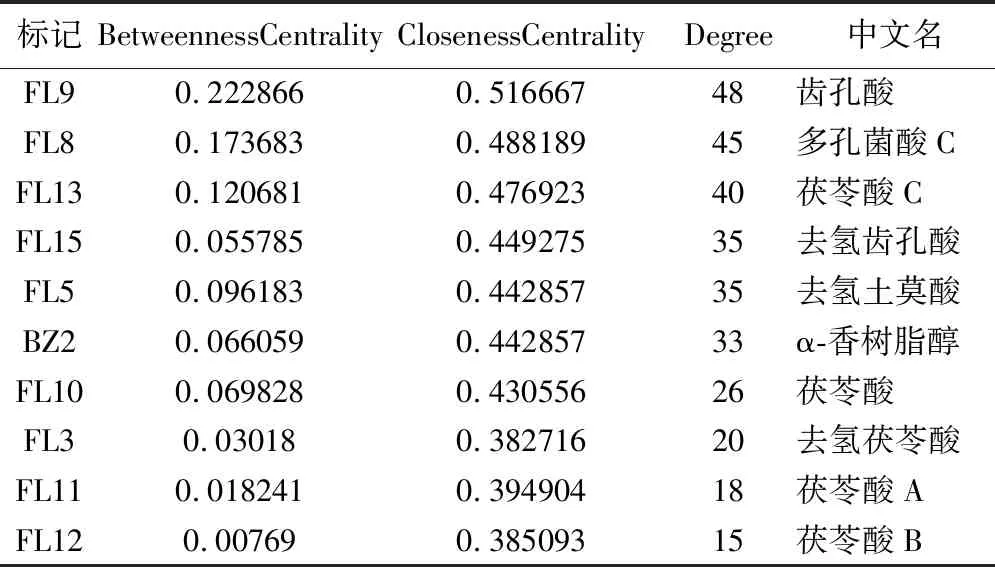
表2 主要化合物成分网络节点参数
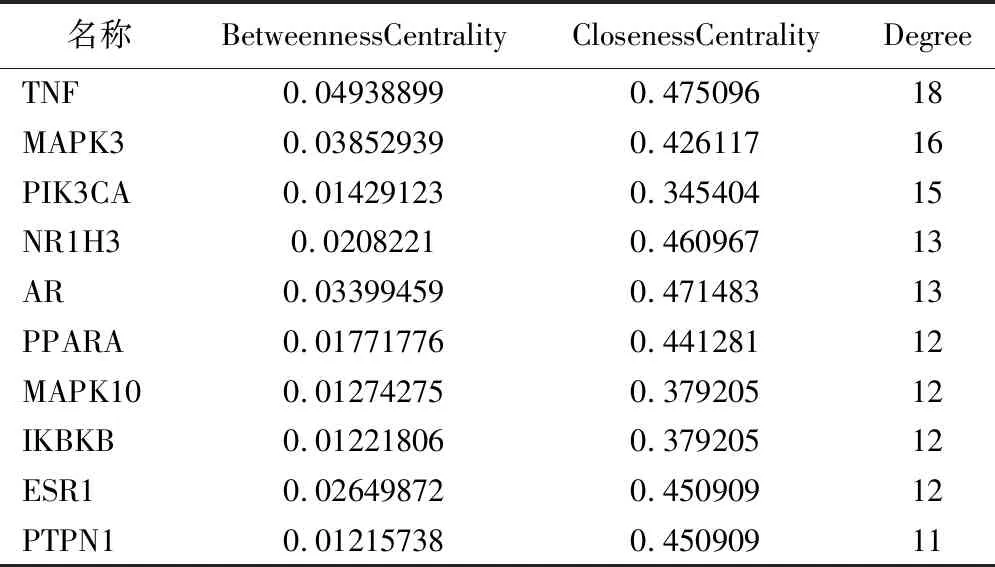
表3 主要靶点网络节点参数
2.6 分子对接结果 结果显示靶点与成分的结合能均≤-5.0 kcal/mol,说明具有较好的亲和力,见表4。关键靶点与其结合活性最好的化合物可视化结果见图6。
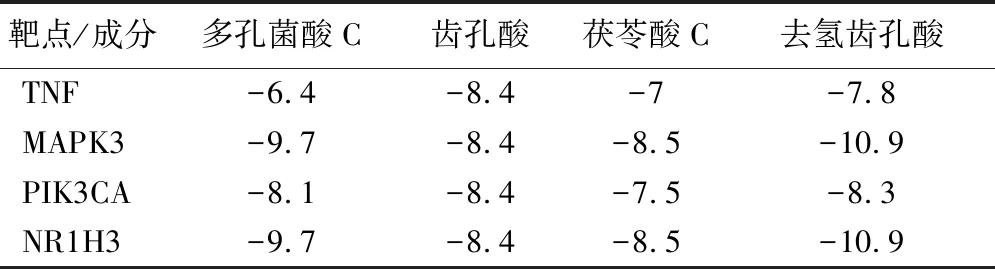
表4 分子对接结果 kcal/mol
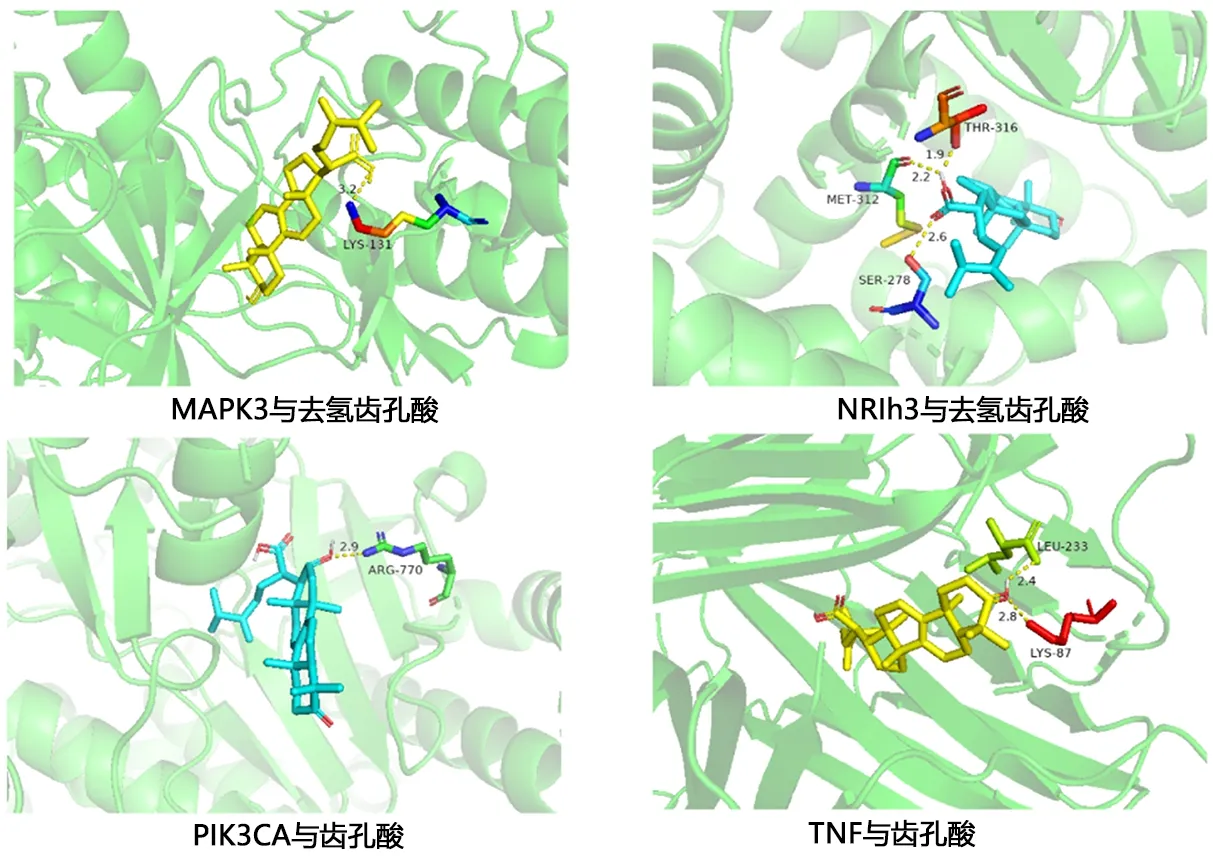
图6 最优对接结果可视化图
3 讨论
目前西医治疗NAFLD的方法是改变生活方式、健康饮食和规律运动,同时以调节血脂作为辅助治疗,然而效果并不理想,而中医药在防治NAFLD方面有独特优势[16]。治未病是中医整体观的一部分,如张景岳以“肝邪之见,本由脾胃之虚,使脾胃不虚,则肝木虽强,必无乘脾之患”言肝脾关系。如叶天士曰:“夫木郁土,古人制肝补脾升阳散邪,皆理偏就和为治。” 因此,发挥中医学整体观的特色,从健脾法来指导中医药治疗NAFLD患者具有重要意义。
本研究初步筛选出FB治疗NAFLD的核心成分为齿孔酸、多孔菌酸C、茯苓酸C及去氢齿孔酸。研究表明齿孔酸能够抑制Fas的表达水平,从而降低脂肪的积累;齿孔酸对高脂饲料喂养的糖尿病小鼠的胰岛素抵抗有保护作用[17]。多孔菌酸能抑制小鼠巨噬细胞NO的产生,从而可能发挥抗炎作用[18]。去氢齿孔酸可能通过增强过氧化物酶体增殖物激活受体α(PPARα)和肉碱棕榈酰转移酶Ia(CPT-1a)的表达水平以及通过抑制肝脏和脂肪组织中成脂脂肪酸合成酶(FAS)的表达水平,从而导致肝脏中储存脂肪的减少和甘油三酯含量的降低[19]。研究表明茯苓酸能通过抑制磷酸酶A2(PLA2) 、白三烯B4 分泌,降低弹性蛋白酶和COX-2的活性实现抗炎作用[20]。
靶点方面,FB治疗NAFLD的主要核心靶点为TNF、MAPK3、PIK3CA、NR1H3,这些靶点以直接或者间接方式涉及NAFLD的发病机制。有研究表明TNF的亚型TNF-α是一种重要的促炎细胞因子,可诱导NF-κB通路的激活[21,22];TNF也能激活NLRP3炎症体,这些都会增强促炎效应而导致肝细胞坏死。自噬是一种细胞吞噬并降解受损细胞质成分的细胞过程,MAPK3可通过刺激ATG7依赖性自噬,从而在肝脂质代谢中发挥有益作用[23]。研究表明NR1H3可以通过促进胆固醇外排和抑制炎性基因,对细胞胆固醇加载过程中产生的氧甾醇产生反应,从而发挥抗炎作用[24]。
此外,药对治疗NAFLD涉及多条复杂的信号通路。其中,PPAR信号通路的PPARa亚型与肝脏组织的脂肪酸代谢密切相关,其配体激活的PPARa可以通过干扰AP-1和NFjB信号通路抑制细胞因子诱导的炎症因子IL-6基因表达[25];另外有研究表明PPARa激活可改善NASH动物模型的脂肪变性、炎症和纤维化[26]。T细胞受体信号通道能激活调节性T细胞的分化,而后者在控制自身耐受和炎症反应方面发挥着关键作用[27]。HIF-1信号通道可通过抑制中链和长链酰基辅酶A脱氢酶从而抑制脂肪酸的分解代谢[28]。另外,HIF1α水平升高可能会增强脂肪细胞中的胰岛素信号传导,从而促进葡萄糖向脂肪酸和甘油三酸酯的转化,从而导致肥胖[29]。故推测茯苓-白术药对可能通过抑制HIF-1信号通路从而降低脂肪的产生。在NAFLD发病机制中,炎症是连接上游胰岛素抵抗/脂肪变性和下游细胞损伤的中心事件,而NOD样受体信号通道中包含多种炎性小体,如NLRP-1、NLRP-3、NLRP-4[30]。饱和的脂肪酸可诱导NLRP3炎症体的激活,从而导致炎症因子IL-1β和IL-18的释放[31]。故推测茯苓-白术药对可能抑制了NOD样受体信号通道而发挥抗炎作用。
