中老年肌肉减少症与非酒精性脂肪性肝病的关系*
2022-11-28左玉强李辉贤
关 兴 左玉强 李辉贤
1.石家庄市人民医院体检中心 (河北 石家庄, 050000) 2.河北医科大学第二医院体检中心 3.石家庄市人民医院胸外科
肌肉减少症(SP)是一种进行性的全身性骨骼肌疾病,包括骨骼肌质量和功能的加速丧失,增加了患者发生跌倒、功能下降、死亡等不良事件的发生率;其常发生于老年人,但在一定条件下也见于中年人[1]。非酒精性脂肪性肝病(NAFLD)在全球范围内是一个日益严重的健康问题,其全球患病率超过25%,高危人群患病率更是超过60%[2]。以往研究显示SP和NAFLD有多种共同病理生理背景,且SP与NAFLD的发生、发展和预后有关[3]。目前,国内外有关SP与NAFLD相关性的研究人群多为慢性病患者(2型糖尿病患者、慢阻肺患者、慢性肾病患者、老年住院患者等),而有关健康人群SP与NAFLD关系的研究尚未见诸报道,本研究就健康体检中老年人SP与NAFLD的相关性进行探讨,为SP的防治提供理论依据。
1 资料与方法
1.1 一般资料 分析2020年1月至2020年12月期间在我院进行年度健康体检且行人体成分测定的中老年人的临床资料及相关检查数据。纳入标准:①年龄≥45岁的年度健康体检者;②有完善的肝脏超声检查、生物电阻抗分析仪(BIA)行人体成分测定及血液生化指标测量;③能配合肌肉力量及躯体机能测定;排除标准:①排除病毒性肝病、酒精性肝病、药物性肝病及自身免疫性肝病患者;②排除有残疾、神经-肌肉疾病或骨骼-肌肉疾病、先天性肌营养不良、药物性肌病等影响骨骼肌者;③ 患有与甲状腺激素、性激素、糖皮质激素等影响肌肉功能或骨代谢相关疾病者。共计纳入1363例研究对象,所有研究对象均签署知情同意书。本研究经石家庄市人民医院伦理委员会审核通过。
1.2 方法
1.2.1 基线资料及慢性病史采集 由一名住院医师对所有纳入者的基线资料(性别、年龄)及与SP、NAFLD密切相关的慢性病史(2型糖尿病及高脂血症病史)进行采集,并询问其服药及饮酒习惯等信息。
1.2.2 人体成分测定及肌肉力量、躯体功能测定 人体成分测定经东华原(北京)DBA550多频BIA人体成分分析仪进行测定。测定前,体检者需禁食2 h、禁止剧烈活动并排空大小便。测定时体检者穿贴身内衣站立于机器上,手、足分别接触相应电极,测定体检者体重、骨骼肌肉量、四肢骨骼肌质量(ASM)、体脂肪量、内脏脂肪面积、体脂肪率、体质量指数(BMI)及腰臀比等定量指标。肌肉力量测定采用香山(广东)EH101型号握力计进行测定,体检者双手自然下垂,双手各握两次,取最大值(kg)计入。躯体功能测定以体检者6 m步行距离计算,每位体检者测量两次,取两次的平均时间(s)。
1.2.3 血液生化指标测定及肝脏超声检查 所有纳入者进行血液生化检查之前需禁食10 h以上,清晨空腹经肘正中静脉采集静脉血10 ml。生化指标测定采用瑞士罗氏公司cobas 8000型全自动生化分析仪测定甘油三酯、总胆固醇、血糖等指标。采用美国GE公司LOGIQ-E9型超声波诊断仪进行肝脏检查。
1.3 诊断标准 肌肉减少症的诊断符合亚洲肌肉减少症工作组(AWGS)于2019年发布的亚洲肌少症诊断及治疗共识中发布的关于SP诊断标准[4],即:①四肢骨骼肌含量(BIA):男<7.0 kg/m2,女<5.7 kg/cm2;②肌肉力量(握力):男<28 kg,女<18 kg;③躯体功能:6 m步行速度<1.0 m/s;需满足①+②或①+③。脂肪性肝病诊断及分级标准参考超声结果。NAFLD诊断符合《非酒精性脂肪性肝病防治指南(2018更新版)》[5]诊断标准。
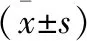
2 结果
2.1 基本资料及中老年人SP患病率 本研究中共纳入体检者1 363例,其中男性988例,女性375例;年龄45~89岁,平均(56.33±13.47)岁。共计有86例被诊断为SP,中老年SP总患病率为6.31%,其中男5.36%(53/988)、女8.80%(33/375)。45~59岁、60~74岁年龄段女性SP患病率均高于男性,且差异均有统计学意义(P均<0.05),而75~89岁年龄段男女患病率间差异无统计学意义(P>0.05)。不同性别中老年人SP患病率均随年龄增大而增加,差异有统计学意义(P<0.05)见表1。
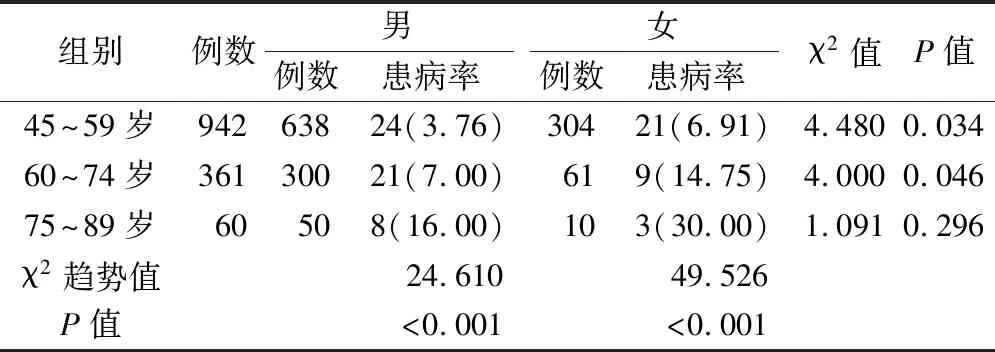
表1 不同年龄段及性别中老年人SP患病率比较 [n(%)]
2.2 SP组与非SP组体检者临床资料及人体成分对比分析 本研究中单因素分析结果显示,中老年SP组女性患病率、平均年龄、2型糖尿病患病率高于非SP组,而BMI低于非SP组,且组间差异均有统计学意义(P均<0.05);中老年SP组肌肉量、ASM、SMI、体脂肪量、腰臀比及内脏脂肪面积均低于非SP组,组间差异均有统计学意义(P均<0.05)见表2。
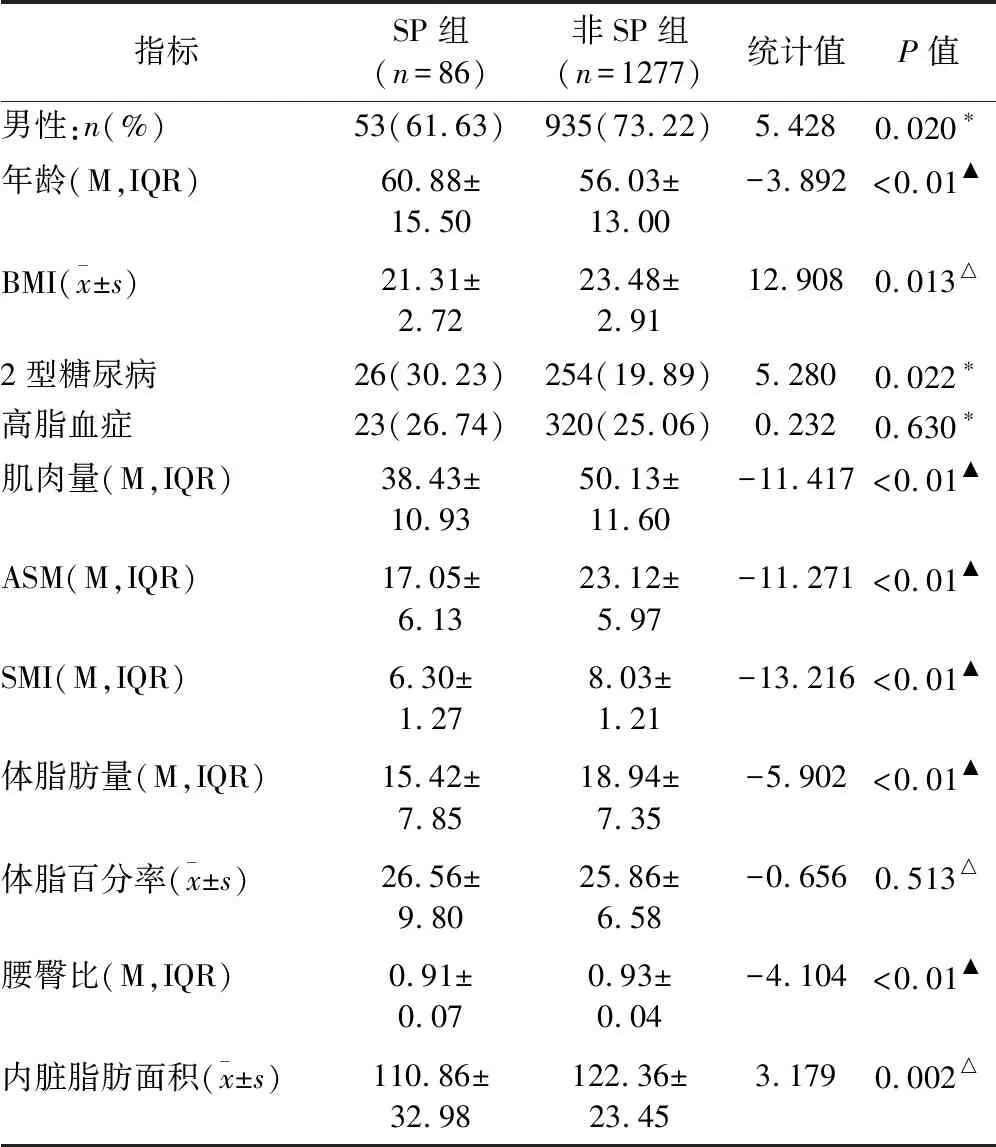
表2 临床资料及人体成分在两组患者间比较
2.3 中老年SP与NAFLD关系 本研究中共发现354例NAFLD患者,总患病率为23.97%(354/1 363),NAFLD组中老年SP患病率为15.54%(55/354),非NAFLD组中老年SP患病率为2.82%(31/1 009);NAFLD组中老年SP患病率明显高于非NAFLD组,且差异有统计学意义(χ2=68.872,P<0.001);354例NAFLD患者中,根据超声影像表现进行分级:轻度182例、中度106例、重度66例;其中老年SP发病率分别为8.24%(15/182)、16.98%(18/106)、33.33%(22/66),提示中老年SP发病率有随着NAFLD程度增加而升高趋势,且差异有统计学意义(χ2趋势值为22.866,P<0.001)见图1。
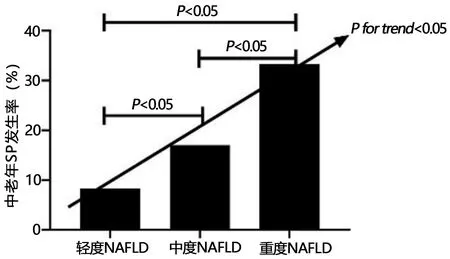
图1 不同程度NAFLD中老年体检者SP发生率及趋势图
3 讨论
SP是一种与年龄相关的肌肉质量减少、肌肉力量和躯体机能逐渐丧失的疾病,而骨骼肌作为胰岛素介导的葡萄糖代谢的主要器官,其质量和力量的降低在胰岛素抵抗和代谢综合征中起关键作用[3]。NAFLD是世界范围内最常见的肝病,其在全球发病率高达22.5%,在亚洲的发病率高达27%[6]。胰岛素抵抗与SP的主要病理生理学机制有关,其在NAFLD的发生、发展中同样存在重要作用。
本研究中SP组患者平均年龄大于非SP组,且两组间存在显著差异(P<0.05),将年龄分成不同年龄段进行趋势卡方检验发现SP患病率随年龄增大而升高;这与以往研究结果一致,再次印证SP是一种增龄性病变。本研究中中老年SP总患病率为6.31%,女性总体患病率高于男性,且45~59岁、60~74岁年龄段女性SP患病率显著高于男性,而>75岁年龄段不同性别患病率无显著差异,该结果与部分学者研究结果相矛盾[4];笔者分析导致不同研究结果中不同性别人群SP患病率存在差异的原因可能在于研究对象不同,且目前所有有关SP的研究均为单中心、较小样本量的研究,其结果不可避免的存在一定差异;此外,不同生活习惯亦可能对SP的发生存在一定影响。
本研究通过BIA进行人体成分分析,结果显示SP组患者BMI、肌肉量、ASM、SMI、及腰臀比均低于非SP组,且组间均存在显著性差异(P<0.05),这与以往研究结果基本一致[7],再次提示BMI、腰臀比、肌肉量、ASM可以作为中老年人群营养状态好坏的评价指标,由此可见SP组中老年人存在一定状态的营养不良。此外,本研究发现,SP组体脂肪量及内脏脂肪面积均低于非SP组,该结果与本课题前期研究结果L3 SMI与内脏脂肪面积呈正相关相一致。有研究显示当成人腹部内脏脂肪较多时,由于内脏脂肪分子活性较高,其可导致椎旁肌群骨骼肌脂肪浸润程度增大,从而增大SP的发生率[8]。有关SP与体内脂肪的关系及骨骼肌脂肪浸润的分子机制尚待未来进一步研究。
本研究在分析中老年SP与NAFLD关系时,将临床中与该两者关系密切2型糖尿病及高脂血症一并纳入观察指标中,结果显示中老年SP组2型糖尿病高于非SP组,且组间存在显著性差异(P<0.05)。分析导致该结果的原因可能在于2型糖尿病与SP存在相同的病理生理学机制,即胰岛素抵抗;此外2型糖尿病患者可能随着病程延长而导致外周神经病变及毛细血管密度降低,从而引起骨骼肌血流灌注及氧摄取下降进而导致骨骼肌功能降低而最终导致SP的发生。
以往有研究显示SP为NAFLD的独立危险因素[9],鉴于NAFLD临床高发病率,本研究尝试进一步探讨NAFLD与SP的关系,结果发现,NAFLD患者并发SP的几率较非NAFLD患者高,组间差异有统计学意义(P<0.05),且NAFLD患者SP发病率随着NAFLD程度加重而升高,这与Kim JA[3]等研究结果一致。该病理学机制可能是由于骨骼肌通过表达胰岛素依赖性转运体GLUT-4而维持体内葡萄糖的稳态,SP则可以降低骨骼肌的胰岛素敏感性,而胰岛素敏感性的降低可以损害葡萄糖的摄取并抑制胰岛素刺激糖原的生成,进而导致过量的葡萄糖在肝内转化为甘油三脂,最终导致NAFLD的生成,反之亦然[10]。此外,SP和NAFLD之间除胰岛素抵抗外,还有慢性炎症、氧化应激、维生素D缺乏及缺乏运动等共同病理生理背景。
综上所述,SP是一种增龄性疾病,其中老年女性发病率高于男性;SP在NAFLD患者中发病率更高,且发病率随NAFLD严重程度增加而升高;SP患者患2型糖尿病几率亦高于非SP患者。SP可导致人体成分发生改变,表现为BMI、肌肉量、体脂肪量、内脏脂肪面积减少。本研究存在一定局限性:①为单中心研究,样本量较小,且纳入者多为脑力工作者,因此可导致结果存在一定偏倚,未来需基于多中心、更大样本量研究以进一步验证;②本研究为横断面设计,SP与NAFLD之间因果关系及分子机制需要进一步研究。
