基于COⅠ和Cytb基因的浙江不同抗性水平二化螟种群的遗传结构分析
2022-11-28鲁艳辉郭嘉雯田俊策薛钊鸿郑许松吕仲贤
鲁艳辉,郭嘉雯,田俊策,薛钊鸿,郑许松,吕仲贤
(浙江省农业科学院 农产品质量安全危害因子与风险防控国家重点实验室 植物保护与微生物研究所,浙江 杭州 310021)
二化螟(Chilosuppressalis)属于鳞翅目(Lepidoptera)草螟科(Crambidae),它的危害伴随着水稻整个生育期,且为害症状因为害期的不同而不同。初孵的二化螟幼虫主要取食水稻较嫩的叶鞘组织,造成水稻枯鞘。在水稻分蘖期,二化螟钻入水稻茎秆中下部为害,造成枯心苗。在水稻的孕穗期和抽穗期为害还会造成水稻白穗和枯孕穗等症状,严重影响水稻品质和产量[1-2]。
线粒体DNA(mitochondria DNA, mtDNA)是一种群体遗传学研究中常用的分子标记[3],其具有严格的母系遗传、核苷酸替代率高、进化速度快等特点,并缺少基因重组[3-4]。目前昆虫线粒体基因中结构与功能研究较为深入的是线粒体细胞色素氧化酶亚基Ⅰ(COⅠ)基因和细胞色素b(Cytb)基因[5-6],因此在柑橘木虱(Diaphorinacitri)[7]、缅甸安小叶蝉(Anakaburmensis)[8]、亚洲玉米螟(Ostriniafurnacalis)[9]、橡实象虫(Curculioarakawai)[10]、大螟(Sesamiainferens)[11]、甜菜夜蛾(Spodopteraexigua)[12]等多种昆虫的遗传多样性及种群结构研究中广为应用。
目前,二化螟的防治仍然主要依赖化学农药,化学农药的不合理使用导致二化螟抗性水平不断提高,其中浙江省大部分稻区二化螟对氯虫苯甲酰胺的抗性已达到高抗水平,对其他药剂的抗药性也有所提高[13]。为了明确不同抗性水平二化螟地理种群的遗传多样性,本实验选用线粒体COⅠ和Cytb基因作为分子标记,对浙江省8个不同抗性水平二化螟地理群的遗传多样性和种群遗传结构进行研究,以期能够指导抗性二化螟监测,为制定合理的二化螟综合防治策略提供理论依据。
1 材料与方法
1.1 二化螟成虫样品采集
2018年春季(3—4月份),通过灯诱的方法分别在浙江省平湖(PH)、萧山(XiaoS)、象山(XS)、宁海(NH)、永康(YK)、温岭(WL)、乐清(YQ)、瑞安(RA)8个不同地区诱集二化螟成虫,样品采集信息见表1。按二化螟的形态特征镜检确认后,每个地理种群随机选取一定数量(大约50头)的二化螟成虫作为试虫,提取单头样品基因组DNA。其余成虫用于产卵,孵化出的F1代3龄幼虫用于抗性水平监测。其中幼虫置于温度(27±2)℃,相对湿度(70±5)%,光周期16 h/8 h的人工气候室饲养,饲养方法采用人工饲料法[14]。

表1 八个不同地理种群二化螟的采集信息
1.2 毒力测定方法
采用稻苗浸渍法测定8个不同地理种群对氯虫苯甲酰胺、阿维菌素和甲氧虫酰肼的抗性水平[2]。每种药剂先用丙酮或者二甲基亚砜配制成1 000 mg·L-1的储存液,然后用含0.1%的Triton X-100水等比稀释5个浓度梯度,0.1%的Triton X-100 水作为对照。将分蘖期的水稻剪成5~6 cm 的茎秆,放入预先配置的药液中浸渍10 s,取出自然阴干。将晾干后的茎秆放入事先准备好的底部铺有4层保湿滤纸的培养皿中(直径7 cm),每个培养皿用毛笔接入10 头二化螟3 龄幼虫,每组重复3 次。72 h 后统计幼虫死亡情况。
1.3 基因组DNA提取
利用动物组织DNA提取试剂盒(天根生化科技有限公司)提取单头不同地理种群二化螟成虫基因组DNA,操作步骤严格按照试剂盒说明书进行。用1%的琼脂糖凝胶电泳检测提取基因组DNA的完整性。提取的DNA样品置于-20 ℃冰箱里保存,以便用于后续的PCR扩增。
1.4 PCR扩增及测序
以基因组DNA为模板,以COⅠ和Cytb基因的通用引物为引物(表2),进行PCR扩增。PCR反应总体系为50 μL,包括25 μL 10×PCR buffer Mix(天根生化科技有限公司),2 μL正向引物,2 μL反向引物,7.0 μL模板DNA,14 μL双蒸水。PCR扩增条件:94 ℃变性3 min; 94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共循环35次;最后72℃延伸5 min。PCR产物由擎科生物技术有限公司进行纯化测序。

表2 用于COⅠ和Cytb基因PCR扩增的引物和产物长度
1.5 数据统计与分析
利用DPS软件[15]计算3种药剂对二化螟3 龄幼虫的致死中浓度LC50。
序列分析:利用SeqMan软件[16]对获得的双向测序序列进行比对拼接。利用ClusterW(https://www.genome.jp/tools-bin/clustalw)将拼接后的DNA序列进行比对。种群的总单倍型数及多态位点数检测采用DnaSP v5软件完成[17]。二化螟种群的遗传多样性参数,包括每个种群的单倍型数(H)、单倍型多样度(h)、核苷酸多样度(π)及两两序列比对平均核苷酸差异数(k)的计算利用Arlequin 3.5[18]软件完成。
种群遗传结构分析:分子变异方差分析(AMOVA)利用Arlequin 3.5 完成,通过1 000次重抽样来检验组间、组内群体间、群体内个体间的协方差的显著性。两两群体间的遗传差异采用Tumura-Nei模型下的群体分化指数(Fst)分析,通过1 000次重抽样检验Fst值的显著性[19]。利用R语言(https://www.r-project.org/)进行遗传距离与地理距离的Mantel相关性检验及抗性水平与遗传多样性间的Pearson相关性检验。利用TCS 法建立单倍型网络关系图(http://popart.otago.ac.nz)。单倍型系统发育进化树采用邻接法(neighbor-joining method)计算并使用Mega 6.0软件构建[3]。
2 结果与分析
2.1 不同地理种群的抗性水平监测结果
测定了这8个二化螟地理种群对氯虫苯甲酰胺、阿维菌素、甲氧虫酰肼3种药剂的抗药性。结果表明,8个种群对氯虫苯甲酰胺的抗药性最高,抗性倍数在57.84~216.77倍,其中抗性最高的是WL种群,最低的为PH种群;对阿维菌素的抗药性较低,抗性倍数在9.21~19.16倍,其中抗性最高的为PH种群,最低的为WL种群,与对氯虫苯甲酰胺的抗性水平截然不同;对甲氧虫酰肼的抗性也相对较高,抗性倍数在50.47~136.61倍,其中抗性最高的为XiaoS种群,最低的为WL种群(表3)。

表3 不同地理种群二化螟对氯虫苯甲酰胺、阿维菌素和甲氧虫酰肼的抗性水平
2.2 种群遗传多样性分析
实验获得8个不同地理种群二化螟的COⅠ基因测序结果,去除引物序列及部分端序列后得到355条627 bp的等长序列。序列分析结果显示,A、T、C、G的平均含量分别为29.6%、39.5%、15.5%、15.4%,AT(69.1%)含量明显高于GC(30.9%)含量,各群体碱基组成相近,没有出现碱基插入和缺失现象。所有同源序列中监测出了68个多态性位点,其中单突变位点22个,简约突变位点46个。共出现了85个单倍型,每个群体的平均单倍型为18.25个,其中RA种群中单倍型最多,为27个单倍型,单倍型多样度h为0.896 3,最低的为NH种群(h=0.511 1);核苷酸多样性指数最高的为XiaoS种群(π=0.009 5),最低的为NH种群(π=0.002 9)(表4)。
实验获得8个不同地理种群二化螟的Cytb基因测序结果,去除引物序列及部分端序列后得到326条455 bp的等长序列。序列分析结果显示,A、T、C、G的平均含量分别为31.2%、41.5%、17.7%、9.6%,AT(72.7%)含量明显高于GC(27.3%)含量,各群体碱基组成相近,同样没有出现碱基插入和缺失现象。所有同源序列中监测出了45个多态性位点,其中单突变位点19个,简约突变位点26个。共出现了64个单倍型,每个群体的平均单倍型为14.375个,其中YQ种群中单倍型最多,为25个单倍型,单倍型多样度h为0.934 4,最低的为NH种群(h=0.266 2);核苷酸多样性指数最高的为PH种群(π=0.010 7),最低的为NH种群(π=0.003 4)(表4)。

表4 基于COⅠ和Cytb标记的二化螟8个不同抗性水平地理种群的遗传学参数
抗性水平与遗传多样性Pearson相关性分析结果显示:二化螟对氯虫苯甲酰胺、阿维菌素和甲氧虫酰肼的抗性水平与种群遗传多样性参数单倍型多样度h和核苷酸多样性指数π无显著相关性(P>0.05,表5)。

表5 二化螟不同地理种群抗性水平与种群遗传多样性的Pearson相关性分析
2.3 种群遗传结构分析
二化螟不同地理种群间遗传距离及群体间遗传分化系数见表6。基于COⅠ基因的分析结果显示,种群间遗传距离分布在0.005~0.011,遗传距离最高的XiaoS种群与PH、RA、XS、YQ种群间,均为0.011;最低的为NH种群与YK种群之间,遗传距离为0.005,遗传距离和地理距离间无显著相关性。两两种群之间的Fst值分布在-0.002 90~0.451 48,其中RA与NH种群间遗传分化系数最大,YQ与XS间遗传分化系数最小,遗传距离和地理距离间无显著相关性(表6)。
基于Cytb基因的分析结果显示,种群间遗传距离分布在0.006~0.012,遗传距离最高的XiaoS种群与RA、XS、YQ种群间及NH与RA种群间,均为0.012;最低的为NH种群与YK种群之间,遗传距离为0.006,遗传距离和地理距离间无显著相关性。两两种群之间的Fst值分布在-0.015 99~0.586 93,其中RA与NH种群间遗传分化系数最大,YQ与XS间遗传分化系数最小(表6)。

表6 八个二化螟不同抗性水平地理种群间遗传分化系数(对角线下)及遗传距离(对角线上)
基于COⅠ和Cytb基因的AMOVA分析结果显示,二化螟不同地理种群间遗传变异大多数来自于群体内个体间,分别占80.30%(COⅠ)和78.16%(Cytb),且具有显著差异的统计值(P=0.000 1,COⅠ;P=0.000 01,Cytb),较少部分的遗传差异来自于组间,分别占19.43%(P=0.010 8,COⅠ)和21.22%(P=0.014 06,Cytb),而来自于组内群体间的遗传差异分别只占0.27%(P=0.338 2,COⅠ)和0.62%(P=0.308 22,Cytb)(表7)。
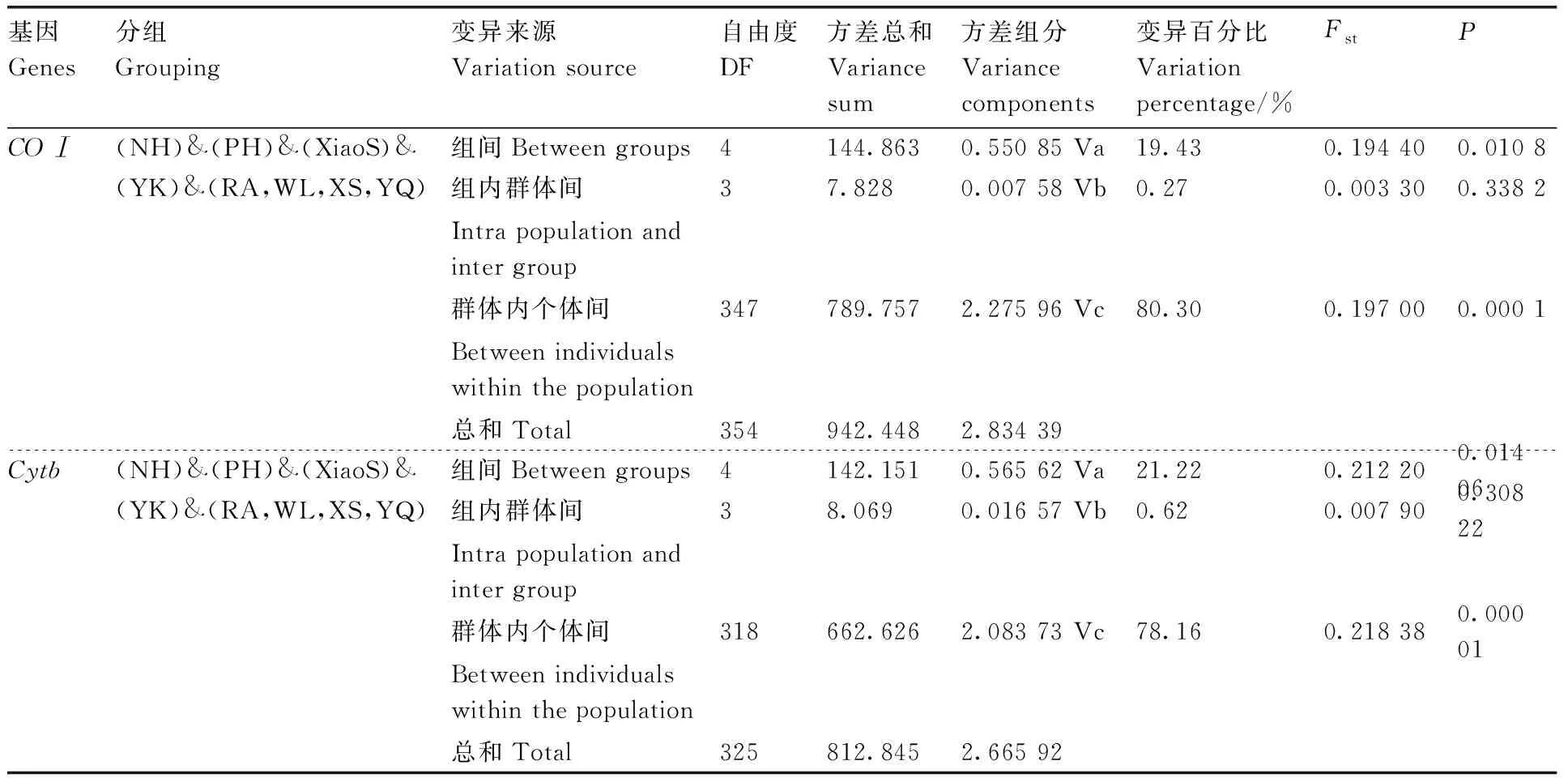
表7 基于COⅠ和Cytb基因序列的二化螟种群遗传变异的AMOVA分析
基于COⅠ基因分析的二化螟不同地理种群单倍型网络关系图显示,Hap_1的拷贝数在NH种群中比例最高(图1)。各单倍型间碱基差异小,不同群体的单倍型未呈现地理分支,没有表现出显著的地理系谱结构。85个单倍型的系统树未表现出清晰的网状结构,支持单倍型网络图的结论(图2)。同样,基于Cytb基因的单倍型网络关系图分析结果显示,Hap_1和Hap_5的拷贝数在所有种群的样品中占比例较高,且Hap_1在NH种群中比例最高(图3)。所有单倍型的系统树也未表现出清晰的网状结构(图4)。

图1 基于COⅠ基因分析的85个单倍型网络关系图Fig.1 Haplotype network of 85 haplotypes based on COⅠ gene analysis

图2 二化螟COⅠ基因不同单倍型邻接树Fig.2 Haplotype neighbor-joining tree based on COⅠ genes of Chilo suppressalis

图3 基于Cytb基因分析的64个单倍型网络关系图Fig.3 Haplotype network of 64 haplotypes based on Cytb gene analysis

图4 二化螟Cytb基因不同单倍型邻接树Fig.4 Haplotype neighbor-joining tree based on Cytb genes of Chilo suppressalis
3 讨论
室内测定了浙江省内8个不同地理种群对氯虫苯甲酰胺、阿维菌素和甲氧虫酰肼3种药剂的抗性水平,除PH、XS、RA种群外,其余种群对氯虫苯甲酰胺的抗性倍数均高于100倍;除NH和WL种群外,其余种群对甲氧虫酰肼的抗性倍数也均高于100倍;所有监测的种群对阿维菌素的抗药性仍处于相对较低的水平。由此可见,浙江省内大部分田间二化螟种群对氯虫苯甲酰胺和甲氧虫酰肼都产生了高水平抗性,而不同种群之间抗性水平的差异可能与当地用药历史和用药次数有关。
基因序列变异与遗传多样性是研究生物多样性的基础,核苷酸多样性和单倍型多样性是评价遗传多样性的重要指标[3]。本研究通过对我国浙江地区8个不同抗性水平的二化螟地理种群COⅠ和Cytb基因进行扩增和序列分析发现:一是AT含量明显高于GC含量,这种严重A+T偏向性现象与其他鳞翅目昆虫类似[20-21]。二是二化螟种群遗传多样性参数较低,三百多个个体中分别检测到85个单倍型(COⅠ)和64个单倍型(Cytb),表明二化螟种群的遗传多样性处于相对较低的水平。这与其他鳞翅目夜蛾科昆虫的研究结果较为一致[21-22]。此外,Grant等[23]提出了单倍型多样性和核苷酸多样性组合中的“高h,低π”的遗传多样性类型,我们的研究结果显示,二化螟种群具有较高水平的单倍体多样性和较低水平的核苷酸多样性,与Grant等[23]提出的遗传多样性类型相符合。具有较低水平遗传多样性的物种易受到外界因素的影响,在不利的环境条件下生存容易受到一定的威胁,这对于抗性二化螟的田间防控是一个相对有利的因素。AMOVA 分析发现,群体间的Fst值较低且多为不显著,表明不同群体间没有形成显著的遗传分化,只有NH和PH种群间存在较低程度的遗传分化。总的来看,所检测的不同抗性水平的二化螟群体间没有形成显著的遗传结构,遗传分化程度低,群体间可能存在基因交流现象。
目前,二化螟抗药性发展迅速,对多种类型的药剂都产生了较高水平的抗药性。我们的研究结果显示,二化螟种群遗传距离与地理距离之间不存在显著的相关性;不同种群二化螟抗性水平与种群遗传多样性无显著的相关性。由此可见,田间存活下来的抗性个体扩散、造成不同地理种群的基因交流可能是二化螟抗药性快速发展的关键。因此,采取一定的措施尽量限制其快速扩散到其他水稻主产区对控制二化螟成灾及抗性二化螟的有效治理具有重要意义。
