miR-31靶向SATB2对结肠癌上皮细胞HCT116焦亡的促进作用
2022-11-27张文琴都新新张一楠任彩佩崔香丽
张文琴,都新新,张一楠,任彩佩,崔香丽
山西医科大学生理学系,山西 太原 030001
结肠癌是世界上发病率最高的三大癌症之一,其死亡率位居世界癌症死亡的第二[1]。已知结肠癌与慢性炎症密切相关,且慢性炎症主要表现在肿瘤发生的早期阶段[2]。炎症性肠病(inflammatory bowel disease,IBD)主要有两种:溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn disease,CD),患者病程经常反复,长期迁延不愈者结肠炎相关性肠癌的风险增高[3],发病机制尚不完全清楚。因此,有必要探索结肠炎相关结肠癌的预防方法和治疗靶标。
近年来,随着分子生物学技术的发展,结肠癌的预防与治疗也深入到基因调节机制层面。microRNA是一类内源性表达并在转录后水平调控基因表达的长度约20个核苷酸的单链非编码RNA,其表达与宿主基因的转录和加工有关[4],参与了肿瘤和多种炎症的发病机制[5]。
SATB2是特殊的富含AT序列的结合蛋白,其通过调节染色质的结构以及作为转录辅助因子影响基因的表达。其表达具有组织特异性,除在干细胞和祖细胞中高度表达外,在多种癌症的发生、发展和转移中也起着重要作用[6]。
细胞焦亡是一种由胱天蛋白酶(Caspase)-1/4/5/11介导的细胞程序性死亡的新形式,此过程可被某些炎症小体如NLRP3等激活。细胞焦亡导致细胞肿胀、质膜溶解、染色质碎裂和细胞内促炎成分IL-18、IL-1β的释放[7],与各种疾病密切相关,对于癌症,其具有双重作用[8]。胃泌素蛋白D(gasdermin D,GSDMD)是Caspase-1的底物,切割后GSDMD的N-末端片段迅速靶向巨噬细胞的膜部分,诱导质膜孔的形成,是介导细胞焦亡的关键分子。因此,阐明细胞焦亡通路中关键蛋白的作用和影响因素,可为癌症的治疗和预防提供新的思路和依据。
本实验室前期实验检测出miR-31在结肠炎组织中高表达,通过双荧光素酶报告基因检测技术证明SATB2是miR-31的直接靶标。miR-31对肠炎的促进作用是否与上皮细胞焦亡有关、此作用是否通过靶向SATB2实现目前尚未见报道。因此,本实验将结肠癌上皮细胞HCT116作为研究对象,探讨miR-31是否通过靶向SATB2来调节细胞焦亡通路蛋白的表达,以期为结肠癌发病机制的研究及治疗提供新的靶标。
1 材料与方法
1.1 细胞 结肠癌上皮细胞HCT116购自中国科学院。
1.2 miR-31、质粒及菌株miR-31 mimic(miR-31模拟物)、miR-31 inhibitor(miR-31抑制剂)、质粒si-SATB2(敲低SATB2的表达)、含pEXP-RB-Mam-SATB2过表达质粒和pEXP-RB-Mam空载体的15%甘油菌购自广东锐博生物科技有限公司。
1.3 主要试剂及仪器 转染试剂购自赛默飞世尔科技中国有限公司;DMEM高糖培养基购自山西赛奥生物有限公司;胎牛血清、胰酶、青链霉素混合液(penicillin-streptomycin solution,P/S)和羊抗兔IgG二抗购自北京全式金生物技术有限公司;RIPA裂解液购自上海碧云天生物技术有限公司;BCA检测试剂盒购自江苏凯基生物技术股份有限公司;质粒小提试剂盒购自北京康为世纪生物科技有限公司;超敏ECL发光液购自上海爱必信生物技术有限公司;LB培养基购自北京索莱宝科技有限公司;NLRP3、GSDMD-N、IL-18、IL-1β兔多克隆抗体和SATB2兔单克隆抗体购自美国Abcam公司;Caspase-1兔单克隆抗体购自美国Invitrogen公司;β-actin鼠单克隆抗体购自武汉Proteintech公司;兔抗鼠IgG二抗购自美国Cell Signaling公司;NANODROP 2000c购自美国Thermo公司。
1.4 质粒的提取 将菌液接种于LB培养基,置37℃恒温摇床培养12 h,9 000×g离心30 s,弃上清,收集细菌,用质粒小提试剂盒提取质粒。
1.5 细胞转染及分组处理 将HCT116细胞于37℃复苏,加入培养基,放入孵箱孵育。取对数生长期的细胞,接种至6孔培养皿中,分为miR-31 mimic组、miR-31 inhibitor组和si-SATB2组,采用脂质体瞬时转染的方法将miR-31 mimic、miR-31 inhibitor和si-SATB2转染HCT116细胞(终浓度为62.5 ng/mL),并设对照组(加入100µL无血清、无P/S的DMEM培养基);另将细胞分为SATB2过表达组和空载体组,采用质粒转染的方法转染pEXP-RB-Mam-SATB2过表达质粒和pEXP-RB-Mam空载体(终浓度均为400 ng/µL),并设对照组(加入500µL无血清、无P/S的DMEM培养基),十字摇匀后,37℃,5% CO2培养箱培养72 h,收集细胞,提取蛋白,BCA试剂盒检测蛋白浓度。
1.6 细胞焦亡通路相关蛋白表达的检测 采用Western blot法。裂解各组细胞,用NANODROP 2000c测定蛋白浓度。各组分别取20µg蛋白样品,经10%SDS-PAGE分离后,转移至PVDF膜上,用5%脱脂奶粉室温封闭2 h;TBST缓冲液洗膜30 s,分别加入SATB2兔单抗(1∶5 000稀释)、NLRP3兔多抗(1∶1 000稀释)、Caspase-1兔单抗(1∶2 000稀释)、GSDMD-N兔多抗(1∶1 000稀释)、IL-18兔多抗(1∶200稀释)、IL-1β兔多抗(1∶1 000稀释)、β-actin鼠单抗(1∶5 000稀释),4℃孵育过夜;分别加入羊抗兔IgG、兔抗鼠IgG二抗(均1∶2 000稀释),室温摇床孵育1 h;TBST缓冲液洗膜4次,每次8 min,放入ChemicDocTMMP显影系统,利用Image Lab检测条带灰度值,分别计算各蛋白在HCT116细胞中的相对表达量。
1.7 统计学分析 应用Graphpad Prism 6软件进行统计分析,实验结果以均数±标准差()表示,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 miR-31对SATB2蛋白表达的影响 与对照组(0.546 7±0.042 56)相比,miR-31 mimic(0.313 3±0.026 03)可显著抑制SATB2蛋白的表达(t=4.677,P<0.01);si-SATB2的效应与miR-31 mimic相似,SATB2蛋白的表达(0.293 3±0.037 56)显著下降(t=4.463,P<0.05);miR-31 inhibitor组SATB2蛋白表达(0.736 7±0.038 44)显著升高(t=3.313,P<0.05)。见图1。表明miR-31可抑制SATB2的表达,同时也证明miR-31 mimic、miR-31 inhibitor和si-SATB2转染成功。

图1 Western blot分析各组HCT116细胞中SATB2蛋白的表达Fig.1 Western blotting of expression of SATB2 in HCT116 cells of various groups
2.2 miR-31/SATB2对细胞焦亡信号通路蛋白NLRP3、Caspase-1表达的影响 与对照组相比,miR-31 mimic和si-SATB2组NLRP3蛋白的表达均显著升高(t分别为3.702和2.859,P分别<0.01和<0.05),Caspase-1蛋白的表达也显著升高(t分别为6.286和5.588,P均<0.01);miR-31 inhibitor组NLRP3和Caspase-1蛋白的表达显著降低(t分别为2.747和3.332,P均<0.05)。见图2和表1。表明miR-31过表达或抑制SATB2的表达,均可促进NLRP3和Caspase-1蛋白的表达。
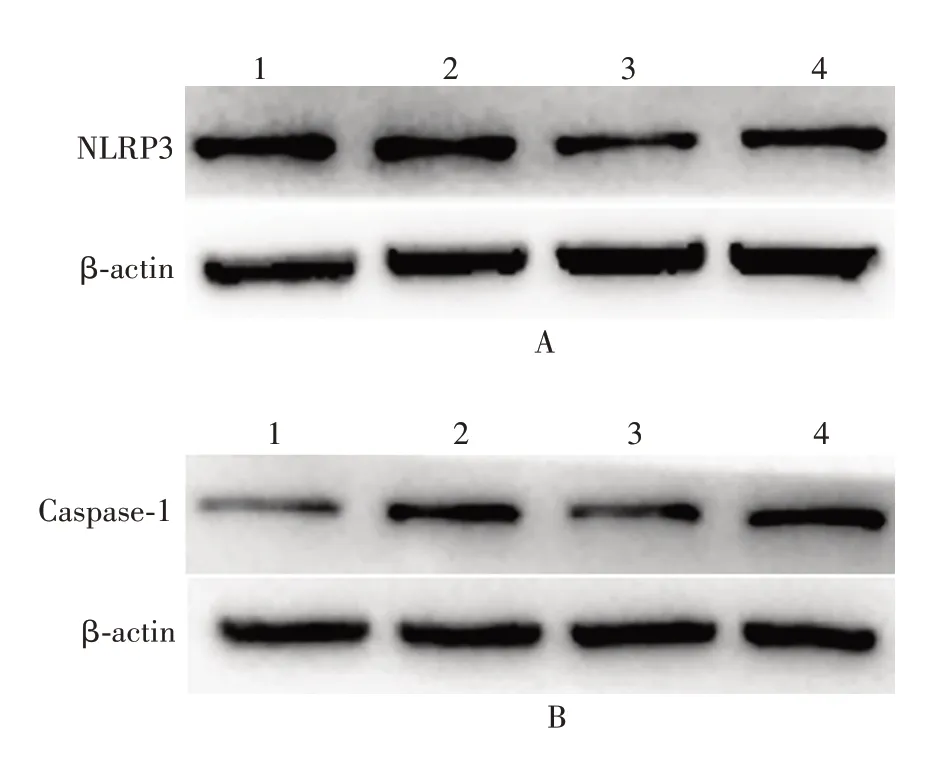
图2 Western blot分析各组HCT116细胞中NLRP3(A)和Caspase-1(B)蛋白的表达Fig.2 Western blotting of expressions of NLRP3(A)and Caspase-1(B)in HCT116 cells of various groups
2.3 miR-31/SATB2对细胞焦亡通路中促炎因子IL-18和IL-1β蛋白表达的影响 与对照组相比,miR-31 mimic和si-SATB2组IL-18蛋白的表达显著升高(t分别为6.069和5.211,P均<0.01),IL-1β蛋白的表达也显著升高(t分别为5.017和6.843,P均<0.01);miR-31 inhibitor组IL-18和IL-1β蛋白的表达显著降低(t分别为3.545和2.862,P均<0.05)。见图3和表2。表明miR-31过表达或抑制SATB2的表达,均可促进细胞焦亡通路中促炎因子IL-18和IL-1β蛋白的表达。
表1 各组HCT116细胞中NLRP3和Caspase-1蛋白的相对表达量(±s)Tab.1 Relative expression levels of NLRP3 and Caspase-1 in HCT116 cells of various groups(±s)

表1 各组HCT116细胞中NLRP3和Caspase-1蛋白的相对表达量(±s)Tab.1 Relative expression levels of NLRP3 and Caspase-1 in HCT116 cells of various groups(±s)
注:与对照组比较,a表示P<0.05,aa表示P<0.01。
组别对照miR-31 mimic miR-31 inhibitor si-SATB2 NLRP3(n=5)0.162 0±0.024 37 0.322 0±0.035 69aa 0.076 0±0.019 65a 0.276 0±0.031 56a Caspase-1(n=4)0.320 0±0.052 76 0.735 0±0.039 69aa 0.125 0±0.025 33a 0.785 0±0.064 36aa

图3 Western blot分析各组HCT116细胞中IL-18(A)和IL-1β(B)的表达Fig.3 Western blotting of expressions of IL-18(A)and IL-1β(B)in HCT116 cells of various groups
2.4 miR-31/SATB2对细胞焦亡信号通路蛋白GSDMD-N表达的影响 与对照组(0.260 0±0.02 082)相比,miR-31 mimic(0.403 3±0.012 02)和si-SATB2(0.440 0±0.026 46)组GSDMD-N蛋白的表达显著升高(t分别为3.748和4.564,P分别<0.01和<0.05);miR-31 inhibitir组GSDMD-N蛋白的表达(0.146 7±0.027 28)显著降低(t=3.110,P<0.01)。见图4。表明miR-31过表达或抑制SATB2的表达,可促进细胞焦亡通路关键蛋白GSDMD-N的表达,反映细胞焦亡的发生。
表2 各组HCT116细胞中IL-18和IL-1β的相对表达量(±s)Tab.2 Relative expression levels of IL-18 and IL-1βin HCT116 cells of various groups(±s)

表2 各组HCT116细胞中IL-18和IL-1β的相对表达量(±s)Tab.2 Relative expression levels of IL-18 and IL-1βin HCT116 cells of various groups(±s)
注:与对照组比较,a表示P<0.05,aa表示P<0.01。
组别对照miR-31 mimic miR-31 inhibitor si-SATB2 IL-18(n=4)0.367 5±0.051 21 0.922 5±0.075 76aa 0.142 5±0.037 5a 0.787 5±0.062 23aa IL-1β(n=3)0.163 3±0.035 28 0.446 7±0.044 10aa 0.056 67±0.012 02a 0.463 3±0.026 03aa
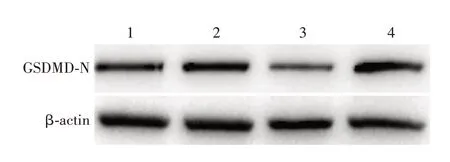
图4 Western blot分析各组HCT116细胞中GSDMD-N蛋白的表达Fig.4 Western blotting of expression of GSDMD-N in HCT-116 cells of various groups
2.5 SATB2过表达的检测 与对照组(0.440 0±0.047 26)相比,空载体组SATB2蛋白的表达(0.430 0±0.030 55)差异无统计学意义(t=0.177 7,P=0.867 6);SATB2过表达组SATB2蛋白的表达(2.800±0.378 6)显著升高(t=6.186,P<0.01)。见图5。表明SATB2过表达质粒转染成功。
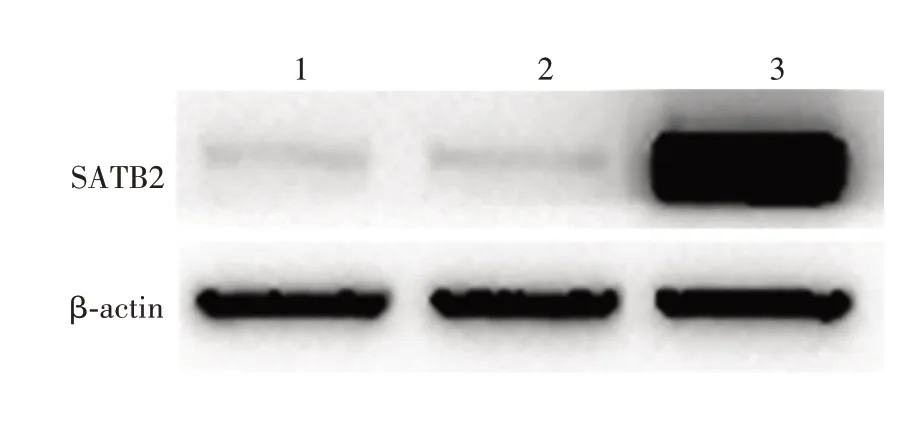
图5 Western blot分析各组HCT116细胞中SATB2蛋白的表达Fig.5 Western blotting of expression of SATB2 in HCT116 cells of various groups
2.6 SATB2过 表 达 对HCT116细 胞 中NLRP3和Caspase-1蛋白表达的影响 与对照组相比,空载体组NLRP3和Caspase-1蛋白的表达差异无统计学意义(t分别为0.033 10和0.083 62,P分别为0.975 2和0.937 4);SATB2过表达组NLRP3和Caspase-1蛋白的表达显著降低(t分别为4.307和2.963,P均<0.05),与miR-31 inhibitor组一致。见图6和表3。表明SATB2可降低NLRP3和Caspase-1蛋白的表达。
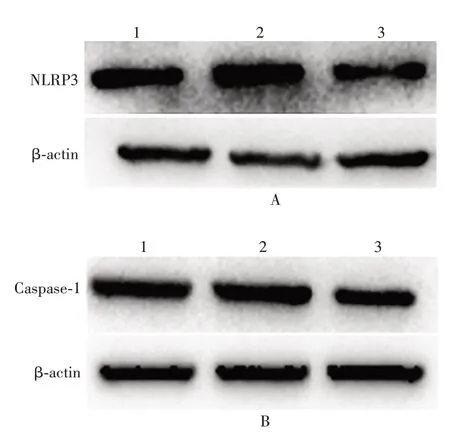
图6 Western blot分析各组HCT116细胞中NLRP3(A)和Caspase-1(B)蛋白的表达Fig.6 Western blotting of expressions of NLRP3(A)and Caspase-1(B)in HCT116 cells of various groups
表3 各组HCT116细胞中NLRP3和Caspase-1蛋白的相对表达量(±s,n=3)Tab.3 Relative expression levels of NLRP3 and Caspase-1 in HCT116 cells of various groups(±s,n=3)
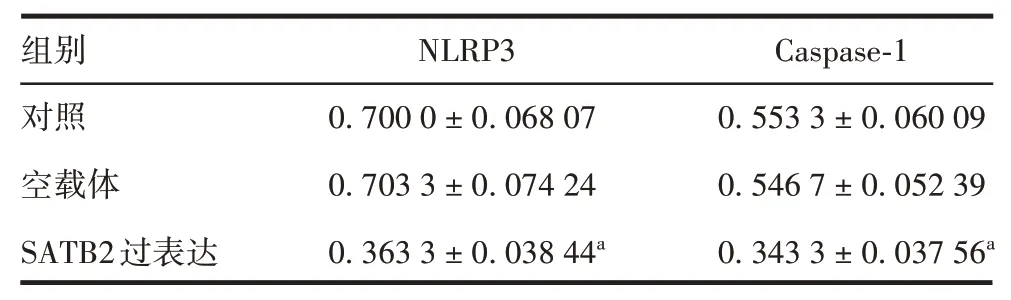
表3 各组HCT116细胞中NLRP3和Caspase-1蛋白的相对表达量(±s,n=3)Tab.3 Relative expression levels of NLRP3 and Caspase-1 in HCT116 cells of various groups(±s,n=3)
注:a表示与对照组比较,P<0.05。
组别对照空载体SATB2过表达NLRP3 0.700 0±0.068 07 0.703 3±0.074 24 0.363 3±0.038 44a Caspase-1 0.553 3±0.060 09 0.546 7±0.052 39 0.343 3±0.037 56a
2.7 SATB2过表达对HCT116细胞中IL-18和IL-1β蛋白表达的影响 与对照组相比,空载体组IL-18和IL-1β蛋白的表达差异无统计学意义(t分别为0.063 44和0.264 4,P分别为0.952 5和0.804 5);SATB2过表达组IL-18和IL-1β蛋白的表达显著降低(t分别为7.894和4.510,P分别<0.01和<0.05),与miR-31 inhibitor组一致。见图7和表4。表明SATB2可降低促炎因子IL-18和IL-1β蛋白的表达。
2.8 SATB2过表达对HCT116细胞中GSDMD-N蛋白表达的影响 与对照组(0.293 3±0.014 53)相比,空载体组GSDMD-N蛋白的表达(0.276 7±0.014 53)差异无统计学意义(t=0.811 1,P=0.462 8);SATB2过表达组GSDMD-N蛋白的表达(0.180 0±0.026 46)显著降低(t=3.755,P<0.05),与miR-31 inhibitor组一致。见图8。表明SATB2过表达可降低细胞焦亡关键蛋白GSDMD-N的表达,促进细胞焦亡的发生。

图7 Western blot分析各组HCT116细胞中IL-18(A)和IL-1β(B)蛋白的表达Fig.7 Western blotting of expressions of IL-18(A)and IL-1β(B)in HCT116 cells of various groups
表4 各组HCT116细胞中IL-18和IL-1β蛋白的相对表达量(±s,n=3)Tab.4 Relative expression levels of IL-18 and IL-1βin HCT116 cells of various groups(±s,n=3)

表4 各组HCT116细胞中IL-18和IL-1β蛋白的相对表达量(±s,n=3)Tab.4 Relative expression levels of IL-18 and IL-1βin HCT116 cells of various groups(±s,n=3)
注:与对照组比较,a表示P<0.05,aa表示P<0.01。
组别对照空载体SATB2过表达IL-18 1.410 0±0.072 34 1.403 0±0.076 23 0.763 3±0.038 44aa IL-1β 0.416 7±0.054 87 0.396 7±0.052 07 0.163 3±0.012 02a
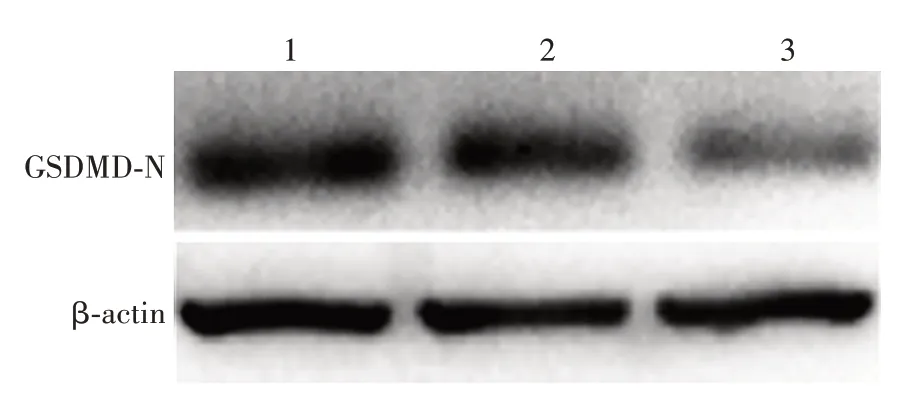
图8 Western blot分析各组HCT116细胞中GSDMD-N蛋白的表达Fig.8 Western blotting of expression of GSDMD-N in HCT-116 cells of various groups
3 讨 论
结直肠癌(colorectal cancer,CRC)作为一种恶性肿瘤,在中国的死亡率呈逐年上升趋势[9],已成为国人关注的主要健康问题之一。其发病可能与吸烟、饮酒、家族遗传、年龄、性别和地域等多种因素有关[10-13],发病机理尚不完全清楚,因此,早期预防和诊断对结肠癌的治疗意义重大。IBD是结肠炎相关结肠癌发展的重要危险因素,CRC发生可表现为FEARON和VOGELSTEIN[14]提 出 的 一 系 列 基 因 改变,即“CRC的遗传途径”。而癌症的体细胞遗传变化不仅限于突变,还可包括各种表观遗传学变化,表观遗传的沉默机制涉及miRNA的参与[15]。miRNA作为一种小的非编码RNA分子,可调节一系列生物学功能,包括细胞存活、增殖、凋亡、肿瘤生长和转移[16]。本实验室发现,肠炎患者炎症部位miR-31-5p表达显著高于正常部位组织[17],但其机制尚不清楚,因此,本实验将miR-31及其可能作用的靶基因SATB2作为主要研究对象,分析其调控的分子机制。
细胞焦亡是一种新的程序性细胞死亡形式。GSDMD作为细胞焦亡的执行者,主要表达于胃肠道和皮肤,位于Caspase的下游,活化的Caspase-1可将其切割为两个片段:N-末端结构域和C-末端结构域,N-末端结构域易位到质膜形成10~15 nm的膜孔,细胞渗透压发生变化,促炎因子进一步释放,导致焦磷酸化的发生[18]。据报道,细胞焦亡与动脉粥样硬化和糖尿病肾病密切相关,最近的研究发现,细胞焦亡可影响肿瘤的增殖、侵袭和转移,这受一些非编码RNA和其他分子的调控[7]。已发现,在某些特定的癌症中,miRNA与细胞焦亡有关[19]。依赖Caspase-1的细胞焦亡途径由NLRP3炎症小体直接激活,由于炎症小体可识别内源性和外源性病原体感染,已有研究者报道它们在IBD和CRC发展中的作用[20]。炎症小体在引发和调节慢性炎症中的双重作用提示它们在肿瘤的形成和进展中同样具有促进或抑制的双重作用[21]。NLRP3的表达被证明是转录后调节的,且多个miRNA已牵涉到炎症小体的转录后调节中[22]。但目前细胞焦亡在肠炎和肠炎相关肠癌中的作用机制仍不清楚,且miRNA在经典的细胞焦亡通路中的研究较少,因此,本课题组聚焦于研究miR-31在结肠癌中的作用是否与细胞焦亡通路的参与有关。本研究结果表明,在HCT116细胞中,过表达miR-31-5p后,炎症小体蛋白NLRP3、Caspase-1、GSDMD-N、促炎因子IL-18和IL-1β蛋白表达显著升高;敲低miR-31-5p,炎症小体蛋白NLRP3、Caspase-1、GSDMD-N、促炎因子IL-18和IL-1β蛋白表达降低,表明miR-31可上调细胞焦亡通路中的蛋白表达,其促进结肠炎和相关肠癌的作用很可能与促进焦亡相关。为了进一步阐明其作用途径,本实验又将其靶基因SATB2作为研究对象,观察细胞焦亡通路蛋白的表达变化。结果表明,抑制SATB2表达,炎症小体蛋白NLRP3、Caspase-1、GSDMD-N、促炎因子IL-18和IL-1β蛋白表达明显升高,与过表达miR-31组一致;过表达SATB2后,炎症小体蛋白NLRP3、Caspase-1、GSDMD-N、促炎因子IL-18和IL-1β蛋白表达降低,与抑制miR-31结果一致。这些结果提示,一定程度上降低miR-31的表达或增加SATB2的表达,可降低细胞焦亡通路蛋白的表达,对结肠炎和结肠炎相关肠癌的发生发展起到一定的抑制作用,但其详细的调控机制仍有待更深入的研究。
综上所述,miR-31可促进结肠癌细胞HCT116细胞焦亡通路中NLRP3、Caspase-1、GSDMD-N、IL-18、IL-1β蛋白的表达,其靶基因SATB2具有同样的作用,提示miR-31靶向SATB2上调细胞焦亡通路中的蛋白表达,促进结肠炎相关肠癌的发生发展,为肠炎和肠炎相关肠癌的发生机制提供了实验依据。
