lncRNA KCNQ1OT1表达下调对高糖诱导肾小球系膜细胞增殖、凋亡及纤维化的影响
2022-11-27李佳路华王丽李庆超谢震石红光李楠
李佳,路华,王丽,李庆超,谢震,石红光,李楠
1中国人民解放军海军第九七一医院肾脏病科,山东青岛 266071;2中国人民解放军海军第九七一医院干部保健科
糖尿病肾病是糖尿病最常见的并发症之一,20%~40%的糖尿病患者可合并糖尿病肾病。近年来,与糖尿病相关的终末期肾病已成为肾功能衰竭的重要原因,并严重影响糖尿病患者的生存和预后。现有临床治疗措施仅能部分延缓糖尿病肾病进程,但不能从根本上治愈。目前尚无更有效的检测手段可以满足糖尿病肾病早期诊断的需求,所以亟需发现新的标志物及治疗靶点。KCNQ1OT1是一个位于KCNQ1位点的长链非编码RNA(lncRNA),既往研究表明,KCNQ1OT1参与糖尿病视网膜病变、糖尿病心肌病变等病理过程,可能在糖尿病及糖尿病并发症中起重要作用,但KCNQ1OT1在糖尿病肾病中的作用机制尚不明确。2020年12月—2021年12月,本课题组观察了KCNQ1OT1在高糖诱导的肾小球系膜细胞中的差异表达情况,观察KCNQ1OT1表达变化对高糖诱导的肾小球系膜细胞增殖、凋亡及纤维化的影响。现报告如下。
1 材料与方法
1.1 实验细胞与主要材料小鼠肾小球系膜细胞株购于ScienCell公司。转染试剂Lipofectamine3000购自Thermo Fisher公司。TRIzol、逆转录试剂盒和SYBR Green试剂购自TaKaRa公司。去内毒素质粒小提试剂盒购自Omega公司。胎牛血清购自上海生工生物工程股份有限公司。SDS-PAGE相关试剂及细胞裂解液、BCA蛋白定量试剂盒购自上海碧云天生物技术有限公司。PVDF膜购自美国Millipore公司。兔抗Notch1、Hes1、Bcl-2/Bax、纤连蛋白(FN)、Ⅰ型胶原蛋白(ColⅠ)、Ⅳ型胶原蛋白(ColⅣ)、β-actin均购自Abcam公司。
1.2 高糖诱导肾小球系膜细胞中KCNQ1OT1表达观察将肾小球系膜细胞株HMCs接种于含10%胎牛血清的DMEM完全培养液中,置于5% CO2、37℃孵育箱中培养。将细胞分为高糖组、低糖对照组、高渗对照组。高糖组在高糖(30 mmol/L葡萄糖)DMEM培养基中培养,低糖对照组在低糖(5.5 mmol/L葡萄糖)DMEM培养基中培养,高渗对照组在含24.5 mmol/L甘露醇的低糖DMEM培养基中培养。培养24 h后,将细胞接种于6孔板,24 h后提取细胞RNA。采用qRT-PCR法检测KCNQ1OT1。以GAPDH为内参。KCNQ1OT1上游引物序列为5'-CGTATAGGGTCCGCACATGG-3',下游引物序列为5'-TGTGGGACTGGAAGTGCTTG-3';GAPDH上游引物序列为5'-GAATGGGCAGCCGTTAGGAA-3',下游引物序列为5'-AAAAGCATCACCCGGAGGAG-3'。收集各组细胞,以TRIzol试剂提取总RNA,微量核酸测定仪检测RNA纯度,使用Primer-ScriptTM反转录试剂盒将RNA逆转录成cDNA,以cDNA为模板进行qRT-PCR反应。PCR反应条件:95℃10 min;95℃15 s、60℃30 s、72℃30 s,共40个循环。以2-ΔΔCt表示目的基因相对表达量。
1.3 KCNQ1OT1对高糖诱导肾小球系膜细胞增殖、凋亡及细胞纤维化的影响观察
1.3.1 细胞分组与操作将HMCs细胞分为si-KCNQ1OT1组、NC组、HG组、NG组。si-KCNQ1OT1组、NC组、HG组细胞以高糖DMEM培养基培养,NG组以低糖DMEM培养基培养。si-KCNQ1OT1组、NC组培养24 h后,将细胞接种于6孔板,待75%~80%融合时,采用Lipofectamine3000分别转染si-KCNQ1OT1(5'-AUAUAAAAGGCUAUUUGACCU-3')、si-NC(5'-AAGACAUUGUGUGUCCGCCTT-3'),5 h后换为含15%血清的培养基,24 h后提取细胞。
1.3.2 细胞增殖能力检测调整细胞密度为1×104/mL,加入96孔板,每孔100μL,24 h后更换新培养液并加入0.5 mg/mL的MTT,4 h后加入100μL的DMSO,采用ELISA法检测570 nm波长处的光密度(OD)值,表示细胞增殖能力。实验重复3次。
1.3.3 细胞凋亡率测算按Invitrogen凋亡试剂盒说明书进行。将各组细胞以低血清培养基培养24 h,加入预冷的PBS洗涤2次,重悬于200μL的结合缓冲液中,调整细胞密度为1×106/mL。加入AnnexinV及10μL PI,37℃避光孵育15 min,缓冲液稀释细胞,上流式细胞仪,用488 nm激发光检测并计算细胞凋亡率。实验重复3次。
1.3.4 细胞凋亡、纤维化相关蛋白及Notch信号通路相关蛋白检测将各组细胞常规消化后,以蛋白裂解液重悬细胞,沉淀于冰上放置30 min,超声破碎1 min,共5次,以12 000 r/min离心10 min,BCA试剂盒测定蛋白浓度,-70℃保存备用。将蛋白样品进行SDS-PAGE电泳后转至PVDF膜,5%脱脂奶粉封闭液室温封闭1 h;分别加入兔抗Notch1、Hes1、Bcl-2、Bax一抗(1∶500稀释),兔抗FN一抗(1∶200稀释),兔抗ColⅠ一抗(1∶1 000稀释),兔抗ColⅣ一抗(1∶2 000稀释),内参β-actin(1∶5 000稀释),孵育过夜,TBST洗膜;加入山羊抗兔IgG二抗(1∶2 000)孵育2 h,TBST洗涤;加入化学发光试剂反应5 min,用Bio-Rad凝胶成像检测系统观察并照相,分析灰度值。实验重复3次。
1.4 统计学方法采用SPSS19.0统计软件。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 KCNQ1OT1在高糖诱导的肾小球系膜细胞中表达变化高糖组、低糖对照组、高渗对照组细胞中KCNQ1OT1相对表达量分别为2.90±0.27、1.01±1.10、0.99±0.07,高糖组KCNQ1OT1表达高于低糖对照组和高渗对照组(P均<0.05)。
2.2 si-KCNQ1OT1对高糖诱导肾小球系膜细胞增殖、凋亡及纤维化的影响
2.2.1 各组细胞增殖能力比较NG组、HG组、NC组、si-KCNQ1OT1组细胞OD值分别为1.01±0.09、1.56±0.09、1.54±0.11、1.16±0.06,HG组细胞增殖能力高于NG组,si-KCNQ1OT1组细胞增殖能力低于NC组(P均<0.05)。HG组与NC组差异无统计学意义。
2.2.2 各组细胞凋亡率及凋亡相关蛋白表达比较NG组、HG组、NC组、si-KCNQ1OT1组细胞凋亡率 分 别 为42.73%±3.25%、4.13%±0.57%、15.89%±1.18%、39.91%±1.37%,HG组细胞凋亡率低于NG组,si-KCNQ1OT1组细胞凋亡率高于NC组(P均<0.05)。HG组Bax蛋白表达低于NG组,Bcl-2蛋 白 表 达 高 于NG组(P均<0.05);si-KCNQ1OT1组Bax蛋白表达高于NC组,Bcl-2蛋白表达低于NC组(P均<0.05)。HG组与NC组Bcl-2、Bax蛋白表达差异无统计学意义。详见表1。
表1 NG组、HG组、si-KCNQ1OT1组、NC组细胞中Bcl-2、Bax蛋白表达比较(±s)
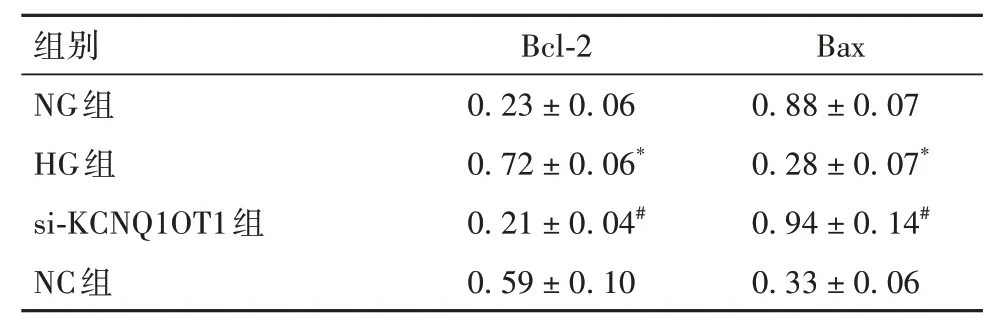
表1 NG组、HG组、si-KCNQ1OT1组、NC组细胞中Bcl-2、Bax蛋白表达比较(±s)
注:与NG组相比,P<0.05;与NC组相比,#P<0.05。
组别NG组HG组si-KCNQ1OT1组NC组Bcl-2 0.23±0.06 0.72±0.06*0.21±0.04#0.59±0.10 Bax 0.88±0.07 0.28±0.07*0.94±0.14#0.33±0.06
2.2.3 各组细胞纤维化相关蛋白表达比较HG组FN、ColⅠ、ColⅣ蛋白表达高于NG组,si-KCNQ1OT1组FN、ColⅠ、ColⅣ蛋白表达低于NC组(P均<0.05)。HG组与NC组FN、ColⅠ、ColⅣ蛋白表达差异无统计学意义。详见表2。
表2 NG组、HG组、si-KCNQ1OT1组、NC组细胞中纤维化相关蛋白表达比较(±s)
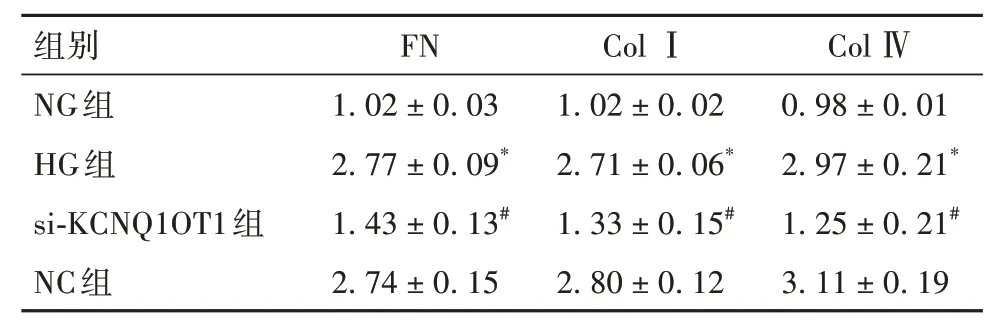
表2 NG组、HG组、si-KCNQ1OT1组、NC组细胞中纤维化相关蛋白表达比较(±s)
注:与NG组相比,*P<0.05;与NC组相比,#P<0.05。
组别NG组HG组si-KCNQ1OT1组NC组FN 1.02±0.03 2.77±0.09*1.43±0.13#2.74±0.15 ColⅠ1.02±0.02 2.71±0.06*1.33±0.15#2.80±0.12 ColⅣ0.98±0.01 2.97±0.21*1.25±0.21#3.11±0.19
2.2.4 各组细胞Notch信号通路相关蛋白表达比较HG组Notch1、Hes1蛋白表达高于NG组,si-KCNQ1OT1组Notch1、Hes1蛋白表达低于NC组(P均<0.05)。HG组与NC组Notch1、Hes1蛋白表达差异无统计学意义。详见表3。
表3 NG组、HG组、si-KCNQ1OT1组、NC组细胞中Notch1、Hes1蛋白表达比较(±s)
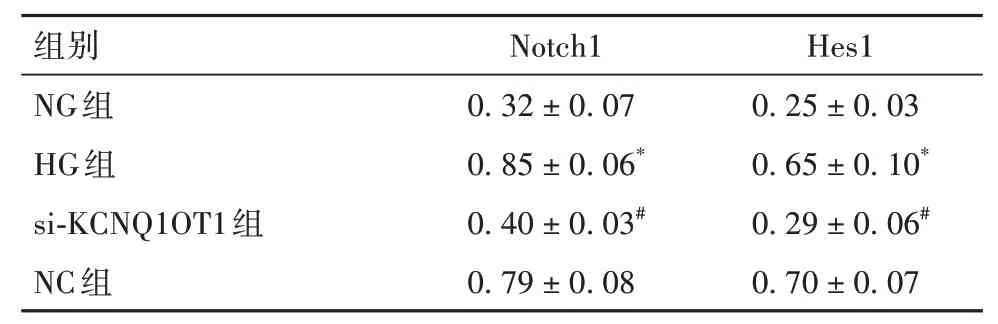
表3 NG组、HG组、si-KCNQ1OT1组、NC组细胞中Notch1、Hes1蛋白表达比较(±s)
注:与NG组相比,*P<0.05;与NC组相比,#P<0.05。
组别NG组HG组si-KCNQ1OT1组NC组Notch1 0.32±0.07 0.85±0.06*0.40±0.03#0.79±0.08 Hes1 0.25±0.03 0.65±0.10*0.29±0.06#0.70±0.07
3 讨论
目前对糖尿病肾病发病机制的研究已取得一定进展。蛋白激酶C、多元醇通路和非酶糖基化产物受血糖及其代谢产物的激活,参与损伤肾脏的结构和功能[1]。肾小球系膜细胞位于肾小球毛细血管环之间,是肾小球中的主要细胞群,在维持肾小球系膜基质稳态中起重要作用。系膜细胞外基质包裹系膜细胞,细胞外基质组成和数量的变化直接影响系膜细胞功能。肾小球中系膜细胞外基质堆积是糖尿病肾脏受累的特征性病理改变。研究表明,抑制高糖诱导下肾小球系膜细胞的细胞外基质堆积有利于预防或延缓肾小球硬化进展[2]。糖尿病导致肾小球损伤后,系膜基质蛋白过度增生,可能是由FN、ColⅣ、蛋白多糖、糖胺聚糖等胶原蛋白和非胶原糖蛋白合成增多或降解减少造成的。FN、ColⅠ、ColⅣ蛋白表达与细胞外基质沉积水平具有密切联系[3]。
高糖还可影响肾小球系膜细胞凋亡。Bcl-2是重要的凋亡抑制因子,可抑制线粒体释放Cyt-C,抑制Caspase级联反应,从而抑制细胞凋亡。Bax可与Bcl-2结合形成二聚体,拮抗Bcl-2对细胞凋亡的抑制作用。另一方面,Bax还可激活Caspase-3,促进Ca2+释放,进而导致细胞凋亡。Bcl-2/Bax可反映细胞凋亡情况,Bcl-2/Bax升高表明细胞凋亡减少[4]。现已发现哺乳动物的Notch受体有4种,分别为Notch1、2、3、4;已发现的人类Notch配体有5种,分别为Delta-like1、Delta-like3、Delta-like4、Jagged1及Jagged2。在肾脏发育过程中,Notch家族各成员都具有重要作用。研究显示,高糖可通过上调系膜细胞中Notch信号通路相关分子表达,导致肾脏纤维化和糖尿病肾病的发生[5]。高糖能抑制肾小管上皮细胞存活,促进凋亡,可能与Notch信号通路调控有关。研究显示,db/db2糖尿病肾病模型中Notch1、Notch2和靶基因Hes1表达增加,提示糖尿病肾病状态下Notch通路被激活[6]。Hes1是Notch信号通路重要的下游基因,其表达水平代表Notch信号通路的激活状态。有学者发现,Notch信号在糖尿病肾病中异常活化,Notch1可能全程参与肾纤维化,并与纤维化程度和肾小球硬化程度相关[7]。但Notch信号通路参与糖尿病肾病发病的具体机制尚不明确。
lncRNA可从表观遗传、转录及转录后水平调控基因表达[8]。研究表明,lncRNA参与糖尿病肾病的发病过程,但确切机制仍不清楚[9]。有学者发现,靶向lncRNA MGC的化学修饰寡核苷酸可抑制糖尿病小鼠肾小球细胞外基质堆积,减轻肾小球肥大程度[10]。DUAN等[11]发现,lncRNA TUG1可拮抗miR-377的作用,减少细胞外基质在肾小球系膜细胞内的积聚。还有研究显示,CYP4B1-PS1-001和CYP4A12A可通过影响肾小球系膜细胞的增殖和纤维化从而干预糖尿病肾病的进程[12]。KCNQ1OT1作为印迹基因,只表达父源等位基因,其可调控多个目的基因转录,参与生长发育过程[13]。以往研究表明,KCNQ1OT1与多种疾病的发生发展相关。在高糖环境下,KCNQ1OT1表达明显上调,参与糖尿病视网膜病变的发生发展[14]。YANG等[15]通过生物信息学分析发现,KCNQ1OT1在糖尿病心肌病患者的心脏组织中显著上调,沉默KCNQ1OT1可通过上调miR-214-3p、抑制Caspase-1表达,抑制糖尿病心肌细胞凋亡。李莹等[16]研究发现,糖尿病肾病患者血清KCNQ1OT1水平高于正常对照组,且合并大量蛋白尿患者高于微量蛋白尿患者,血清KCNQ1OT1水平与肾小球滤过率呈负相关。以上研究提示,KCNQ1OT1可能在糖尿病及糖尿病并发症的发生过程中起重要作用。
本研究用高糖培养的HMCs构建糖尿病肾病细胞模型,证实KCNQ1OT1在高糖诱导的肾小球系膜细胞中高表达,提示KCNQ1OT1可能参与了高糖介导的肾小球系膜细胞损伤。在高糖诱导下,HMCs活力增强且凋亡率降低,Notch1蛋白及FN、ColⅠ、ColⅣ等纤维化相关蛋白表达增加,表明高糖可诱导细胞外基质堆积和纤维化。下调KCNQ1OT1表达后,HMCs增殖能力降低,凋亡率增高,Notch1、Hes1、Bcl-2、FN、ColⅠ、ColⅣ蛋白表达降低,Bax蛋白表达增高,表明下调KCNQ1OT1表达可抑制高糖诱导的肾小球系膜细胞的增殖并促进细胞凋亡,下调KCNQ1OT1可调控Notch信号通路Notch1和Hes1表达,抑制细胞外基质堆积。大量研究已证实,KCNQ1OT1介导了多种竞争性内源RNA调节机制。目前认为,lncRNA与mRNA都具有miRNA结合位点,lncRNA可与miRNA结合形成lncRNA-miRNA-mRNA轴,导致所调控的蛋白质表达发生变化,从而影响细 胞功 能[17],如KCNQ1OT1/miR-138-5p/ABCB1、KCNQ1OT1/miR-124-3p/TRIM14、KCNQ1OT1/miR-701-3p/FGFR3等[18-20]。我们将在今后研究中进一步探索KCNQ1OT1可能竞争性结合的miRNA或KCNQ1OT1与蛋白质的相互作用,深入分析KCNQ1OT1在糖尿病肾病发生发展中的可能作用机制。
