黄芪治疗肾透明细胞癌作用机制的网络药理学分析
2022-11-27赵凯张宗亮尹心宝王振林朱冠群王科
赵凯,张宗亮,尹心宝,王振林,朱冠群,王科
1辽宁中医药大学研究生学院,沈阳 116600;2青岛大学附属医院泌尿外科
在泌尿系统性肿瘤中,肾细胞癌(RCC)病死率居首位[1]。RCC中,以肾透明细胞癌(ccRCC)最常见,其发病相对隐匿,临床表现无特异性,多数患者有明显症状时已属晚期。约20%的局限性肾癌患者手术治疗后会发生肿瘤转移,预后较差。肾癌相关疾病负担已成为需要重视的公共卫生问题[2]。黄芪作为常用的补益类中药,有益气固表、补气升阳、托脓透毒的功效[3]。黄芪的有效成分黄芪多苷被证实具有抗肿瘤作用,黄芪精口服液、黄芪注射液等黄芪制品已用于临床抗肿瘤治疗,但具体作用机制尚不明确。因此,本研究通过网络药理学方法筛选黄芪治疗ccRCC的活性成分及作用靶点,初步分析黄芪治疗ccRCC的作用机制。现报告如下。
1 材料与方法
1.1 黄芪活性成分和靶基因的筛选在TCMSP平台检索黄芪活性成分,筛选条件为口服生物利用度(OB)≥30%、类药性(DL)≥0.18。在TCMSP平台分析黄芪活性成分所对应的相关靶点,借助Uniprot数据库进行靶点标准化。
1.2 ccRCC疾病靶点筛选以“clear-cell renal cell carcinoma”“ccRCC”为关键词,分别在Genecards、OMIM、PharmGkb、TTD和DrugBank五个数据库中检索ccRCC相关基因,并对各数据库的检索结果进行合并,建立ccRCC相关基因。从GEO NCBI数据库下载ccRCC相关芯片。芯片纳入标准:①研究对象包含ccRCC患者和正常对照;②研究类型为Expression profiling by array;③筛选有关人类ccRCC的基因表达数据。经筛选发现GSE168845的芯片数据符合要求,包含4个ccRCC样本和配对对照样本。下载芯片中的矩阵文件和GPL21185平台文件。应用Strawberry Perl5.30.2.1软件将基因探针注释为基因名称。用R语言“lima”包进行差异分析,以|log-FC|>1且校正P<0.05筛选差异表达基因,并用“pheatmap”包绘制火山图,选取表达上调和下调最显著的前20个基因绘制热图。使用Venn将数据库检索到的疾病基因与GEO数据库获得的差异基因去重复值,作为ccRCC的疾病靶点。
1.3 黄芪治疗ccRCC的核心活性成分及靶点筛选将“1.1”获得的药物靶点和“1.2”得到的疾病靶点取交集,定义为黄芪治疗ccRCC的关键靶点并生成Venn图。利用Cytoscape3.8.0软件得到药物—成分—靶点—疾病网络图。网络图由表示药物、化合物、靶点和疾病的节点和表示相互作用的边所构成。节点的自由度和介数越大,表明该节点在网络中越重要,筛选得到核心成分。将药物与疾病的交集靶点通过STRING数据库构建蛋白质相互作用(PPI)网络模型。将物种设置为“Homo sapiens”,将置信度设置为“combine score>0.900”,排除网络中游离的部分节点,获取黄芪治疗ccRCC的PPI网络。用Cytoscape中的CytoNCA插件构建关键子网络。
1.4 黄芪治疗ccRCC靶基因功能分析借助R语言和Bioconductor生物信息软件包中的“colorspace”“stringi”“ggplot2”“clusterProfiler”“enrichplot”“DOSE”“pathview”,并设置过滤条件为P≤0.05,进行GO功能和KEGG通路富集分析,以柱状图或气泡图的结果呈现。
1.5 活性成分与靶点蛋白的分子对接验证将PPI网络中筛选出的核心靶点和药物—成分—靶点—疾病网络中筛选出的主要活性成分进行分子对接。在Uniprot数据库中搜索所选基因编码的受体蛋白,从RCSB PDB数据库下载核心靶点蛋白的3D PDB格式结构,在Pub Chem数据库下载分子配体的二维结构,利用ChemBio 3D软件计算和导出3D结构;再用PyMOL2.4.0软件处理受体蛋白,用Auto Dock Tools1.5.6软件处理后,保存为pdbqt格式文件;用Auto Dock Tools及Auto Dock Vina软件进行分子对接,采用PyMOL软件进行可视化处理。对接分数越低表明靶点蛋白与化合物的结合力越强。将最佳化合物—靶点对放入PyMOL软件中进行可视化。
2 结果
2.1 黄芪活性成分及治疗靶点以OB≥30%、DL≥0.18为条件,得到有效成分21个。在TCMSP平台的DrugBank数据库共得到462个潜在治疗靶点,去重及标准化后得到395个潜在治疗靶点。
2.2 黄芪治疗ccRCC的靶点搜集到ccRCC疾病靶点9 552个,筛选出ccRCC差异表达基因2 946个。将2 946个差异表达基因与疾病靶点基因用Venn去重,共获得ccRCC疾病靶 点10 898个。将ccRCC疾病靶点与黄芪活性成分治疗靶点进行交集,最终获得180个药物—疾病交集靶点,即黄芪治疗ccRCC的靶点。
2.3 黄芪治疗ccRCC的核心成分对数据进行网络构建,得到一个包含196个节点和2 979条边的网络。运用网络拓扑结构分析得出度值排名前5位的活性成分分别为槲皮素(134)、山柰酚(53)、黄芪皂苷(34)、芒柄花素(30)、异鼠李素(28),这些度值较高的活性成分可能是黄芪治疗ccRCC的核心成分。
2.4 黄芪治疗ccRCC的核心靶点黄芪治疗ccRCC的PPI网络中包括179个节点、586条边,平均节点度值为6.55。根据其度值,使用CytoNca软件,获得了由13个靶基因组成的关键子网络,发现转录活化因子(JUN)、肿瘤蛋白P53(TP53)、苏氨酸激酶1(AKT1)、丝裂原活化蛋白激酶14(MAPK14)等蛋白相互作用频次高,靶点与靶点之间相互作用强,可能为黄芪治疗ccRCC的核心靶点。
2.5 黄芪治疗ccRCC靶点基因的GO富集分析结果黄芪治疗ccRCC靶点基因的GO分析结果共涉及2 529个条目,其中生物过程(BP)2 250条、分子功能(MF)203条、细胞成分(CC)76条。富集程度前10的条目见表1。黄芪治疗ccRCC的靶点基因主要涉及细胞氧化应激反应、细胞缺氧反应的正调控等。此外,还有20个与免疫相关的GO富集,提示靶基因在恶性肿瘤中起重要作用。
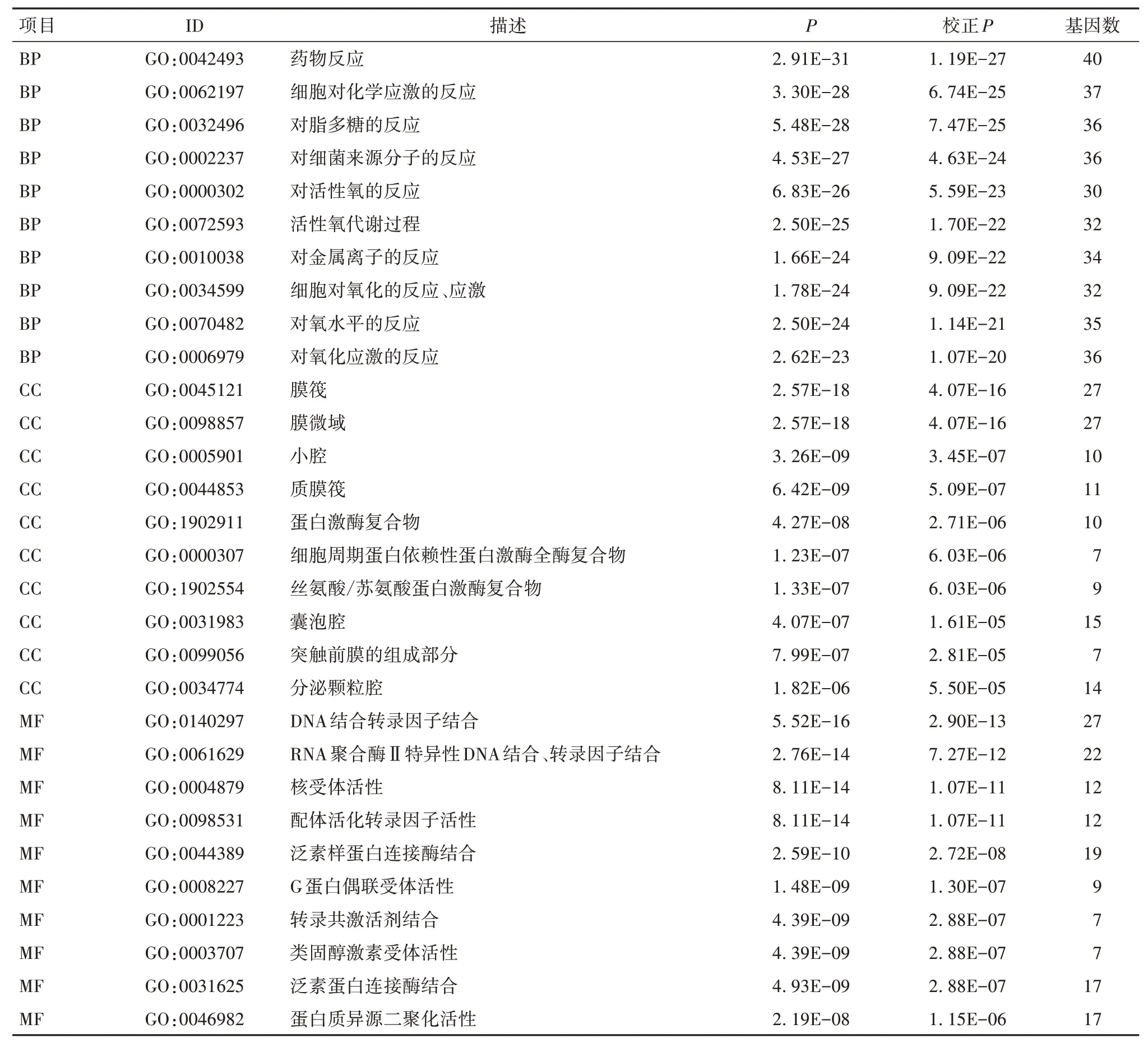
表1 黄芪治疗ccRCC靶点基因的GO富集分析结果
2.6 黄芪治疗ccRCC靶点基因的KEGG富集分析结果黄芪治疗ccRCC靶点基因的KEGG富集分析结果共涉及175条通路,P值排序前30的通路见表2。靶点基因主要富集于PI3K-AKT信号通路、MAPK信号通路、AGE-RAGE信号通路、TNF信号通路、IL-17信号通路、Th17细胞分化等。
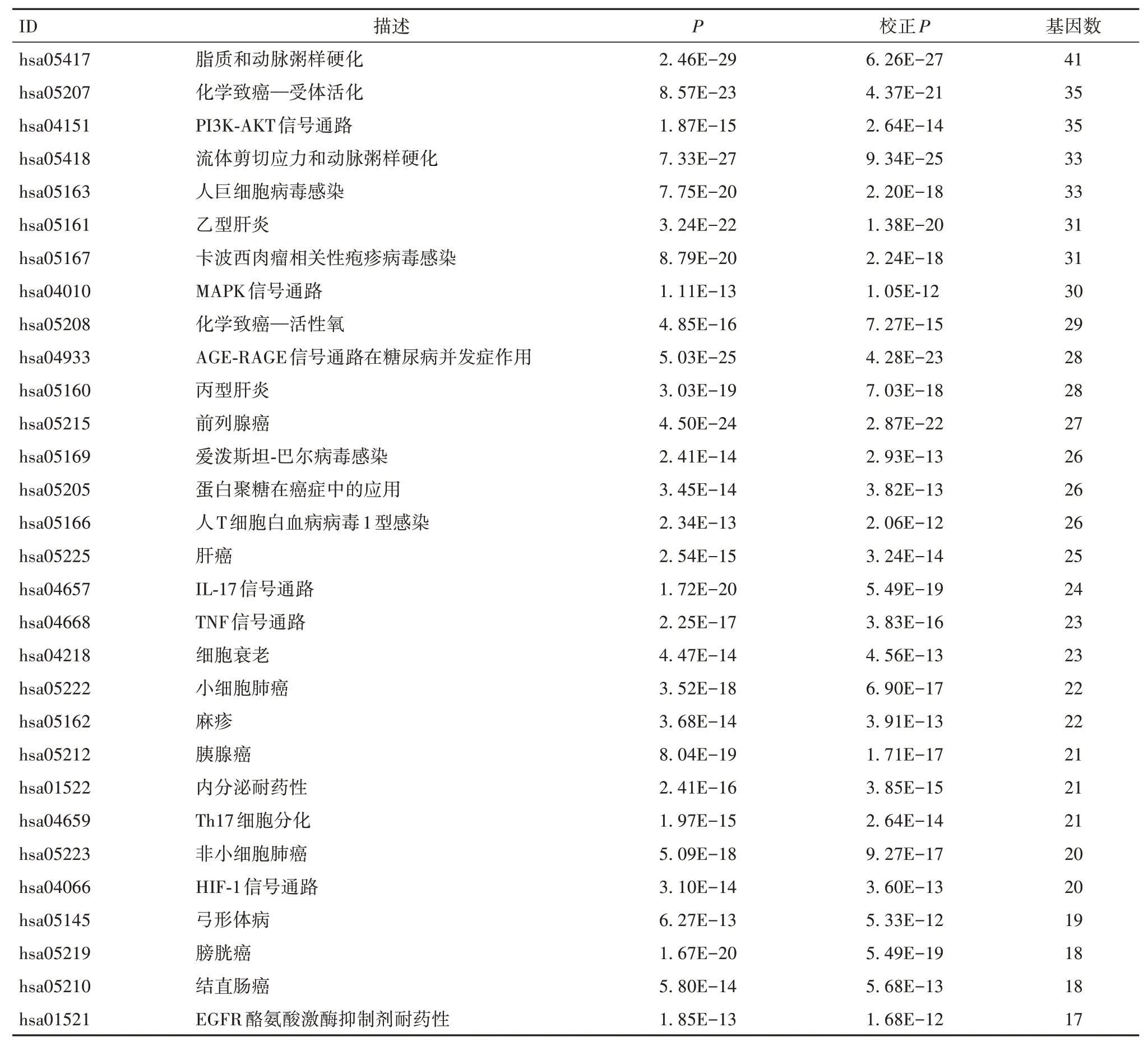
表2 黄芪治疗ccRCC靶点基因的KEGG分析结果
2.7 黄芪核心活性成分与核心靶点结合能力预测结果将黄芪核心活性成分槲皮素、山柰酚、黄芪皂苷、芒柄花素、异鼠李素与核心靶点JUN、TP53、AKT1、MAPK14进行分子对接结合能力预测,结果发现黄芪的5种活性成分与4个关键靶点均有较强的结合能力(结合能<-7.0 kcal/mol),其中槲皮素-8.4 kcal/mol、山 柰 酚-8.1 kcal/mol、黄 芪 皂苷-8.7 kcal/mol、芒柄花素-7.7 kcal/mol、异鼠李素-7.4 kcal/mol。
3 讨论
黄芪的入药部位为豆科植物蒙古黄芪或膜荚黄芪的干燥根,其化学成分主要分为三大类,分别为多糖类、皂苷类和黄酮类。黄芪在抗肿瘤治疗方面具有着积极作用[4],但抗肿瘤的具体作用机制尚不完全明确。本研究借助网络药理学及分子对接等方法系统探讨黄芪治疗ccRCC的潜在活性成分、作用靶点及信号通路,共筛选出5个核心活性成分,其中槲皮素、山柰酚、芒柄花素、异鼠李素均属于黄酮类化合物。黄酮类化合物泛指两个苯环通过三个碳原子相互连接而成的一系列化合物,其广泛存在于植物中,属植物次生代谢产物,可调节与恶性肿瘤相关的生物学过程,包括炎症反应、免疫反应、氧化还原反应、细胞代谢、细胞生长、细胞自噬、细胞凋亡和细胞周期等[5]。
WEI等[6]发现,槲皮素通过抑制PD-1/PD-L1相互作用来减弱PD-L1对T细胞的抑制作用,使肿瘤生长速率降低。槲皮素被认为对辐射引起的肝肾损伤具有治疗潜力。在体内恶性肿瘤模型中,槲皮素对顺铂肾毒性的干预作用与其抗氧化、抗炎和抗凋亡作用有关,而且这些特性并不影响顺铂的抗肿瘤效果[7]。山柰酚为一种主要来源于姜科草本植物山柰根茎的黄酮类化合物。实验研究显示,山柰酚能通过多途径、多靶点抑制恶性肿瘤的生长[8]。芒柄花素又名刺芒柄花黄素、芒柄花黄,是一种植物异黄酮,具有明显的植物雌激素特点。研究表明,芒柄花素通过抑制肿瘤细胞增殖、诱导细胞凋亡、细胞周期停滞及抑制细胞的迁移、侵袭等发挥抗肿瘤作用[9]。异鼠李素是槲皮素的直接代谢物,其能抑制多种类型恶性肿瘤,包括宫颈癌、胃癌、皮肤癌、结肠癌、肺癌等[10-11]。黄芪皂苷是一种主要来源于中药黄芪的皂苷类物质,具有免疫调节、抗炎、抗肿瘤及增效减毒的作用[12]。研究发现,黄芪皂苷能够显著激活CD45蛋白酪氨酸磷酸酯酶,从而增强细胞免疫功能[13]。王敏等[14]通过体内动物实验发现,黄芪皂苷可显著抑制肝癌肺转移。但黄芪皂苷对ccRCC治疗作用的文献报道较少,值得后期进一步探究。
本研究通过PPI网络模型筛选得到度值最高的13个核心靶点,包括AKT1、JUN、TP53、MAPK14等,其中AKT1可能是黄芪治疗ccRCC的关键靶点[15-16]。AKT是一种丝氨酸/苏氨酸激酶,有AKT1、AKT2、AKT3三种亚型,均由3个功能域组成。AKT的激活促进下游分子磷酸化,调控下游多种蛋白质如mTOR、Bad、Caspase-9、NF-κB、叉头框转录因子O亚家族等,参与调节细胞存活、增殖、凋亡及血管生成等[17-18]。JUN是AP-1家族转录因子的成员之一,通过与靶基因启动子中的TRE元件结合,活化下游核转录因子激活转录,介导应激状态下的细胞改变。OYA等[19]发现,c-JUN高表达与获得性囊性肾脏疾病和肾细胞癌非典型细胞异常增殖有关,强调了c-JUN活化在肾细胞癌早期病变过程中的作用。TP53基因编码具有转录激活、DNA结合和寡聚化域的肿瘤抑制蛋白,是抑癌基因,能诱导细胞周期阻滞、细胞凋亡、细胞衰老,TP53基因突变与多种人类恶性肿瘤有关。研究显示,存在TP53基因突变的转移性肾细胞癌进展更快[20]。作为P38 MAPK家族的重要成员,MAPK14在多种恶性肿瘤中发挥双重作用。有报道称,PTEN可以降低MAPK14的活性,抑制肾癌细胞的增殖与迁移[21]。
GO基因富集分析结果显示,黄芪治疗ccRCC的靶点基因涉及多个生物学过程,包括细胞氧化应激反应,细胞缺氧反应,对药物、损伤、细胞外刺激的反应,氧水平的调控,活性氧代谢过程,细胞转移酶活性以及细胞凋亡、增殖调控等。KEGG通路富集结果显示,黄芪治疗ccRCC的靶点基因主要富集在PI3K-AKT、MAPK、AGE-RAGE、TNF、IL-17等信号通路。其中PI3K/AKT信号通路基因富集数目最多、显著性最明显,提示PI3K/AKT信号通路可能起着重要作用。PI3K是由调节亚基p85和催化亚基p110构成的二聚体,其与生长因子受体结合后,可改变AKT蛋白结构并使其活化,并以磷酸化作用激活或抑制下游底物(如凋亡相关蛋白Bax、Caspase-9)活性,从而调节细胞的增殖、分化、凋亡及迁移等过程。PI3K/AKT通路的下游靶点哺乳动物雷帕霉素靶蛋白(mTOR)在肿瘤发展中起关键作用。mTOR的下游转录因子包括HIF-1α、c-Myc、FoxO等[22],与ccRCC的发生发展关系密切。MAPK信号通路是真核生物信号转导过程中较为重要的途径,不仅能够在肿瘤发生发展中发挥作用,还参与肿瘤耐药的发生[23]。有研究报道,阻断一个或多个MAPK信号通路可抑制肾癌的进展[24]。AGEs-RAGE系统与多种疾病有关,包括糖尿病的血管并发症、心血管疾病、神经退行性疾病、炎症、自身免疫性疾病及肿瘤等。AGE-RAGE信号通路可通过影响氧化应激、细胞凋亡与自噬等参与恶性肿瘤的发病[25]。TNF-α信号通路在器官发育、免疫反应和造血等多种生理过程中发挥作用,也与肿瘤等许多疾病的发生有关。GWU等[20]的研究表明,肾癌患者血清TNF-α表达水平明显低于健康志愿者,且TNF-α表达水平与肿瘤分期呈负相关。本研究中,黄芪的核心活性成分与核心靶点之间具有良好的结合活性,这也印证了黄芪治疗ccRCC的科学性。同时我们发现,黄芪皂苷对核心靶点的结合活性很强,其对ccRCC的治疗作用值得进一步研究。
综上所述,本研究运用网络药理学方法,筛选出黄芪治疗ccRCC的主要活性成分,这些活性成分可能通过关键靶点AKT1,参与PI3K-AKT等信号通路,发挥调节机体免疫功能及影响细胞增殖、分化、凋亡、迁移等作用,从而治疗ccRCC。本研究初步阐明了黄芪治疗ccRCC的主要活性成分及可能的作用靶点和相关通路,为后续研究提供了思路。
