糖尿病肾病患者血清Wnt5a水平变化及其影响因素分析
2022-11-27阚全娥赵梦宇袁家楠曹欢郭文雨
阚全娥,赵梦宇,袁家楠,曹欢,郭文雨
1河南大学人民医院郑州大学人民医院河南省人民医院内分泌科,郑州 450003;2郑州市第九人民医院内分泌科
糖尿病肾病(DKD)是终末期肾脏病的主要原因[1]。DKD早期特征为高血糖引起肾血流动力学变化,肾小球高灌注和高滤过导致肾小球基底膜和系膜基质增加、肾小球体积增大,进而发生功能障碍,尿白蛋白排泄增加,肾小球滤过率降低,进一步导致肾小球肥大、足细胞损伤、肾间质纤维化和肾小球硬化,最终发生DKD[1]。DKD发病机制复杂,与多种因素有关。炎症是DKD发生的重要机制之一。研究显示,在DKD的初始阶段,肾小球和近端小管中生长因子、细胞因子水平增高均可诱导炎症发生[1]。无翅型MMTV整合位点家族成员5a(Wnt5a)是巨噬细胞释放的强促炎因子,是Wnt家族的重要成员。本研究观察了DKD患者血清Wnt5a水平变化,分析血清Wnt5a与炎症因子、血糖、血脂及胰岛素抵抗(IR)的关系,旨在为临床早期防治DKD探索新的靶点。
1 资料与方法
1.1 临床资料选择2019年4月—2020年6月在河南省人民医院内分泌科住院的DKD患者100例,均符合1999年WHO糖尿病诊断和分型标准[3]和2021版中国糖尿病肾病防治指南中DKD的诊断标准[4]。排除标准:1型糖尿病及特殊类型糖尿病;6个月内发生糖尿病急性并发症、创伤疾病手术、急性心梗、严重脑血管疾病及肝硬化患者;经肾活检确诊的原发性肾脏疾病、其他继发性肾脏疾病及透析患者;合并恶性肿瘤或感染性疾病的患者。根据尿白蛋白与肌酐比值(UACR),将患者分为微量白蛋白尿组(UACR 30~300 mg/g)和大量白蛋白尿组(UACR>300 mg/g)各50例。微量白蛋白尿组男25例、女25例,年龄44~71(57.64±6.26)岁,BMI(25.65±1.30)kg/m2,糖尿病病程5~12(8.06±1.60)年,UACR(147.26±48.93)mg/g;大量白蛋白尿组男27例、女23例,年龄48~72(59.56±5.64)岁,BMI(25.73±1.28)kg/m2,糖尿病病程5~15(9.88±2.16)年,UACR(536.09±158.91)mg/g。另选择UACR<30 mg/g的2型糖尿病(T2DM)患者50例作为对照组,其中男26例、女24例,年龄44~74(58.42±6.52)岁,BMI(25.61±1.31)kg/m2,糖尿病病程1~9(5.00±2.02)年,UACR(10.80±4.65)mg/g。三组性别、年龄、BMI比较差异均无统计学意义,具有可比性。微量白蛋白尿组和大量白蛋白尿组病程长于对照组、UACR高于对照组,大量白蛋白尿组UACR高于微量白蛋白尿组(P均<0.01)。本研究通过河南省人民医院伦理委员会批准,研究对象均签署知情同意书。
1.2 血清Wnt5a及炎症因子检测采集患者空腹静脉血5 mL,离心获得上层血清,-80℃冰箱保存待测。采用ELISA法检测血清Wnt5a、转化生长因子β1(TGF-β1)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)。Wnt5a试剂盒购于中国武汉华美生物工程有限公司,TGF-β1、IL-6、TNF-α试剂盒购于中国武汉伊莱瑞特生物科技股份有限公司。严格按照试剂盒说明书操作。
1.3 血糖、血脂指标检测采集患者空腹静脉血5 mL。采用葡萄糖氧化酶法检测空腹血糖(FPG)。采用BIO-RAD D-10高效液相层析法检测糖化血红蛋白(HbA1c)。采用全自动化学发光免疫分析仪测定空腹胰岛素(FINS),计算稳态模型评估胰岛素抵抗指数(HOMA-IR),HOMA-IR=(FPG×FINS)/22.5。采用全自动生化仪检测总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。
1.4 统计学方法采用SPSS25.0统计软件。计量资料以±s表示,多组间比较采用单因素方差分析,方差齐时,两两比较采用LSD检验。相关性分析采用Pearson相关分析法。血清Wnt5a的影响因素分析采用多元线性回归分析法。P<0.05为差异有统计学意义。
2 结果
2.1 三组血清Wnt5a水平比较对照组、微量白蛋白尿组、大量白蛋白尿组血清Wnt5a水平分别为(0.98±0.24)、(1.24±0.48)、(1.56±0.50)ng/mL。微量白蛋白尿组、大量白蛋白尿组血清Wnt5a水平高于对照组,大量白蛋白尿组高于微量白蛋白尿组(P均<0.05)。
2.2 三组血清炎症因子、血糖、血脂水平及HOMAIR比较与对照组相比,大量白蛋白尿组、微量白蛋白尿组HbA1c、TC、TGF-β1、IL-6、TNF-α升高,大量白蛋白尿组FPG、HOMA-IR、LDL-C升高(P均<0.05);与微量白蛋白尿组相比,大量白蛋白尿组HbA1c、TC、TGF-β1、IL-6、TNF-α升高(P均<0.05)。见表1、表2。
表1 三组血清炎症因子水平比较(±s)

表1 三组血清炎症因子水平比较(±s)
注:与对照组相比,*P<0.05;与微量白蛋白尿组相比,#P<0.05。
组别微量白蛋白尿组大量白蛋白尿组对照组n 50 50 50 IL-6(pg/mL)34.90±10.59*45.10±11.99*#8.36±4.83 TGF-β1(ng/mL)4.78±1.80*5.92±1.90*#0.77±0.55 TNF-α(pg/mL)35.16±12.64*45.38±13.21*#7.79±4.62
表2 三组血糖、血脂指标及HOMA-IR比较(±s)
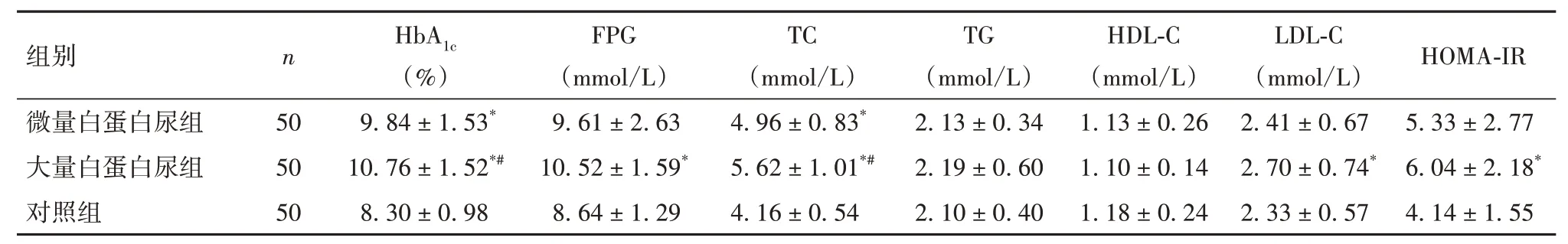
表2 三组血糖、血脂指标及HOMA-IR比较(±s)
注:与对照组相比,*P<0.05;与微量白蛋白尿组相比,#P<0.05。
组别微量白蛋白尿组大量白蛋白尿组对照组n 50 50 50 HbA1c(%)9.84±1.53*10.76±1.52*#8.30±0.98 FPG(mmol/L)9.61±2.63 10.52±1.59*8.64±1.29 TC(mmol/L)4.96±0.83*5.62±1.01*#4.16±0.54 TG(mmol/L)2.13±0.34 2.19±0.60 2.10±0.40 HDL-C(mmol/L)1.13±0.26 1.10±0.14 1.18±0.24 LDL-C(mmol/L)2.41±0.67 2.70±0.74*2.33±0.57 HOMA-IR 5.33±2.77 6.04±2.18*4.14±1.55
2.3 血清Wnt5a与炎症因子、血糖、血脂、HOMAIR及UACR的相关性血清Wnt5a与TGF-β1、IL-6、TNF-α、HbA1c、FPG、HOMA-IR、TC、LDL-C、UACR均呈正相关(r分别为0.575、0.544、0.580、0.691、0.631、0.660、0.541、0.535、0.625,P均<0.01)。
2.4 血清Wnt5a的影响因素多元逐步线性回归分析显示,UACR、HOMA-IR是Wnt5a的独立影响因素。见表3。
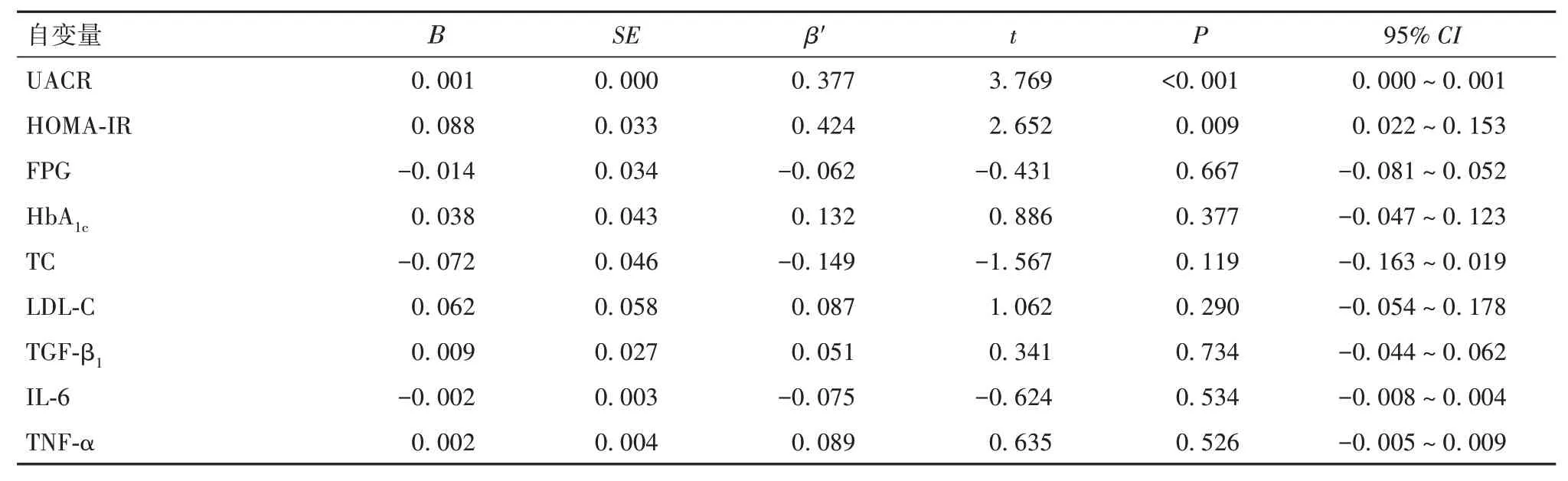
表3 血清Wnt5a影响因素的多元线性回归分析结果
3 讨论
DKD是糖尿病常见的并发症,尚缺乏有效的治疗方法。有学者提出,炎症是DKD重要的病理生理机制。在DKD的初始阶段,肾小球和近端小管中生长因子、细胞因子的增加都会诱导炎症发生[2]。Wnt5a可通过激活非经典Wnt信号通路和抑制经典Wnt信号通路,促进肾间质纤维化,加速DKD的发生[3]。Wnt5a可通过激活Wnt-Ca2+/PKC信号通路,活化NF-κB,引起TNF-α、黏附分子、趋化因子等释放增加,导致血管内皮出现炎症。在Wnt-PCP通路中,Wnt5a与酪氨酸激酶样孤儿素受体2(ROR2)结合,促进脂肪合成[4];Wnt5a与Frz5受体结合,激活巨噬细胞及脂肪细胞下游信号分子JNK1,引起胰岛素受体底物1丝氨酸磷酸化,阻断胰岛素信号通路,导致IR[5-6]。Wnt5a主要通过参与上述非经典Wnt信号通路,参与肾脏炎症反应,促进肾间质纤维化,加速DKD发生发展。肾脏纤维化的特征是成纤维细胞活化、上皮—间充质转化、巨噬细胞浸润和细胞外基质积聚,这些都可导致终末期肾病的发生[7]。本研究结果显示,大量白蛋白尿组和微量白蛋白尿组血清Wnt5a水平均高于对照组,且大量白蛋白尿组高于微量白蛋白尿组,相关性分析显示血清Wnt5a与UACR呈正相关,提示高水平的Wnt5a参与了DKD的发生发展。
Wnt5a与Ca2+结合,一方面激活PKC,活化NF-κB,促进TNF-α、趋化因子等释放,引起血管内皮炎症;另一方面激活钙调蛋白依赖性蛋白激酶Ⅱ,促进巨噬细胞释放炎症因子,引起局部或全身炎症反应[8]。炎症刺激可通过激活NF-κB信号通路,参与Wnt5a转录的调控,促进Wnt5a表达[9]。炎症因子表达增加与DKD有关。糖尿病患者体内持续高血糖环境,导致活性氧产生增多,激活炎症介质,抑制抗氧化机制,进而引起氧化应激,造成肾脏损伤[10]。本研究结果显示,大量白蛋白尿组和微量白蛋白尿组血清TGF-β1、IL-6、TNF-α水平均高于对照组,且大量蛋白尿组高于微量白蛋白尿组,提示炎症因子在DKD的发生发展中具有重要作用。
研究显示,TGF-β1在糖尿病患者肾小球组织中表达增加[11]。TGF-β1可作用于Wnt5a-Ca2+/PKC通路激活NF-κB,诱导促炎细胞因子产生,加剧局部炎症。因此,TGF-β1水平异常增高可诱导DKD发生。血清Wnt5a表达增高,抑制经典Wnt/β-catenin信号,与TGF-β1产生协同效应,可加速糖尿病患者肾脏纤维化进程。Wnt5a能以JNK依赖方式促进巨噬细胞炎症因子表达。有学者发现,Wnt5a可上调巨噬细胞中IL-6的表达[12]。因此推测,在DKD患者中,Wnt5a可促进脂肪组织巨噬细胞释放IL-6,通过Wnt-PCP/JNK通路引起IR,产生全身慢性炎症反应;通过Wnt-Ca2+/CAMKⅡ通路,引起肾组织巨噬细胞释放IL-6,诱导肾脏炎症反应。TNF-α可诱导肾脏中MCP-1的表达。有学者认为,DKD患者体循环中过量的TNF-α可能上调肾脏中MCP-1表达,趋化和激活巨噬细胞,介导炎症反应[13]。还有学者发现,T2DM患者特别是DKD患者血清TNF-α水平显著增加[14]。本研究结果显示,血清Wnt5a与TGF-β1、IL-6、TNF-α均呈正相关,提示TGF-β1、IL-6、TNF-α共同促进了DKD的进展。
慢性高血糖激活DAG-PKC信号通路,提高DKD患者早期肾脏中一氧化氮的利用率,一氧化氮可提高前列腺素E1水平、增加血管紧张素Ⅱ活性、激活血管内皮生长因子,导致血管内皮通透性增加、内皮功能障碍、肾小球高滤过和蛋白尿。此外,PKC激活后增加活性氧和糖基化终产物产生,引起TGF-β和纤溶酶原激活物抑制剂1(PAI-1)分泌增多,促使纤维连接蛋白、Ⅳ型胶原及细胞外基质增加,导致系膜扩张和纤维化[15]。有研究发现,T2DM患者血清Wnt5a与HbA1c呈正相关,提示Wnt5a与糖尿病患者血糖水平密切相关[16]。脂质沉积会加速肾小球损伤和肾小管间质纤维化,加速DKD病情进展[17]。ox-LDL受体胆固醇调节元件结合蛋白表达水平增加,可引起血管内皮细胞生长因子、TGF-β表达,系膜细胞扩增,细胞外基质沉积,导致肾小球纤维化[18]。在Wnt-PCP通路中,Wnt5a与ROR2结合,拮抗经典Wnt信号通路,促进脂肪细胞形成;Wnt5a与Frz5受体结合后可促进脂肪因子形成,从而加速DKD的进展。本研究中,大量白蛋白尿组和微量白蛋白尿组的糖尿病病程、HbA1c、TC高于对照组,大量白蛋白尿组FPG、LDL-C高于对照组,血清Wnt5a水平与HbA1c、FPG、TC、LDL-C均呈正相关,与以上研究结果一致。
本研究还发现,大量白蛋白尿组HOMA-IR、Wnt5a水平均高于对照组,血清Wnt5a水平与UACR、HOMA-IR均呈正相关。回归分析结果显示,UACR、HOMA-IR是Wnt5a的独立影响因素。Wnt5a可与Fz受体结合,激活下游信号分子JKN1而引起IR。过量的胰岛素可激活肾素—血管紧张素—醛固酮系统,提高肾小球基底膜通透性和囊内压,引起肾小球滤过增加,同时上调TGF-β1表达,刺激肾小球系膜细胞增殖,细胞外基质沉积,系膜和肾小管间质重塑,从而加重肾组织损伤。此外,IR可上调PAI-1基因表达,抑制细胞外基质降解,促进肾脏纤维化[19]。这提示IR和血清Wnt5a水平升高在DKD发生发展中可能发挥协同作用。
综上所述,DKD患者血清Wnt5a水平较T2DM无肾脏病患者明显升高,血清Wnt5a与炎症因子、血糖、血脂及IR密切相关。如能通过多种途径对Wnt信号通路及Wnt5a进行调控,减轻IR及炎症反应对肾脏的损害,有望为DKD的治疗提供新选择。
