卡格列净对高糖环境下小鼠肾小球系膜细胞的抗炎、抗凋亡作用及其机制
2022-11-27尹一帆谭睿陟王丽刘建
尹一帆,谭睿陟,王丽,刘建
1成都市第三人民医院西南交通大学附属医院肾内科,成都 610014;2西南医科大学附属中医医院中西医结合研究中心;3西南医科大学附属中医医院肾内科
糖尿病肾病(DKD)是糖尿病常见并发症之一[1],已成为导致终末期肾脏病的首位病因[2]。研究表明,炎症是DKD发生发展的关键因素[3]。高血糖可触发和维持多种信号通路激活,且肾小球系膜细胞相较于肾其他固有细胞更易受高糖环境影响[4]。大量临床试验表明,钠—葡萄糖协同转运蛋白2(SGLT-2)抑制剂具有肾保护作用[5-6]。KDIGO指南和APSN指南均明确推荐SGLT-2抑制剂作为2型糖尿病(T2DM)伴DKD患者的一线用药[7-8]。SGLT-2抑制剂可减轻肾脏炎症及纤维化,改善肾血流动力学稳态,减轻氧化应激水平[9]。TGF-β/Smad3信号通路是导致DKD肾脏炎症及纤维化的经典途径,其中Smad3被认为是其中的关键因子[10]。2020年5月—2021年1月,本研究观察了SGLT-2抑制剂卡格列净对高糖环境下小鼠肾小球系膜细胞的抗炎、抗凋亡作用,并基于TGF-β/Smad3信号通路探讨作用机制。现报告如下。
1 材料与方法
1.1 实验细胞与主要材料小鼠肾小球系膜细胞系SV40 MES13购自中国典型培养物保藏中心。DMEM低糖培养基购自HyClone公司,卡格列净购自MCE公司,葡萄糖购自美国Sigma公司,兔抗鼠TGF-β1多克隆抗体购自万类公司,鼠抗鼠Smad3单克隆抗体、HRP标记鼠抗鼠IgG、鼠抗鼠TNF-α单克隆抗体、鼠抗鼠IL-6单克隆抗体购自Santa Cruz公司,兔抗鼠p-Smad3单克隆抗体、FITC-兔抗鼠IgG购自Cell Signaling Technology公司,HRP标记山羊抗兔IgG购自北京博奥森公司。MCP-1 ELISA试剂盒购自欣博盛公司,TNF-α、IL-6 ELISA试剂盒购自睿信生物公司,Annexin V-FIFC/PI试剂盒购自南京诺唯赞公司,转染试剂购自美国Zata Life公司。
1.2 卡格列净作用浓度筛选及分组处理将SV40 MES13细胞培养于含10%胎牛血清的DMEM低糖培养基中;采用CCK8法观察不同浓度卡格列净对细胞存活率的影响,筛选出卡格列净的低剂量干预浓度为5μoml/L,高剂量干预浓度为15μoml/L。将细胞随机分为正常组、高糖组、卡格列净1组、卡格列净2组。正常组在含5.5 mmol/L葡萄糖的DMEM低糖培养基中培养,高糖组、卡格列净1组、卡格列净2组在含35 mmol/L葡萄糖的DMEM高糖培养基中培养,卡格列净1组、卡格列净2组分别加入5、15μoml/L的卡格列净。各组均培养24 h后进行后续检测。
1.3 细胞培养液上清及细胞中炎症因子检测收集各组细胞培养液上清,参照ELISA试剂盒说明书检测MCP-1、TNF-α、IL-6。收集各组细胞,用4%多聚甲醛固定15 min,0.5% Triton破膜工作液室温通透15 min;加入10%山羊血清封闭1 h,加入稀释后的TNF-α一抗、IL-6一抗,4℃过夜;加入稀释的二抗,室温避光孵育1 h,加入DAPI工作液,室温静置10 min;荧光显微镜观察,用Image J软件分析各组免疫荧光图像的平均荧光密度。
1.4 凋亡细胞检测收集各组细胞,消化离心,参照Annexin V-FIFC/PI试剂盒说明书进行操作,利用流式细胞仪检测凋亡细胞,在双色流式细胞仪散点图上,Annexin V-FIFC阳性、PI阴性为早期凋亡或坏死细胞,Annexin V-FIFC、PI阳性为晚期凋亡细胞或坏死细胞。计算早期凋亡细胞比例和晚期凋亡细胞比例。
1.5 细胞中TGF-β1、p-Samd3、Smad3检测采用Western blotting法。收集细胞,分别提取各组细胞总蛋白,BCA法测定各组样品蛋白浓度后变性备用。上样,进行聚丙烯酰胺凝胶电泳,转膜,封闭,4℃摇床孵育一抗过夜;洗膜后加入二抗室温孵育1 h,洗膜后用滴加化学发光液显色并上机检测。用Image J软件对图像灰度值进行分析及处理,以目的蛋白条带灰度值与内参条带灰度值的比值表示目的蛋白相对表达量。
1.6 过表达Smad3对卡格列净作用下高糖SV40 MES13细胞炎症因子表达及凋亡的影响观察将SV40 MES13细胞接种于6孔板中培养24 h,分为NC组、HG组、HG+Can组、HG+Can+Smad3 OE组。NC组在含5.5 mmol/L葡萄糖的低糖培养基中培养;HG组、HG+Can组、HG+Can+Smad3 OE组在含35 mmol/L葡萄糖的高糖培养基中培养,HG+Can组加入15μoml/L卡格列净,HG+Can+Smad3 OE组转染pcDNA3.1-Smad3质粒24 h后加入15μoml/L卡格列净。培养24 h后收集细胞,采用Western blotting法检测TGF-β1、p-Samd3、Smad3,方法同“1.5”;采用免疫荧光法检测各组细胞中的TNF-α、IL-6,方法同“1.3”;采用流式细胞仪检测凋亡细胞,方法同“1.4”。
1.7 统计学方法采用GraphPad Prism软件进行统计分析。计量资料以±s表示;多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 卡格列净对高糖环境下SV40 MES13细胞的抗炎、抗凋亡作用
2.1.1 各组上清液MCP-1、TNF-α、IL-6水平比较高糖组上清液MCP-1、TNF-α、IL-6水平高于正常组,卡格列净1组、卡格列净2组上清液MCP-1、TNF-α、IL-6水平低于高糖组,卡格列净2组上清液MCP-1、TNF-α、IL-6水平低于卡格列净1组(P均<0.05)。见表1。
表1 各组细胞上清液MCP-1、TNF-α、IL-6水平比较(pg/mL,±s)
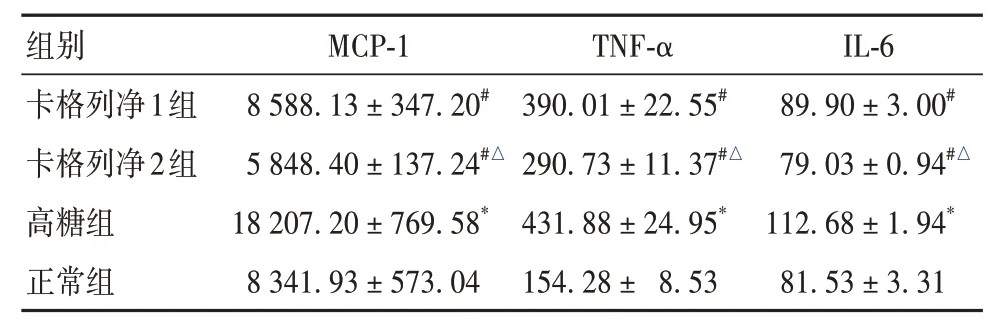
表1 各组细胞上清液MCP-1、TNF-α、IL-6水平比较(pg/mL,±s)
注:与正常组相比,*P<0.05;与高糖组相比,#P<0.05;与卡格列净1组相比,△P<0.05。
组别卡格列净1组卡格列净2组高糖组正常组MCP-1 8 588.13±347.20#5 848.40±137.24#△18 207.20±769.58*8 341.93±573.04 TNF-α 390.01±22.55#290.73±11.37#△431.88±24.95*154.28±8.53 IL-6 89.90±3.00#79.03±0.94#△112.68±1.94*81.53±3.31
2.1.2 各组细胞TNF-α、IL-6表达比较高糖组细胞中TNF-α、IL-6表达高于正常组,卡格列净1组、卡格列净2组TNF-α、IL-6表达低于高糖组,卡格列净2组细胞中TNF-α、IL-6表达低于卡格列净1组(P均<0.05)。见表2、图1。
表2 各组细胞中TNF-α、IL-6表达比较(±s)

表2 各组细胞中TNF-α、IL-6表达比较(±s)
注:与正常组相比,*P<0.05;与高糖组相比,#P<0.05,与卡格列净1组相比,△P<0.05。
组别卡格列净1组卡格列净2组高糖组正常组TNF-α 10.56±0.80#7.20±0.30#△20.12±0.68*5.66±1.05 IL-6 23.60±0.99#16.85±0.70#△37.52±0.89*9.89±0.25
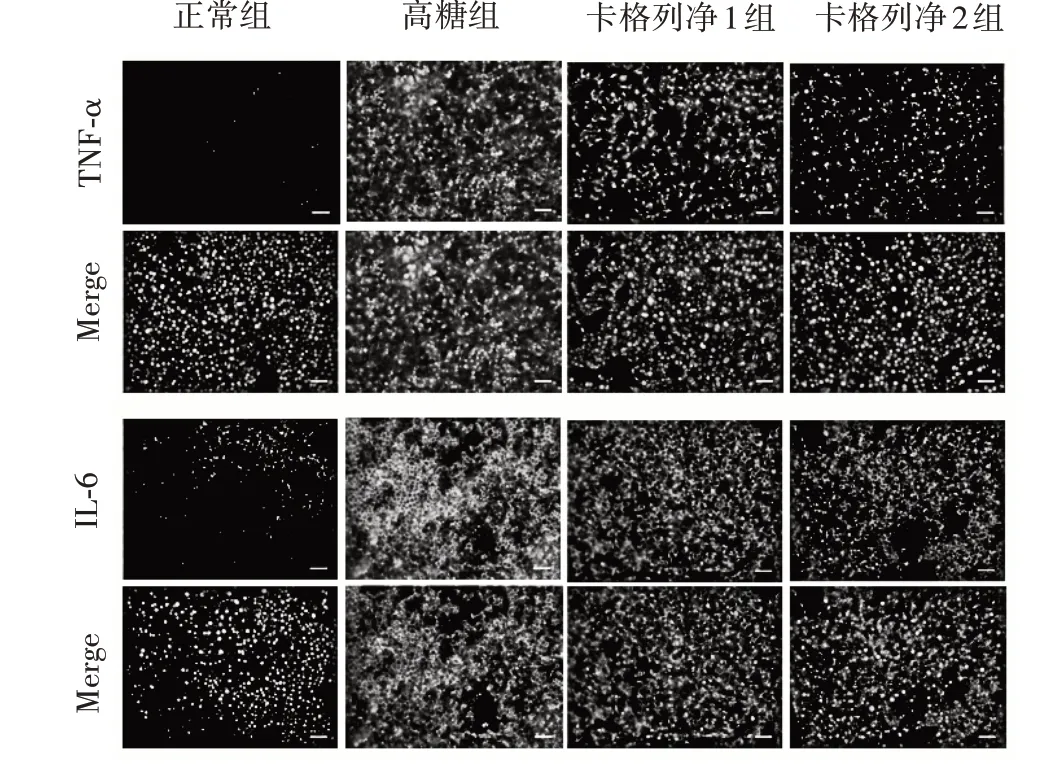
图1 卡格列净1组、卡格列净2组、高糖组、正常组细胞TNF-α、IL-6表达情况(免疫荧光法)
2.1.3 各组细胞凋亡情况比较高糖组早、晚期凋亡细胞比例高于正常组,卡格列净1组、卡格列净2组早期凋亡细胞比例低于高糖组,卡格列净2组早期凋亡细胞比例低于卡格列净1组(P均<0.05)。见表3。
2.1.4 各组细胞TGF-β1、p-Samd3/Smad3表达比较高糖组TGF-β1表达及p-Smad3/Smad3高于正常组,卡格列净1组、卡格列净2组TGF-β1表达及p-Smad3/Smad3低于高糖组(P均<0.05)。见表3。
表3 各组细胞凋亡情况、TGF-β1表达及p-Smad3/Smad3比较(±s)
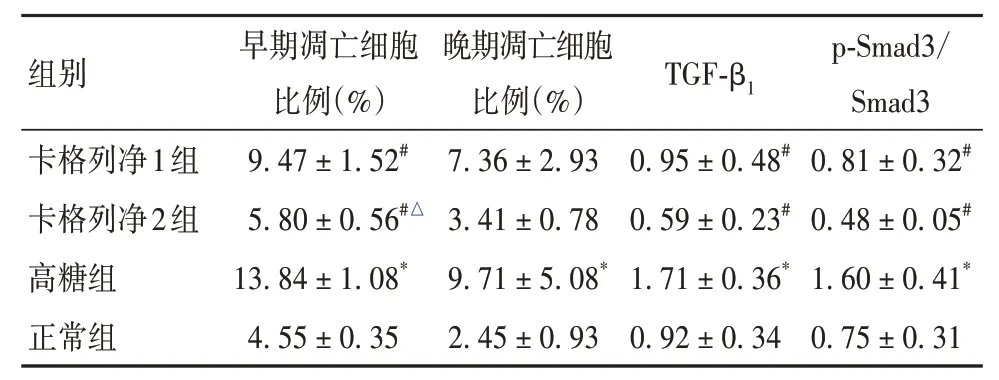
表3 各组细胞凋亡情况、TGF-β1表达及p-Smad3/Smad3比较(±s)
注:与正常组相比,*P<0.05;与高糖组相比,#P<0.05,与卡格列净1组相比,△P<0.05。
组别卡格列净1组卡格列净2组高糖组正常组早期凋亡细胞比例(%)9.47±1.52#5.80±0.56#△13.84±1.08*4.55±0.35晚期凋亡细胞比例(%)7.36±2.93 3.41±0.78 9.71±5.08*2.45±0.93 TGF-β1 0.95±0.48#0.59±0.23#1.71±0.36*0.92±0.34 p-Smad3/Smad3 0.81±0.32#0.48±0.05#1.60±0.41*0.75±0.31
2.2 过表达Smad3对卡格列净作用下高糖SV40 MES13细胞炎症因子表达及凋亡的影响
2.2.1 各组细胞TGF-β1表达及p-Smad3/Smad3比较NC组、HG组、HG+Can组、HG+Can+Smad3 OE组TGF-β1相对表达量分别为0.66±0.09、1.07±0.02、0.84±0.03、1.00±0.08,p-Smad3/Smad3分别为0.30±0.01、1.00±0.01、0.83±0.03、0.91±0.02。HG组TGF-β1表达及p-Smad3/Smad3高于NC组,HG+Can组TGF-β1表达及p-Smad3/Smad3低于HG组,HG+Can+Smad3 OE组TGF-β1表 达 及p-Smad3/Smad3高于HG+Can组(P均<0.05)。
2.2.2 各组细胞炎症因子表达比较HG组TNFα、IL-6表达高于NC组,HG+Can组TNF-α、IL-6表达低于HG组,HG+Can+Smad3 OE组TNF-α表达高于HG+Can组(P均<0.05)。见表4。
2.2.3 各组细胞凋亡情况比较HG组早、晚期凋亡细胞比例高于NC组,HG+Can组早、晚期凋亡细胞比例低于HG组,HG+Can+Smad3 OE组早、晚期凋亡细胞比例高于HG+Can组(P均<0.05)。见表4。
表4 过表达Smad3对卡格列净作用下高糖环境SV40 MES13细胞TNF-α、IL-6表达及凋亡的影响(±s)
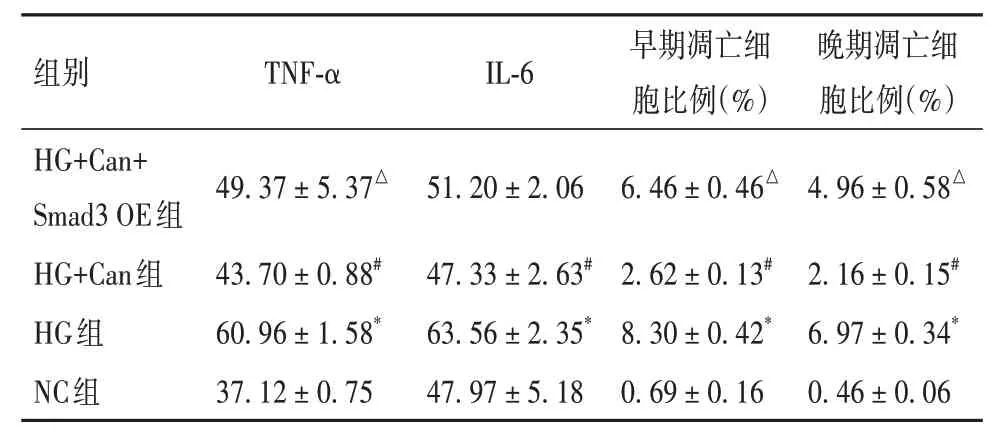
表4 过表达Smad3对卡格列净作用下高糖环境SV40 MES13细胞TNF-α、IL-6表达及凋亡的影响(±s)
注:与NC组相比,*P<0.05;与HG组相比,#P<0.05;与HG+Can组相比,△P<0.05。
组别HG+Can+Smad3 OE组HG+Can组HG组NC组TNF-α 49.37±5.37△43.70±0.88#60.96±1.58*37.12±0.75 IL-6 51.20±2.06 47.33±2.63#63.56±2.35*47.97±5.18早期凋亡细胞比例(%)6.46±0.46△2.62±0.13#8.30±0.42*0.69±0.16晚期凋亡细胞比例(%)4.96±0.58△2.16±0.15#6.97±0.34*0.46±0.06
3 讨论
据报道,30%~50%的T2DM患者会发展为DKD,寻找有效防治DKD的方法一直是目前研究的热点[11]。SGLT-2抑制剂是一种新型的口服降糖药,大量临床研究已证实其具有肾保护作用,但具体机制仍不明确[12]。
高血糖可引起肾小球基底膜增厚、系膜扩张、系膜细胞增生肥大等,最终导致肾小球弥漫性硬化[13]。上述病理改变提示,在糖尿病肾损伤中,对肾小球系膜细胞进行干预可能是防治DKD的有效策略。
持续的高糖环境能诱发炎症,而炎症能直接破坏肾脏结构,形成恶性循环,造成不可逆的肾损伤。炎症因子种类繁多,如趋化因子、促炎细胞因子和黏附因子等[14]。本研究选取MCP-1、IL-6、TNF-α观察高糖环境对肾小球系膜细胞分泌炎症因子的影响,结果显示,高糖环境下,肾小球系膜细胞合成分泌MCP-1、TNF-α、IL-6明显增加,并促进了细胞凋亡,证实高糖环境介导肾小球系膜细胞炎症反应的同时加速细胞凋亡。
TGF-β被认为是DKD的重要致病因子[15],其中TGF-β1是导致肾损伤最重要的细胞因子[16]。TGF-β1可激活下游Smad3,诱导分泌各种炎症因子、促纤维化因子,从而介导肾脏炎症、纤维化的发生发展。TGF-β/Smad3信号通路被认为是系膜细胞激活的主要通路[17]。汤夏莲等[18]研究发现,高糖可引起系膜细胞缺失和凋亡,并上调TGF-β1的表达。ZHANG等[19]研究表明,在DKD模型中调控TGF-β/Smad3信号通路可介导MCP-1的表达。本研究发现,高糖环境下,SV40 MES13细胞中TGF-β1及p-Smad3/Smad3蛋白表达水平明显增加,说明TGF-β/Smad3信号通路可能在高糖介导的肾小球系膜细胞损伤中发挥一定作用。
SGLT-2抑制剂通过选择性抑制SGLT-2对葡萄糖和钠的重吸收,促进尿糖、尿钠排泄,并降低肾小球高滤过状态,从而达到降糖目的,还具有抗炎、抗氧化等作用[20-21]。SGLT-2抑制剂可用于DKD患者,其抗炎作用也被越来越多的研究所证实。TERAMI等[22]发现,对db/db小鼠进行12周的达格列净治疗后,可改善肾小球系膜扩张并减少小鼠肾脏中巨噬细胞浸润;另外,体外实验还证实,达格列净可抑制高糖环境下肾小管上皮细胞氧化应激、细胞凋亡及MCP-1、TGF-β等表达。ALI等[23]研究表明,卡格列净在腺嘌呤诱导的大鼠CKD模型中具有抗炎、抗氧化作用。VALLON等[24]通过糖尿病小鼠模型实验,发现恩格列净可介导NF-κB通路抑制其下游CCL2、IL-6等表达。有学者发现,6种不同的SGLT-2抑制剂治疗糖尿病小鼠均可降低体内IL-1β、MCP-1、IL-6、TNF-α水平[25]。本研究发现,卡格列净可减少高糖环境下SV40 MES13细胞炎症因子分泌及细胞凋亡,进一步实验结果显示,过表达Smad3可使卡格列净作用下的高糖SV40 MES13细胞p-Smad3/Smad3、TGF-β1、TNF-α表达增高并促进细胞凋亡,卡格列净可抑制TGF-β/Smad3信号通路激活。由此推测,卡格列净抑制高糖环境下肾小球系膜细胞炎症因子分泌及细胞凋亡的机制可能与抑制TGF-β/Smad3信号通路有关。上述研究结果为卡格列净治疗DKD的机制研究提供了新的理论基础。
