不同方法合成Y沸石包覆Ru金属催化剂及其性能研究
2022-11-24杨江蒨葛思达吴志杰
杨江蒨,刘 萌,葛思达,吴志杰
(中国石油大学(北京)重质油国家重点实验室CNPC催化重点实验室,北京 102249)
贵金属催化剂因其良好的反应活性而备受重视,在精细化工、石油精制和新能源等领域起着非常重要的作用,但存在成本高、稳定性差等缺点[1-3]。相比于其他贵金属,Ru金属催化剂在保留高催化活性的同时价格相对低廉,在过去的几十年中被广泛应用于加氢、生物质转化和催化氧化等反应中[4-6]。然而,与其他金属催化剂类似,Ru金属粒子的热稳定性仍需要进一步提高。小的金属粒子具有较高的比表面积和比表面能,因此容易发生聚集而失活,限制了其在工业上的广泛应用[7-11]。将金属粒子包覆于高比表面积的微孔无机载体内部,能防止金属粒子的迁移与团聚,同时避免金属粒子的流失,易于回收[12-15]。
沸石具有刚性骨架和多孔结构特征,是包覆金属粒子理想的无机载体。由于沸石包覆的金属催化剂在金属和酸协同催化作用、目标产物的选择性、抗金属流失和抗金属烧结方面具有优异的性能而受到广泛关注。将金属粒子或金属络合物包覆于沸石微孔、超笼或空腔中,可以显著提高催化剂的活性、选择性、稳定性,主要体现在三个方面:由于沸石骨架的高稳定性,将金属粒子包覆于沸石晶体中,能够抑制高温下金属粒子的烧结;因为沸石微孔具有择形催化性能,可提高目标产物的选择性,但是微孔的存在会影响目标产物的传输,从而影响反应速率;沸石包覆的金属催化剂有利于促进金属活性位和沸石骨架上酸性位之间的协同作用,在加氢、重整、氧化、降解等反应中具有优异的催化性能[16]。其中,Y沸石包覆的金属催化剂在临氢反应中展现出了优异的活性和选择性等优势,近几年备受关注[17-22]。
制备沸石包覆金属催化剂有多种方法,最常用的方法是原位水热法、离子交换法和浸渍法等。其中,离子交换法和浸渍法在合成催化剂过程中存在扩散问题,金属易聚集在沸石表面形成大颗粒,无法实现金属的包覆。原位水热法是实现沸石包覆金属的适宜方法。本文以Y沸石包覆Ru金属粒子为切入点,结合原位水热法对其开展研究,并考察其催化特性。
在原油加工过程中常产生大量的C4烃类,其中烷烃常被用作燃料而不能充分发挥其价值,因此将C4烷烃转化为其他高附加值化学品具有重要的经济意义[23]。C4烷烃中的正丁烷作为一种重要的化工原料,可用作蒸汽热解生产乙烯的原料,还可以脱氢制丁烯、氧化制酸酐和乙酸、取代制卤丁烷和硝基丁烷,具有较高的附加值及应用前景,而异丁烷的主要下游产品为甲基叔丁基醚(MTBE)。目前,国内不少炼厂MTBE产能有限,无法完全消化异丁烷产品,若能将异丁烷逆向异构化为正丁烷,对提高C4烃类的利用具有重要的经济意义。因此,本文以异丁烷加氢异构化为探针反应,评估Ru@HY催化剂的异构化活性和选择性。
1 实验部分
1.1 实验原料
RuCl3·nH2O(Ru金 属 的 质 量 分 数 为37.5%~40.0%),优级纯,国药集团化学试剂有限公司;偏铝酸钠(以Al2O3计,质量分数45.0%),化学纯,天津市津科精细化工研究所;氯化铵(质量分数99.5%),分析纯,天津市光复科技有限公司;氢氧化钠(质量分数96.0%),分析纯,天津市光复精细化工研究所;粗孔硅胶(质量分数98.0%),工业级,青岛白沙河催化剂厂;去离子水(298 K下的电阻率<0.1 μS/cm),实验室自制。
1.2 催化剂的制备
1.2.1 Y沸石的制备 利用原位水热法制备理论n(Si)/n(Al)为2.4的Y沸 石,实 验 操 作 步 骤如下。
实验开始前,配制100.00 g硅酸钠溶液(Na2O的质量分数为10.6%,SiO2的质量分数为26.5%)。配置步骤:将13.68 g氢氧化钠和59.82 g去离子水放入烧杯中,搅拌均匀后加入26.50 g粗孔硅胶,继续搅拌至均匀,得到硅酸钠溶液。
Y沸石的制备分三天进行。第一天制备导向剂:首先,将1.28 g氢氧化钠和6.40 g去离子水放入100 mL反应釜中,然后立即加入0.769 g偏铝酸钠试剂,磁力搅拌至偏铝酸钠完全溶解后,加入7.689 g硅酸钠溶液,磁力搅拌10 min以上;将高压反应釜拧紧,在室温下放置24 h,最终制成导向剂。第二天制备硅铝凝胶:将0.44 g氢氧化钠和44.00 g去离子水放入250 mL塑料烧杯中,然后立即加入4.818 g偏铝酸钠粉末,磁力搅拌至偏铝酸钠完全溶解后,加入48.204 g硅酸钠溶液,直至所制凝胶呈乳液状;缓慢加入5.16 g第一天制备的陈化24 h的导向剂,剧烈搅拌20 min以形成均匀的体系;将所形成的凝胶从塑料烧杯中移入200 mL水热合成釜中,拧紧釜帽后在室温下放置24 h。第三天,将放置24 h的水热合成釜放入373 K烘箱中,晶化6 h后取出,离心分离,至上层清液pH为7时将分离得到的固体产品移入表面皿中,在373 K烘箱中干燥约12 h后放入马弗炉,在空气气氛、823 K下焙烧6 h制得Y沸石。
1.2.2 原位水热法制备Ru@Y系列沸石 在制备Y沸石的过程中添加Ru金属实现包覆。在原位水热法合成Y沸石过程中,分别在加入铝源、硅源和导向剂之后添加一定量的RuCl3水溶液(Ru金属负载量为1.00%(质量分数,下同)),制备Ru@Y系列沸石,并分别命名为Ru@Y-Al、Ru@Y-Si、Ru@Y-Si-Al。
1.2.3 离子交换法制备Ru/Y-EX 将30 mL去离子水倒入50 mL圆底玻璃烧瓶中,加入一定量的RuCl3水溶液(Ru金属负载量为1.00%),进行磁力搅拌,并在搅拌的过程中加入5.00 g无水Y沸石;将此烧瓶放入电加热套中,并在烧瓶的颈部安装水冷式冷凝管;将上述混合物加热至约373 K,并转速为600 r/min、回流条件下磁力搅拌保持约7 h;关闭加热器并取下冷凝管,将烧瓶冷却至室温,使沸石粉末沉降,抽滤得到沉淀物,将沉淀物放在373 K烘箱中静置24 h,在马弗炉中于空气气氛、823 K下焙烧6 h制得Ru/Y-EX。
1.2.4 过量浸渍法制备Ru/Y-WI 称取5.00 g Y沸石置于100 mL玻璃烧杯中,加入50 g去离子水进行磁力搅拌;搅拌均匀后,加入一定量的RuCl3水溶液(Ru金属负载量为1.00%),置于353 K水浴锅中搅拌约4 h进行浸渍;蒸干水分后,放入373 K烘箱中干燥,然后在马弗炉中于空气气氛、823 K下焙烧6 h制得Ru/Y-WI。
1.2.5 等体积浸渍法制备Ru/Y-WN 称取5.00 g Y沸石置于100 mL玻璃烧杯中,测定其吸水量,并用Y沸石所吸的水溶解一定量的RuCl3水溶液(Ru金属负载量为1.00%);加入5.00 g Y沸石粉末,将其搅拌均匀,放置一段时间使其更好浸渍;放入373 K烘箱中干燥,然后在马弗炉中于空气气氛、823 K下焙烧6 h制得Ru/Y-WN。
1.3 催化剂的表征
沸石的晶体结构采用德国Bruker公司生产的D8 Advance型X射线衍射仪进行表征。操作条件为:以CuKα射线(λ=0.154 18 nm)作为射线源,管电压为40 kV,管电流为40 mA,扫描步长为0.02°,扫描频率为5(°)/min,扫描范围2θ在5°~50°。采用荷兰帕纳科公司生产的Axios MAX型X射线荧光光谱仪对合成沸石的元素组成进行定量分析。采用美国Thermo Fisher公司生产的K-Alpha型光谱仪对固体沸石的元素组成进行定性、定量及价态分析。采用美国ZEISS公司生产的Gemini 300型场发射扫描电镜对沸石的形貌以及颗粒粒径进行表征。采用美国FEI公司生产的配备有EDS光谱仪的FEI Tecnai G2 F20透射电镜进行表征。采用湖南华思仪器有限公司生产的DAS-7000多功能动态吸附仪进行氨气程序升温脱附(NH3-TPD)、氢气程序升温脱附(H2-TPD)以及氢气程序升温还原(H2-TPR)。采用德国Bruker公司生产的配备有MCT检测器的Bruker Tensor II进行吡啶红外和低温CO红外表征。
1.4 催化剂的评价
采用中国石化石油科学研究院生产的固定床微反应器对催化剂进行评价,反应管规格为360 mm×10 mm。在常压下,采用不同催化剂进行异丁烷加氢异构化反应,操作步骤如下。
装填反应管,并放入300 mg催化剂,接入反应装置,通入N2程序升温至673 K;通入H2体积分数为10%的混合气(H2与N2的混合气)对沸石进行还原,2 h后通入异丁烷气体,固定n(H2)/n(i-C4)为1。反应产物使用北京中科惠分仪器有限公司生产的GC-7820气相色谱仪进行取样分析,该气相色谱仪配备有安捷伦科技有限公司生产的HP-PONA色谱柱(50.0 m×0.2 mm×0.5 μm)。
2 结果与讨论
2.1 催化剂的性质
2.1.1 组成和结构 图1为不同沸石的XRD谱图,表1为不同沸石的晶体结构参数和组成。

图1 不同沸石的XRD谱图Fig.1 XRD patterns of different zeolites
由图1可见,所有沸石均具有Y沸石的特征衍射峰,证明Ru金属的添加不会影响沸石的拓扑结构;XRD谱图中未观察到Ru金属或Ru金属氧化物相关的特征衍射峰,这可能是沸石中Ru金属负载量(<0.60%)较低或金属分散度高,没有生成大的Ru金属粒子。
由表1可知,加入RuCl3溶液的顺序以及制备方法的不同,均会对所合成沸石的相对结晶度、晶胞参数以及n(Si)/n(Al)带来一定影响;在添加Ru金属后,所有沸石的相对结晶度均有所下降,说明Ru金属的加入会使沸石骨架结构部分坍塌。其中,除了Y沸石,Ru@Y-Si相对结晶度最高。由表1还可知,XRF测试得到的n(Si)/n(Al)与XRD测试得到的结果接近,说明沸石中的Al原子基本进入骨架;RuCl3溶液加入顺序不同,所得沸石的Ru金属负载量稍有不同,但n(Si)/n(Al)几乎不变。合成方法不同,所得沸石的Ru金属负载量有较大差别,采用原位水热法制得的沸石中Ru@Y-Si的Ru金属负载量较高,但是低于离子交换法或浸渍法制得的沸石。

表1 不同沸石的晶体结构参数和组成Table 1 Crystal structure parameters and compositions of different zeolites
2.1.2 形貌 将原位水热法合成的Ru@Y系列沸石与离子交换法、浸渍法制得的Ru/Y系列沸石的SEM图进行了对比,结果如图2所示。由图2可知,所有沸石均有明显的八面立方体结构,边界清晰,是典型Y沸石的特征形貌;在原位水热法合成的沸石中,Ru@Y-Al晶粒粒径相比其他两种沸石的晶粒粒径稍大,Ru@Y-Si和Ru@Y-Si-Al晶粒粒径相差不大。结合表1中Ru金属负载量的数据发现,在原位水热法合成过程中,Ru金属的添加不利于沸石晶体的生长,Ru金属质量分数越小,晶粒粒径越大。离子交换法、浸渍法合成的3种沸石,其晶粒粒径和形貌与Y沸石基本一致,说明采用离子交换法及浸渍法负载少量的Ru金属,对Y沸石结构稳定性的影响较小。

图2 Y沸石负载Ru金属的SEM图Fig.2 SEM images of Y zeolite supported Ru metal
2.1.3 Ru金属状态 图3为不同沸石及Ru/SiO2的H2-TPR图。由图3(a)可知,Ru/SiO2的前驱体在429 K左右可被H2还原。从图3(b)可知,离子交换法、浸渍法制得的Ru/Y系列沸石与Ru/SiO2相比,催化剂前驱体的还原温度提高了10~50 K,这可能是Ru金属物种进入沸石微孔,与沸石骨架发生了强相互作用[17-19];相比于离子交换法或浸渍法制得的Ru/Y系列沸石,原位水热法合成的Ru@Y系列沸石的还原温度更高,其中Ru@Y-Si的还原温度最高为519 K。这从侧面证明,在原位水热法合成的沸石中,更多的Ru金属物种进入到沸石的微孔内,Ru金属物种与沸石之间存在较强的相互作用,难以被还原。从合成角度分析,离子交换法及浸渍法合成的沸石负载Ru金属催化剂,采用RuCl3金属盐溶解于水中后,生成的可被交换或静电吸附的(Ru(H2O)6)3+水合离子粒径过大,难以迅速扩散并进入Y沸石孔内,Ru金属物种容易在沸石外表面或孔口沉积,易于还原。这说明后处理制得的Ru/Y系列沸石容易在沸石外表面生成Ru金属大颗粒。
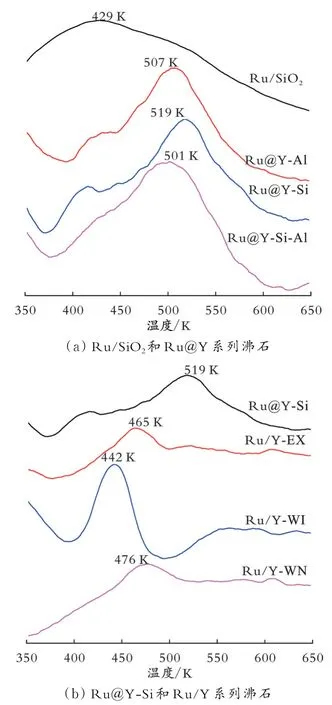
图3 不同沸石及Ru/SiO2的H2-TPR图Fig.3 H2-TPR diagram of different zeolites and Ru/SiO2
图4为Ru@Y系列沸石的HRTEM和EDS mapping图,其中左侧为HRTEM图,右侧为EDS mapping图。图5为Ru/Y系 列 沸 石 的TEM和HRTEM图。

图4 Ru@Y系列沸石的HRTEM和EDS mapping图Fig.4 HRTEM images and EDS mapping of Ru@Y zeolites

图5 Ru/Y系列沸石的TEM和HRTEM图Fig.5 TEM and HRTEM images of Ru/Y zeolites
由图4、5可知,在原位水热法合成的Ru@Y系列沸石中均未发现大的Ru金属粒子存在,Y沸石晶格条纹清晰,Ru金属在沸石上高度分散,说明Ru金属成功包覆于Y沸石中,粒径为1.0~1.2 nm;在离子交换法及浸渍法合成的Ru/Y系列沸石中,发现了10 nm以上的Ru金属粒子的存在,其中Ru/YWI的金属粒子最大,这进一步说明Ru金属粒子发生了团聚现象,无法进入沸石孔道而负载在其外表面上。这一结果与H2化学吸附的结果一致,同时充分说明原位水热法有利于实现Ru金属的包覆。总体而言,Ru@Y系列沸石中Ru金属呈高分散性,Ru@Y-Si和Ru@Y-Al的 分 散 度 高 且 接 近,Ru金 属粒径约为1 nm。这说明,当原位水热法合成Ru@Y系列沸石时,RuCl3的添加顺序对Ru金属物种的分散产生影响。Y沸石合成体系为强碱体系,RuCl3在体系中容易生成氢氧化物类沉淀,添加顺序的不同,会导致Ru金属前体生成不同粒径的前驱体,进而影响金属包覆。对Ru@HY-Al而言,若在Al源生成过程中加入Ru金属物种,则由于Al源的强碱性,Ru金属离子容易生成氢氧化钌大胶粒,若在Si源生产过程中加入Ru金属物种,则酸性的硅物种有利于稳定Ru金属离子。因此,Ru@Y-Si物种具有更高的分散度。
为了进一步验证Ru金属的状态,图6给出了Ru@Y、Ru/Y系列沸石和Ru/SiO2的低温CO-FTIR对比图。由图6可知,含Ru金属的Y沸石在约2 171、2 123 cm-1处出现信号峰,2 170 cm-1左右处的峰为CO与Y沸石中Na+相互作用的结果[24],2 123 cm-1左右处的弱特征峰则属于多配位的Ruδ+与CO相 互 作 用 的 结 果;Ru/SiO2在2 023、1 895 cm-1处 出 现 信 号 峰,2 023 cm-1处 的 峰 对 应CO在Ru金属位点上的线性吸附,1 895 cm-1处的信号峰对应CO在Ru金属物种上的桥式吸附[25-26]。与Ru/Y系列沸石相比,Ru@Y系列沸石在约2 123 cm-1处的衍射峰强度更大,这进一步说明,Ru@Y系列沸石含有更高比例的Ruδ+,Ru金属物种进入沸石的微孔并与骨架发生强相互作用,难以被还原。这一结果与H2-TPR结果一致。另外,Ru/Y-WN在2 183 cm-1处出现了信号峰,此峰对应CO在Run+物种上的线性吸附,说明Ru金属在沸石表面富集,形成大颗粒,与图5中TEM图的结果一致。

图6 Ru@Y、Ru/Y系列沸石和Ru/SiO2的低温CO-FTIR对比Fig.6 Comparison of Ru@Y,Ru/Y zeolites and Ru/SiO2 by CO-FTIR at low temperature
图7为Ru@Y和Ru/Y系列沸石的XPS图。基于XPS测定结果,计算了Ru金属元素不同价态的质量分数,结果见表2。不同价态Ru金属的结合能也列入表2中。由图7可知,原位水热法合成的Y沸石在280.0、285.5 eV左右处存在两个峰,分别归属于Ru0和Run+物种,与低温CO-FTIR结果吻合;在Ru@Y-Si-Al中,低价态的Ru金属物种质量分数偏高,说明Y沸石骨架与Ru金属物种的作用强度不如Ru@Y-Al和Ru@Y-Si;与离子交换法和浸渍法相比,原位水热法制备的Ru@Y系列沸石Ru金属结合能更高,说明Ru金属物种进入Y沸石孔道内,能够与Y沸石骨架产生强的相互作用力。由表2可以看出,在离子交换法或浸渍法合成的Ru/Y系列沸石中,低价态的Ru0物种质量分数偏高,这进一步说明Ru金属在Y沸石表面富集,容易被还原为金属态的Ru0。综上可知,H2-TPR、HRTEM、化学吸附、CO低温红外光谱和XPS等表征结果充分证明,与离子交换法和浸渍法相比,采用原位水热法可促使Ru金属前驱体在Y沸石晶体生长过程中被包覆于Y沸石孔道内部,使Ru金属物种与Y沸石骨架产生强相互作用,稳定Ru金属粒子,进而得到Y沸石包覆的Ru金属。

表2 Ru@Y和Ru/Y系列沸石中不同价态Ru的结合能及质量分数Table 2 The binding energy and mass fraction of different valence states of Ru species in Ru@Y and Ru/Y samples

图7 Ru@Y和Ru/Y系列沸石的XPS图Fig.7 XPS spectra of zeolites of Ru@Y and Ru/Y
2.2 催化剂的酸性质
通过NH3-TPD和吡啶红外光谱,得到了氢型Y沸石的酸性质,结果见表3。NH3-TPD结果显示,HY沸石存在两个氨气脱附峰,为470~500 K的弱酸峰和570 K以上的强酸峰。由表3可知,采用离子交换法和浸渍法合成的沸石,与HY沸石相比,由于Ru金属覆盖部分酸性位,导致沸石的酸性不同程度地下降;原位水热法合成的Ru@Y系列沸石的酸性变化呈现两极分化,其中Ru@HY-Al的酸量最低,而且Brønsted(B)酸酸量和Lewis(L)酸酸量的比值显著降低,说明Ru金属与Y沸石骨架Al之间存在强相互作用,B酸位被覆盖,酸性减弱;Ru@HY-Si的酸量与HY保持一致,而且B酸酸量/L酸酸量值高。结合前述的结构表征结果可知,这可能是因为金属盐前驱体的加入顺序不同,Ru金属物种与Y沸石中的Al物种或Si物种相互作用的概率发生变化,Y沸石骨架与Ru金属离子的作用方式或强度存在一定的差异。总体而言,Ru@HY-Si结晶度高,Ru金属粒子高度分散,而且酸量高,是一种潜在的双功能催化剂。
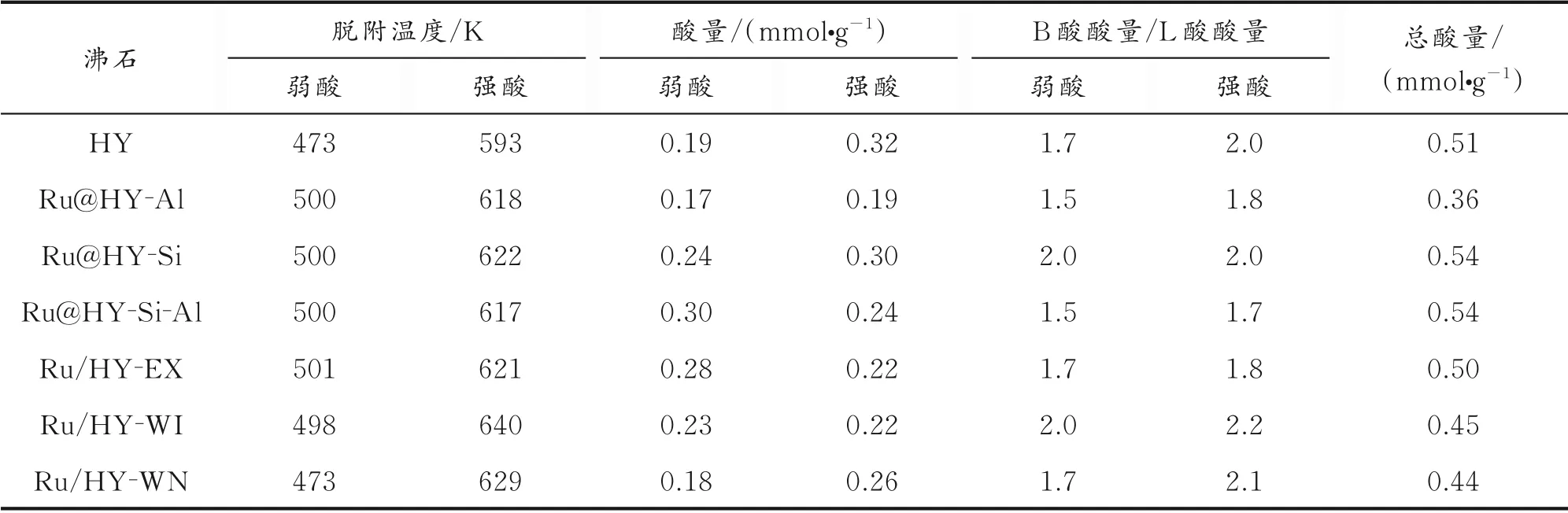
表3 氢型Y沸石的酸性质Table 3 Acid properties of hydrogen formed Y zeolites
2.3 催化剂的反应性能
在反应温度为673 K、反应压力为0.1 MPa、质量 空速为4.0 h-1、n(H2)/n(i-C4)=1的条件 下,对通过不同方法制得的氢型Y系列沸石的异丁烷转化率以及产物选择性进行了对比,结果如图8所示。

图8 Y系列沸石的异丁烷转化率和选择性Fig.8 The isobutane conversion and product selectivity over zeolite samples
由图8可知,异丁烷转化率从大到小的排序为:Ru@HY-Si>Ru@HY-Si-Al>Ru/HY-EX>Ru/HY-WN>Ru@HY-Al>Ru/HY-WI,该顺序与表3中沸石的总酸量具有一定的相关性。Ru@HY-Si、Ru@HY-Si-Al和Ru/HY-EX具 有 较 高 的 酸 量,转化率较高。其中,Ru@HY-Si与Ru@HY-Si-Al总酸量一致,但Ru@HY-Si中Ru金属分散度更高,单位质量催化剂中活性金属原子数量更多,体现了高反应活性,转化率为19.4%。Ru@HY-Al虽然总酸量最低,但其转化率仍高于Ru/HY-WI,主要是源于其更高的Ru金属分散度。这说明金属中心与酸中心数目相匹配,能够优化反应活性。Ru@HY-Si不仅具有最高的转化率,而且正丁烷选择性也最高(68%)。由此可知,虽然原位水热法合成的Ru@HY-Si的Ru金属负载量较低,但其高金属分散度和高酸量能够促进异丁烷加氢异构化。
在反应压力为0.1 MPa、n(H2)/n(i-C4)=1的条件下,考察了不同反应温度及不同质量空速下异丁烷加氢异构化反应转化率及选择性,结果如图9所示。由图9可知,保持质量空速(4.0 h-1)不变,当反应温度由473 K向723 K变化的过程中,异丁烷转化率逐渐增大,473 K时异丁烷转化率非常低,仅有0.6%,而反应温度为723 K时异丁烷转化率达到了36.6%。这是由于异丁烷加氢异构化反应为吸热反应,高温有利于反应的进行[27]。由图9还可知,温度升高时,正丁烷的选择性先逐渐增大后减小,473 K时选择性最低,仅有19%,673 K时达到最高,为68%;当质量空速由1.0 h-1向5.0 h-1变化时,正丁烷的选择性逐渐增大,由50%增加到71%,异丁烷转化率逐渐减小,从32.9%减少至9.9%。

图9 Ru@HY-Si的选择性及转化率Fig.9 The product selectivity and conversion of Ru@HY-Si
在异丁烷逆向异构反应中,出现了C1-C3的轻质烃产物,主要以乙烷为主。例如,低温(473~673 K)时,乙烷的选择性较高(12%~30%),此温度并非酸催化烷烃发生催化裂解的适宜温度,说明乙烷应该是Ru金属中心表面的C-C裂解反应产物,这与文献中报道的Ru金属具有优异的C-C裂解活性相一致[28]。改变温度和质量空速,反应产物中的甲烷和丙烷质量分数较低,这说明在473~673 K发生自由基机理热裂解和碳正离子的β断裂的概率较小。由此可以推断,产物中的乙烷,可能是正丁烷分子在Ru金属中心上的均裂反应产物。
3 结 论
通过对比离子交换法、浸渍法和原位水热法合成的Y沸石负载Ru金属粒子的性质发现,原位水热法是适宜的沸石包覆金属的合成方法。离子交换法和浸渍法负载Ru金属,Ru金属粒子会在沸石外表面富集且生成大颗粒,而采用原位水热法能够实现1 nm左右的Ru金属粒子的包覆。通过改变原位合成过程中Ru金属前驱体的添加顺序,能够在保证沸石骨架结构不变的基础上,对沸石的酸性和金属分散性进行调变。在Y沸石凝胶合成过程中,硅源添加后加入Ru金属前驱体制得Ru@Y-Si,具有高的沸石结晶度和酸量,金属分散度高,为0.98。在异丁烷异构化制正丁烷反应中,Ru@Y-Si具有最优的催化性能,在温度为673 K、氢气压力为0.1 MPa、质量空速为4.0 h-1时,异丁烷转化率为19.4%,正丁烷选择性可达68%。
