免疫评分对低级别胶质瘤患者生存期的预测作用
2022-11-24王占峰
陈 平,王占峰
(1.吉林大学中日联谊医院,吉林 长春130033;2.南华大学附属第二医院,湖南 衡阳421000)
胶质瘤是常见的中枢神经系统肿瘤,占所有原发性中枢神经系统恶性肿瘤的80.8%;而低级别胶质瘤(LGG)是常见的胶质瘤之一,占所有胶质瘤的16%[1],LGG包括Ⅱ级和Ⅲ级星形细胞瘤和少突胶质细胞瘤[2]。虽然LGG的预后要好于高级别胶质瘤(如胶质母细胞瘤),但近70%的LGG在10年内发生进展[3]。LGG具有较强的侵袭性,目前难以做到完全治愈。肿瘤微环境(TME)由大量不同数量的免疫细胞、基质细胞和其他非肿瘤成分组成,在肿瘤的发生和发展中起着关键作用[4]。免疫治疗是目前胶质瘤治疗的研究热点,近年来越来越多的研究表明免疫浸润与胶质瘤的预后相关[5-6]。因此,本研究拟建立一个科学的预测模型来预测预后,以期能筛选出LGG中的高位人群并尽早干预。
1 资料与方法
1.1 数据获取
TCGA是目前可用于肿瘤基因组分析的最大数据集,包括至少200种癌症和临床信息,以及DNA甲基化、RNA测序等测量(https://cancergenome.nih.gov/)。本研究通过访问cbioportal数据库(http://www.cbioportal.org/)下载LGG患者TCGA的临床病理信息,包括患者的唯一编号、年龄、性别、病理诊断、分期、总生存期(OS)及OS时间。通过基因表达数据计算免疫评分,并使用免疫评分来估计浸润免疫细胞的水平。本研究通过美国德州大学MD安德森癌症中心的数据库(https://bioinformatics.mdanderson.org/)下载LGG的免疫评分。依据在删除重复病例及剔除不完整数据后,最终有514例LGG患者纳入本研究。所有患者的诊断均依据病理结果,其中星形细胞瘤(astrocytoma)194例、少星形细胞瘤(Oligoastrocytoma)129例及少突胶质细胞瘤(Oligodendroglioma)191例。514例患者中男性患者284例,女性患者230例,年龄14-87岁,平均年龄(42.95±13.37)岁。
1.2 统计分析
本研究使用X-tile 3.6.1软件(美国康涅狄格州纽黑文耶鲁大学医学院)获得免疫评分的分界点,并做了X-tile图对免疫分数进行评估。分类数据用卡方检验或Fisher检验进行分析,连续变量用方差检验(ANOVA)或Kruskal-Wallis H检验对分布异常和方差同质的变量进行分析。使用Kaplan-Meier方法构建生存曲线,并使用对数秩检验进行比较,以了解不多免疫评分亚组之间生存是否存在差异。多变量Cox比例风险回归模型用于确定OS的独立预测因子。在同时考虑年龄、性别、病理诊断结果和肿瘤分期的影响后,估计了调整后的危险比(HR)和95%置信区间(CI)。
使用根据多因素分析的结果绘制列线图。这些列线图经过1 000次bootstrap自助法抽样,用于分析数据库的内部验证。通过计算一致性指数(C-index)来评估预测预后模型的性能。C-index在0.5-1之间,1为理想状态,说明该模型预测结果与实际完全一致,0.5则相反,说明该模型没有完全预测作用。通过比较观察到的生存率和模型预设的生存率,绘制了3年、5年OS的校准曲线及计算时间依赖性受试者工作特征(ROC)曲线以评估模型的预测效能。所有统计检验均为双侧检验,P值<0.05被认为差异具有统计学意义。上述所有的统计分析及作图均在R软件(4.1.1版,https://www.r-project.org/)中完成。
2 结果
2.1 免疫评分分组
数据整理后,共有514名患者被纳入研究中。免疫评分的分界点为-1184.9和303.4,患者随后被分为高、中、低免疫评分3个亚组(X-tile图如图1所示)。共有117例(22.76%)患者低于或等于-1184.9(低免疫评分亚组),327例(63.62%)介于-1184.9和303.4(中等免疫评分亚组)之间,70例(13.62%)名患者高于303.4(高免疫分数亚组)。
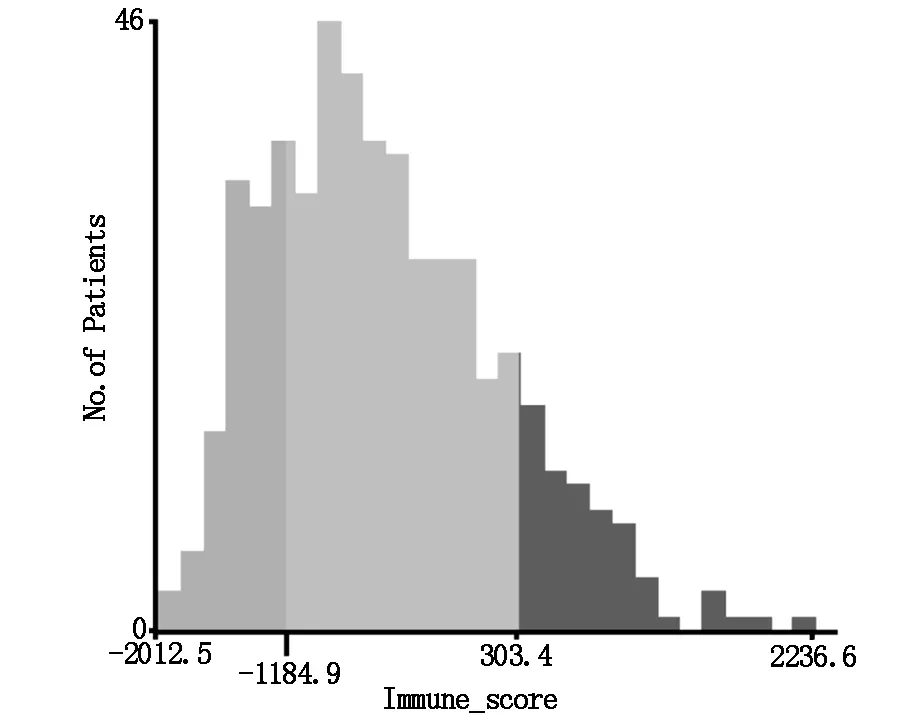
图1 X-tile图显示截断值
2.2 OS的多因素COX比例回归风险分析
如图2和图3所示,免疫评分低、中、高的患者在OS方面存在显著差异。多变量Cox比例风险回归分析结果如图2所示。与免疫评分低的患者相比,免疫评分中及高的患者显著增加了OS的风险,其HR及95% CI分别为1.88(1.08-3.3)、3.26(1.66-6.4)。肿瘤分期也是影响OS的关键因素,相比于G2期,G3期患者的OS风险明显增加,HR值为2.38(95%CI,1.58-3.6)。年龄对OS的影响正如预期的一样,相比于小于或等于40岁的较年轻的患者而言,其他年龄段的患者随着年龄的增长其生存风险也明显增加。不同年龄段的风险比如下:41-50岁的患者HR为1.94(95%CI,1.14-3.3),51-60岁的患者HR为3.40(95%CI,1.99-5.8),大于60的患者HR为7.62(95%CI,4.56-12.7)。而性别及胶质瘤的病例类别对于OS未产生明显的影响。
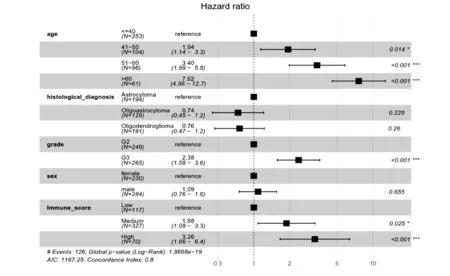
图2 森林图展示多因素COX回归分析的结果
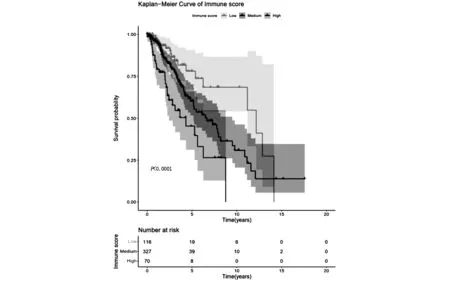
图3 Kaplan-Meier曲线描述了免疫评分亚组与LGG患者总生存率(OS)的关联
2.3 OS的预后列线图
图4显示了综合考虑了OS的所有独立因素的预后列线图。OS预测的C-index为0.8,95%CI为0.759-0.841。3年、5年ROC曲线下面积(AUC)值分别为0.844及0.795(图5)。3年、5年生存概率的校准图(图6A及6B)显示,列线图预测结果与实际观察结果吻合良好。

图4 LGG生存列线图
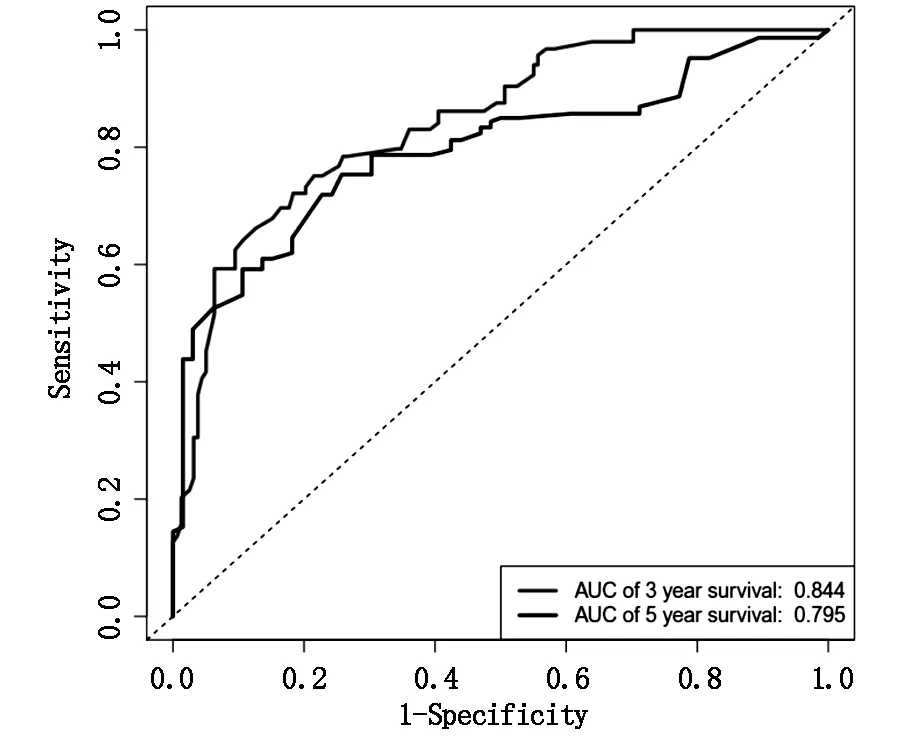
图5 3年、5年OS的ROC曲线
3 讨论
本研究利用LGG患者的基因表达数据评估了免疫评分的预后意义,在考虑了可能的混杂因素后发现免疫评分与LGG患者的OS显著相关。同时建立了列线图,以便能够简单直观的预测LGG患者的生存率。
免疫细胞对胶质瘤的作用已得到确认[7],并且免疫基因标记被认为是免疫治疗反应的生物标志物。目前已有一些研究表明基因免疫特征与胶质瘤的预后密切相关,如Zhang等[6]筛选16个免疫相关基因的表达量来进行评分,并以此评分的高低将胶质瘤分成高低两组,随后的分析发现评分的高低与预后密切相关。通过检测一些基因的表达来对患者的预后做出一些初步的评估,但这些挑选的基因无法全面而真实反映肿瘤的免疫浸润情况,且单纯依据中位数或者均数的截断值划分高低位组也不确切。因此,采用ESTIMATE算法[8]来计算LGG的免疫评分,能够较为准确反映LGG的免疫细胞的水平,同时根据研究目的来选取截断值,并探讨免疫评分与LGG预后的关系。

图6 LGG患者5年和3年总生存率(OS)的校准曲线
在排除可能的混杂因素后,免疫评分越高,LGG患者的OS越差,两者呈负相关,这与之前的研究结果相一致[9];与本研究结果相反的是在许多其他类型的肿瘤中(包括肺癌、结肠癌及黑色素瘤),免疫浸润与OS呈正相关[10-12]。为什么会呈现这种截然不同的结果,有以下可能的原因。其一,LGG患者中存在IDH突变的预后更好[13],而IDH突变可导致肿瘤代谢物2-羟基戊二酸(2-HG)的产生[14]。2-HG是被认为是一种免疫抑制剂,可创造了一个免疫抑制的肿瘤微环境[15]。其二,高免疫评分LGG患者的肿瘤微环境可能主要浸润抑制性免疫细胞[16]。研究发现,在免疫高风险组中积累了更多的免疫抑制细胞(MDSC、Treg和成纤维细胞)、免疫抑制细胞因子(CCL5、CCL22和IL-10)和免疫检查点分子(PD-1、PD-L1、CTLA-4、TIM-3、LAG-3和BTLA),这些细胞在免疫激活后可以逃避免疫识别和清除[5]。其三,在免疫抑制的肿瘤微环境中,可能出现肿瘤干细胞减少[17],从而导致低免疫评分LGG患者OS的提高。
本研究基于免疫评分和临床病理特征预测LGG患者OS的列线图。通过这些评分系统,可对患者实现个体化的生存预测,尽早识别高风险人群,尽早干预以改善预后。目前包括可用于计算免疫评分的基因表达文件在内的数据集很少,因此本研究的列线图未能进行外部数据验证。今后应进一步收集与免疫基因表达相关的数据,以及纳入更多的临床病理因素。
