T-ARMS PCR多重检测方法研究*
2022-11-21陶明丽李莹雪李传宇周连群李金泽
陶明丽,李莹雪,李 豪,张 威,李传宇,周连群,李金泽▲
1.中国科学技术大学生命科学与医学部生物医学工程学院(苏州),江苏苏州 215123;2.中国科学院苏州生物医学工程技术研究所,江苏苏州 215163
肝细胞癌(简称肝癌)是一种高度恶性肿瘤。2020年中国癌症中肝癌发病率位居男性第3位,女性第7位,死亡率位居恶性肿瘤相关死亡的第3位[1-2]。到2030年,将有超过100万人死于肝癌[3],使其成为全球最致命的癌症类型之一。因此,肝癌的早期诊断、病情监测及预后评估是提高肝癌患者治愈率,降低病死率的关键。肝癌的诊断常使用甲胎蛋白(AFP)水平检测或使用无创成像检查,如超声检查、计算机断层扫描(CT)和磁共振(MRI),但是这些方法由于灵敏度低,只有在恶性肿瘤晚期时才能检测到肿瘤的存在,从而导致治疗方案选择有限且预后不佳[4]。通过早期检测和监测治疗后可能的肝癌复发,可以显著提高治疗有效性。肝细胞癌变离不开单核苷酸多态性(SNP)突变,SNP检测常用Taqman探针基因分型法,等位基因富集法则是新兴的一种方法[5]。等位基因富集法能在大量野生型等位基因存在的情况下检测突变型等位基因,减弱野生型背景的干扰,具有用于临床诊断的潜力。
等位基因富集可以通过去除野生型等位基因或通过选择性扩增突变型等位基因来实现。振荡电泳能够有效去除野生型序列[6-7];野生型特异探针和双链特异核酸酶被用于选择性降解野生型DNA分子[8],通过耗尽野生型等位基因来改善突变型等位基因的扩增。突变型等位基因的选择性富集通常是通过聚合酶链反应(PCR)实现的,其中野生型DNA序列PCR扩增被阻止,其方法包括PCR阻断剂[9]、锁核酸和肽核酸钳PCR[10-11]、改良型完全富集低变性温度下的复合PCR(ICE-COLD PCR)[12-13]和阻断剂置换扩增[14]。尽管这些等位基因富集的方法已多种多样,但是鲜有能实现多重基因突变检测的。
多重PCR检测技术仅在一支反应管中就可检测出多个靶标,使得检测时间和检测试剂用量减少,具有高效便捷、经济节约、特异度和灵敏度高等优点,具有普通单重PCR方法不可比拟的优越性[15]。肝癌相关的基因突变位点是多个的,难以预测的,若能一次检测多个位点,将对肝癌的临床诊治带来极大便捷。因此,多重PCR检测技术对肝癌诊治及临床研究有重大意义和价值。
本研究提出有错配的加尾双引物扩增受阻突变体系PCR(T-ARMS PCR)的方法,该方法通过熔解曲线和扩增曲线分析即可得出结果,是一种能实现多重检测的等位基因富集方法,能有效地抑制野生型DNA序列的扩增,达到富集突变型DNA序列的目的,同时能解决多重情况下引物二聚体干扰的问题,为动态监测肝癌患者的病情状况、早期检测肝细胞癌变及肝癌肿瘤复发的实时评估等提供理论依据。
1 材料与方法
1.1材料 本研究使用的质粒是由安徽通用生物股份有限公司合成的野生型质粒和突变型质粒。
1.2仪器与试剂 本研究使用的引物由上海生工生物工程股份有限公司合成,Taq Pro HS Universal Probe Master Mix购于南京诺唯赞生物科技股份有限公司,EveGreen(20× in water)购于上海翌圣生物科技有限公司,ABI QuantStudio7实时荧光定量PCR(qPCR)仪购于美国Applied Biosystems公司。
1.3方法
1.3.1单重体系qPCR 分别对肝细胞RNA的TP53 R249S、TP53 R273H、CTNNB1 S45F 3个基因突变位点进行分析,检测均采用染料法qPCR,样品均设置3次重复和空白对照(NTC),质粒浓度均为103copy/μL。染料是EveGreen,其具有极高的灵敏度且PCR抑制性极小,非常适合多重PCR及高分辨率熔解曲线(HRM)的分析。均采用30 μL体系,反应条件:95 ℃ 30 s预变性1个循环;然后按95 ℃ 10 s变性,60 ℃ 30 s退火/延伸,共40个循环;默认扩增曲线和熔解曲线荧光采集。引物序列5′端不加一段DNA序列(Tail Free Primer),采用扩增受阻突变体系PCR(ARMS PCR)引物设计原理,具体序列见表1。引物序列5′端加一段相同的DNA序列(Tailed Primer),引物序列见表2。

表1 试验所用Tail Free Primer

表2 试验所用Tailed Primer
1.3.2三重体系qPCR结果对照 T-ARMS PCR研究方案的原理如图1所示。将Tail Free Primer三重体系与Tailed Primer三重体系做对比。分别将3对Tail Free Primer及其对应模板、3对Tailed Primer及其对应模板进行PCR扩增,均以野生型模板和突变型模板作对照,采用30 μL体系,qPCR仪器设置的程序与1.3.1相同,将两种三重体系扩增结果做对比分析。
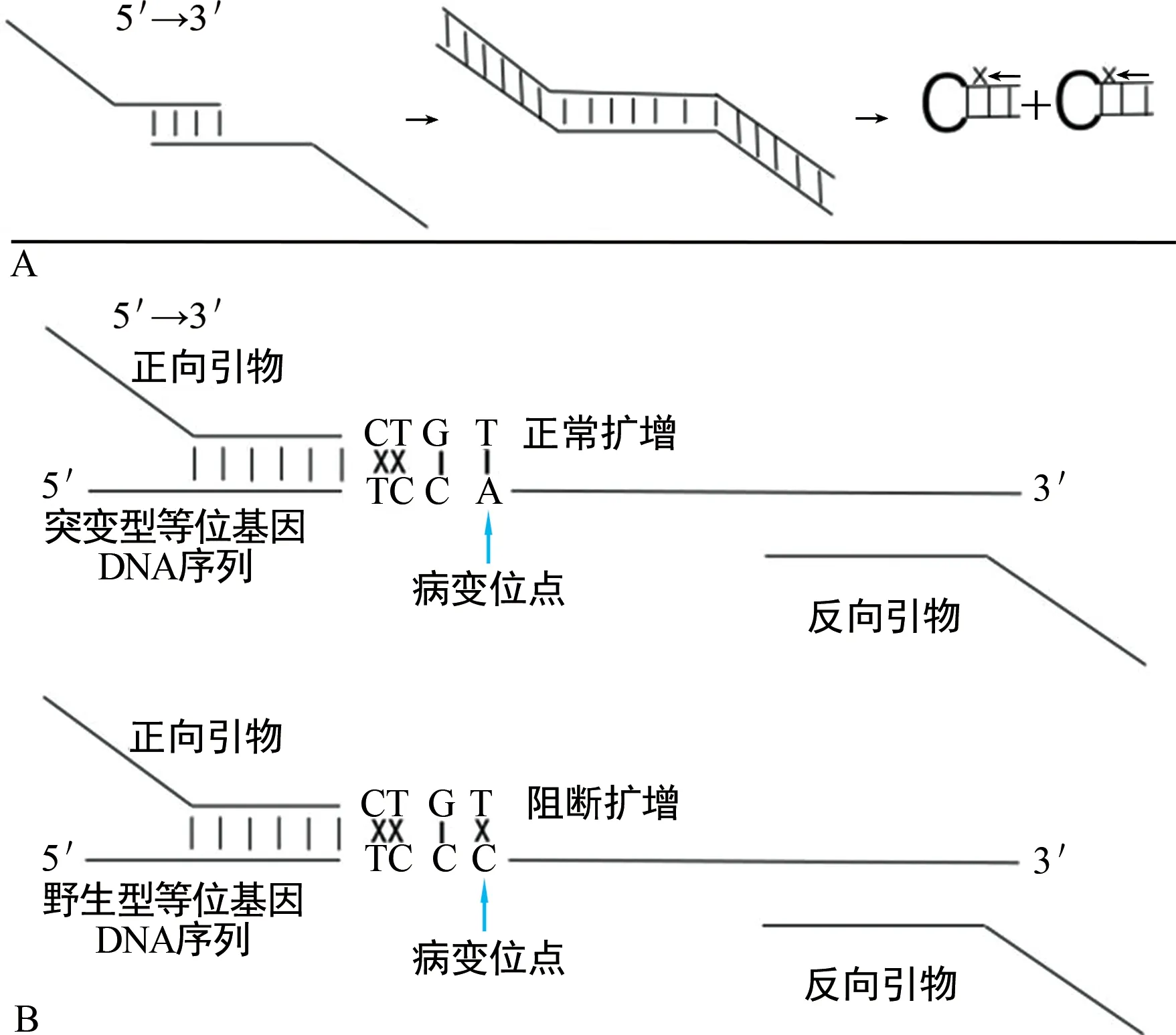
图1 T-ARMS PCR多重检测方法原理图
1.3.3突变负荷的检测限及特异性检测 将野生型质粒与突变型质粒以不同比例混合,野生型质粒终浓度为104copy/μL,得到突变型质粒与野生型质粒的浓度比(突变负荷)分别为0.00%、0.05%、0.10%、0.25%、1.00%的标本,进行PCR扩增,通过扩增曲线Ct值及熔解曲线来分析在大背景为野生型质粒的情况下该方法对突变型质粒突变负荷的检测限,比较野生型质粒和有突变负荷的野生型质粒的Ct值大小,就可得出突变负荷的检测限,同时观察引物特异性。每份标本进行3次重复平行实验。
1.3.4T-ARMS PCR与Taqman探针基因分型方法的对比 Taqman探针基因分型方法的具体引物及探针序列如表3所示,其针对的突变位点是TP53 R249S。反应体系有纯合子野生型、纯合子突变型、杂合子,均加入两种荧光探针,采用30 μL探针法qPCR,样品均设置3次重复和NTC。反应条件:95 ℃ 30 s预变性1个循环;然后按95 ℃ 10 s变性,60 ℃ 30 s退火/延伸,共45个循环;最后60 ℃,1 min延伸;默认荧光采集程序。
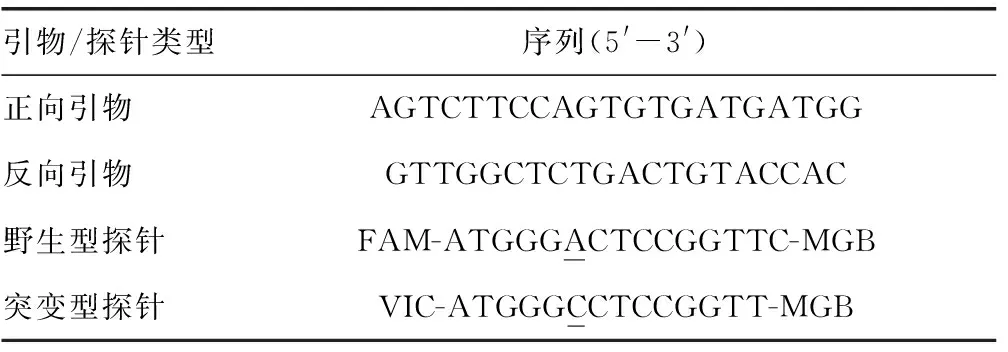
表3 针对突变位点TP53 R249S的基因分型引物及探针序列
2 结 果
2.13个基因突变位点Tailed Primer单重体系扩增结果 TP53 R249S突变型质粒扩增的Ct值为24.23,野生型质粒无Ct值(图2A);突变型质粒解链温度(Tm)为83.06 ℃,NTC无峰值(图2B)。CTNNB1 S45F突变型质粒扩增的Ct值为26.99,野生型质粒Ct值为38.02(图2C);突变型质粒Tm为81.96 ℃,NTC无峰值(图2D)。TP53 R273H突变型质粒扩增的Ct值为29.52,野生型质粒Ct值为39.02(图2E);突变型质粒Tm为86.45 ℃,NTC无峰值(图2F);3个基因突变位点Tailed Primer单重体系突变型质粒的扩增均优于野生型质粒,野生型质粒的扩增均被有效抑制。
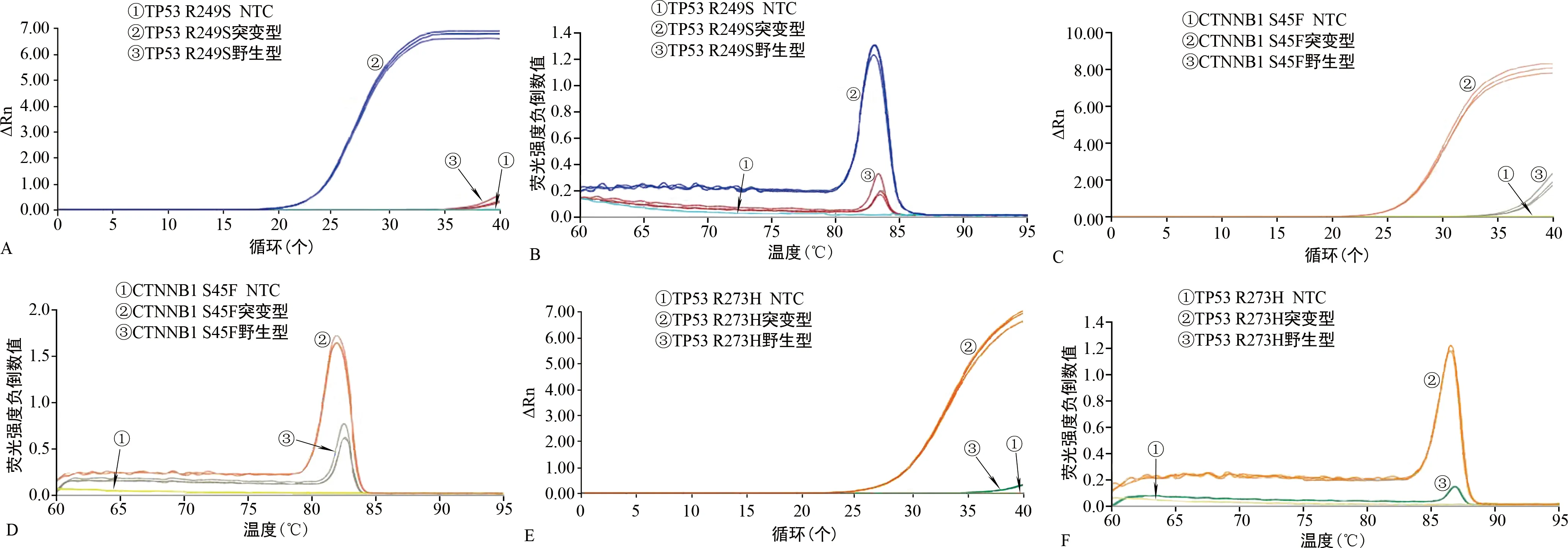
注:ΔRn为每点测量的荧光强度与荧光基线强度的差值。A、B分别为TP53 R249S的单重体系扩增曲线、熔解曲线;C、D分别为CTNNB1 S45F的单重体系扩增曲线、熔解曲线;E、F分别为TP53 R273H的单重体系扩增曲线、熔解曲线。图2 三个基因突变位点的Tailed Primer单重体系扩增结果
2.2三重体系qPCR熔解曲线比较 在Tail Free Primer三重体系熔解曲线(图3A)中,3个突变型质粒反应体系熔解曲线出现2个明显的峰值且有引物二聚体,未能体现出3个峰值,2个Tm分别为84.3 ℃和88.4 ℃;3个野生型质粒反应体系熔解曲线出现的峰值为引物二聚体,野生型质粒几乎未扩增;NTC有引物二聚体的峰值出现,表明Tail Free Primer三重体系中有非特异性扩增产物。在Tailed Primer三重体系熔解曲线(图3B)中,3个突变型质粒反应体系熔解曲线出现明显的3个峰值,Tm依次为81.11 ℃、82.36 ℃、86.35 ℃,分别对应CTNNB1 S45F、TP53 R249S、TP53 R273H,该三重体系的3个Tm与单重体系的Tm均吻合;野生型质粒和NTC反应体系熔解曲线均未出现峰值,无引物二聚体,无非特异性扩增产物。突变型质粒扩增明显优于野生型质粒扩增。
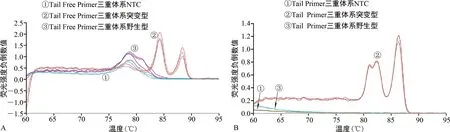
注:A为Tail Free Primer三重体系熔解曲线;B为Tailed Primer三重体系熔解曲线。图3 三重体系qPCR熔解曲线结果
2.33个基因突变位点突变负荷的检测限及特异性检测结果 3个基因突变位点突变负荷的检测限检测结果如表4所示,将没有添加突变型质粒与添加了不同比例突变型质粒的Ct值进行比较,表中Ct值均为3个重复平行实验的均值,TP53 R249S和R273H突变负荷的最低检测限可达0.05%,CTNNB1 S45F突变负荷的最低检测限可达0.10%。熔解曲线均为单一峰,Tm值唯一,特异性好。
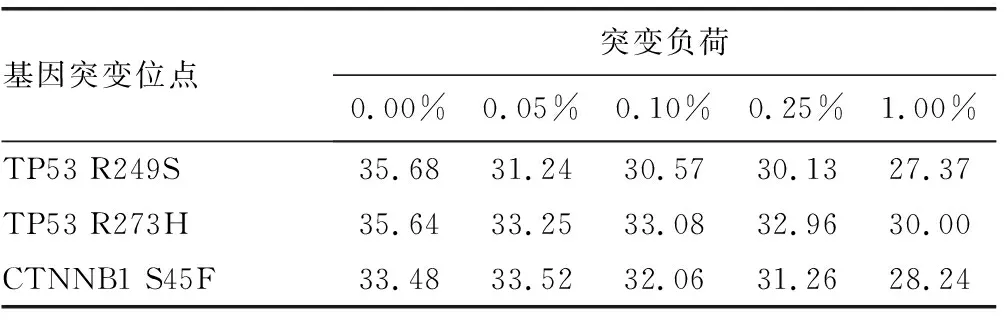
表4 3个基因突变位点不同突变负荷的Ct值
2.4T-ARMS PCR与Taqman探针基因分型方法的结果比较 TP53 R249S基因突变位点T-ARMS PCR结果显示,野生型与突变型质粒浓度均为103copy/μL,突变型质粒扩增明显优于野生型,野生型质粒扩增被抑制(图4A)。TP53 R249S基因突变位点Taqman探针基因分型方法扩增结果显示,野生型与突变型质粒混合的浓度均为103copy/μL,以1∶1混合得到杂合子,2个等位基因的探针分别标记FAM和VIC的荧光,野生型和突变型质粒的Ct值的大小相差1.8,扩增效率差异不大(图4B)。
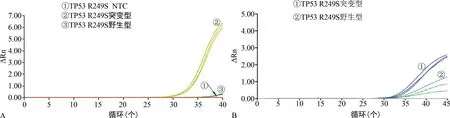
注:ΔRn为每点测量的荧光强度与荧光基线强度的差值。A为T-ARMS PCR方案的扩增曲线;B为Taqman探针基因分型方法的扩增曲线。图4 TP53 R249S的T-ARMS PCR与Taqman探针基因分型方法的扩增曲线
3 讨 论
在T-ARMS PCR研究方案中,如图1A所示,引物均增加相同的DNA序列,若两引物互补延伸,由于引物尾巴序列相同,提高退火温度时则形成颈环结构,阻止引物二聚体的扩增。图1B是T-ARMS PCR方法抑制野生型等位基因扩增的原理图,传统的ARMS PCR需要两对引物,本研究T-ARMS PCR方法只用一对引物,进一步减少引物二聚体形成的可能。引入错配碱基能阻止野生型等位基因的扩增,起到富集突变型等位基因的目的。
本研究以TP53 R249S、TP53 R273H、CTNNB1 S45F 3个基因突变热点进行研究,具有一定实际意义。TP53的表达与肝癌中的R249S突变显著相关[16-17]。而R273H是TP53上与肝癌相关的另一个突变热点。CTNNB1是肝癌最显著的变异基因之一,其编码β-catenin蛋白,参与Wnt信号通路调控,对于肝癌的机制发生和发展起着重要的作用。有报道显示,肝癌中大约90%的CTNNB1突变发生在两个热点区域,密码子32~37和41~45,分别占肝癌中所有CTNNB1突变的55%和34%[18-19],S45F为其突变热点之一[20]。
多重PCR检测技术是一种简单和经济的基因突变检测方法,能在一定程度上解决多重PCR产生引物二聚体的问题。引物序列5′端加一段DNA序列的方法,能调控产物Tm使不同产物更易区分,只扩增突变型等位基因,使得在多重情况下能减少Tm通道占用,增加检测靶标数。本研究中,采用ARMS PCR的原理设计上游引物,由于多重PCR扩增始终存在引物二聚体的干扰,故采用Tailed Primer的方法,来消除引物二聚体的影响[21]。ARMS PCR是检测SNP基因型的一种简单和经济的方法,传统的ARMS PCR使用4个引物,扩增完成后进行凝胶电泳获取结果[22]。本研究在此基础上对该方法进行了一定的创新,使用一对引物即可,正向引物引入错配碱基使野生型序列扩增受到抑制,只扩增突变型,结合荧光定量PCR染料法分析其扩增曲线及熔解曲线可得到最后结果。相同反应体系,质粒浓度均为103copy/μL,只是模板差异,野生型质粒扩增曲线的Ct值明显大于突变型质粒的Ct值,NTC无非特异性产物,则可判断野生型模板扩增受到有效抑制,而突变型扩增产物被放大。另外,本研究将Tail Free Primer体系和Tailed Primer体系进行比较,可以明确引物5′端加尾能阻止引物二聚体的产生。
Taqman探针基因分型方法是最常见的SNP检测方法,通过相应仪器检测荧光值的变化就可以得到基因分型的结果。该方法每个位点需要合成一对探针,探针合成费用高,且野生型和突变型的扩增效率差别不大,每次只能检测一个SNP位点,通量低。而本研究使用的方法能有效抑制野生型的扩增从而减少一个通道占用,可同时检测多个SNP位点,节约时间和成本,且操作简便。
本研究中3个突变基因位点突变负荷的检测限与特异性检测结果显示,TP53 R249S和TP53 R273H突变负荷的最低检测限可达到0.05%,CTNNB1 S45F突变负荷的最低检测限可达0.10%,且特异性均表现良好,无引物二聚体干扰。通常,qPCR突变负荷的检测限低至1%,ARMS PCR低至0.1%[23],本研究中T-ARMS PCR突变负荷的检测限可达0.10%。未来计划进一步将该方法应用于临床标本,获得更真实可靠的结果。
本研究方法还有待改进,下一步实验方案应考虑将其应用于多种临床标本,并采用全基因组测序的方法对T-ARMS PCR实验方法的突变负荷的检测限、特异性和重复性进行验证,同时对于更多重的检测方案和灵敏度的提高方面还可以进行进一步的探索。在患者发病早期甚至还未发病前进行干预,有利于患者得到及时的治疗和减少不恰当的诊疗,提高生存率。而高灵敏度的检测方法带来的也可能是更多的干扰,多重PCR的非特异性扩增及引物二聚体的存在等问题的解决仍需进一步探讨。
综上所述,运用T-ARMS PCR熔解曲线的方法进行一管三重检测,能有效检测到目的基因突变,抑制野生型模板的扩增,并区分不同的基因突变位点。同时Tailed Primer设计减少了多重情况下引物二聚体的产生。该方法有望为临床中肝癌的早期筛查、预后评估、病情监测提供理论依据。
