非酒精性脂肪性肝病患者血清铁代谢及氧化应激相关指标变化的Meta分析
2022-11-19赵丽梅郭晓红刘立新
赵丽梅, 郭晓红,2,3, 刘立新,2,3
1.山西医科大学第一医院消化内科,山西 太原 030001; 2.山西医科大学第一医院科研实验中心; 3.山西医科大学肝病与器官移植研究所
随着生活质量的提高以及饮食结构的变化,非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)已成为我国一个日益严重的公共卫生问题。目前NAFLD全球患病率为25.24%,亚洲地区患病率达27%[1]。专家评估如果肥胖和糖尿病患病率在未来趋于平稳,预计在未来10年间,NAFLD总患病率将持续稳定增长,而我国由于城市化以及人口老龄化,肝病患者死亡率和晚期肝脏疾病将增加1倍以上[2]。此外,研究发现NAFLD不仅与肝硬化、肝癌的发生密切相关,而且与动脉粥样硬化、心血管疾病、糖尿病、男性结直肠癌、女性乳腺癌等多种疾病的发生也有着密切的联系[3]。由于目前非酒精性单纯性脂肪性肝病(non-alcoholic fatty liver,NAFL)患者进展为非酒精性脂肪性肝炎(non-alcoholic steatosis heptitis,NASH)的唯一诊断金标准为肝脏活检,而肝脏活检作为一种侵入性检查,未能被患者广泛接受,因此通过监测有效的血清学相关指标的变化,早期预测及识别NAFLD病情严重程度进而实现早期干预极为重要。
铁作为人体代谢必需的微量元素,在人体内主要以铁蛋白的形式存在,并受铁调素的调节。研究证实铁超载与代谢综合征有关,而NAFLD作为代谢综合征的肝脏表现,近年来被发现与铁超载密切相关,过量的铁可通过刺激机体产生活性自由基,加速机体氧化应激的产生,进而参与NAFLD的发生及进展[4],然而有研究却得出铁超载与NAFLD无联系[5]。因此,本研究拟通过Meta分析系统评价NAFLD患者血清铁代谢及氧化应激相关指标的变化,明确铁超载和氧化应激与NAFLD的关系,及其相关指标是否可作为评估NAFLD病情严重程度的血清学标志物,进而为临床早期识别及干预NAFLD进展提供依据。
1 资料与方法
1.1 检索策略通过PubMed、Embase、Web of Science、万方、中国知网等期刊全文数据库检索2021年12月前公开发表的有关NAFLD患者血清铁代谢及氧化应激相关指标变化的文献报道,关键词为:Non-alcoholic fatty liver disease、iron、serum iron、serum ferritin、hepcidin、glutathione、malondialdehyde、glutathione peroxidase、非酒精性脂肪性肝病、血清铁、铁蛋白、铁调素、谷胱甘肽、丙二醛、谷胱甘肽过氧化物酶。
1.2 纳入及排除标准纳入标准:(1)2021年12月前公开发表的NAFLD患者血清铁代谢及氧化应激相关指标变化的病例对照研究;且能获取患者铁代谢及氧化应激相关指标的数值(Mean±SD);(2)纽卡斯尔-渥太华量表(Newcastle-Ottawa scale,NOS)评分≥6分;(3)研究对象为依据NAFLD诊断标准确诊的NAFLD成年患者;(4)能获取全文的中英文文献。排除标准:(1)非病例对照研究;(2)无法获取全文或相关指标的数值(Mean±SD);(3)重复发表或资料雷同;(4)综述、会议记录、报告等。
1.3 文献筛选、质量评价及数据处理2位研究人员严格按照纳入、排除标准独立对检索结果进行筛选,出现分歧时互相讨论或重新查看全文处理,采用NOS评分对纳入文献进行评分,NOS评分≥6分纳入Meta分析。最后,对所纳入文献进行信息提取,包括:作者、发表年份、国家、患者年龄、性别、辅助诊断方法等。
1.4 统计学方法采用Revman 5.3软件进行统计学处理。由于本Meta分析研究指标均为连续性变量,因此,采用均数差(mean difference,MD)和95%CI为疗效评估统计量;采用χ2检验对各项研究间的异质性进行分析,I2≤50%,P>0.1,采用固定效应模型,I2>50%,P≤0.1,采用随机效应模型。并分析异质性产生的原因。此外,通过比较不同效应模型时合并效应量的点估计和区间估计的差异变化进行敏感性分析。由于本研究中大部分指标纳入的文献数量小于10篇,因此通过Egger法、剪补法综合评估发表偏倚。
2 结果
2.1 纳入文献基本信息经过初步检索,共找到7 546篇文献,经由2位研究者阅读文题和摘要后筛选出文献95篇,进一步对文献进行筛选排除不能获取相关指标及NOS评分<6分的文献,最终有38篇文献[5-42]符合标准并纳入分析。具体文献筛选流程如图1所示。纳入文献基本特征及NOS评分如表1~2所示。

图1 文献筛选的流程图Fig 1 Flow diagram of studies screening
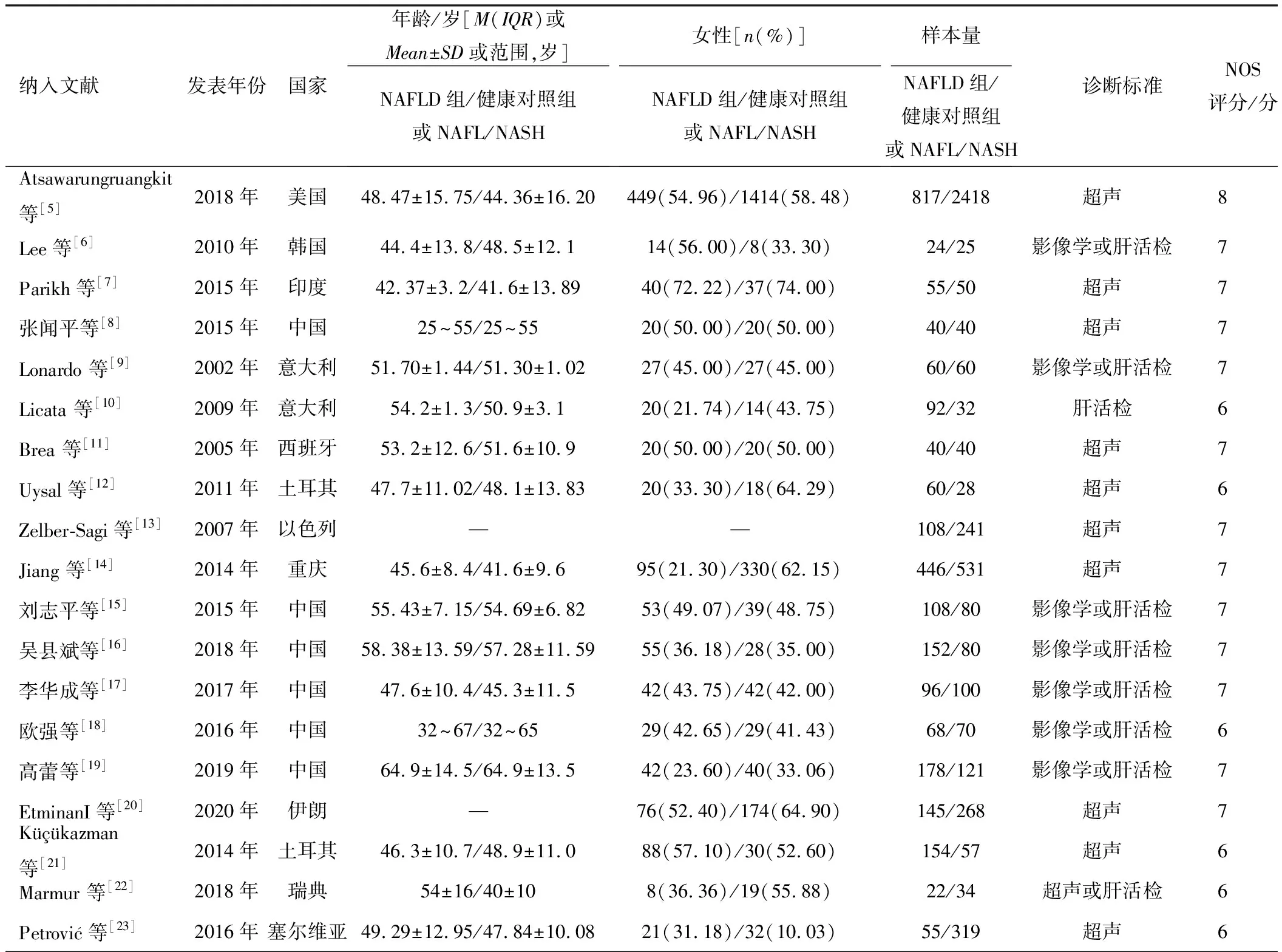
表1 纳入文献基本信息表
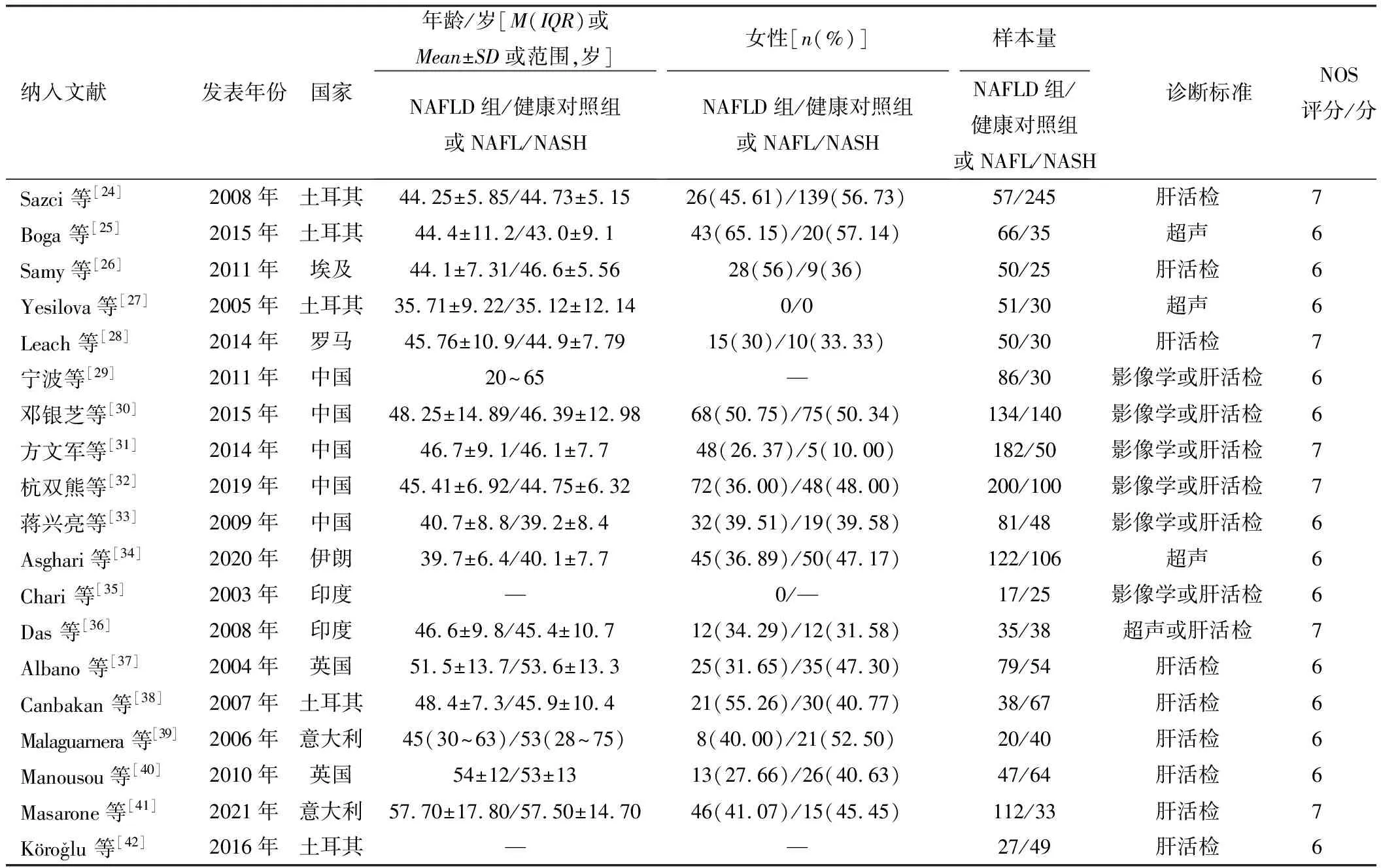
续表1
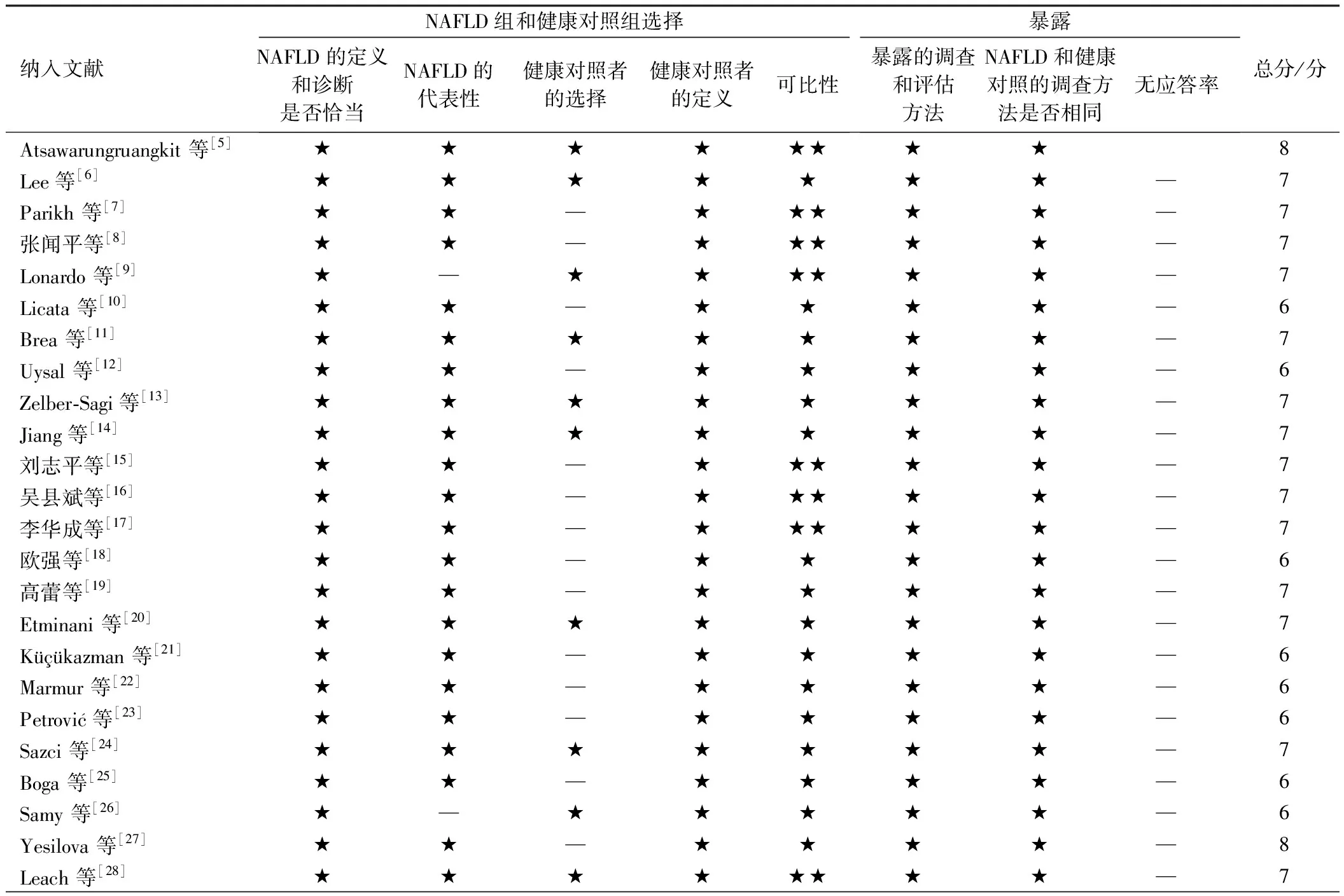
表2 纳入文献NOS评分表

续表2
2.2 Meta分析结果
2.2.1 NAFLD患者体内血清铁及铁蛋白水平变化:共19篇文献[5-10,12-24]比较了NAFLD组与健康对照组血清铁蛋白水平,累计样本量7 536例(NAFLD组2 737例,健康对照组4 799例)。各研究间异质性较大(P<0.1,I2>50%),采用随机效应模型进行统计学分析,结果显示NAFLD组血清铁蛋白水平明显高于健康对照组(MD=98.09,95%CI:74.69~121.49,P<0.05),提示血清铁蛋白与NAFLD密切相关,因异质性较大,行亚组分析显示,两组差异均有统计学意义(P<0.05)(见图2)。

图2 NAFLD组与健康对照组血清铁蛋白对比Fig 2 Comparison of serum ferritin between NAFLD group and healthy control group
9篇文献[5-13]对NAFLD组与健康对照组血清铁水平进行了比较。各研究间异质性较大(I2=99%,P<0.1),故采用随机效应模型进行统计学分析,结果显示NAFLD组血清铁水平明显高于健康对照组(MD=13.26,95%CI:3.91~22.60,P<0.05),因异质性较大,行亚组分析示:亚洲地区异质性较小(I2=0,P=0.53),两组间差异均有统计学意义(MD=21.58,95%CI:15.24~27.92,P<0.05)(见图3)。
2.2.2 NAFLD患者体内血清铁调素水平变化:共4篇文献[12,16,18,25]比较了NAFLD组与健康对照组血清铁调素水平,累计样本量559例(NAFLD组346例,健康对照组213例)。各研究间异质性较大(I2>50%,P<0.1),故采用随机效应模型进行统计学分析,结果显示NAFLD组血清铁调素水平明显低于健康对照组(MD=-5.59,95%CI:-9.40~-1.78,P<0.05)(见图4)。

图3 NAFLD组与健康对照组血清铁对比Fig 3 Comparison of serum iron between NAFLD group and healthy control group
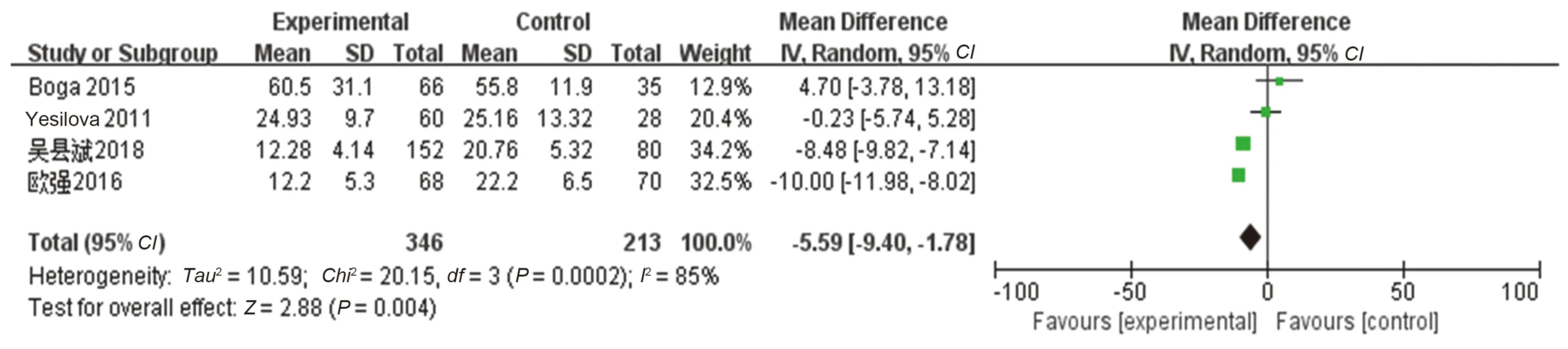
图4 NAFLD组与健康对照组血清铁调素对比Fig 4 Comparison of serum hepcidin between NAFLD group and healthy control group
2.2.3 NAFLD患者体内血清丙二醛(malondialdehyde,MDA)、谷光甘肽(glutathione,GSH)及谷光甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性水平变化:8篇文献[26-27,29-34]比较了NAFLD组与健康对照组血清MDA水平,累计样本量1 435例(NAFLD组906例,健康对照组529例),各研究间异质性较大(I2>50%,P<0.1),采用随机效应模型进行统计学分析,结果显示NAFLD患者血清MDA明显高于健康对照组(MD=1.82,95%CI:0.97~2.66,P<0.05),因异质性较大,行亚组分析示:欧美、中东组异质性较小,两组比较差异有统计学意义(见图5)。
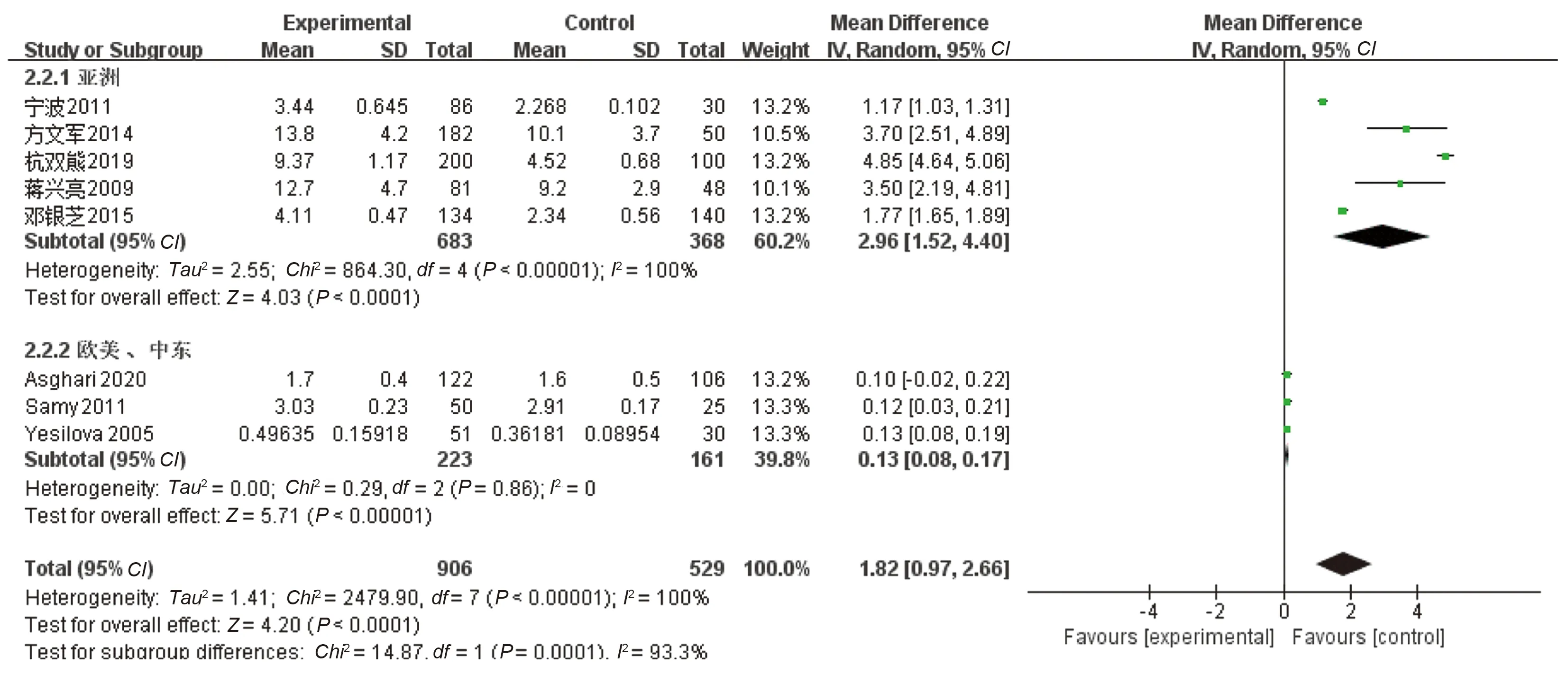
图5 NAFLD组与健康对照组血清MDA对比Fig 5 Comparison of serum MDA between NAFLD group and healthy control group
各有3篇文献比较了NAFLD组与健康对照组血清GSH[28-30]和红细胞内GSH-Px活性水平[34-36],各研究间异质性较大(I2>50%,P<0.1),故采用随机效应模型进行统计学分析,结果显示NAFLD组血清GSH水平(MD=-105.78,95%CI:-150.59~-60.97,P<0.05)、红细胞GSH-Px活性(MD=-5.80,95%CI:-6.99~-4.60,P<0.05)明显低于健康对照组(见图6~7)。

图6 NAFLD组与健康对照组GSH对比Fig 6 Comparison of GSH between NAFLD group and healthy control group

图7 NAFLD组与健康对照组GSH-Px对比Fig 7 Comparison of GSH-Px between NAFLD group and healthy control group
2.2.4 比较NAFL与NASH患者血清铁蛋白水平:6篇文献[7,37-41]比较了NAFL组与NASH组血清铁蛋白水平,累计样本量620例(NAFL组331例,NASH组289例)。各研究间异质性较大,剔除Malaguarnera等[39]、Manousou等[40]2篇文献后,异质性明显下降(I2=1%,P=0.39),故采用固定效应模型进行统计学分析,结果显示NASH患者血清铁蛋白明显高于NAFL患者(MD=-33.24,95%CI:-35.58~-30.90,P<0.05)(见图8),提示血清铁蛋白与NAFLD严重程度密切相关。

图8 NASH与NAFL血清铁蛋白对比Fig 8 Comparison of serum ferritin between NAFL and NASH
2.2.5 比较NAFL与NASH患者血清MDA水平:2篇文献[38,42]比较了NAFL患者与NASH患者血清MDA水平,累计样本量181例(NAFL组65例,NASH组116例)。各研究间异质性较大(I2=97%,P<0.1),采用随机效应模型进行统计学分析,结果显示NAFL患者血清MDA水平与NASH患者差异无统计学意义(MD=-1.16,95%CI:-2.82~0.49,P>0.05)(见图9)。
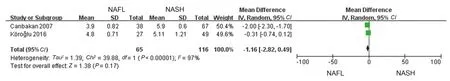
图9 NASH与NAFL血清MDA对比Fig 9 Comparison of serum MDA between NAFL and NASH
2.3 发表偏倚分析本研究纳入文献36篇,由于大部分指标纳入文献均小于10篇,因此采用Egger法进行发表偏倚分析,结果显示血清铁、铁调素、GSH、MDA、GSH-Px指标P均>0.05,提示不存在发表偏倚,由于铁蛋白Egger法P<0.05,因此采用剪补法,结果显示剪补前后统计效应量未发生明显变化,提示发表偏倚对结果的影响小,发表偏倚小。
2.4 敏感性分析通过比较不同效应模型时合并效应量的点估计值和区间估计的差异变化进行敏感性分析,结果显示,结论均无改变,表明该研究Meta分析结果稳定性良好。
3 讨论
NAFLD是最常见的慢性肝病之一,研究报道20%~25%的NAFLD成人患者在10年内发展为肝硬化,11.3%的NAFLD肝硬化患者在5年内发展为肝细胞癌[43],因此了解NAFLD患者相关血清学指标变化,早期预测及识别疾病严重程度极为重要。本研究运用Meta分析评估铁代谢及氧化应激相关指标在NAFLD患者体内的变化,早期预测及识别疾病严重程度,并明确铁超载及氧化应激与NAFLD关系,为临床治疗提供依据。
本次Meta分析结果显示:(1)NAFLD组患者血清铁、铁蛋白、MDA均明显高于健康对照组,而GSH、红细胞GSH-Px、血清铁调素明显低于健康对照组,提示大部分NAFLD患者体内可能存在铁超载及氧化应激,这与Rametta等[44]的观点一致。(2)NASH患者铁蛋白明显高于NAFL,血清MDA在两者之间差异无统计学意义,而纳入原始数据显示NASH患者血清MDA高于NAFL患者,考虑可能与纳入文献少有关。此外,有研究发现NASH患者血清铁明显高于NAFL患者[7],而GSH和GSH-Px明显低于NAFL患者[42],提示NAFLD患者体内存在明显的铁超载及氧化应激反应,而NASH上述现象更严重。关于铁超载及氧化应激与NAFLD的具体联系,近来有部分研究提出铁超载可能通过Fenton反应产生活性氧诱导脂质过氧化,其中脂质过氧化产物MDA不仅可与蛋白质和DNA反应形成交联的加合物,扩大细胞的损伤,还可诱导刺激M1巨噬细胞发生反应,增强机体相关免疫反应[45],强化免疫介导的肝损伤。机体在正常状态下,GSH-Px可利用还原的GSH作为辅助因子将脂质过氧化物转化为醇,减少上述损伤。机体内铁超载时,体内活性氧自由基产生过多, GSH耗竭,氧化程度超出氧化物的清除,氧化系统和抗氧化系统失衡,导致细胞死亡、组织损伤。
上述过程中生化指标的改变与本次Meta分析指标变化一致,且研究发现在NAFLD患者中肝细胞铁沉积与氧化应激及氧化性DNA损伤密切相关[46-47],对NAFLD患者行静脉放血、去铁螯合剂清除铁的治疗后,其肝功及胰岛素抵抗也明显改善[48],提示铁超载可能参与了NAFLD的发生及进展,氧化应激可能在此过程中扮演了重要的角色。Handa等[49]在动物体内进行实验,发现铁摄入过量及体内铁超负荷会导致肝脏氧化应激进而引发及加重NAFLD也证实了这一点。此外,在临床上也观察到肾脏透析患者使用静脉铁剂疗法后,脂肪肝发生及加重的风险明显增加[50]。然而,有研究提出NAFLD本身的脂肪变性、细胞因子激活和氧化应激,会导致铁过载,而后者又可引起更多的氧化应激和炎症反应,使环境更有利于第三次打击[51]。但无论铁超载和NAFLD发生先后顺序,铁超载似乎在NAFLD发展进程中均发挥了一定的作用,而氧化应激在其中扮演了不可或缺的角色。Dixon等[52]将上述这种铁依赖性的脂质过氧化命名为铁死亡,而GSH耗竭、GSH-Px酶活性下降以及氧化物的积累作为铁死亡的典型生化特征,在本研究结果中被观察到显著存在于NAFLD患者体内,且Maliken等[46]研究发现在NAFLD患者中肝细胞铁沉积与氧化应激及细胞死亡密切相关,可能提示NAFLD与铁死亡有关,但由于目前相关临床研究较少,因此仍需进一步研究证实其具体关系。
本研究对于异质性较高的指标,以样本量、地区行亚组分析后,部分指标异质性下降,对NAFL患者与NASH血清铁蛋白水平行Meta分析时,剔除Malaguarnera等[39]、Manousou等[40]2篇文献后,异质性明显下降,可能与Malaguarnera等[37]纳入NAFLD患者大部分合并2型糖尿病,Manousou等[40]为回顾性研究有关。
本研究结果表明,NAFLD患者体内存在明显的铁超载及氧化应激,且NASH患者中血清铁蛋白水平明显高于NAFL患者,提示铁超载和氧化应激与NAFLD密切相关,且血清铁蛋白可作为NAFLD疾病严重程度的血清标志物,去铁治疗在未来有望成为NAFLD的一种新的治疗策略。
值得注意的是,本研究局限性在于所纳入研究均为横断面及回顾性的临床对照研究,关于铁超载及氧化应激与NAFLD的实质性关系,今后仍需大规模,多中心临床及基础前瞻性研究证实。
