吡格列酮通过AMPK/mTOR/SREBP-1通路抑制SREBP-1活性促进自噬改善代谢相关脂肪性肝病
2022-11-19廖星晨张庆玉吴鹏波谭诗云
廖星晨,田 甜,张庆玉,吕 昂,吴鹏波,谭诗云
武汉大学人民医院消化内科/消化系统疾病湖北省重点实验室,湖北 武汉 430060
代谢相关脂肪性肝病(metabolic associated fatty liver disease,MAFLD),过去称非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD),全球患病率高达25%,是目前世界上最常见的慢性肝病之一[1],且在我国的发病率逐年上升,已成为我国第一大慢性肝病,给社会、患者及其家庭带来巨大负担[2]。MAFLD的发病与胰岛素抵抗、肥胖、糖尿病等代谢性疾病有着紧密的联系[3]。目前临床上有很多患者同时患有2型糖尿病和MAFLD,两者合并发生率为70%~80%[4]。吡格列酮(Pioglitazone,PGZ)是目前临床上常用的噻唑烷二酮类胰岛素增敏剂,其可以通过改善胰岛素抵抗进而改善肝细胞损伤,减少肝脏脂肪细胞数量。有不少研究者将PGZ用于治疗伴或不伴2型糖尿病的MAFLD,取得了较好的疗效[5-7]。自噬现象存在于所有真核细胞内,已被证明在包括能量代谢、生长、衰老等病理生理反应,以及人类疾病,如癌症和神经退行性疾病中发挥重要作用。研究[8]表明,自噬在调节肝脏生理学和平衡肝脏代谢方面也扮演着关键角色,参与了肝脂肪变性、肝炎、肝纤维化、肝硬化、肝癌等肝脏疾病的发生发展。腺苷酸活化蛋白激酶/雷帕霉素靶蛋白(AMPK/mTOR)通路是一条经典的自噬通路,其介导的自噬激活是NAFLD的重要保护机制[9],其下游信号分子甾醇调节元件结合蛋白1(sterol regulatory element binding protein 1,SREBP-1),主要调控脂肪的从头合成途径,在肝脏中参与脂质代谢。有研究[10-11]表明,抗糖尿病药物如二甲双胍和PGZ,可以激活AMPK信号传导。因此,激活AMPK已被作为提高胰岛素敏感性、改善胰岛素抵抗及MAFLD脂质蓄积的重要靶点。本研究利用油酸(oleic acid,OA)构造MAFLD细胞模型,并用PGZ干预,旨在探究PGZ通过AMPK/mTOR通路调节自噬和SREBP-1对MAFLD细胞模型脂质蓄积、凋亡的影响,现将结果报道如下。
1 材料与方法
1.1 材料(1)细胞株: 人肝癌细胞株HepG2(中国科学院干细胞库)。(2)试剂:PGZ(HY-13956)(MCE公司);OA(Sigma公司);油红O(北京索莱宝科技有限公司);mTOR抗体(sc-517464)、p-mTOR抗体(sc-293133)、AMPK抗体(proteintech 66536-1-lg)、p-AMPK(CST#2535)抗体、LC3抗体(CST#12741);p62抗体(proteintech 18420-1-AP)、GAPDH抗体(proteintech 60004-1-lg)、Bcl-2抗体(proteintech 12789-1-AP)、Bax抗体(proteintech 50599-2-Ig);SREBP-1抗体(sc-13551x)。(3)仪器设备:CO2培养箱(德国赛默飞公司);倒置显微镜、正置显微镜(奥林巴斯公司);垂直层流洁净工作台(青岛海尔公司)。
1.2 方法
1.2.1 细胞培养:收到购自中国科学院细胞库的HepG2细胞后,消化传代,用含质量浓度为100 g/L的胎牛血清、1%青链霉素的DMEM高糖完全培养基培养细胞。待细胞密度为80%以上后进行传代,取处于对数生长期的细胞进行后续实验。
1.2.2 CCK-8法检测细胞活力:取对数生长期的HepG2细胞,接种于96孔板中。次日换液,每组分别以0、10、20、30、40、50 μmol/L浓度的PGZ处理。隔日换液加入100 μl不含血清培养基和10 μl的CCK-8试剂,避光孵育1 h后测定450 nm处吸光度值。细胞活力=[(干预组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。
1.2.3 油红O染色:取对数生长期的HepG2细胞,接种于放置了细胞爬片的12孔板中,培养24 h后分为对照组(CON)、OA组(OA:0.6 mmol/L)、PGZ-L组(OA:0.6 mmol/L,PGZ:10 μmol/L)、PGZ-H组(OA:0.6 mmol/L,PGZ:30 μmol/L),分组给药。隔日用4%多聚甲醛固定,油红O染液37 ℃水浴孵育,75%乙醇脱色,苏木精染液染色,脱色封片,正置显微镜下观察脂滴蓄积情况。
1.2.4 Bodipy染色:取对数生长期的HepG2细胞,接种于放置了细胞爬片的12孔板中,置于培养箱中培养,24 h后分组给药(分组同油红O染色),隔日取出12孔板并弃去培养基,用PBS洗1遍。然后用4%多聚甲醛固定20 min,弃去多聚甲醛并用PBS洗3遍,避光条件下每孔加入2 ml的Bodipy工作液(Bodipy原液∶PBS=1∶1 000)染色30 min,然后用PBS洗3遍,再使用DAPI染液染核10 min,PBS洗5遍,用抗荧光淬灭剂封片,正置显微镜下观察。
1.2.5 Western blotting法检测蛋白表达:取对数生长期细胞接种于6孔板中培养,待细胞密度为50%以上,分组(按油红O染色分组)加入药物干预24 h后,弃去培养基,用PBS洗1遍,每孔加入100 μl细胞裂解液进行冰上裂解,用细胞刮刀收集到离心管中并进行超声裂解,然后4 ℃离心,取上清加入Loading buffer,100 ℃煮沸20 min,然后上样电泳、电转,脱脂奶粉室温封闭1 h,4 ℃一抗摇床孵育过夜,隔天回收一抗,PBS清洗3遍,二抗室温孵育1 h,再用PBS清洗3遍,配置显影液,显影成像。
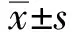
2 结果
2.1 PGZ对HepG2细胞活力的影响采用不同浓度(0、10、20、30、40、50 μmol/L)的PGZ干预HepG2细胞,24 h后检测细胞活力,结果显示,在10~50 μmol/L的浓度范围内,经PGZ处理过后的HepG2细胞活力均在75%以上,在此浓度范围内,PGZ对其无明显细胞毒性(见图1)。
2.2 各组HepG2细胞内脂质蓄积水平油红O染色显示,CON组未见明显脂滴;而OA组可见大量红色脂滴蓄积;经过PGZ干预后,可见红色脂滴明显减少,且相比于PGZ-L组,PGZ-H组脂滴减少更显著(见图2A)。同时Bodipy染色显示,CON组可见少量绿色荧光,而OA组可见呈现绿色荧光的大量脂滴;PGZ-L组和PGZ-H组相较于OA组绿色荧光明显减少,且PGZ-H组减少更为显著(见图2B~2C)。
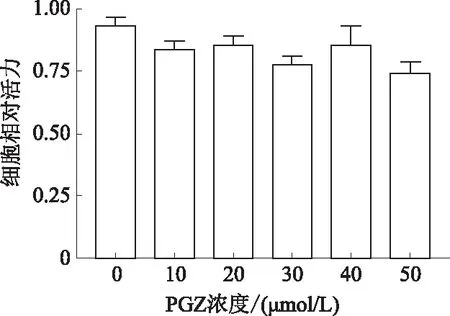
图1 不同浓度PGZ对HepG2细胞活力的影响Fig 1 Effect of different PGZ concentrations on the viability of HepG2 cells
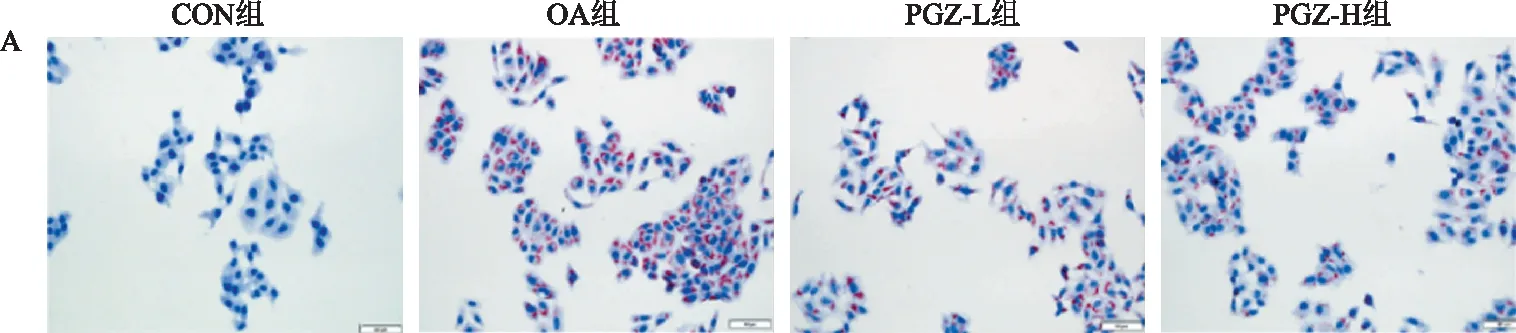
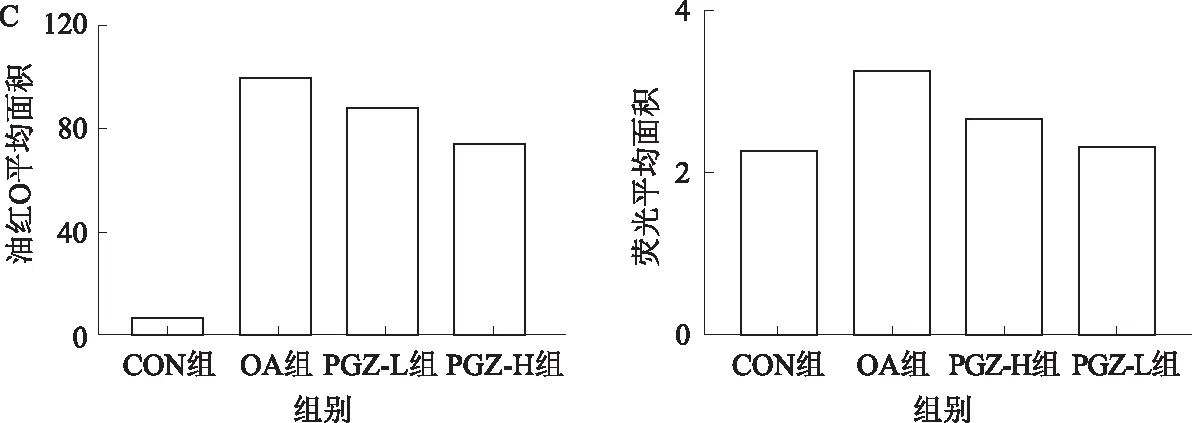
A:油红O染色结果(放大200倍);B:Bodipy染色结果(放大200倍);C:油红O面积及荧光面积统计图。
2.3 各组AMPK及mTOR蛋白磷酸化水平Western blotting结果显示,与CON组比较,OA组AMPK磷酸化程度明显降低,而mTOR磷酸化程度升高,AMPK/mTOR通路被抑制,而在经过PGZ干预后,这种情况被逆转(见图3)。
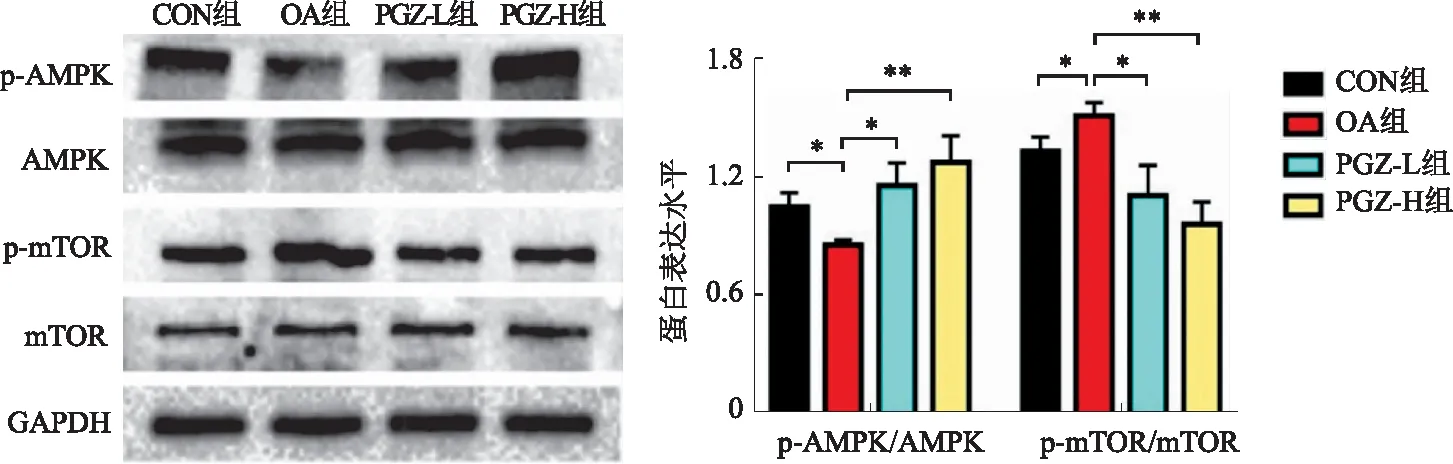
注:*P<0.05,**P<0.01。
2.4 各组SREBP-1蛋白表达水平比较Western blotting结果显示,与CON组比较,OA组SREBP-1蛋白表达水平明显升高;而经过PGZ干预后,这种情况被逆转。与OA组比较,PGZ-L组和PGZ-H组SREBP-1蛋白表达水平降低;且与PGZ-L组比较,PGZ-H组SREBP-1蛋白表达水平降低更显著(见图4)。

注:*P<0.05,**P<0.01。
2.5 各组HepG2细胞内自噬水平比较通过Western blotting法检测各组HepG2细胞中自噬相关蛋白p62和LC3-Ⅱ/Ⅰ的表达情况,与CON组比较,OA组p62蛋白表达水平升高,LC3-Ⅱ/Ⅰ比值降低,自噬通量受损;在经过PGZ干预后,这种情况被逆转,与OA组比较,PGZ-L组和PGZ-H组HepG2细胞p62蛋白表达水平显著降低,而细胞内LC3-Ⅱ/Ⅰ比值显著升高。且与PGZ-L组比较,PGZ-H组LC3-Ⅱ/Ⅰ比值升高,p62水平降低(见图5)。
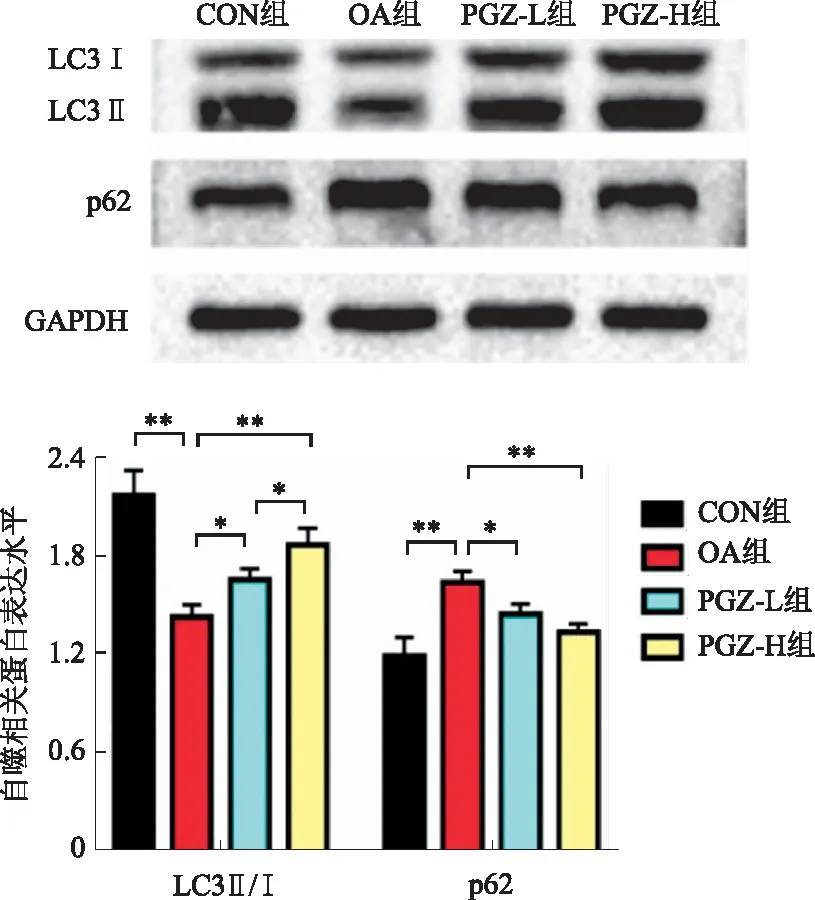
注:*P<0.05,**P<0.01。
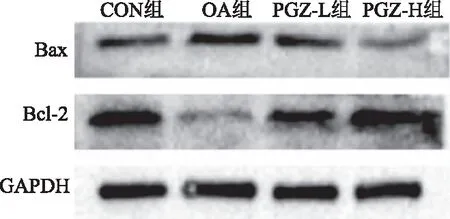
2.6 各组HepG2细胞内凋亡水平比较通过Western blotting法检测各组细胞中凋亡相关蛋白Bax和Bcl-2的表达情况,与CON组比较,OA组Bax蛋白表达水平升高,Bcl-2表达水平降低;在经过PGZ干预后,这种情况被逆转,凋亡水平被抑制;与OA组比较,PGZ-L组和PGZ-H组细胞Bax蛋白表达水平降低,而Bcl-2表达水平显著升高。且与PGZ-L组比较,PGZ-H组Bcl-2水平升高,Bax水平降低(见图6)。
3 讨论
近来,国际专家共识已将疾病名称由NAFLD更改为MAFLD。随着MAFLD定义的更新以及2型糖尿病和肥胖在世界范围内的日益流行,MAFLD的患病率可能会更高。鉴于2型糖尿病和MAFLD的紧密联系,已经有研究人员把目光投入到糖尿病治疗药物上,探究其对MAFLD的治疗效果。噻唑烷二酮类药物PGZ是一种胰岛素增敏剂,在临床上主要应用于2型糖尿病患者。有研究发现,其能改善胰岛素抵抗、脂质代谢和炎症,从而改善MAFLD动物模型的肝脂肪变性[12-13]。针对2型糖尿病患者的研究也显示,与安慰剂相比,PGZ能减轻胰岛素抵抗,发挥降糖及减脂作用,改善肝脏脂肪变性、炎症和纤维化[14-16],这些研究提示了PGZ有治疗MAFLD的潜力。本研究为进一步探究PGZ可能作用于MAFLD的体外作用机制,应用CCK-8法检测PGZ对HepG2细胞活力的影响,发现在10~50 μmol/L范围内,PGZ对HepG2细胞的活力无较大影响。经过预实验及查阅相关文献,选择10、30 μmol/L的PGZ及0.6 mmol/L的OA对细胞模型处理及进行后续实验。
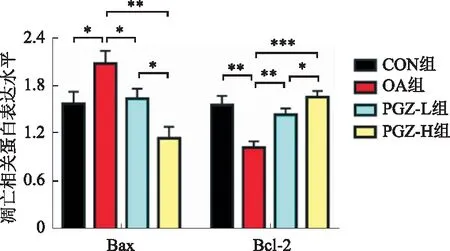
注:*P<0.05,**P<0.01, ***P<0.001。
应用OA造模,从油红O染色及Bodipy荧光染色结果可以看出,OA成功诱导了HepG2细胞内大量的脂滴蓄积,成功构造了MAFLD细胞模型。而经过PGZ干预后,可以显著降低MAFLD细胞模型中的脂滴含量,且相比于PGZ-L组,PGZ-H组的脂滴减少更多,提示PGZ可以改善MAFLD细胞模型的脂质蓄积。为了探究其可能机制,接下来我们运用Western blotting法检测了各组AMPK/mTOR通路蛋白表达情况。AMPK是一种广泛分布于真核细胞的高度保守的丝氨酸/苏氨酸蛋白激酶,是细胞能量状态的主要感受器和维持能量稳态的枢纽。各种类型的代谢应激或ATP消耗可激活AMPK,抑制脂质、蛋白质和碳水化合物的合成,同时激活如葡萄糖代谢和自噬的各种分解代谢过程,从而维持能量平衡[17]。mTOR是一种营养敏感激酶,其作用和它的上游AMPK正好相反。在营养丰富的条件下,mTOR可以促进合成代谢,如刺激蛋白质、脂质和核苷酸的合成,同时阻断分解代谢过程,如抑制自噬,从而促进细胞的生长和增殖。因此,AMPK可以通过抑制mTOR的上述作用来维持能量平衡,从而在治疗某些肝损伤中发挥至关重要的作用。有充分的证据表明,增加AMPK活性可以抑制肝脏中的新生脂肪生成,增加肝脏中脂肪酸氧化及促进脂肪组织中的线粒体功能,从而改善NAFLD[18]。例如研究发现,白桦酸可以通过激活CAMKK/AMPK/mTOR/S6K/SREBP1途径来缓解NAFLD[19]。在本研究中,相比于对照组,MAFLD细胞模型组的p-AMPK/AMPK下调,AMPK被抑制,而经过PGZ干预后这种情况被逆转,p-AMPK/AMPK升高,证明PGZ激活了AMPK活性。
mTOR是哺乳动物自噬通路的主要靶点,自噬是细胞将蛋白质、受损细胞器和其他大分子通过自噬溶酶体消化、自我降解的过程。自噬的失调与包括癌症、神经退行性病变等在内的人类重大疾病有关。另外,自噬可以降解脂滴,又称为噬脂,是自噬参与调节肝脏脂质代谢的主要机制[20],对于调控细胞内脂平衡至关重要。研究[21]表明,高脂饮食或长期脂质积累可能会降低自噬活性,而自噬的激活可以减弱肝脂肪变性。例如He等[22]发现利拉鲁肽可以通过诱导自噬来改善肝脂肪变性并减少肝脂质积累。本研究发现,OA构造的MAFLD细胞模型组相比于对照组,LC3-Ⅱ/Ⅰ比值下降,p-mTOR/mTOR比值和p62蛋白表达升高,自噬通量受损,而经过PGZ处理后,LC3-Ⅱ/Ⅰ比值升高,p-mTOR/mTOR比值和p62蛋白表达下降,自噬被重新激活。
除了自噬外,肝细胞凋亡是MAFLD发生发展的另一个核心因素,因此,我们还检测了凋亡蛋白Bax及Bcl-2的表达水平,发现在MAFLD模型组中,伴随着自噬受损的同时凋亡水平也升高了,Bcl-2蛋白表达明显减少,Bax蛋白表达明显增加。而PGZ处理后这种情况被改善,激活了自噬的同时还抑制了凋亡。因此,我们推测促进自噬抑制凋亡可能是治疗MAFLD的潜在靶点。
脂肪的从头合成途径主要受AMPK/mTOR信号通路的下游分子SREBP-1调控。SREBP-1以SREBP-1a和SREBP-1c两种同工型表达,据研究[23]报道,SREBP-1c控制肝细胞中脂肪酸合成酶和乙酰辅酶A羧化酶1的mRNA表达,从而调控肝细胞中TG的生成和积累。此外,肝脏SREBP-1c在MAFLD患者中高度表达[24]。本研究发现,以HepG2细胞构造的MAFLD细胞模型中,SREBP-1蛋白表达水平升高,脂质合成增加,而PGZ的处理则逆转了OA诱导的SREBP-1高表达,减少了脂质的蓄积,这与我们的油红O染色和Bodipy染色显示的结果一致。
综上所述,我们的研究表明PGZ可能通过激活AMPK/mTOR/SREBP-1通路,下调SREBP-1的表达,促进细胞自噬,抑制凋亡,改善OA诱导的MAFLD细胞模型的脂质蓄积。
