复合微生物制剂对大豆中胰蛋白酶抑制因子发酵处理的参数优化研究
2022-11-17林大彪
林大彪,杨 斌
(长春大学食品科学与工程学院,吉林 长春 130022)
胰蛋白酶抑制因子(KTI)是大豆及其副产物中主要抗营养因子,在各品种大豆中的平均含量约为17.7 mg/g(程慧等,2020),该物质能与糜蛋白酶和胰蛋白酶结合形成复合物,使两种消化酶失活(周天骄等,2015)。在经济动物养殖中,大豆与豆粕中KTI过高会导致饲料中蛋白消化利用率显著下降,破坏营养物质的氮平衡,引起动物腹泻,进而抑制动物生长(姜雷,2019)。同时,过量食用KTI浓度高的食物会导致动物胰腺细胞肿大,增加体内自由基产生使胰腺分泌功能紊乱(刘勇杰,2017),严重时会导致胰腺细胞产生强烈的氧化应激,对细胞产生不可逆损伤(李德发,2019;赵琳琳等,2018)。“玉米-豆粕”型日粮是我国单胃动物养殖中应用最为广泛的日粮类型,在反刍动物养殖中大豆及其副产物是精料组成的重要原料之一,在饲用抗生素禁止使用且氧化锌在日粮中用量减少的背景下,由KTI引起的动物腹泻是降低动物生产性的主要原因之一。因此,本文以大豆为研究材料,使用微生物制剂对大豆粉进行发酵处理,观察其对大豆发酵物中KTI含量的影响,通过筛选最优发酵工艺,对大豆类产品在动物饲料生产与养殖中的深入应用提出新的见解。
1 材料与方法
1.1 主要研究材料 大豆购自中粮集团有限公司,经过粉碎机粉碎后过40目筛,低温冷风烘干,阴凉干燥区域储存,测定大豆中KTI含量,剩余样品待后续试验使用。微生物制剂主要组成为乳酸菌、酵母菌及枯草芽孢杆菌,购自益加益生物工程科技有限公司,具体微生物含量见表1。

表1 微生物制剂中的微生物含量
1.2 主要试剂与仪器
1.2.1 主要试验仪器 双锥回转真空干燥机(SZG型,常州市旭宇环保工程科技有限公司),发酵装置(YD-GA-0.25L型,上海有道生工),粉碎机(40目筛片),匀浆机(FSH-2A,常州金坛良友仪器有限公司),漩涡混合器(UMV-1,北京优晟联合科技有限有限公司),具塞离心管(济南新美康生物技术有限公司),电子称(LS30-08MT型,浙江良石智能技术有限公司),分析天平(上海花潮实业有限公司),微孔板酶标仪(JC-1086A,青岛聚创环集团有限公司)等。
1.2.2 主要检测试剂KTI检测试剂盒(上海酶联生物科技有限公司),KTI标准品(CAS号:9035-81-8),GB/T 6682规定的二级水。
1.3 KTI检测方法 大豆与大豆发酵产物中胰蛋白酶抑制因子的检测方法参考国家市场监督管理总局与国家标准化管理委员会制定的《GB/T 40368-2021植物代谢产物胰蛋白酶抑制因子测定 酶联免疫吸附法》。主要步骤如下:(1)样品前处理:精确称取1.00 g左右大豆粉或者大豆发酵物,置于15 mL具塞离心管中,按照试剂盒要求配制提取物液并对其进行稀释。(2)测定:样品经过处理,样品液KTI与微孔板中KTI抗体结合,清洗为结合的其他成分,再次与KTI抗体结合,加入酶标底物,在酶标仪中使用450 nm波长进行吸光度值测定,以便计算KTI含量。(3)平行试验:对同一标准溶液和样品溶液进行6次平行试验以保证测定结果准确性。(4)空白实验:不称取样品,按照上述步骤进行操作,以进行校准。(5)阳性质控:根据大豆或大豆发酵物KTI含量,选择合适的质控标准,确保试验结果准确性。(6)根据上述步骤所得标准品质量浓度与吸光度变化关系绘制标准工作曲线。(7)根据试剂盒说明,将吸光度值带入标准工作曲线,计算样品液质量浓度(ρ)。(8)样品中KTI的含量计算公式如下:

式中:W为KTI含量,g/mg;ρ为KTI的质量浓度,ng/mL;V为样品液体积,mL;a为在处理过程中样品液稀释倍数;m样品的精确称样量,g。
1.4 试验设计
1.4.1 单因素试验 在本研究中,主要考察微生物制剂添加量、发酵温度、料水比对大豆发酵产物KTI含量的影响。初始发酵工艺参数设定为:按照1 kg大豆粉加入0.2 g微生物制剂的添加量将微生物制剂与大豆粉混匀,料水比控制为1.0:0.8,发酵温度为30℃,然后根据复合微生物制剂厂家提供的使用说明,将发酵时间固定为3 d并置于阴凉、避光条件下。发酵完毕,将大豆发酵物取出,低温烘干后测定KTI含量。
依据初始发酵工艺参数,按照单因素轮换法,保持料水比为1.0:0.8、发酵温度30℃,依次考察1 kg大豆中分别加入0.1、0.2、0.3、0.4、0.5 g微生物制剂对大豆发酵物中KTI含量的影响;然后,保持微生物制剂接种量为0.2 g/kg、发酵温度为30℃,依次考察料水比为1.0:0.7、1.0:0.8、1.0:0.9、1.0:1.0、1.0:1.1对大豆发酵物KTI含量的影响;最后,保持微生物制剂接种量为0.2 g/kg、料水比为1.0:0.8,依次考察发酵温度25、30、35、40、45℃对大豆发酵物中KTI含量的影响。通过单因素轮换法获得,3种因素的最优参数所处范围,然后进行下一步正交试验。
1.4.2 正交试验 根据单因素试验KTI检测结果,筛选各项参数对KTI影响的最优范围,进行正交试验,以KTI含量最低为优化目标获得最佳工艺参数。单因素试验与正交试验均重复测定3次,取平均值。
1.4.3 方法学考察与验证 根据正交试验所得最佳工艺参数,进行6次平行试验确定大豆发酵物中KTI含量及其稳定性,同时对比大豆与大豆发酵物中其他抗营养因子(大豆球蛋白、β-伴大豆球蛋白)含量。大豆球蛋白与β-伴大豆球蛋白使用酶联免疫吸附法测定,检测试剂盒购自上海酶联生物科技有限公司。
1.5统计与分析 所有试验数据使用Excel软件进行初步整理,再通过SPSS 2021软件进行正交试验设计,并对正交试验结果进行方差分析和极差分析。使用t检验统计大豆与大豆发酵物中抗营养因子含量显著性,试验数据以“平均值”或“平均值±标准误”形式表示。
2 结果与分析
2.1 大豆原料中KTI含量测定结果 由表1可知,大豆原料KTI平均含量为16.49 mg/g,并且变异系数CV值为0.26%,说明本试验中所购的大豆原料KTI指标稳定、原料一致性较好,可进行后续试验。
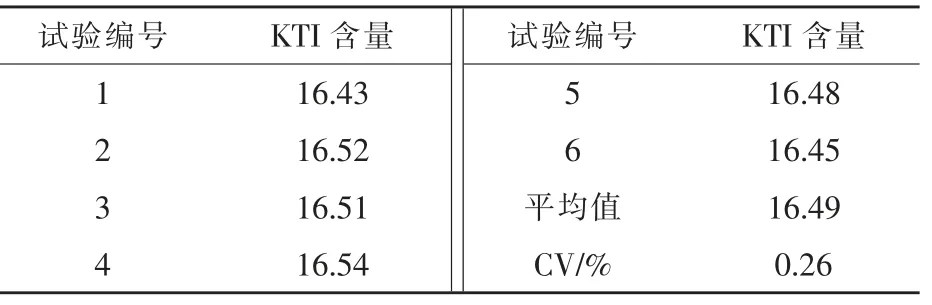
表1 大豆原料中KTI含量 mg/g
2.2 单因素试验结果与分析
2.2.1 微生物制剂接种量对KTI含量的影响由图1可知,随着微生物制剂接种量的增加,KTI在大豆发酵物中含量呈先降低而后上升的趋势。在接种量为0.3 g/kg时,KTI含量最低,为4.23 mg/g。当超过0.3 g/kg的接种量时,KTI浓度缓慢上升,以KTI浓度最低为优化目标可以认为最佳微生物制剂接种量为0.2~0.4 g/kg。
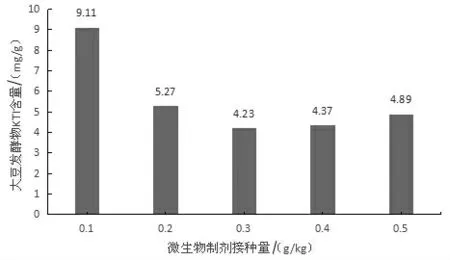
图1 微生物接种量对大豆发酵物中KTI含量的影响
2.2.2 料水比对KTI含量的影响 由图2可知,随着料水比下降,发酵物中KTI含量越低。当料水比为1.0:1.0时,KTI含量最低,为3.65 mg/g。此后,发酵物中KTI含量随着料水比的下降有一定程度上升,因此根据结果可认为料水比最佳范围处于1.0:0.9至1.0:1.1。

图2 料水比对大豆发酵物中KTI含量的影响
2.2.3 发酵温度对KTI含量的影响 由图3可知,随着发酵温度的上升,大豆发酵物中KTI含量先递减然后再大幅度上升,当发酵温度为35℃时,KTI含量最低,为2.23 mg/g。根据测定结果可以认为,最佳发酵温度为30~40℃。

图3 发酵温度对大豆发酵物中KTI含量的影响
2.3 最优生产工艺的确定
2.3.1 正交分析结果 根据单因素试验结果,本研究将发酵时间固定为3 d,然后以微生物制剂接种量、料水比和发酵温度为主要考察因素进行正交分析。正交分析各项因素与水平依据单因素结果设定(表2)。
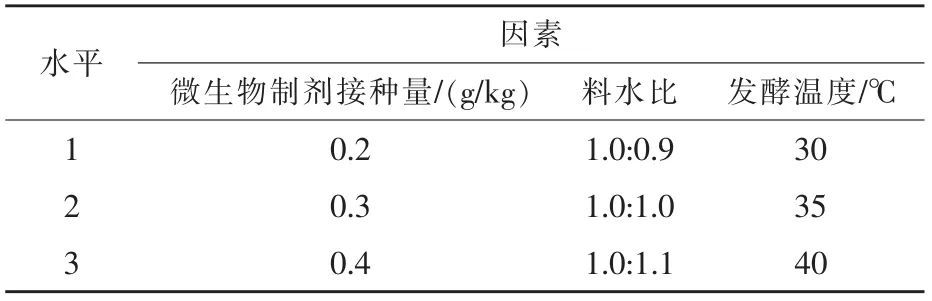
表2 正交试验的因素与水平
使用SPSS软件生成正交分析表(表3),根据正交试验表按照指定工艺参数进行发酵,并对发酵物KTI含量进行测定。由方差分析结果可知(表4),料水比对发酵物中KTI含量影响显著(P<0.05),发酵温度对发酵物中KTI含量影响极显著(P<0.01)。极差分析表明接种量、料水比、发酵温度的R值分别为0.57、0.71、195,R值越大对KTI含量的影响程度越高,因此可以判定3种因素的重要性排序从高到低依次为发酵温度>料水比>微生物接种量。以KTI最低为优化目标,根据值,可认为在发酵时间固定为3 d条件下,最佳发酵参数为微生物接种量0.3 g/kg、料水比1.0:1.0,发酵温度35℃。
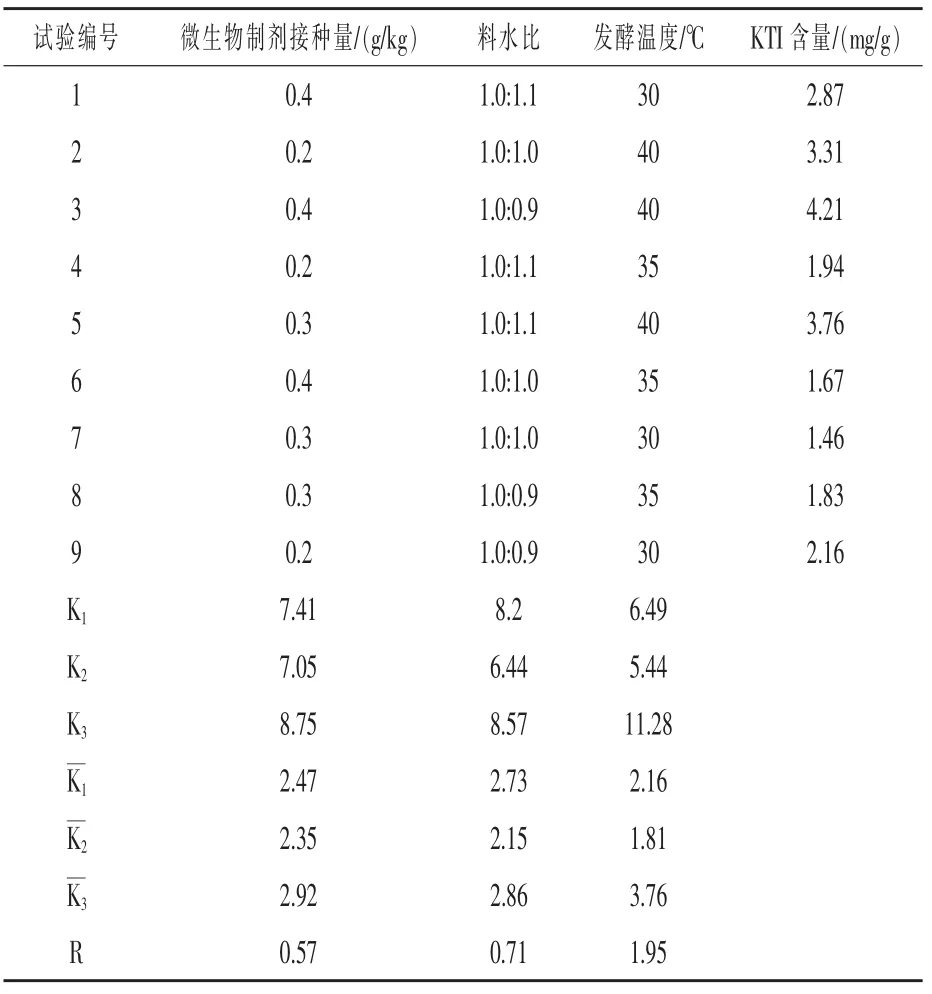
表3 正交试验与极差分析结果

表4 方差分析结果
2.3.2 最优工艺参数条件下大豆发酵物KTI含量测定 根据上述最佳工艺参数,连续进行6次平行试验,所得大豆发酵物中KTI平均含量约为1.3167mg/g,比大豆原料中KTI含量下降约92.01%(表5),并且该工艺参数下CV值低于5%,说明在该工艺参数下,可稳定地生产KTI含量较低的发酵大豆用于饲料生产。
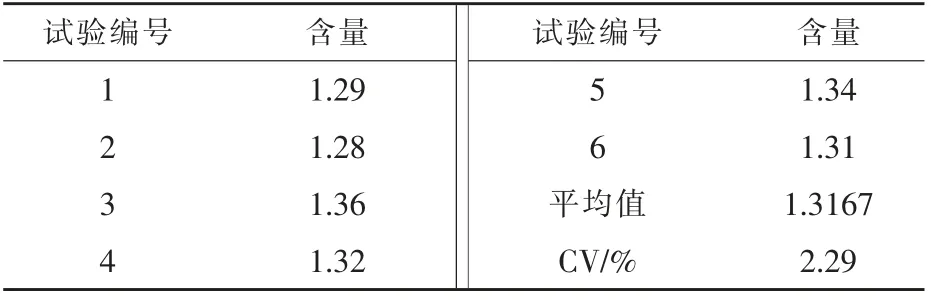
表5 大豆发酵物中KTI含量 mg/g
2.3.3 大豆与大豆发酵物中抗营养因子的含量大豆与大豆发酵物中抗营养因子中KTI、大豆球蛋白、β-伴大豆球蛋白含量差异如表6所示。尽管本研究是以KTI含量最低为优化目标,但在最佳发酵工艺参数下发酵物中大豆球蛋白和β-伴大豆球蛋白含量分别比大豆下降81.27%和75.07%。
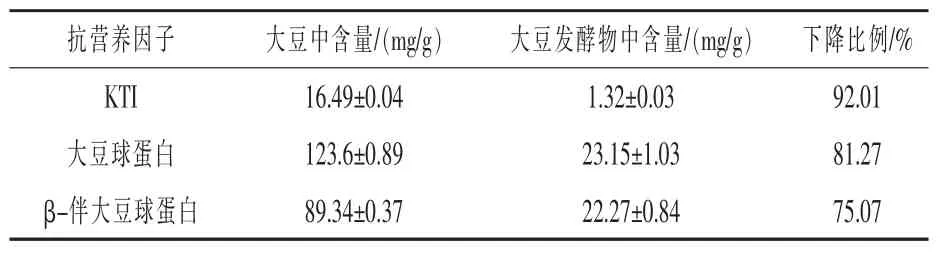
表6 大豆与大豆发酵物中抗营养因子差异
3 讨论
KTI是大豆中含量较高的抗营养因子之一,降低豆类产品中KTI是对于饲料和食品行业的重要研究内容(Bendre等,2019)。饲粮工业发展早期依靠加热对豆类原料中KTI进行处理,但该方法适用性较差(Ascenzi等,2003),温度不够易导致胰蛋白酶抑制因子去除不彻底,温度过热易破坏饲料中维生素、氨基酸等营养成分,并且蛋白质会在加热过程中出现“美拉德反应”,导致蛋白消化利用率下降,可能造成幼龄动物消化不良进而导致腹泻的出现(包健等,2015)。乳酸菌、酵母菌和枯草芽孢菌等微生物可将KTI作为养分用于自身增殖代谢,因此对各类原料中的KTI均有降解作用(王小明等,2017),但单一微生物发酵对KTI降解的作用有限,如枯草芽孢杆菌对豆类饲料原料发酵,其中KTI降解率最高仅为63.12%(梁运祥等,2010),目前复合微生物制剂用于豆类产品发酵应用更为广泛。研究认为微生物在增殖过程中存在竞争关系,当竞争过于剧烈会降低发酵效果(马艳娟,2021;彭翔等,2020;吴金男等,2015),这可能是本研究中微生物制剂接种量提升,而KTI含量先降低而后小幅度升高的原因。水分含量适中是合理发酵的基础,过高的水分容易使降解KTI必要的物质过于分散而导致发酵效果较差,而水分含量过低容易使空气进入影响微生物增殖(周苗苗等,2015;孙合美等,2014)。而发酵温度对于微生物存活与增殖代谢有重要关联(李春梅等,2022;陈倩倩等,2020;杨晓婷等,2020),微生物在最适温度下增殖速度最高,对KTI代谢速率也会有显著提升。尽管本研究以降低KTI为目标对发酵工艺参数进行优化,但在后续的检测结果中发现复合微生物制剂对大豆中大豆球蛋白与β-伴大豆球蛋白抗营养因子同样具有降解作用。研究表明,微生物发酵是有效降解豆类饲料原料中抗营养因子的重要途径之一(李英英等,2022;姚怡莎等,2015),但目前的研究鲜见有微生物发酵过程中对抗营养因子降解的偏好有明确报道。尽管在实际饲料生产中对大豆进行膨化是最为常见的去除抗营养因子的手段,但这种方法仅对热敏性抗营养因子有较好的作用,微生物降解抗营养因子的优势在于对不同类别的抗营养因子均具有降解作用,效率远高于膨化处理(花蕴等,2020)。
4 结论
本试验结果表明,复合微生物制剂在发酵时间固定为3 d时,微生物接种量0.3 g/kg,料水比1.0:1.0,发酵温度35℃为大豆发酵的最佳工艺参数,此时大豆发酵物中KTI含量最低,为1.3167 mg/g,并且大豆球蛋白和β-伴大豆球蛋白含量显著下降。因此本研究认为通过微生物复合制剂发酵大豆可以有效减少大豆中抗营养因子的含量,对提高畜禽生产和饲料消化利用率有重要作用。
