大豆球蛋白和β-伴大豆球蛋白的富集分离研究
2016-01-03王昱婷王笑宇
王昱婷 王笑宇 许 晶
大豆球蛋白和β-伴大豆球蛋白的富集分离研究
王昱婷 王笑宇 许 晶
(东北农业大学理学院,哈尔滨 150030)
以低温脱脂豆粕为原料,采用优化Nagano法分离大豆球蛋白和β-伴大豆球蛋白。本文系统考察提取过程中多个单因素对分离大豆球蛋白和β-伴大豆球蛋白的蛋白质含量和提取率的影响。并根据单因素试验结果设计响应面试验,对浸提温度、浸提pH、沉淀剂用量进行优化,分别确定高提取率大豆球蛋白和β-伴大豆球蛋白的分离条件。试验结果表明:大豆球蛋白的最佳提取条件为浸提温度44.4℃,浸提pH 8.5,CaCl220 mmol/L,提取率64.14%,纯度83.6%;β-伴大豆球蛋白的最佳提取条件为浸提温度49.5℃,浸提pH 8.6,CaCl20.00 mmol/L,提取率40.15%,纯度82.9%。
大豆球蛋白 β-伴大豆球蛋白 富集 分离
大豆蛋白作为一种重要的植物蛋白,具有优良的功能性质和较高的营养价值,被广泛应用于食品工业中。按照沉降模式,大豆蛋白可分为4个主要的组分:2S、7S、11S 和15S[1-2],其中11S 的成分是大豆球蛋白,即11S球蛋白;7S的主要成分是β-伴大豆球蛋白,即7S球蛋白。大豆球蛋白和β-伴大豆球蛋白二者结构不同,在理化性质、营养价值和功能特性方面均有很大差异[3]。因此,如何从大豆蛋白中高效分离这两种组分是研究者关注的重点。
目前,Thanh 法[4]、Saio 法[5]和Nagano 法[6]是分离大豆球蛋白和β-伴大豆球蛋白的3种主要方法。在这3 种方法的基础上,王孝英等[7]、段春红等[8]、朱晓烨等[9]、姜剑等[10]、宋佳等[11]不断改进和完善试验方法,简化了分离步骤,提高了产品的纯度。但结合Thanh法、Saio法、Nagano法3种经典方法,在保证一定蛋白质含量的基础上,单独的分别确定大豆球蛋白和β-伴大豆球蛋白高提取率的系统优化鲜见报道。
本研究采用优化Nagano法分离大豆球蛋白和β-伴大豆球蛋白,基于Thanh法和Saio法加入沉淀剂,系统考察浸提温度、浸提pH、沉淀剂用量对分离大豆球蛋白和β-伴大豆球蛋白的蛋白质含量和提取率的影响。在保证一定蛋白质含量的基础上,根据单因素试验结果设计响应面试验,对浸提温度、浸提pH、沉淀剂用量进行优化,为分别得到高收率的大豆球蛋白和β-伴大豆球蛋白的分离方法提供依据。
1 材料与方法
1.1 材料与试剂
低温脱脂豆粕:哈高科;NaOH、SBS(NaHSO3)、NaCl、HCl、电泳试剂盒、Tris 碱、甘氨酸、SDS(十二烷基硫酸钠)、考马斯亮兰R250、冰乙酸、甲醇、溴酚蓝、DTT、硫酸铜(CuSO4)、硫酸钾(K2SO4)、浓硫酸(H2SO4)、硼酸、碳酸钠、甲基红、溴甲酚绿,均为分析纯。
1.2 仪器与设备
FW100型高速万能粉碎机:天津市泰斯特仪器有限公司;HSY2-SP电热恒温水浴锅:北京市永光明医疗仪器厂;ZD-2型自动电位滴定仪:上海精密科学仪器有限公司;LNK-872型多功能快速消化器:江苏省宜兴市科教仪器研究所制造;自动凯氏定氮仪:济南海能仪器有限公司。
1.3 试验方法
1.3.1 脱脂大豆粉的制备
将低温脱脂大豆粕经高速万能粉碎机粉碎,过50目筛,得低温脱脂大豆粉。
1.3.2 大豆球蛋白和β-伴大豆球蛋白的分离方法
采用优化Nagano法[6]分离大豆球蛋白和β-伴大豆球蛋白,分离流程图见图1。
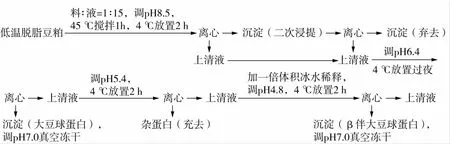
图1 大豆球蛋白和β-伴大豆球蛋白分离流程图
蛋白提取率=(冻干粉中蛋白含量×冻干粉质量)/(脱脂豆粉中的蛋白含量×脱脂豆粉质量)×100%
1.3.3 单因素试验
通过3组单因素试验考察浸提温度(25、35、45、55、65 ℃)、浸提pH(8.0、8.5、9.0)、沉淀剂用量(0、5、10、20、30 mmol/L)对分离大豆球蛋白和β - 伴大豆球蛋白的蛋白质含量及提取率的影响。
1.3.4 响应面试验
根据单因素试验的结果,采用响应面分析以浸提温度、浸提pH、沉淀剂用量为试验因素,分别以大豆球蛋白和β-伴大豆球蛋白提取率为指标,设计三因素三水平的Box-Behnken试验。
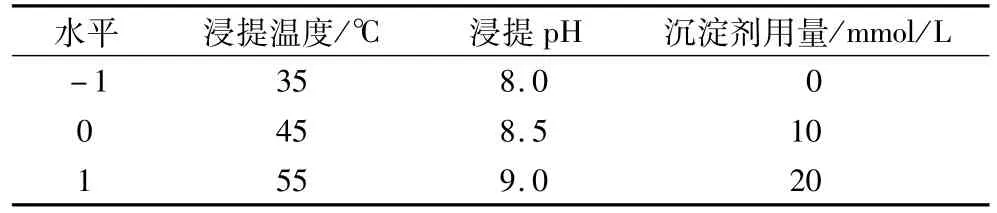
表1 响应面试验因素水平表
1.3.5 SDS-聚丙烯酰胺凝胶电泳测定分析
根据Laemmli法[12]的SDS-PAGE 不连续电泳方法,分别配制5%的分离胶,12%的浓缩胶,上样量为10μL。开始电泳时电压为80 V,样品到达分离胶后改为120 V,电泳结束后,取出胶片用考马斯亮蓝R-250染色,然后用甲醇/冰醋酸脱色后对电泳图谱进行分析。
1.3.6 结果分析
根据凯氏定氮法[13]进行蛋白质含量分析,采用BandScan 5.0软件进行SDS-PAGE分离效果和蛋白组分纯度分析,采用Microsoft Office Excel 2007和Design-Expert 8.0.6软件进行统计分析。
2 结果讨论
2.1 单因素试验
2.1.1 浸提温度的确定
较高的温度有利于蛋白溶出,但过高的温度又会造成蛋白变性。Riblett等[2]报道大豆球蛋白和β-伴大豆球蛋白的最初变性温度接近82℃和68℃。因此本试验浸提温度选择25~65℃。随着温度升高大豆球蛋白和β-伴大豆球蛋白的蛋白质含量和提取率先增加后减少(除65℃ β-伴大豆球蛋白提取率),在45℃时最高。65℃ β-伴大豆球蛋白提取率又出现上升,这可能是由于浸提温度升高蛋白质变性并产生热聚集导致的。

表2 浸提温度对大豆球蛋白和β-伴大豆球蛋白的蛋白质含量及提取率的影响
2.1.2 浸提pH的确定
Than法的浸提pH是8.0。但大豆球蛋白的基本亚基的等电点是8.0~8.5,较低的pH值(低于8.0)对于基本亚基的提取是不利的[14]。因此,进一步考察浸提pH是必要的,试验结果见表3。在pH 8.5的条件下提取大豆球蛋白和β-伴大豆球蛋白的蛋白质含量和提取率最高,选择浸提pH 8.5。
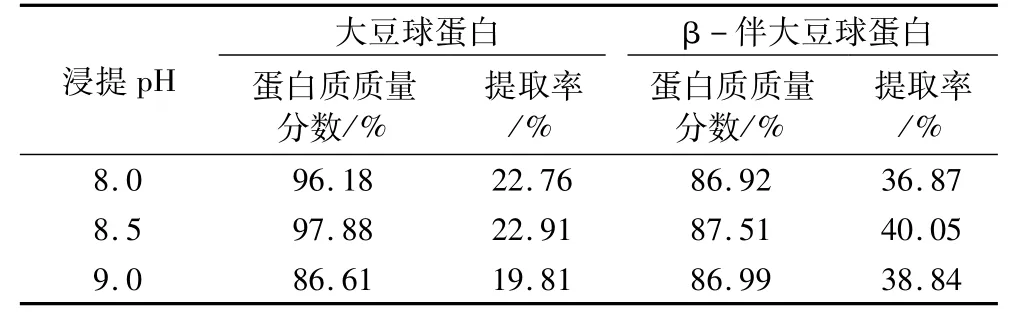
表3 浸提pH对大豆球蛋白和β-伴大豆球蛋白的蛋白质含量及提取率的影响
2.1.3 沉淀剂用量的确定
钙盐沉淀法[15]可用于提取大豆球蛋白和β-伴大豆球蛋白,试验考查了0~30 mmol/L CaCl2沉淀剂对提取结果的影响,试验结果见表4。随着沉淀剂用量的增加,大豆球蛋白和β-伴大豆球蛋白的蛋白质含量下降,且分别保证在80%和65%以上,可以用于一定的性质测定;但大豆球蛋白的提取率从0~10 mmol/L CaCl2明显增加,然后10 ~ 30 mmol/L CaCl2趋于平缓,β-伴大豆球蛋白的提取率随之从0 ~10 mmol/L CaCl2明显下降,这与Zi等[16]研究结论一致,然后10~30 mmol/L CaCl2趋于平缓。因此,10 mmol/L CaCl2沉淀剂的加入与否对大豆球蛋白和β-伴大豆球蛋白的提取率有很大影响。

表4 沉淀剂用量对大豆球蛋白和β-伴大豆球蛋白的蛋白质含量及提取率的影响
2.2 大豆球蛋白和β-伴大豆球蛋白提取率的响应面分析
响应面试验设计方案及试验结果见表5。
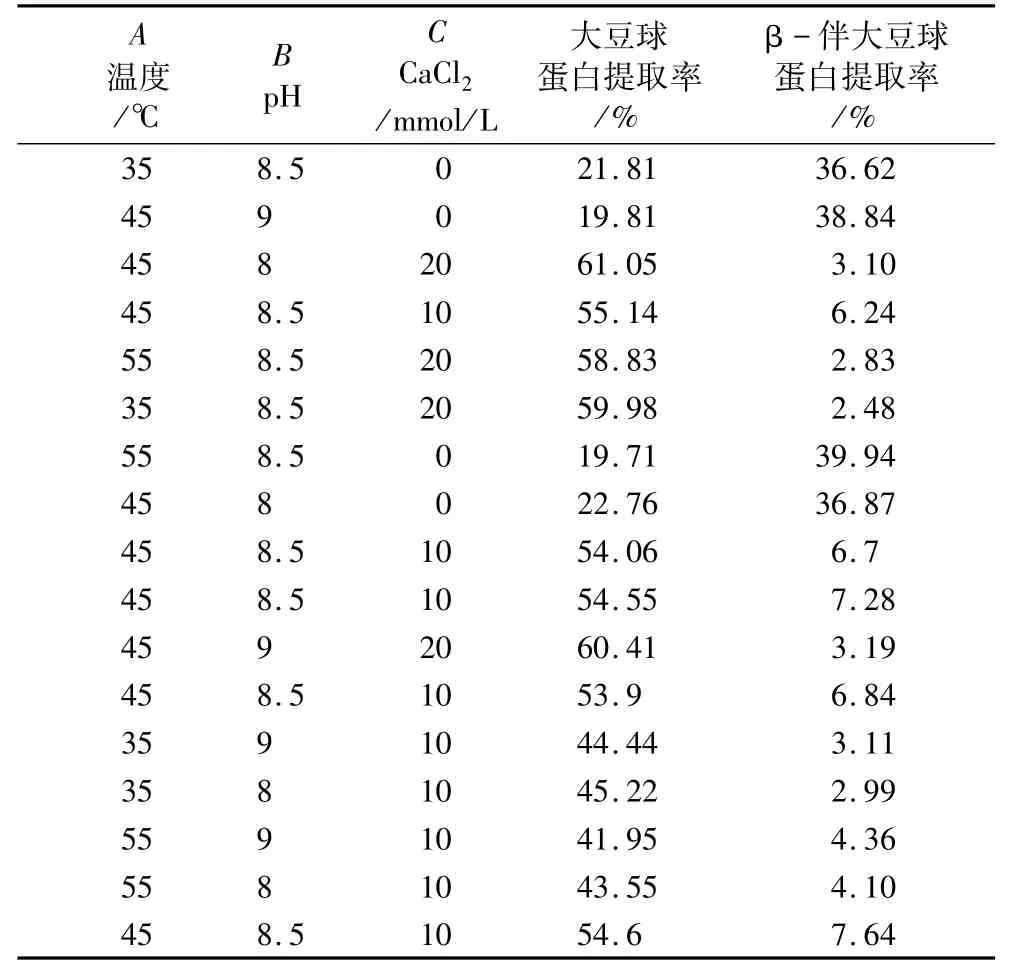
表5 大豆球蛋白和β-伴大豆球蛋白提取率的响应面设计与试验结果
使用Design-Expert 8.0.6软件对所得试验数据进行回归分析,可以得到如下的回归方程:
大豆球蛋白=54.45 -0.93A -0.75B +19.52C -0.20AB +0.24AC +0.58BC -5.79A2-4.87B2-8.58C2
β-伴大豆球蛋白=6.94+0.75A+0.31B -17.58C +0.035AB - 0.74AC - 0.47BC - 1.67A2-1.63B2+15.19C2
对试验数据进行方差分析,分析结果见表6。大豆球蛋白和β-伴大豆球蛋白模型P>F小于0.000 1,说明该模型是极显著的。此外在模型中的其他参数A、B、C、BC、A2、B2、C2都是显著的(P > F 小于0.05)。模型失拟项Lack of Fit(P >F 大于0.05),说明模型失拟项是不显著的,结果表明该模型选择合适;相关系数均大于0.9,说明模型拟合程度良好;大豆球蛋白模型的变异系数为1.04,β-伴大豆球蛋白模型的变异系数为4.42,表示所得的模型方程可以反映真实的试验值。通过上述分析,可知能用该模型来分析大豆球蛋白和β-伴大豆球蛋白提取率的变化。
经过表6的回归分析,可以得出浸提温度A、浸提pH B、沉淀剂加入量C三因素对考察指标交互作用影响,采用响应面分析法,得到大豆球蛋白预测的最佳提取条件为浸提温度44.41℃,浸提pH 8.49,CaCl220 mmol/L,提取率65.42%;β-伴大豆球蛋白预测的最佳提取条件为浸提温度49.51℃,浸提pH 8.62,CaCl20.00 mmol/L,提取率40.15%。由于表5响应面设计中,不包含分析得到的最佳提取条件,需要检验响应面法所得结果的可靠性。本试验结合实际操作情况,根据优化条件对大豆球蛋白和β-伴大豆球蛋白提取条件进行修正,大豆球蛋白提取条件修正为浸提温度44.4℃,浸提pH8.5,CaCl2
20 mmol/L,β-伴大豆球蛋白提取条件修正为浸提温度49.5 ℃,浸提pH 8.6,CaCl20.00 mmol/L,然后进行提取测得大豆球蛋白蛋白质量分数81.64%,提取率为64.14%,β-伴大豆球蛋白蛋白质量分数86.84%,提取率为40.15%,与回归方程预测值基本吻合,表明模型是合理有效的。
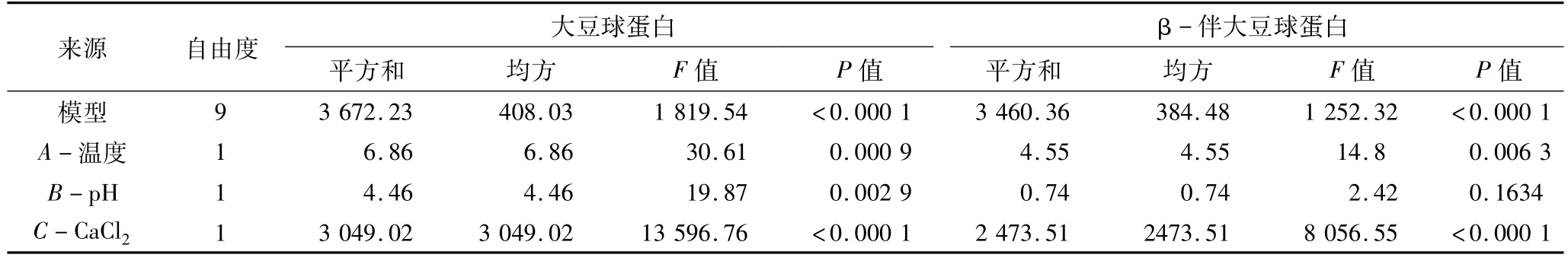
表6 大豆球蛋白和β-伴大豆球蛋白响应面方差分析
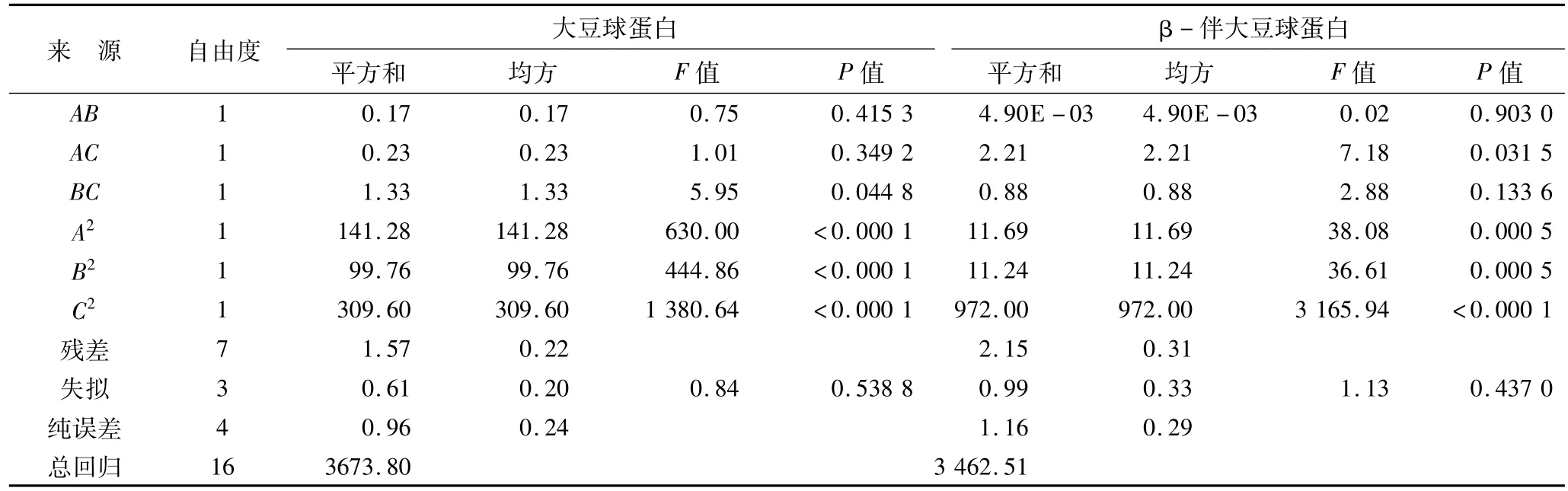
表6 (续)
2.3 不同方法分离大豆球蛋白和β-伴大豆球蛋白效果的比较
SDS-PAGE凝胶电泳技术测定Saio法、Thanh法、Nagano法、优化Nagano法分离出大豆球蛋白和β-伴大豆球蛋白,比较蛋白分离效果和纯度,其SDS-PAGE图见图2。根据电泳图谱,用凝胶分析软件(BandScan5.0)对SDS-PAGE电泳图像中的条带进行含量分析,分析结果列于表7。
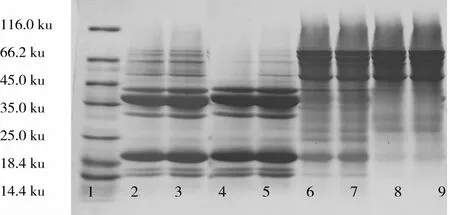
图2 不同方法分离大豆球蛋白β-伴大豆球蛋白电泳图
4种方法的大豆球蛋白组分和β-伴大豆球蛋白组分亚基组成和含量不同。由图3、表7可知,Saio法分离的β-伴大豆球蛋白组分与大豆球蛋白组分并未完全分开,而Thanh法分离效果较好,Nagano方法分离效果最好,纯度更高,本试验优化后方法,大豆球蛋白分离纯度没有Nagano高,这可能是由于沉淀剂CaCl2的加入,但在蛋白质含量和大豆球蛋白分段含量一定下,提取率较高,可以用于后续性质测定。
结果统计表明,该大豆球蛋白组分中大豆球蛋白纯度为83.6%,β-伴大豆球蛋白组分中β-伴大豆球蛋白纯度82.9%。采用优化Nagano法分离大豆球蛋白和β-伴大豆球蛋白得到样品的纯度较高,基本达到了预期的效果。
3 结论
本研究在Thanh法、Saio法和Nagano法3种提取大豆球蛋白和β-伴大豆球蛋白的主要方法基础上,通过单因素试验和响应面试验优化了大豆球蛋白和β-伴大豆球蛋白的分离方法,优化的Nagano法提高了大豆球蛋白和β-伴大豆球蛋白的提取率(大豆球蛋白可达64.14%和β-伴大豆球蛋白可达40.15%),且纯度为大豆球蛋白83.6%和β-伴大豆球蛋白82.9%,为进一步的实际生产提供了参考。
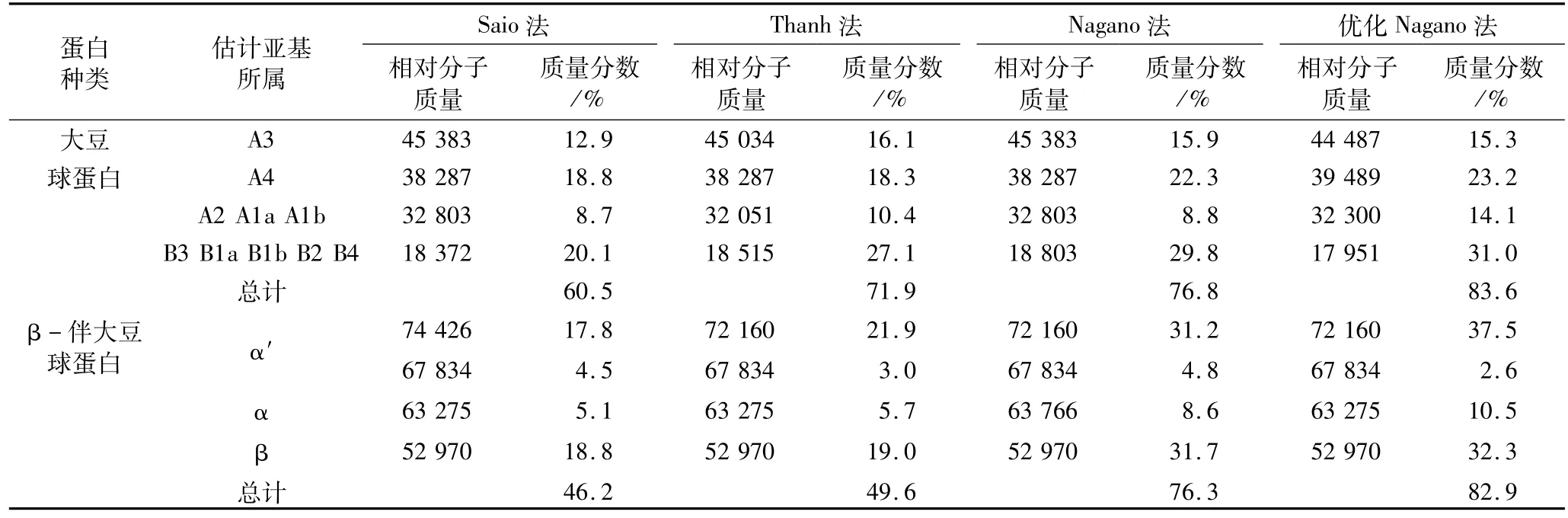
表7 大豆球蛋白中亚基含量分析
[1]Mujoo R,Trinh D T,Ng P K W.Characterization of storage proteins in different soybean varieties and their relationship to tofu yield and texture[J].Food Chemistry,2003,82:265 -273
[2]Riblett R C,HeraldT J,Schmidt K A,et al.Characterization ofβ-conglycinin and glycinin soy protein fractions from four selected soybean genotypes[J].Journal of Agricultural and Food Chemistry,2001,49:4983 -4989
[3]Utsumi S,Kinsella J E.Structure - function relationship in food proteins,subunit interactions in heat- induced gelation of 7S,11S,and soy isolate proteins[J].Journal of Agricultural and Food Chemistry,1985,33:297 -303
[4]Thanh V H,Shibasaki K.Major proteins of soybean seeds.A straightforward fraction and their characterization[J].Journal of Agricultural and Food Chemistry,1976,24:1117 -1121
[5]Saio K,Watanabe T.Food use of soybean 7Sand 11Sproteins(extraction and functional properties of their fractions)[J].Journal of Food Science,1973,38(7):1139 -1145
[6]Nagano T,Hirotsuka M,Mori H.Dynamic viscoelastic study on the gelation of 7S globulin from soybeans[J].Journal of Agricultural and Food Chemistry,1992,40:941 -944
[7]王孝英,张雪旺,刘汉灵.7S和11S大豆球蛋白的分离研究[J].中国食品添加剂,2006,32(3):74 -77,43
Wang Xiaoying,Zhang Xuewang,Liu Hanling.Studies on the separation of 7Sand 11Sglobulin in soybean protein[J].China Food Additives,2006,32(3):74 -77,43
[8]段春红,孙婉,姚晓琳,等.Thanh法提取7S、11S球蛋白功能特性的研究[J].食品工业科技,2011,32(7):79 -82
Duan Chunhong,Sun Wan,Zhao Xiaolin,et al.Study on functional properties of 7S and11S globulin extracted by Thanh method[J].Science and Technology of Food Industry,2011,32(7):79 -82
[9]朱晓烨,迟玉杰,刘红玉.大豆蛋白7S和11S组分分离方法的优化[J].食品工业科技,2011,32(7):267 -269
Zhu Xiaoye,Chi Yujie,Liu Hongyu.Optimization of separation method of 7S and 11S in soy protein[J].Science and Technology of Food Industry,2011,32(7):267 -269
[10]姜剑,迟玉杰,孙艳梅,等.分离β-伴大豆球蛋白和大豆球蛋白工艺研究[J].食品科学,2011,32(6):11 -15
Jiang Jian,Chi Yujie,Sun Yanmei,et al.An Investigation into the Separation Process forβ-Conglycinin and Glycinin[J].Food Science,2011,32(6):11 -15
[11]宋佳,陈野,郑晓晨,等.大豆11S和7S球蛋白提取工艺优化研究[J].食品研究与开发,2013,34(2):77 -81
Song Jia,Chen Ye,Zheng Xiaochen,et al.Study on Extraction Process Optimization of Soybean 11 Sand 7 SGlobulin[J].Food Research and Development,2013,34(2):77 -81
[12]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680 -685
[13]AACC.Crude protein - micro Kjeldhal method.In approved methods of the AACC(Vol- II,10th ed.).2000,AACC method,46 -13
[14]Silvana P,Maria C A.Soy protein isolate components and their interactions[J].Journal of Agricultural and Food Chemistry,1995,43:1762 -1767
[15]郭庆启,张娜,赵新淮.基于钙离子诱导的大豆蛋白分级技术[J].农业机械学报,2009,40(11):161 -164
Guo Qingqi,Zhang Na,Zhao Xinhuai.Fractionation of soybean proteins based on technique of Ca2+inducedprecipitation[J].Transactions of the Chinese Society for Agricultural Machinery,2009,40(11):161 -164
[16]Zi T,Liu X Q,Lin L.Fractionation of soybean globulins using Ca2+and Mg2+:a comparative analysis[J].Journal of the American Oil Chemists Society,2009,86:409 -417.
Enrichment and Separation Study on Glycinin and β-conglycinin
Wang Yuting Wang Xiaoyu Xu Jing
(College of Science,Northeast Agricultural University,Haerbin 150030)
Based on low - temperature defatted soybean meal as raw material,this paper adopted the method of optimization of Nagano for separation of glycinin andβ-conglycin.This paper studied effect of the multiple single factors on protein content and extraction yield of glycinin andβ-conglycin in the process of extraction.According to the results of single factor experiment,we designed response surface experiments,and the extraction temperature,extraction pH and amount of precipitant were optimized.We had respectively determined the separation conditions for glycinin andβ-conglycin with high extraction yield.The experimental results showed that the optimum extraction conditions of glycinin were extraction temperature of 44.4 ℃,extraction pH of 8.5,CaCl220 mmol/L,the extraction yield of 64.14%and purity of 83.6%;the optimum extraction conditions of ptionglycin were extraction temperature of 49.5 ℃,extraction pH of 8.6,CaCl20.00 mmol/L,the extraction yield of 40.15%and purity of 82.9%.
glycinin,β - conglycin,enrichment,separation
TS209
A
1003-0174(2016)08-0024-06
国家自然科学基金(31301600),中国博士后特别资助(2014T70306),哈尔滨市应用技术研究与开发项目(2014RFQXJ123),黑龙江省教育厅科学技术研究项目(12541008)
2014-12-11
王昱婷,女,1989年出生,硕士,植物蛋白工程
许晶,女,1979年出生,副教授,粮食、油脂与植物蛋白工程
