含硫正离子聚类肽水凝胶的合成与性能
2022-11-15颜舒婷姚远陶鑫峰林绍梁
颜舒婷,姚远,陶鑫峰,林绍梁
(华东理工大学材料科学与工程学院,上海市先进聚合物材料重点实验室,上海 200237)
水凝胶具有水含量高、生物相容性好、比表面积大和结构可控等优点,且具有与细胞外基质相似的弹性,在药物输送、组织工程、伤口敷料、人造皮肤等生物医学领域具有广阔的应用前景[1~9].其中抗菌水凝胶由于具有保护伤口、减少感染和加速伤口愈合的作用,逐渐成为研究的热点.通常,水凝胶的抗菌能力来自于负载的各种纳米粒子[10~15](Ag纳米粒子[11~13]和Au纳米粒子[14,15]等)、抗菌剂(环丙沙星[16]、强力霉素[17]等)和生物提取物[18]等,这些释放类抗菌材料有一定的局限性,包括导致细菌耐药性、重金属对人体的毒副作用、价格高等.因此开发不会导致细菌耐药性的本征抗菌水凝胶具有重要意义.阳离子型水凝胶可以通过静电作用吸附在微生物的细胞膜表面,使细胞膜穿孔并裂解起到杀菌作用,因为其无需与细胞膜上的特定靶点结合就能起到抗菌作用,所以不会引起细菌的耐药性[19,20].
带正电的硫正离子化合物广泛存在于天然的动植物中[21],具有显著的抗菌作用,而且烷基化的硫正离子相对于铵或鏻类物质而言,具有更好的生物相容性[22],更适合用于制备具有固有抗菌能力的水凝胶.与小分子相比,含硫正离子的聚合物[23]通常表现出更高的稳定性和可加工性.但目前关于含硫正离子的聚合物报道较少,且主要集中在聚氨基酸材料上,利用聚合物侧链中的硫醚基团与环氧化合物反应即可生成硫正离子[24,25].
聚类肽是一种新兴的聚氨基酸材料,与聚肽具有相似的结构,但其侧链在氮原子上,而不是在α-碳上,通过改变氮原子上的取代基可以得到各种功能化的聚类肽[26~29].聚类肽因具有优良的溶解性[30]、可加工性[31]、酶稳定性[27,32]、可氧化降解性[33]、生物相容性[34]和无免疫原性而受到越来越多的关注[30,35].其中,聚肌氨酸(PSar)具有优异的水溶性、生物相容性、蛋白酶稳定性以及非免疫原性[36],被看作是聚乙二醇的替代物[30,32,37],是制备水凝胶的理想材料.通过调节聚类肽氮原子上的取代基[30,35,38],并选用合适的交联方式,如具有高选择性、高效率、反应条件温和的点击化学反应,有望得到具有可控力学性能、降解速率、凝胶形态、优异生物相容性且无免疫原性的聚类肽水凝胶.
本文结合了硫正离子基团和聚类肽的优点,通过伯胺引发的肌氨酸-N-硫代羧酸酐(Sar-NTA)和N-烯丙基甘氨酸-N-硫代羧酸酐(NGA-NTA)的可控开环聚合制备了三嵌段聚类肽,即聚(N-烯丙基甘氨酸)-b-聚肌氨酸-b-聚(N-烯丙基甘氨酸)(PNAG-b-PSar-b-PNAG,PASA),再通过巯-烯“点击”反应制备了聚类肽水凝胶(HG),然后与环氧化合物反应,将聚合物网络中的硫醚基团转变为硫正离子,制备了一种具有本征抗菌能力的含硫正离子聚类肽水凝胶(S+HG)(Scheme 1).研究了不同Sar摩尔分数的S+HG的吸水能力、微观形貌、力学性能以及广谱抗菌性能.S+HG对革兰氏阴性的大肠杆菌(E.coli)和革兰氏阳性的金黄色葡萄球菌(S.aureus)均表现出较高的抗菌活性.
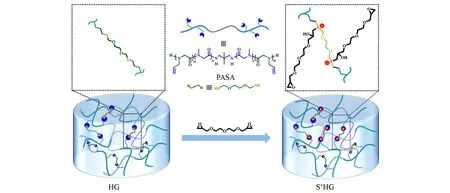
Scheme 1 Schematic diagram of polypeptoid hydrogel(HG)and sulfonium-containing polypeptoid hydrogel(S+HG)
1 实验部分
1.1 试剂与仪器
烯丙基胺(60%水溶液)、2-羟基-4′-(2-羟乙氧基)-2-甲基苯丙酮(I2959,纯度98%)、乙醛酸水合物(纯度98%)和超干乙腈(纯度99.9%),安耐吉化学技术(上海)有限公司;肌氨酸(Sar,纯度98%),上海阿达玛斯试剂有限公司;三溴化磷(纯度99%)、氢氧化钠(纯度99%)、聚乙二醇二环氧乙烷甲基醚(纯度99%),上海麦克林生化科技有限公司;2,2-二甲基-1,3-丙二胺(纯度98%)、3,6-二氧杂-1,8-辛烷二硫醇(纯度97%),梯希爱(上海)化成工业发展有限公司;浓盐酸(质量分数37%)、三氯甲烷、无水乙醚均为分析纯,国药集团化学试剂有限公司;碳酸氢钠(纯度99.5%)、无水硫酸镁(纯度98%)、乙酸(纯度99%)、石油醚(精馏级)、乙酸乙酯(精馏级)、无水乙醇(纯度99.7%)和磷酸盐缓冲溶液(PBS,pH=7.4),上海泰坦科技股份有限公司;参照文献[39,40]方法合成S-乙氧基硫代羰基巯基乙酸(XAA)和N-取代甘氨酸-N-硫代羧酸酐(NNTA).
AVANCEⅢ400型核磁共振波谱仪(1H NMR),瑞士Bruker公司;PL-50型凝胶渗透色谱仪(GPC),日本Agilent公司;Nicolet 5700型傅里叶变换红外光谱仪(FTIR),美国Thermo Scientific公司;S-3800型扫描电子显微镜(SEM),日本日立公司;RL-MARS3型平板流变仪,美国Thermo Hakke公司.
1.2 实验过程
1.2.1 NAG-NTA的合成图S1(见本文支持信息)给出NAG-NTA的合成路线.在烧瓶中加入92.05 g(1.0 mol)一水合乙醛酸、78.00 g(0.5 mol)烯丙基胺水溶液和300 mL水,室温下搅拌反应24 h.加入240 mL(2.8 mol)浓盐酸,油浴加热至120℃,回流12 h.旋转蒸发除去溶剂,粗产物在甲醇/丙酮溶剂体系中重结晶,干燥后得到37.21 g白色晶体,即为产物N-烯丙基甘氨酸盐酸盐(NAG·HCl),产率50.0%.1H NMR(400 MHz,DMSO-d6),δ:3.57(d,2H),3.79(s,2H),5.43(dd,2H),5.93(m,1H),9.55(s,2H).
将30.00 g(0.75 mol)NaOH用300 mL水溶解,冷却至室温.将37.20 g(0.25 mol)NAG·HCl和45.06 g(0.25 mol)XAA溶解在NaOH溶液中,45℃下搅拌反应3 d后,用浓盐酸调节至pH=1.然后用三氯甲烷萃取,加入无水MgSO4干燥1 h,过滤、旋转蒸发除去溶剂,得到白色固体N-乙氧基硫代羰基-N-烯丙基甘氨酸.抽真空通N2气3次,在N2气氛围下加入无水CH3Cl溶解上述白色固体.在冰水浴保护下缓慢滴加28 mL(0.30 mol)PBr3,反应10 min后撤去冰水浴,继续反应1 h.分别用饱和NaHCO3溶液和去离子水洗涤反应溶液,再用无水MgSO4干燥,过滤、旋转蒸发除去溶剂,得到粗产物.用柱色谱提纯粗产物,展开剂为石油醚-乙酸乙酯(体积比为8∶1).最终得到纯净的黄色油状产物12.10 g,即NAG-NTA,产率30.8%.1H NMR(400 MHz,CDCl3),δ:4.14(d,2H),4.16(s,2H),5.31(dd,2H),5.80(m,1H).
1.2.2 Sar-NTA的合成图S1给出Sar-NTA的合成路线.以肌氨酸为原料,粗产物用柱色谱分离提纯,展开剂为石油醚-乙酸乙酯(体积比为4∶1),得到浅黄色油状产物,产率22.9%.1H NMR(400 MHz,CDCl3),δ:3.11(s,3H),4.21(s,2H).
1.2.3 三嵌段聚类肽PASA的合成聚合操作均在预先除水、N2气保护的聚合瓶中使用Schlenk技术进行.以PASA-Sar49%的合成为例,[Sar]0/[NAG]0/[I]0=60/60/1([Sar]0,[NAG]0和[I]0分别表示Sar-NTA、NAG-NTA和引发剂的起始摩尔浓度):向聚合瓶中依次加入0.35 g(2.67 mmol)Sar-NTA和7 mL超干乙腈后,通过注射器加入0.30 mL配制好的0.15 mol/L 2,2-二甲基-1,3-丙二胺的乙腈溶液,在60℃下密闭反应24 h.用注射器加入0.83 mL(3.12 mol/L)的NAG-NTA的乙腈溶液,继续反应36 h.将反应液缓慢滴入剧烈搅拌的冰无水乙醚中,然后离心得到白色沉淀,用无水乙醚洗涤白色固体3次,最后真空干燥,得到0.40 g白色固体,即为PASA-Sar49%.
将NAG-NTA乙腈溶液的加入量调整为0.58 mL(3.12 mol/L),采用相同的方法合成PASA-Sar64%.
1.2.4 S+HG的制备将0.1 g PASA-Sar49%溶解在1 mL乙醇中,加入7 mg(0.03 mmol)光引发剂I2959和55 mg(0.3 mmol)3,6-二氧杂-1,8-辛烷二硫醇([C=C]∶[SH]∶[I2959]=1∶1∶0.05).用波长365 nm的紫外灯(1.125 W/cm2)照射15 min后,用水透析3次,然后冷冻干燥,得到白色干凝胶.将0.1 g干凝胶和0.47 g(3.0 mmol)聚乙二醇二环氧乙烷甲基醚加入到5 mL醋酸中,在37℃下反应3 d,反应后凝胶用超纯水透析,得到S+HG.
1.2.5 水凝胶的溶胀动力学将一定质量(m0,g)的S+HG浸入5 mL PBS缓冲盐溶液中,在特定的时间段(0.5,1.0,2.0,3.0,4.0和5.0 min)将水凝胶取出,用干燥的滤纸吸掉表面多余的水分后称重(m1,g).重复实验3次,按下式计算溶胀率(Swelling ratio,%):

1.2.6 水凝胶的流变性能用平板流变仪测量S+HG的流变性能.流变仪装有直径为25 mm的平行板,实验条件为37℃.测试过程中首先对水凝胶进行动态应变扫描,频率为1.0 Hz,振幅在0.1%~500%之间.然后进行动态频率扫描,振幅为5%,频率在0.1~100 rad/s.
1.2.7 水凝胶的抗菌性能采用振荡法测试水凝胶的抗菌性能,具体过程如下:(1)将0.1 g冻干的S+HG样品剪碎;(2)将枪头、试管、玻璃棒等实验用品高温灭菌;(3)取1 mL 1×108cfu/mL的菌液加入装有9 mL PBS缓冲液的试管中,涡旋振荡,按梯度稀释至1×105cfu/mL,加入剪碎的S+HG样品,置于37℃恒温培养箱内振荡24 h,转速250 r/min;(4)振荡结束后,用PBS缓冲溶液将菌液稀释到1×104cfu/mL,并取0.1 mL接种在琼脂培养皿上,于37℃培养箱培养24 h,进行菌落计数,取3次实验的平均值.
2 结果与讨论
2.1 三嵌段聚类肽PASA的合成
参照本课题组已报道的方法合成并表征了Sar-NTA和NAG-NTA[41,42](图S1~图S3,见本文支持信息).Sar-NTA聚合生成PSar,其具有良好的水溶性,可作为水凝胶中的亲水链段.NAG-NTA聚合后生成聚(N-烯丙基甘氨酸)(PNAG),其侧链含有双键,可以作为水凝胶中的交联位点.为了制备基于PSar的水凝胶,可以将PSar作为中间嵌段,两端再接上可以进行交联的PNAG链段,得到三嵌段聚合物PASA.伯胺引发的N-取代甘氨酸-N-硫代羧酸酐(NNTA)开环聚合具有活性特征,通过顺序投料的方式可以制备嵌段聚类肽[33].因此,可以利用2,2-二甲基-1,3-丙二胺引发Sar-NTA在乙腈中于60℃下聚合得到亲水的PSar,24 h后取少量反应溶液用于1H NMR分析,以保证Sar-NTA已经消耗完毕,然后再加入NAG-NTA继续聚合36 h,最终得到三嵌段聚合物PASA(Scheme 2).由于伯胺引发的NNTA聚合具有良好的可控性,通过调节投料比[Sar]0/[NAG]0/[I]0,制备得到两种不同嵌段比例的PASA,聚合数据总结于表1.
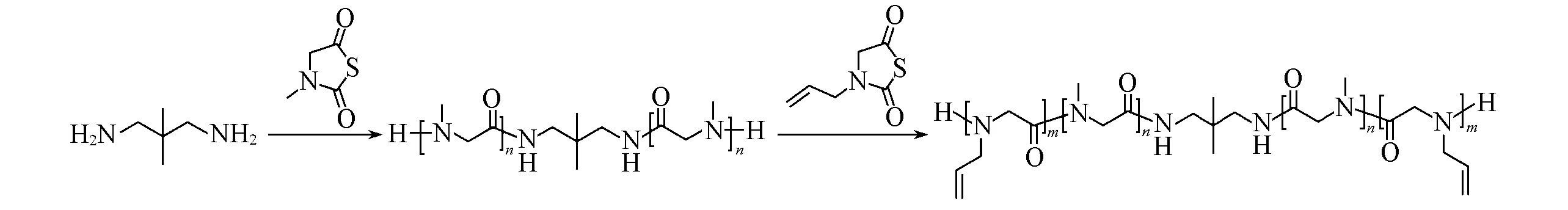
Scheme 2 Synthetic pathway of PASA

Table 1 Synthesis and characterization of PASA with different Sar molar fractionsa
在PASA的1H NMR谱图中可清楚地观察到Sar与N-烯丙基甘氨酸(NAG)重复单元的特征信号(图1).其中,引发剂的甲基质子信号(Ha)位于0.76,Sar单元的甲基质子信号(Hd)位于2.62~3.07,NAG单元的双键质子特征信号Hh和Hg分别位于4.95~5.38和5.54~5.94,而聚类肽主链和侧链的亚甲基质子信号(Hc+e+f)位于3.65~4.60.根据引发剂与重复单元特征信号的积分比例,得到各嵌段的聚合度(DP)、聚合物的分子量(MnNMR)以及Sar单元的摩尔分数(Sar molar fraction,%)通过下式计算:

式中:I(Ha)代表引发剂甲基峰的面积,I(Hd)和I(Hg)分别代表Sar单元的甲基峰面积和NAG单元的双键峰面积.根据公式计算,2种三嵌段聚合物的组成分别为PA27S53A27和PA18S59A18,对应的Sar摩尔分数分别为49%和64%.为了更直观地反映聚合物的组成,本文将这两种聚合物分别命名为PASA-Sar49%和PASA-Sar64%.GPC曲线表明,两种嵌段聚合物都具有中等的分子量分布(1.29~1.37),并且分子量的变化趋势与核磁计算所得的分子量一致(图2).上述结果表明,成功制备了不同Sar摩尔分数的三嵌段聚合物PASA.
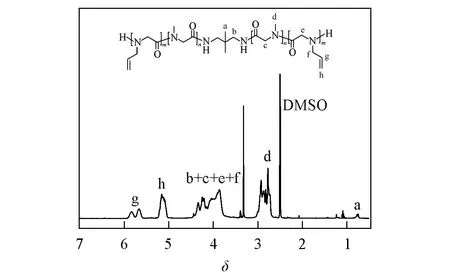
Fig.1 1H NMR spectrum of PASA-Sar64% in DMSO-d6

Fig.2 GPC traces of PASA-Sar49%(a)and PASA-Sar64%(b)
2.2 含硫正离子聚类肽水凝胶的制备

Fig.3 Images of the solution of PASA,3,6-dioxa-1,8-octanedithiol and photoinitiator I2959 before and after UV irradiation(A)and S+HG with different molar fraction of Sar(B)
PASA聚合物上的烯丙基和双硫醇化合物通过巯-烯“点击”反应使PASA分子链交联形成网络结构,然后再将所得聚类肽水凝胶(HG)浸泡于聚乙二醇二环氧乙烷甲基醚的乙酸溶液,得到一种含硫正离子聚类肽水凝胶(S+HG)(Scheme 1).将PASA三嵌段聚合物和3,6-二氧杂-1,8-辛烷二硫醇按照双键和巯基等摩尔比混合均匀,以I2959为光引发剂,用365 nm紫外灯的照射15 min[图3(A)],通过倒置法可以证明凝胶的形成.PASA-Sar46%和PASA-Sar64%形成的聚类肽水凝胶分别标记为HG-Sar49%和HG-Sar64%.巯-烯点击反应后生成大量的硫醚基团,可以进一步与聚乙二醇二环氧乙烷甲基醚在乙酸中反应生成硫正离子,然后经过透析除去未反应的物质制备得到如图3(B)所示的S+HG,PASA-Sar46%和PASA-Sar64%形成的含硫正离子聚类肽水凝胶分别标记为S+HG-Sar49%和S+HG-Sar64%.图4给出与聚乙二醇二环氧乙烷甲基醚反应前后水凝胶的FTIR谱图.由图4可见,与HG-Sar49%相比,与聚乙二醇二环氧乙烷甲基醚反应后的S+HG-Sar49%在1303 cm-1处的—OH面内弯曲振动峰及1110 cm-1处醇的C—O伸缩振动峰有所增强,1245 cm-1处脂肪族C—O—C的非对称伸缩振动和835 cm-1处环氧结构的C—O—C的非对称伸缩振动也有所增强,表明硫醚基团与环氧化合物发生了反应,环氧开环后与硫原子相连形成硫正离子,同时出现了相应的羟基(Scheme 1).上述结果表明,本文成功制备了骨架含有硫正离子的水凝胶.
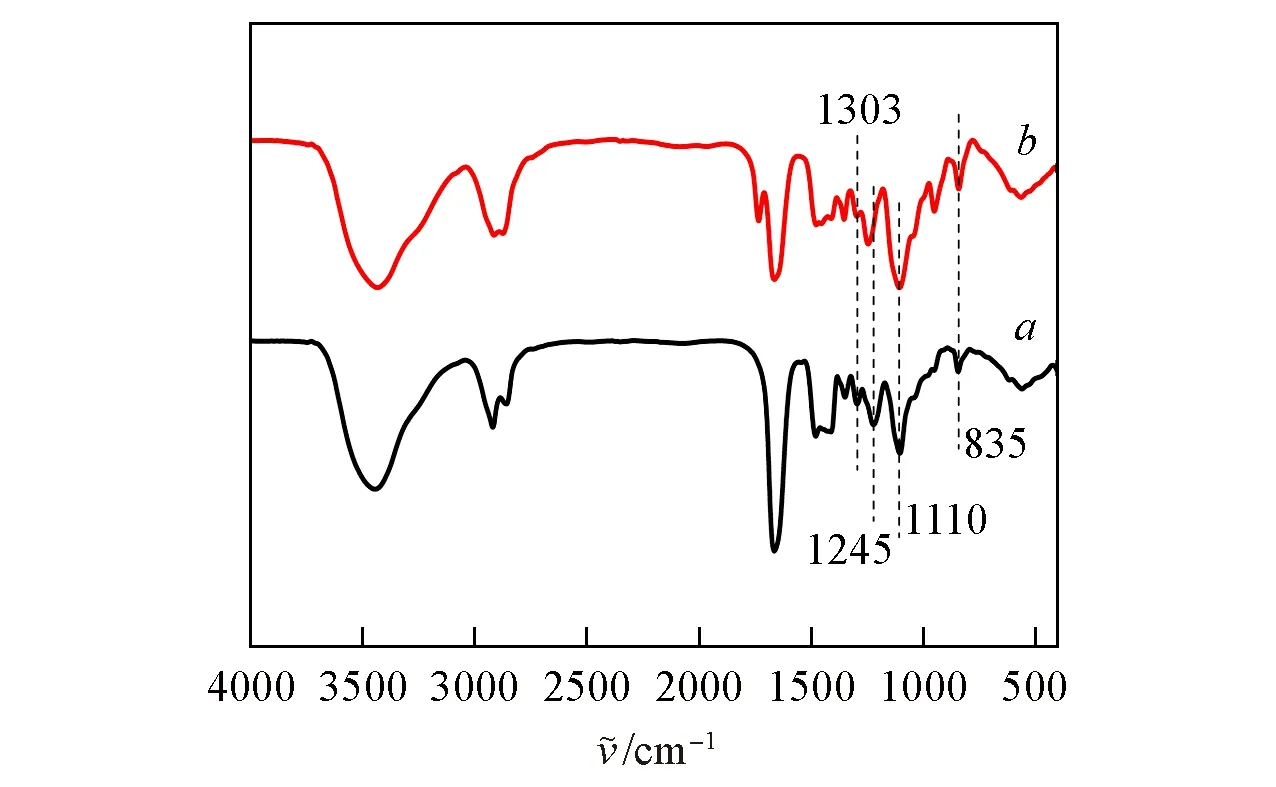
Fig.4 FTIR spectra of HG-Sar49%(a)and S+HG-Sar49%(b)hydrogels
2.3 含硫正离子聚类肽水凝胶的溶胀能力
将S+HG-Sar49%和S+HG-Sar64%冷冻干燥后,采用称重法测试不同时间段水凝胶在37℃PBS(pH=7.4)溶液中的溶胀率.由图5可以看出,不同Sar摩尔分数的S+HG干凝胶均在1 min内就可以达到溶胀平衡,表明S+HG拥有较好的快速溶胀性能.

Fig.5 Swelling kinetics of S+HG-Sar49%(a)and S+HG-Sar64%(b)
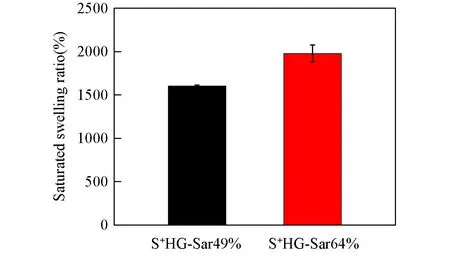
Fig.6 Saturated swelling ratio of S+HG-Sar49% and S+HG-Sar64%(immersed in PBS solution for 24 h)
溶胀率也可以用来模拟S+HG吸收伤口渗出液的能力.由图6可见,得益于水凝胶化学结构上的亲水性,这两种S+HG均具有优异的吸水性,当Sar摩尔分数从49%增加到64%时,S+HG的饱和溶胀率从1596%增加到2024%.由于PSar链段的亲水性比PNAG强,通过增加PASA的Sar摩尔分数,可以制备出溶胀率更高的S+HG水凝胶.
2.4 含硫正离子聚类肽水凝胶的力学性能
S+HG需要具有一定的力学强度和稳定性才能满足实际应用.本文采用流变仪研究了S+HG的力学性能,测试了Sar摩尔分数对水凝胶力学强度的影响(图7).含硫正离子聚类肽水凝胶S+HG-Sar49%和S+HG-Sar64%在剪切力作用下表现出不同的弹性模量(G′)和损耗模量(G″).由图7(A)可见,在动态应变扫描模式下,2种水凝胶的G′和G″在一定范围内保持不变,且G′均大于其G″,表明其以弹性体形式存在.由图7(B)可见,在动态频率扫描模式下,水凝胶的G′基本保持不变,并且G′比G″大一个数量级左右,说明水凝胶具有稳定的共价交联网络,结构上具有良好的稳定性,在受到外界一定的剪切、挤压以及摩擦作用时,水凝胶能够避免发生不可逆的破坏.S+HG-Sar49%和S+HG-Sar64%的G′分别为1056 Pa和756 Pa.G′随着Sar摩尔分数的减小而增大,这主要是因为参与巯-烯“点击”的双键摩尔分数变大,交联点密度变大,使网络结构更加稳定,所以力学强度更高.这表明可以通过调节聚合投料比改变水凝胶的组成,进而调节水凝胶的力学性能,以满足实际应用需求.
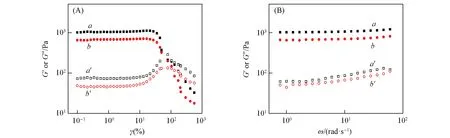
Fig.7 Mechanical properties of S+HG in dynamic amplitude sweep mode(A)and dynamic frequency sweep mode(B)a.G′,S+HG-Sar49%;a′.G″,S+HG-S49%;b.G′,S+HG-S64%;b′.G″,S+HG-S64%.
2.5 含硫正离子聚类肽水凝胶的形貌分析
将S+HG充分溶胀后,用液氮脆断然后冷冻干燥,用SEM观察其内部形貌.由图8可见,2种不同Sar摩尔分数的S+HG内部均为规则的连续海绵孔状网络结构,这表明水凝胶的形成是一个均相反应过程.S+HG-Sar49%水凝胶的孔径小于S+HG-Sar64%凝胶,说明Sar摩尔分数小的S+HG的网络更紧密,这与流变测试的结果相符合.S+HG的SEM结果表明可通过改变PASA聚合物的Sar摩尔分数调节水凝胶内部孔洞的尺寸,从而调节其吸水速度、溶胀率及力学性能等.合适大小的孔洞可以为细胞提供进行氧气和营养物质交换的空间,促进细胞的增殖及生长,有利于水凝胶在医用材料领域的应用[43,44].

Fig.8 SEM images of S+HG-Sar49%(A,B)and S+HG-Sar64%(C,D)
2.6 含硫正离子聚类肽水凝胶的抗菌性能
选用E.coli和S.aureus分别作为革兰氏阴性和革兰氏阳性病原体模型,采用振荡法评估了含硫正离子型聚类肽水凝胶的广谱抗菌性能,结果见图9(A)~(F).可见,PASA水凝胶没有抗菌能力,而S+HG对S.aureus和E.coli均有抗菌作用,当菌液浓度为1×105cfu/mL时,S+HG水凝胶对E.coli和S.aureus的抗菌率都在99.99%以上[图9(G)],表现出优异的广谱抗菌效果.硫正离子的抗菌机理为破坏细菌的细胞膜,S+HG通过静电相互作用黏附在带负电的细菌细胞膜表面,同时水凝胶中的疏水基团插入细菌细胞膜使其破裂,使得细胞内容物泄露,最终导致细菌死亡[23,24].因为其不像抗生素一样需要通过和细菌膜上的特定靶点结合才能起到抗菌作用,所以不会引起细菌的耐药性.而且烷基化的硫正离子与铵或鏻类物质相比具有更好的生物相容性,更适合用于制备具有固有抗菌能力的水凝胶[21,22].

Fig.9 Photographs of bacterial colonies after exposing to HG-Sar49%(A,D),S+HG-Sar49%(B,E)and S+HGSar64%(C,F)against S.aureus(A—C)and E.coli(D—F)and antimicrobial rates of S+HG(G)
3 结论
以伯胺为引发剂,依次引发Sar-NTA和NAG-TA开环聚合,制备了不同Sar摩尔分数的三嵌段聚类肽PASA,再利用侧链双键和双巯基化合物的巯-烯“点击”反应以及硫醚-环氧反应,制备了一种具有抗菌性能的S+HG.S+HG有着优异的吸水能力,能够在1 min内达到吸水平衡,饱和溶胀率高达2024%.S+HG内部由大量规则的连续海绵孔状结构组成,流变测试显示水凝胶的G′比G″大1个数量级左右,G′在一定外力下的能保持不变,水凝胶能够承受一定的剪切、摩擦及挤压等外界应力.Sar摩尔分数高的水凝胶溶胀速度更快、溶胀率更高,但力学强度有所降低,微观孔结构也更大.S+HG上的硫正离子赋予了其固有的优异广谱抗菌能力,对E.coli和S.aureus的抗菌率都在99.99%以上.通过控制单体的投料比即可方便地调节水凝胶的宏观性能,结合S+HG优异的固有抗菌性能,使其在生物医用领域有着广阔的应用前景.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20220381.