基于双波长指纹图谱和含量测定的经典名方百合地黄汤物质基准的质量评价研究
2022-11-15狄志彪刘洋刘峰许刚刘琪琪姜盛楠王春柳李晔张红陕西省中医药研究院西安7000陕西步长制药有限公司西安70075陕西中医药大学陕西咸阳7000
狄志彪,刘洋,刘峰,许刚,刘琪琪,姜盛楠,王春柳,李晔*,张红*(.陕西省中医药研究院,西安 7000;.陕西步长制药有限公司,西安 70075;.陕西中医药大学,陕西 咸阳 7000)
百合地黄汤来源于东汉张仲景所著的《金匮要略》,由“百合七枚(擘),生地黄汁一升组成”[1],原书中该方主要治疗百合病,原书言“百合病未经吐、下、发汗误治,病程虽长,而病情仍如初期,具备首条症状,病机为心肺阴虚内热者,主用百合地黄汤,润养心肺、凉血清热、兼能滋肾”。现代研究表明百合地黄汤具有良好抗抑郁、抗焦虑、调节亚健康状态、改善睡眠症状等作用[2-6]。
随着中医药行业的发展,国家中医药管理局发布了《古代经典名方目录(第一批)》[7],百合地黄汤被收录于此。经典名方的研究主要包括物质基准的研究和制剂方面的研究,而物质基准的研究规定[8]除成型工艺外,其他制备方法应当与古代医籍记载基本一致,因此,如何建立完善的质量标准和制备工艺是亟待解决的关键问题。目前,对百合地黄汤的研究大多数集中在药理方面和临床应用方面,其中对治疗失眠、抗抑郁临床疗效及作用机制等方面的研究较多[9-11]。但有关百合地黄汤质量控制的研究较少,周菲等[12]虽研究了百合地黄汤物质基准,但其未严格按照古籍所记载进行研究。本研究遵循《金匮要略》《国家药监局综合司公开征求古代经典名方中药复方制剂及其物质基准申报资料要求(征求意见稿)意见》中有关物质基准的规定[13]以及相关文献资料[14-18],最终确定处方组成以及煎煮工艺对百合地黄汤物质基准进行研究,并选用HPLC-DAD色谱仪建立了百合地黄汤物质基准的双波长指纹图谱,同时对其中3 种化学成分进行了含量测定,旨在为经典名方百合地黄汤物质基准及其制剂开发的质量评价体系提供依据。
1 材料
1.1 试药
对照品:梓醇(纯度:99.6%,中国食品药品检定研究院,批号:110808-201711);地黄苷D(纯度:99.3%,批号:L21O10Y100752)、益母草苷(纯度:98.0%,批号:L10A6Y2298)(上海源叶生物科技有限公司)。纯净水(娃哈哈食品有限公司);乙腈、甲醇为色谱纯(Fisher Scientific);其他试剂均为分析纯。
1.2 仪器
Agilent 1260 高效液相色谱仪(美国安捷伦公司);HR1871 榨汁机(飞利浦);SQP 型万分之一天平、SQP 型十万分之一天平(赛多利斯科学仪器有限公司);KH-300D 型超声清洗器(昆山禾创超声仪器有限公司)。
1.3 药材
百合地黄汤处方中药材均来源于道地产区,地黄采自河南省焦作市,百合采自湖南省邵阳市隆回县,分别购买不同地区,不同时间段采摘的药材,经孟雪助理研究员鉴定药材分别为玄参科植物地黄Rehmannia glutinosaLibosch 的新鲜块根和百合科植物百合LiLium browniivar.viridulum的肉质鳞叶,各药材产地和信息见表1,将各批次的单味药随机组合为15 批百合地黄汤基准S1 ~S15。
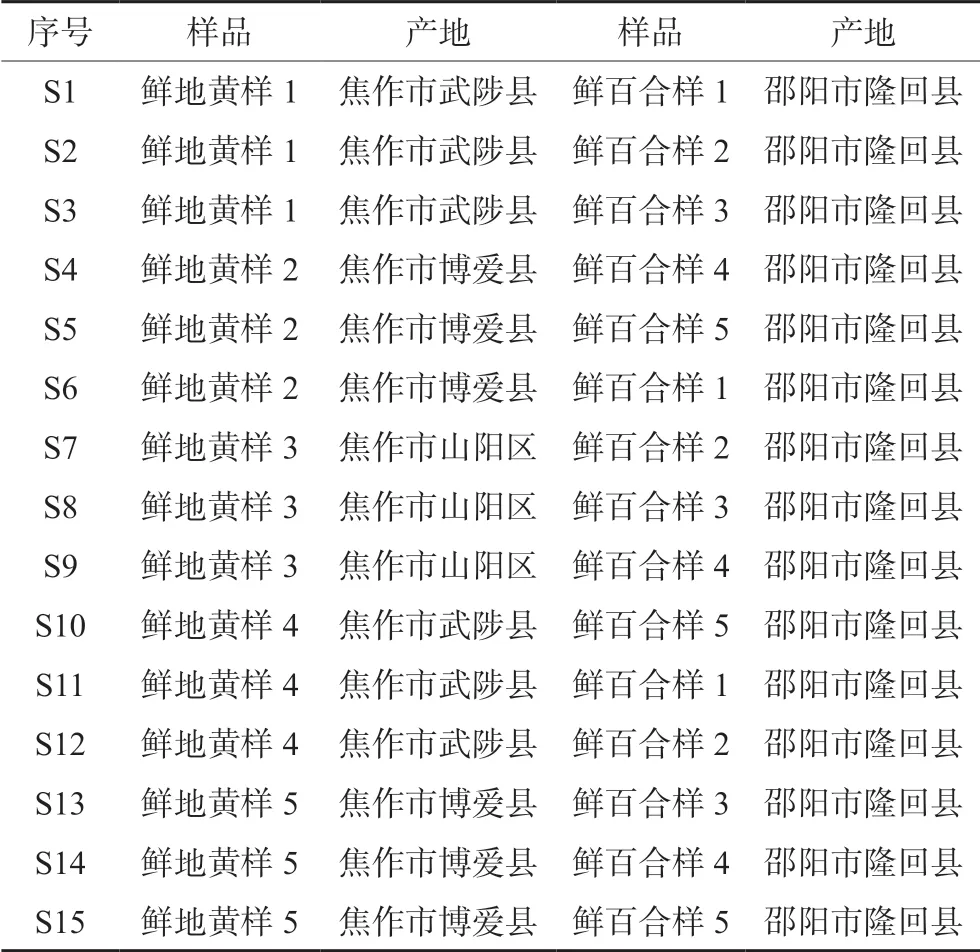
表1 百合地黄汤组方中药材产地信息Tab 1 Origin information of Baihe Dihuang decoction
2 方法与结果
2.1 百合地黄汤物质基准的制备
按照上述随机组合的S1 ~S15,共15 批次的百合地黄汤组方。根据《金匮要略》中百合地黄汤的煎煮工艺,将120 g 鲜百合洗净并加入400 mL 纯净水,浸泡10 h,过滤,滤液弃去,药材中再加入400 mL 水,煎煮至约为200 mL,趁热滤过,并向滤液中加入鲜地黄汁200 mL(鲜地黄直接榨汁取汁),共煎至约为300 mL,并将煎煮液选用冷冻干燥法干燥,即得百合地黄汤物质基准。
2.2 百合地黄汤物质基准指纹图谱的建立
2.2.1 供试品溶液的制备
① 样品溶液的制备:精密称取制得的百合地黄汤物质基准适量(相当于1 mL 百合地黄汤),加流动相(0.1%磷酸水溶液∶乙腈=99∶1)溶解,并定容至10 mL 量瓶中,摇匀,经0.45 μm 的滤膜过滤,即得供试品溶液。
② 地黄阴性样品制备:将鲜百合洗净并加入400 mL 纯净水,浸泡10 h,过滤,滤液弃去,药材中再加入400 mL 纯净水,煎煮至约为200 mL,趁热滤过,滤液中加入纯净水200 mL,共煎至约为300 mL,即得地黄阴性样品煎液。取上述液体1 mL,置于10 mL 量瓶中,加流动相(0.1%磷酸水溶液∶乙腈=99∶1),定容至刻度,摇匀,经0.45 μm 的滤膜过滤,即得。
③ 百合阴性样品制备:取200 mL 纯净水,并加入鲜地黄汁200 mL,共煎至约为300 mL,即得百合阴性样品煎液。取上述液体1 mL,置于10 mL 量瓶中,加流动相(0.1%磷酸水溶液∶乙腈=99∶1),定容至刻度,摇匀,经0.45 μm 的滤膜过滤,即得。
2.2.2 对照品溶液的制备 取梓醇、地黄苷D、益母草苷对照品适量,精密称定,加流动相溶液(0.1%磷酸水溶液∶乙腈=99∶1)分别制成相应浓度的对照品溶液,并吸取相应的各对照品溶液配制成含梓醇797.796 μg·mL-1、地黄苷D 95.924 μg·mL-1、益母草苷131.908 μg·mL-1的混合对照品溶液,经0.45 μm 的滤膜过滤,即得。
2.2.3 色谱条件 采用Kromasil 100-5-C18色谱柱(4.6 mm×250 mm,5 μm);检测波长203、320 nm;流速0.7 mL·min-1;柱温35℃;流动相:乙腈(A)-0.10%磷酸水溶液(B);进样量10 μL;梯度洗脱(0 ~20 min,2.0%A;20 ~60 min,2.0% ~20.0%A;60 ~70 min,20.0 ~40.0%A;70 ~80 min,40.0%~90.0%A)。
2.2.4 精密度试验 称取百合地黄汤物质基准(S3)适量(相当于1 mL 百合地黄汤),精密称定,按“2.2.1”项下方法制备供试品溶液,连续进样6 针,记录各色谱图,在203 nm 时,以地黄苷D 峰为参比峰,计算各共有峰相对保留时间RSD均小于0.10%,相对峰面积RSD均小于1.0%,在320 nm 时,以峰2 为参比峰,计算各共有峰相对保留时间RSD均小于0.10%,相对峰面积RSD均小于2.0%,表明该仪器精密度良好。
2.2.5 稳定性试验 称取百合地黄汤物质基准(S3)适量(相当于1 mL 百合地黄汤),精密称定,按“2.2.1”项下方法制备供试品溶液,分别在0、3、6、11、16、23 h 后进样测定,记录色谱图,在203 nm 时,以地黄苷D 峰为参比峰,计算各共有峰相对保留时间RSD均小于0.10%,相对峰面积RSD均小于1.0%,在320 nm 时,以峰2 为参比峰,计算各共有峰相对保留时间RSD均小于0.10%,相对峰面积RSD均小于2.5%,表明供试品溶液在23 h 内稳定性良好。
2.2.6 重复性试验 称取百合地黄汤物质基准(S3)适量(相当于1 mL 百合地黄汤),精密称定(共6 份),按“2.2.1”项下方法制备供试品溶液,进样测定,记录色谱图,在203 nm 时,以地黄苷D 峰为参比峰,计算各共有峰相对保留时间RSD均小于0.10%,相对峰面积RSD均小于5.0%,在320 nm 时,以峰2 为参比峰,计算各共有峰相对保留时间RSD均小于0.10%,相对峰面积RSD均小于4.0%,表明该方法重现性良好。
2.2.7 双波长指纹图谱的建立及共有峰归属 取15 批百合地黄汤物质基准供试品溶液进样分析,分别记录203 nm、320 nm 下的各色谱图。采用“中药色谱指纹图谱相似度评价系统(2012 版)”软件进行数据分析,指纹图谱1:当波长为203 nm 时,以S1 的图谱为参照图谱,进行多点校正和全谱峰匹配,确定共有峰16 个,并通过与混合对照品溶液对比,指认出其中3 种化学成分,分别为梓醇(峰1)、地黄苷D(峰5)和益母草苷(峰8),见图1。匹配后的15 批样品色谱图,见图2。对各样品进行相似度评价,S1 ~S15 样品与对照图谱的相似度分别为0.993、0.990、0.994、0.993、0.995、0.996、0.995、0.996、0.994、0.997、0.997、0.997、0.991、0.991、0.990,对样品中共有峰进行药材归属,其中峰2、峰9 来源于鲜百合,峰1、3 ~8、10 ~16 均来源于鲜地黄汁,见图3。指纹图谱2:当波长为320 nm 时,以S1的图谱为参照图谱,进行多点校正和全谱峰匹配,确定共有峰有9 个,对样品中共有峰进行归属,其中峰2、4、6、9 来源于鲜地黄汁,峰1、3、5、7 ~8 均来源于鲜百合,见图4,匹配后的15批样品色谱图,见图5。对各样品进行相似度评价,S1 ~S15 样品与对照图谱的相似度分别为0.987、0.990、0.995、0.976、0.970、0.973、0.988、0.994、0.989、0.995、0.984、0.986、0.991、0.992、0.993。
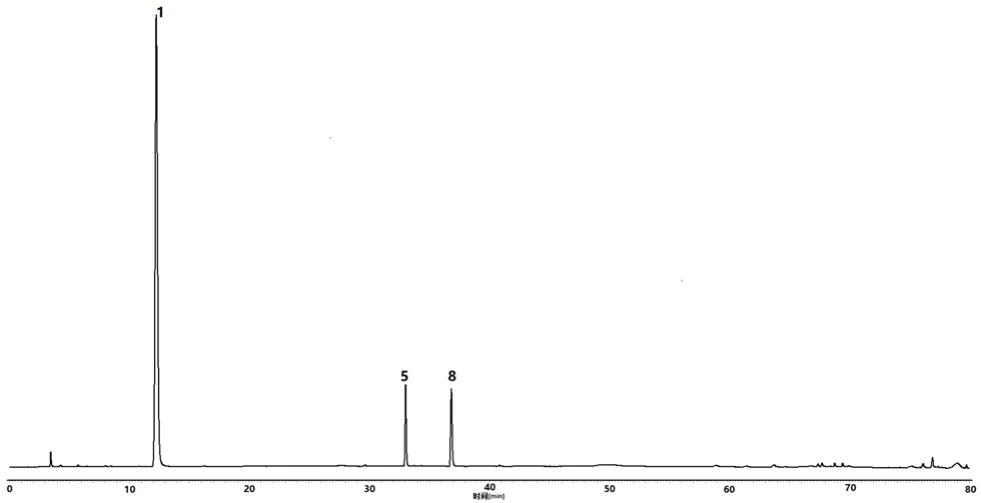
图1 混合对照品HPLC 图(203 nm)Fig 1 HPLC diagram of mixed reference substance (203 nm)
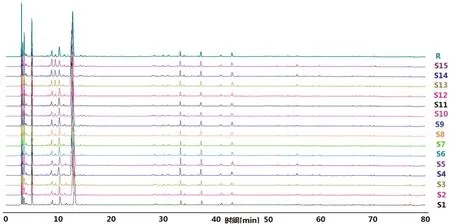
图2 15 批百合地黄汤物质基准的指纹图谱(203 nm)Fig 2 Fingerprints of 15 batches of primary standard of Baihe Dihuang decoction(203 nm)

图3 百合地黄汤物质基准指纹图谱共有峰归属(203 nm)Fig 3 Attribution peak fingerprint of characteristic peak of primary standard of Baihe Dihuang decoction(203 nm)

图4 百合地黄汤物质基准指纹图谱共有峰归属(320 nm)Fig 4 Attribution peak fingerprint of characteristic peak of primary standard of Baihe Dihuang decoction(320 nm)

图5 15 批百合地黄汤物质基准的指纹图谱(320 nm)Fig 5 Fingerprints of 15 batches of primary standard of Baihe Dihuang decoction(320 nm)
2.3 百合地黄汤物质基准中化学成分的含量测定
2.3.1 色谱条件 采用Kromasil 100-5-C18色谱柱(4.6 mm×250 mm,5 μm);检测波长203 nm;流速0.7 mL·min-1;柱温35℃;流动相:乙腈(A)-0.10%磷酸水溶液(B);进样量10 μL;梯度洗脱(0 ~20 min,2.0%A;20 ~60 min,2.0%~20.0%A;60 ~70 min,20.0 ~40.0%A;70 ~80 min,40.0%~90.0%A)。
2.3.2 线性关系 取梓醇、地黄苷D 和益母草苷对照品适量,精密称定,加流动相溶液分别制成梓醇797.796 μg·mL-1、地黄苷D 95.924 μg·mL-1和益母草苷131.908 μg·mL-1的混合对照品溶液,即得。
精密吸取上述混合对照品溶液适量,分别稀释成质量浓度为母液的1、1/2、1/4、1/8、1/16、1/32 的混合对照品溶液,按“2.3.1”项下色谱条件进样分析,并记录色谱图。以对照品溶液的质量浓度为横坐标(X),以峰面积值为纵坐标(Y),进行线性回归,得到线性回归方程为梓醇:Y=8.6387X+32.157(R2=0.9999)、地黄苷D:Y=6.1495X+0.8544(R2=1.000)、益母草苷:Y=5.6197X+2.5602(R2=0.9999), 结果表明梓醇、地黄苷D、益母草苷分别在24.931 ~797.796 μg·mL-1、2.998~95.924 μg·mL-1、4.122~131.908 μg·mL-1与峰面积线性关系良好。2.3.3 精密度试验 称取百合地黄汤物质基准(S3)适量(相当于1 mL 百合地黄汤),精密称定,制备供试品溶液,连续进样6 针,记录各色谱图,以地黄苷D 峰为参比峰,计算各共有峰相对保留时间RSD均小于0.10%,相对峰面积RSD均小于1.0%,表明该仪器精密度良好。
2.3.4 稳定性试验 称取百合地黄汤物质基准(S3)适量(相当于1 mL 百合地黄汤),精密称定,制备供试品溶液,分别于0、3、6、11、16、23 h 后进样测定,记录色谱图,以地黄苷D 峰为参比峰,计算各共有峰相对保留时间RSD均小于0.10%,相对峰面积RSD均小于1.0%,表明供试品溶液在23 h 内稳定性良好。
2.3.5 重复性试验 称取百合地黄汤物质基准(S3)适量(相当于1 mL 百合地黄汤),精密称定(共6 份),制备成供试品溶液,进样测定,记录色谱图,以地黄苷D 峰为参比峰,计算各共有峰相对保留时间RSD均小于0.10%,相对峰面积RSD均小于5.0%,表明该方法重现性良好。
2.3.6 加样回收试验 称取已知含量的百合地黄汤物质基准(S3)适量(相当于1 mL 百合地黄汤),精密称定,制备供试品溶液6 份,每组分别添加地梓醇对照品溶液(1164.32 μg·mL-1)、地黄苷D 对照品溶液(342.59 μg·mL-1)、益母草苷对照品溶液(659.54 μg·mL-1)适量,进样测定,记录色谱图,计算各化合物的平均加样回收率及RSD值。结果显示梓醇低、中、高浓度的平均回收率分别为94.42%、94.15%、96.01%,RSD分别为0.44%、1.5%、1.6%,地黄苷D 低、中、高浓度的平均回收率分别为95.05%、95.80%、100.9%,RSD分别为1.7%、0.80%、4.3%, 益母草苷低、中、高浓度的平均回收率分别为104.4%、101.9%、101.8%,RSD分别为0.27%、1.5%、2.1%,结果表明该方法准确性良好。
2.3.7 指标成分的含量测定 测定15 批次百合地黄汤物质基准的干膏得量,即百合地黄汤物质基准的质量比对应百合地黄汤体积的数值,结果见表2。

表2 15 批百合地黄汤物质基准含量测定结果Tab 2 Content of material reference in 15 batches of Baihe Dihuang decoction
根据含量测定结果可知,15 批百合地黄汤中梓醇、地黄苷D 和益母草苷的含量分别在36.2126 ~48.8442 mg·g-1、2.9734 ~4.8516 mg·g-1和3.6128 ~5.0232 mg·g-1。 根据国家药品监督管理局发布的《国家药监局综合司公开征求古代经典名方中药复方制剂及其物质基准申报资料要求(征求意见稿)意见》[13]规定,物质基准中指标性成分含量一般在均值的70%~130%,15 批次指标成分含量均稳定在均值70%~130%,无离散数据。
3 讨论
本研究按照古籍记载,选用鲜百合和地黄汁(经鲜地黄榨汁处理)入药,同时结合国家中医药管理局发布的关于《古代经典名方信息表(7首方剂)》中剂量换算关系及古代度量衡演变过程[19-20],最终确定制备工艺为:将鲜百合洗净并加入400 mL 纯净水,浸泡10 h,过滤,滤液弃去,药材中再加入400 mL 纯净水,煎煮至约为200 mL,趁热滤过,收集滤液并加入200 mL 鲜地黄汁,共煎至约为300 mL,即得。
为提高百合地黄汤物质基准的质量控制研究,本文建立了HPLC 的双波长指纹图谱,分析处方中特征化学成分的药材来源。相比单波长指纹图谱控制生产过程中的质量,双波长指纹图谱不但对处方的工艺进行了质量控制,而且可以准确的控制生产过程中原药材的质量,进而提高了生产效率和质量控制的效率。试验中选用HPLC-DAD高效液相色谱仪对样品进行了200 ~400 nm 全波长扫描。研究发现,当波长为203 nm 时共有峰数目最多,共有16 个,通过对共有峰归属其中14个来源于鲜地黄汁,2 个来源于鲜百合药材;当波长为320 nm 时,共有峰有9 个,其中5 个来源于鲜百合药材,4 个来源于鲜地黄汁。在203 nm和320 nm 双波长下建立的指纹图谱,可以更加准确、全面地监控物质基准在生产过程中的质量。同时试验还对其中3 种化合物进行了含量测定,分别为梓醇、地黄苷D 和益母草苷,以提高百合地黄汤物质基准的质量的控制,以便更好地生产出合格、放心的产品。建立的双波长指纹图谱和多种化学成分的含量测定,为百合地黄汤物质基准的质量控制和复方制剂的制剂开发提供了可靠的质量控制方法,该方法稳定性和重现性均较好。
