放射性药品监管现状及思考
2022-11-15李衡刘轶张秋华兰文湖南省药品监督管理局长沙4003湖南省药品检验检测研究院长沙4000国家药品监督管理局药用辅料工程技术研究重点实验室长沙4000
李衡,刘轶,张秋华,兰文(.湖南省药品监督管理局,长沙 4003;2.湖南省药品检验检测研究院,长沙 4000;3.国家药品监督管理局药用辅料工程技术研究重点实验室,长沙 4000)
放射性药品是指用于临床诊断或治疗的放射性核素制剂或其标记药物[1]。放射性药品是一类特殊的药品,除具备药品的特点外,还有放射性,利用其发射的射线进行疾病诊断和治疗。放射性药品主要用于心肌显像和心肌疾病的诊断、神经退行性疾病的诊断和恶性肿瘤的诊断、疗效评价和治疗等[2]。
1 背景与特点
我国放射性药品的研究大约从20世纪50年代才开始。随着中国核医学的快速发展和临床需求的增长,放射性药品的产值逐年增加。2020年,中国放射性药品的市场规模约44.56 亿元[3]。生产销售规模位于全国前三的企业依次为中国同福股份有限公司、东诚药业、上海欣科医药,至2017年底,中国大陆医疗机构装备回旋加速器近110 台[2]。未来十年,我国放射性药物行业将继续呈现寡头竞争的局面,行业集中度有望进一步提高。目前,我国设有核医学科且有放射性药品临床应用的医院有600 余家,拥有约880 余台PET/CT,80 余台PET/MR[4]。
我国目前已获批进入临床应用的放射性药品品种有38 个,2020年版《中国药典》收载品种30个,其中24 种为放射性药品制剂,6 种为非放射性配套药盒原料药。目前已发布质量控制指导原则2 个[5]。
放射性药品是一类小众用药,与普通药品相比有其特殊性。药品监管部门对其监管所参考的法规与其他类型药品有所不同,所依据的是《放射性药品管理办法》。2022年1月,国家药品监督管理局发布了《关于进一步加强放射性药品管理有关事宜的通告》[6],对放射性药品生产和使用企业的质量控制体系、人员把关方面做了详细要求,体现了国家层面对放射性药品在新的历史时期、面临新发展背景的重视。
2 日常监督检查中发现的问题
湖南省现有A 公司、B 公司两家放射性药品生产企业,另有共计20 余家制备或使用放射性药品的医疗机构,其中A 公司的生产销售份额在全省一直处于领先地位。2020年至2021年通过对省内两家放射性药品生产企业及部分医疗机构进行日常监督检查,共发现一般缺陷114 条。对存在的缺陷项进行分类,其中人员(机构)方面共计14 条,占比12%;设施设备方面共计6 条,占比6%;物料管理方面共计39 条,占比34%;生产检验方面共32 条,占比28%;文件管理方面共计23 条,占比20%(见图1)。
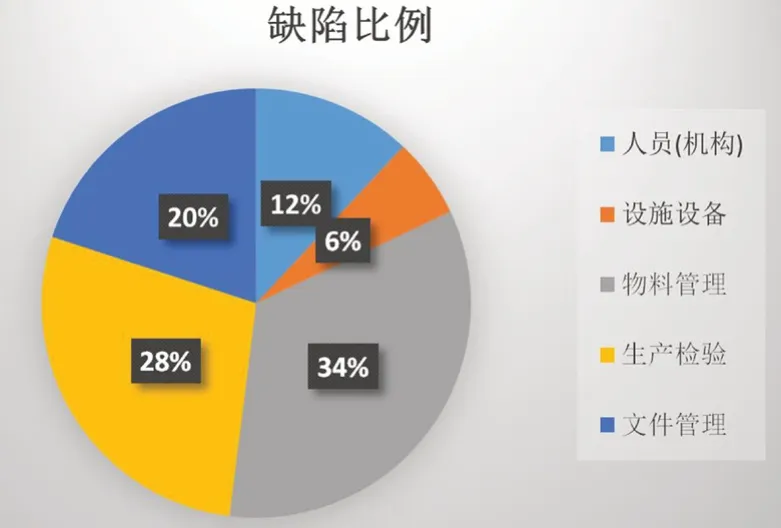
图1 2020—2021年湖南省两家放射性药品生产企业及部分医疗机构日常监督检查缺陷分布情况Fig 1 Daily supervision and inspection of defects by two radioactive drug manufacturers and some medical institutions in Hunan Province from 2020 to 2021
3 检查中发现问题的分析
3.1 人员(机构)
放射性药品本质上是放射性核素与药品共同制备成的一类特殊药品,根据相关法规,生产企业或医疗机构放射性药品制剂部门的关键岗位技术人员应具有核医学或相关专业资质及工作经验,现状是这些人员具有很好的核物理专业背景,但对药品和药品生产,特别是药品生产质量管理规范(GMP)理念比较缺乏。使用环节多为医护人员,对核物理或核医药方面的知识也相对生疏,所以出现了生产和使用环节的操作人员都在各自岗位上出现真空地带,不能很好地将核物理与医药相结合,在理念上、风险点的把控上,存在一定的安全隐患。医疗机构的操作人员多为护理人员,对放射性药品的特性缺乏了解并且自我保护方面意识较弱。
3.2 设备设施
生产企业与医疗机构放射性药品制剂部门部分存在厂房或制备区洁净区内气流流向由非放射区向放射性区、由低污染区向高污染区流动的问题,空调净化系统的配置未充分考虑不同生产工艺、不同工序等方面可能存在交叉污染的问题,活性炭过滤器、除碘过滤器的规范管理的问题。另外设备的使用、维护、保养记录填写不及时或不规范,医疗机构在使用时,多数只配置简易的防护操作台,更谈不上布局合理性的问题。
3.3 物料管理
生产环节存在未按照规程对西林瓶、无菌注射用水进行进厂检验,工艺废水、废弃的发生器、检验废水、手套、擦拭废物未按照规程进行处理等问题。使用环节则包括医疗机构对放射性药品的领取、配药、废弃物的处理未按规程进行操作。
3.4 生产检验
检验记录填写不规范。起始物料、包材等未完全按现行质量标准进行进厂检验。由于检验力量薄弱,部分追索性检验项目无法完成。部分医疗机构未配备相应的场所、检验仪器和设备,未定期对已有的仪器设备进行定期校验。数据可靠性是每次GMP 现场检查的重点核查内容,医疗机构较生产企业对该项目重视程度较差,大部分电子数据未按权限等级保存处理,可随意更改或删除,存在数据丢失的不安全隐患。
3.5 文件管理
部分医疗机构文件体系不完整;验证文件、工艺规程、检验规程、仪器设备的操作和校验规程缺乏或未及时修订等。
4 关于完善对放射性药品监管的建议
4.1 提高省级药监执法人员专业水平和监管能力
在我国,随着SPE-CT、PET/CT 逐渐将进入国家医保目录和各省级医保目录,放射性药品的使用量将不断上升,加之2021年国家药品监督管理局将放射性药品的生产使用许可、日常监管均下放至省局药监部门,对省级药监执法人员的专业水平、监管能力均提出新的要求,因此,需适宜的加强或调整监管方式、能力。
4.2 强化事中事后监管
2022年初,国家药品监督管理局下发了《关于进一步加强放射性药品管理有关事宜的通告》[6],明确要求各省级药品监管部门应当加强事中事后监管,进一步加强放射性药品生产过程的监督检查,督促放射性药品生产企业和医疗机构落实放射性药品质量安全主体责任,确保药品生产全过程持续符合法定要求。
4.3 推进和完善医疗机构使用或自备放射性药品备案制
医疗机构是放射性药品的使用机构,推进医疗机构备案制,一方面有利于监管部门摸清底数,为有效监管提供数据;另一方面对医疗机构有无形的鞭策作用,促进其自觉遵守有关规定,保障用药者的安全。
4.4 推进省级药品检验机构放射性药品检验专业人员检测能力建设
目前省级药品检验机构在人员、检验设施设备等方面均无法胜任放射性药品检验的工作任务,随着放射性药品生产使用监管职能下放至省级药监部门,其对应检验能力和水平亟需加强。省级药检部门应安排专业技术人员参加中国食品药品检定研究院或国家药品监督管理局授权的机构有关放射性药品检验知识及放射性药品管理相关法规的培训。
4.5 推进区域性供药中心的建设
鉴于放射性药品衰变期短、生产运输使用涉及到安全防护的特性,建议推进区域性供药中心,统一生产、专业运输、指导医护人员正确使用,确保这一特殊性药品的全程可控。
4.6 借鉴国际先进管理经验
我国放射性药品相关的政策法规比较滞后,目前缺乏科学、系统的放射性药品管理法规体系和研究指南,对行业的发展有一定的影响。美国建立了关于放射性药品研究的技术指导原则,欧盟也出台了《放射性药物研究指南》和《放射性药物非临床评价指导原则概念文件》等相关指南,国际上完善的放射性药品法规管理体系和修订机制值得我国学习[7]。
4.7 推进制订针对放射性药品的生产质量管理规范
我国可借鉴发达国家的有益经验,尽快制订针对放射性药品的生产质量管理规范,在操作人员、无菌处理、元器件的质量控制、生产步骤的自我验证、个人生产监督、产品发布授权和标签要求等方面给予放射性药品生产质量管理更强的针对性和更大的灵活性[8],缩小生产企业和医疗机构之间在放射性药品生产质量管理方面的差别,促进放射性药品安全、合理应用。
5 对涉及放射性药品生产企业、医疗机构及使用单位的建议
5.1 加强人员培训
放射性药品生产关键岗位人员、使用单位相关医护人员,生产企业关键岗位人员应具有核物理类专业知识;医护人员则具有医药专业背景;质量控制人员应经过中国食品药品检定研究院或国家药品监督管理局授权的机构有关放射性药品检验知识的培训,并取得培训合格证书;应将核素防护及安全操作知识纳入相关人员继续培训范畴。
5.2 推进生产及使用单位各项制度及机构的完善
要求生产及使用单位建立本单位放射性药品研究委员会、建立放射性药品应急处置机制,成立放射性药品应急处置部门,应对突发性安全事件。
5.3 加强放射性药品生产企业、有制备放射性药品的医疗机构的生产质量管理
根据我国放射性药品生产质量管理的现状,应积极加强放射性药品生产企业、有制备放射性药品的医疗机构的生产质量管理,特别要注重提高有制备放射性药品的医疗机构的生产质量管理。
6 结语
通过对放射性药品生产企业和部分医疗机构的日常监督检查缺陷分析,探究进一步完善放射性药品监管的方法,促进我省核医学的发展和进步,以期为临床提供安全有效的放射性药品,更好地为人类健康服务。
