前哨淋巴结活检在早期宫颈癌患者盆腔淋巴结转移诊断中的应用价值
2022-11-11杨火梅宋晓霞张龙
杨火梅,宋晓霞,张龙
(新余市人民医院妇产科,江西 新余 338000)
有研究显示,宫颈癌是导致女性死亡的重要原因,其年增长率约为0.6%,且发病率呈逐年升高的趋势,我国每年宫颈癌病死率高达11.0%[1]。目前,临床常用全子宫切除结合盆腔淋巴结切除术治疗早期宫颈癌,但根据实际数据显示,早期宫颈癌患者仅有不足1/3的患者盆腔淋巴结转移,即约2/3的患者进行了不必要的淋巴结切除,引起机体免疫功能下降,增加术后感染等发生的风险,使患者术后恢复时间延长,甚至影响治疗效果,导致疾病复发[2]。早期宫颈癌的盆腔淋巴结转移率较低,是否所有盆腔淋巴结均需要进行清扫仍存在较大争议,因此,手术前有效诊断患者淋巴结转移情况对于早期宫颈癌手术方案的选择具有重要意义。为减少宫颈癌患者肿瘤切除手术后的创口面积,缩短其预后恢复时间,有专家提出以肿瘤局域淋巴结引流的规律为依据,将肿瘤淋巴引流第一站作为前哨淋巴结(sentinel lymph node,SLN),采取SLN 的活检诊断宫颈癌患者盆腔淋巴结转移情况[3]。基于此,本研究旨在探讨前哨淋巴结活检(sentinel lymph node biopsy,SLNB)技术诊断早期宫颈癌患者盆腔淋巴结转移的敏感性、特异性、准确性,并评价其临床价值,现报道如下。
1 资料与方法
1.1 临床资料 选取2018 年2 月至2020 年9 月于本院确诊的82例早期宫颈癌患者为研究对象,年龄22~70 岁,平均(46.02±12.18)岁。经手术病理证实,病理类型:鳞癌77例,腺癌5例;肿瘤生长情况:内生型15 例,外生型67 例;肿瘤最大直径2.50~5.00 cm,平均(3.84±0.49)cm;宫颈癌国际妇产科协会(federation international of gynecology and obstetrics,FIGO)分期:Ⅰ期27例,Ⅱ期55例;分化程度:3级9例,2级62例,1级11例。本研究经本院医学伦理委员会审核批准。纳入标准:均经病理活检确诊为子宫颈癌;FIGO 分期ⅠA2~ⅡA2 期[4];盆腹腔CT或MR未找到可疑淋巴结;患者及家属对本研究知情同意并签署知情同意书。排除标准:不能配合或不能耐受SLN检查者;合并严重器质性病变疾病患者;合并严重精神疾病患者;合并全身系统及免疫系统疾病患者;存在凝血功能障碍患者。
1.2 方法 采用核素联合亚甲蓝进行示踪。术前12 h,所有纳入对象均于宫颈表面(3、6、9、12 点位置)黏膜下注射0.5 ml 的硫胶体(99Tcm标记),术前20 min 在宫颈表面同部位,采用黏膜下注射1 ml的亚甲蓝。然后在全身麻醉后进行广泛子宫切除术加盆腔淋巴结清扫术,术中观察亚甲蓝染色的淋巴结部位,并用γ-探测仪进行检测,计数升高10倍以上的淋巴结标记为SLN存在部位,切除标记的SLN。
1.3 观察指标 参照SLNB 评价标准[5]:SLN 有无转移定义为阳性或阴性,无转移为阴性,有转移为阳性;SLN无转移但淋巴结有转移为假阴性。采用Kappa 一致性检验SLNB 准确率、灵敏度、特异性、阳性预测、阴性预测、假阴性率及假阳性率。准确率=(真阳性例数+真阴性例数)/总例数×100%;灵敏度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/假阴性率=假阴性数/盆腔淋巴结转移数×100%。假阳性率=假阳性数/盆腔淋巴结转移数×100%。
1.4 统计学方法 采用SPSS 22.0统计学软件进行数据分析,满足正态分布且方差齐的计量资料采用“”表示,组间比较采用两样本独立t检验,计数资料用率(%)表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义,采用Kappa一致性检验SLNB准确率、灵敏度、特异性、阳性预测、阴性预测和Kappa值,Kappa值≥0.7表示一致性较高,Kappa值0.4~0.7表示一致性中等,Kappa值<0.4表示一致性较弱。
2 结果
2.1 SLN 的部位分布情况 82 例患者共切除淋巴结 2 564 枚,其中 SLN 有 266 枚,其中占比最高的是骼内闭孔区域,为76.32%(203/266),其次是髂外及髂总区域,分别为17.29%(46/266)及 5.64%(15/266),骶前区域仅0.75%(2/266),且在腹主动脉旁、腹股沟深及宫旁区域未发现SLN,见表1。
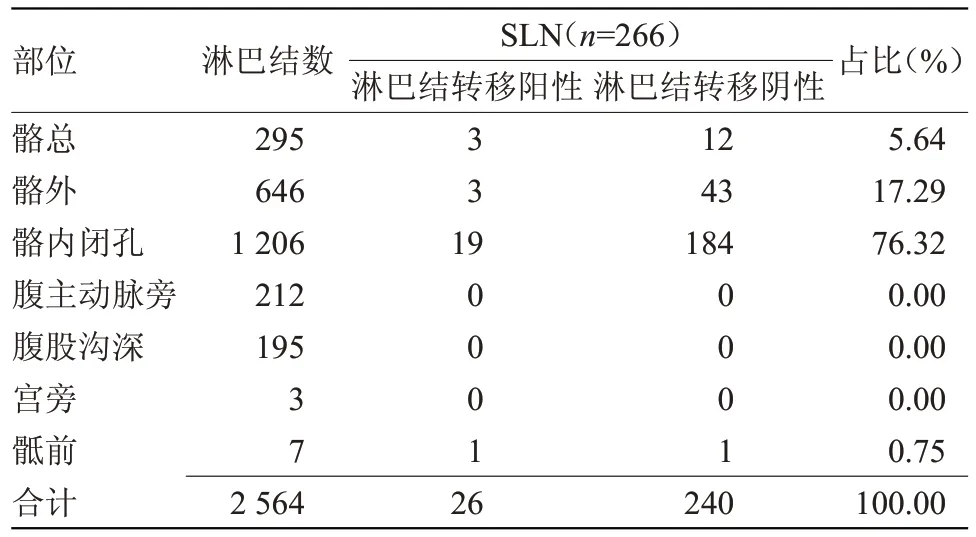
表1 SLN的部位分布情况(枚)
2.2 临床病理特征与前哨淋巴结检出率关系SLN 总检出率为92.68%(76/82),肿瘤最大直径≤4 cm时SLN检出率为96.55%,高于肿瘤最大直径>4 cm 的检出率83.33%,差异有统计学意义(P<0.05);淋巴结转移阳性时检出率为98.00%,高于淋巴结转移阴性时检出率为84.38%,差异有统计学意义(P<0.05)。6例未检出患者中,鳞癌患者占83.33%(5/6),外生型患者占66.67%(4/6),肿瘤>4 cm患者占66.67%(4/6),Ⅰ期患者占50.00%(3/6),分化程度3 级患者占16.67%(1/6),淋巴结阳性患者占16.67%(1/6)。见表2。
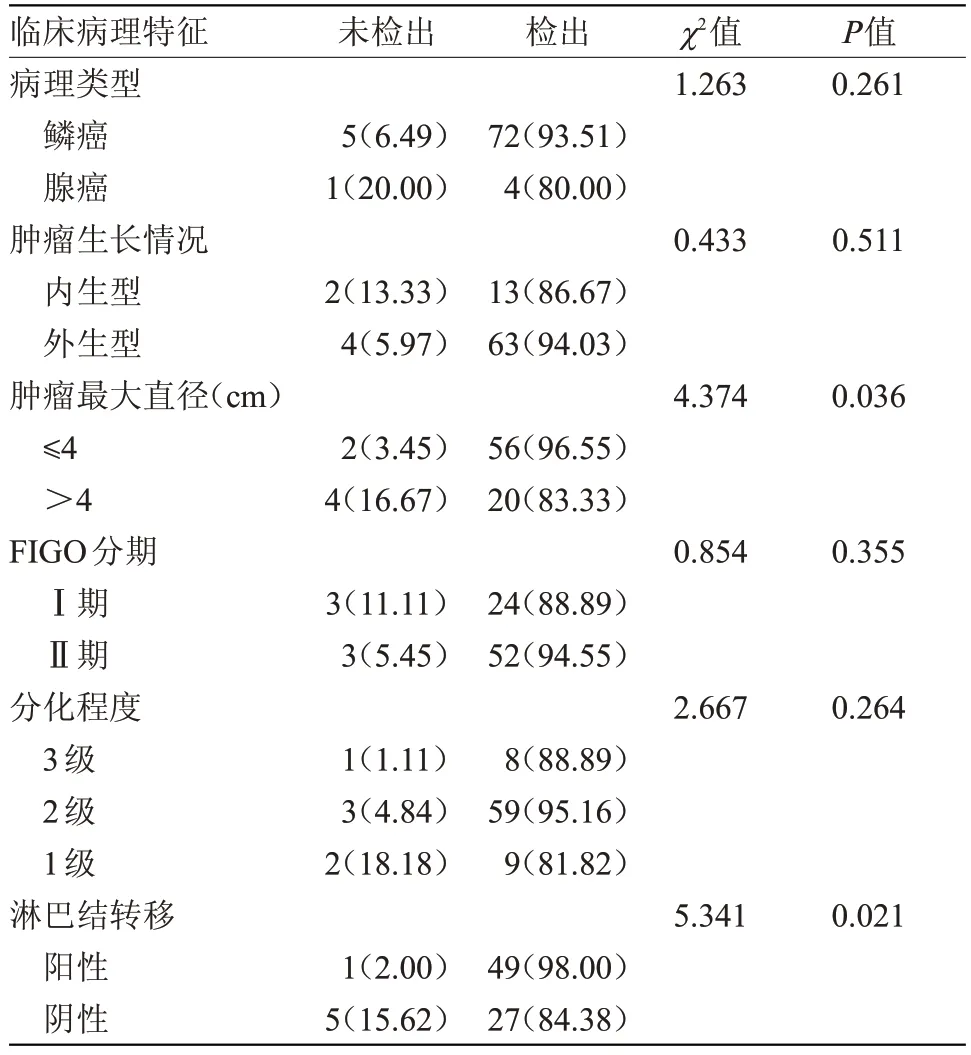
表2 临床病理特征与SLN检出率关系[n(%)]
2.3 临床病理特征与淋巴结转移关系 82 例患者有50 例患者发现淋巴结转移,转移率为60.98%(50/82)。其中内生型肿瘤淋巴结转移率为33.33%,外生型肿瘤淋巴结转移率为67.16%,不同肿瘤生长情况淋巴结转移率比较差异有统计学意义(P<0.05);≤4 cm淋巴结转移率为53.45%,>4 cm淋巴结转移率为79.17%,不同肿瘤最大直径淋巴结转移率比较差异有统计学意义(P<0.05);FIGO 分期Ⅰ期淋巴结转移率为57.69%,Ⅱ期淋巴结转移率为62.50%,不同FIGO 分期淋巴结转移率比较差异有统计学意义(P<0.05);分化程度3级淋巴结转移率为33.33%,2级淋巴结转移率为69.35%,1级淋巴结转移率为36.36%,不同分化程度淋巴结转移率比较差异有统计学意义(P<0.05);患者病理类型淋巴结转移率差异无统计学意义。见表3。
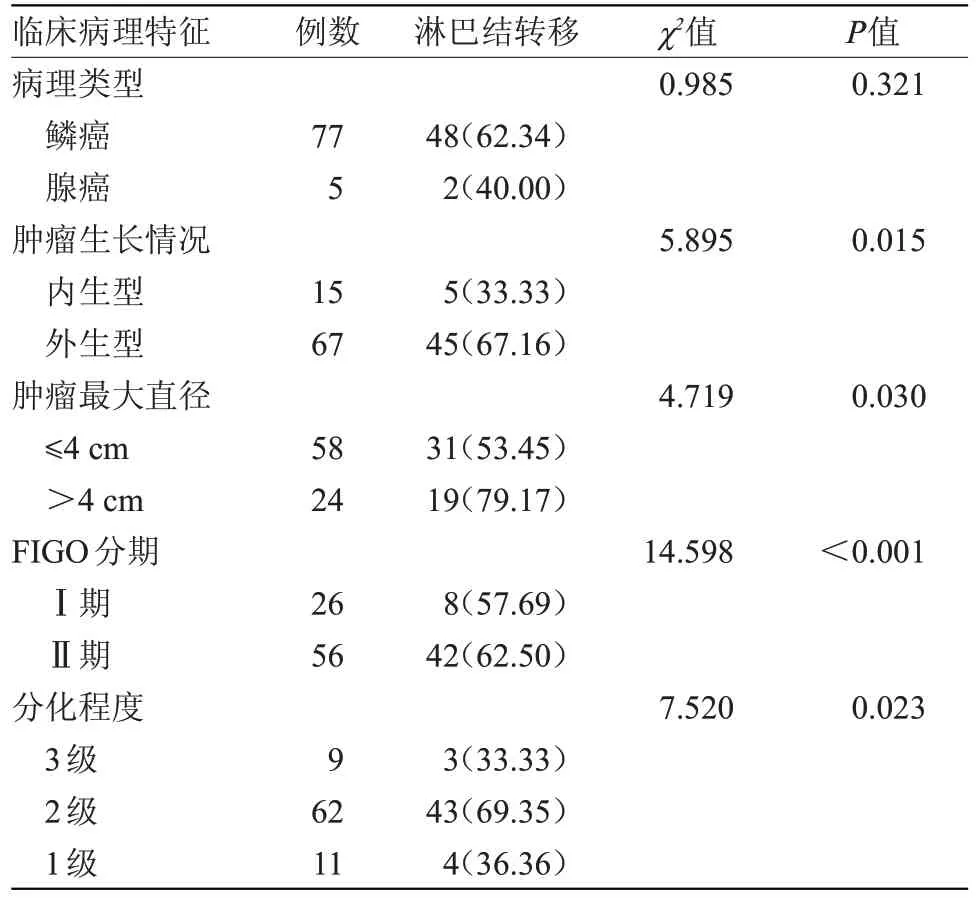
表3 临床病理特征与淋巴结转移关系[n(%)]
2.4 诊断盆腔淋巴结转移与金标准之间的一致性SLN 活检的灵敏度为 98.00%(49/50),特异度为84.38%(27/32),准确率为92.68%(76/82),阳性预测值为90.74%(49/54),阴性预测值为96.42%(27/28),假阴性率为1.32%(1/76),假阳性率为6.58%(5/76),见表4。

表4 诊断盆腔淋巴结转移与金标准之间的一致性
3 讨论
宫颈癌是最常见的妇科恶性肿瘤之一,严重威胁女性健康,根据世界卫生组织的统计数据,宫颈癌每年新增病例53万,约25万女性因宫颈癌死亡,其中发展中国家占比80%[6]。NCCN 指南指出影响早期宫颈癌的高危因素主要是淋巴结转移,推荐对早期宫颈癌患者进行PET-CT检查以诊断有无盆腔淋巴结转移,但是其敏感性和特异性明显低于病理学检查,尤其针对微转移的诊断[7]。而SLNB为诊断早期宫颈癌患者盆腔淋巴结转移情况提供了新的方向,由于淋巴道转移为宫颈癌肿瘤细胞的主要转移途径,因此,该部位的淋巴引流有律可寻,证明SLNB在宫颈癌中临床应用的可能性。在早期宫颈癌患者中进行SLN示踪术,是希望能用其替代传统的盆腔淋巴结清扫术,减少不必要的淋巴结清扫,减少术中及术后并发症。国外SLNB 研究报道,宫颈癌患者进行SLNB,其检出率指标范围为90%~100%,假阴性率指标范围为0~11%,敏感性指标范围为82.3%~100%[8]。本研究结果显示,SLN 检测的灵敏度为98.00%,特异度为84.38%,准确率为92.68%,假阴性率为1.32%,可高效诊断早期宫颈癌患者淋巴结转移情况,与上述研究结果基本相符,说明临床采取SLNB诊断早期宫颈癌患者盆腔淋巴结转移情况具有可行性。
亚甲蓝注射液颗粒小,弥散快,颜色清晰持久,能延长淋巴管蓝染时间,适合前哨淋巴结示踪[9]。本研究采用亚甲蓝联合使用核素进行示踪,共发现82例患者至少有1处SLN,共检出266枚,检出率为92.68%,表明双示踪更能有效诊断出淋巴结转移。SLNB检测可以有效定位需要进行淋巴结切除的部位,且不受病理类型、肿瘤生长情况等外界因素影响,可作为诊断淋巴结转移情况的重要工具[10]。本研究纳入82例Ⅰ~Ⅱ期子宫颈癌患者,发现其SLN检出率与病理类型、肿瘤生长情况、FIGO分期及分化程度均无明显关联,与上述研究报道结论基本相符,表明SLNB 能够有效诊断早期子宫颈癌患者的盆腔淋巴结转移情况。
综上所述,SLNB 在早期宫颈癌中联合使用99Tcm标记的硫胶体和亚甲蓝示踪SLN,诊断评估患者盆腔淋巴结转移状况安全有效,在客观医疗条件较差和医生技术水平不足的区域均可进行,值得临床推广应用。本研究仅初步探讨了SLNB对早期宫颈癌患者盆腔淋巴结的诊断,样本量较少,尚需进一步增加样本量深入研究。
