云南省烟草镰刀菌根腐病菌遗传多样性分析
2022-11-10盖晓彤代快户艳霞王继明姜宁卢灿华夏振远
盖晓彤,代快,户艳霞,王继明,姜宁,卢灿华,夏振远
云南省烟草镰刀菌根腐病菌遗传多样性分析
盖晓彤1*,代快2,户艳霞3,王继明4,姜宁1,卢灿华1,夏振远1
1 云南省烟草农业科学研究院,云南昆明五华区圆通街33号 650031;2 云南省烟草公司玉溪市公司,云南玉溪红塔区凤凰路102号 653100;3 云南省烟草公司大理州公司,云南大理下关鹤庆路71号 671000;4 云南省烟草公司临沧市公司,云南临沧临翔区南天路200号 677300
【背景和目的】尖孢镰刀菌()引起的根腐病是烟草主要的土传病害,在云南烟区普遍发生。为分析云南省不同地理来源尖孢镰刀菌的遗传差异性和亲缘关系。【方法】采用ISSR(inter-simple sequence repeat)和SRAP(sequence- related amplified polymorphism)分子标记技术分析40株菌株遗传多样性。【结果】(1)采用ISSR技术,供试的7条引物共扩增出53条条带,其中多态性条带44条,平均多态性条带83.02%。菌株间的遗传相似系数为0.49~0.96,存在遗传背景差异。遗传相似系数为0.68时,40株菌株可分为3个类群。(2)采用SRAP技术,供试的7对引物共扩增出44条条带,其中多态性条带32条,平均多态性条带72.73%,菌株间的遗传相似系数为0.55~0.96。遗传相似系数为0.70时,40株菌株可分为3个类群,结果与ISSR一致。【结论】云南省烟草尖孢镰刀菌菌株间遗传差异大,ISSR和SRAP分子标记技术可用于烟草尖孢镰刀菌的遗传多样性分析。
烟草镰刀菌根腐病;尖孢镰刀菌;遗传多样性;ISSR;SRAP
烟草镰刀菌根腐病(tobacco fusarium root-rot)是烟草主要的土传病害之一,在烟草苗期至大田期均可发生,发病率3%~5%,重病田的发病率可达30%以上[1]。近年来,烟草镰刀菌根腐病的发生范围不断扩展[2],2009年全国16个主产烟区中仅福建、河南报道该病害,2012年增至7个省份[3]。尖孢镰刀菌寄主范围广,能侵染多种作物[4-5],既可单独侵染,也可与其他病害混合侵染[6-7]。该菌遗传性复杂,易变异,具有明显的生理分化和高度寄主专化性[8],依据致病性可在种下分化为不同专化型,有些专化型又可划分出不同的生理小种和变种[9],采用传统的形态学分类和致病性等技术手段不能准确揭示该菌的进化关系。
DNA分子标记技术已被广泛应用于真菌类群的遗传多样性研究,国内外学者开发出RAPD、RFLP、AFLP、ISSR等诸多方法[10-13]。其中ISSR(inter-simple sequence repeat)分子标记技术[14]具有高度的稳定性和丰富的多态性特点,在镰刀菌遗传多样性研究中具有独特优势[15-16],如镰刀菌种间、种内遗传差异性研究[17];镰刀菌种间遗传差异性和亲缘关系研究[18];玉米禾谷镰刀菌不同地理位置种群的遗传变异研究[19];不同地理来源的尖孢镰刀菌多样性分析[20]。SRAP(sequence- related amplified polymorphism)相关序列扩增多态性技术[21]具有稳定性高、重复性强、共显性高、便于克隆测序等优点,在镰刀菌遗传多样性分析中得到应用,延涵等[22]用于研究地理来源不同的尖孢镰孢菌的遗传差异;田叶韩等[23]用于研究不同寄主、不同地理来源的瓜类枯萎病菌的遗传多样性和亲缘关系;刘丽芳等[24]用于研究尖孢镰孢菌西瓜专化型菌株间亲缘关系与地理来源的相关性。
病原菌的遗传多样性研究可为病原分子分类、遗传演变与进化提供理论依据,不仅可以对传统分类学所反映的亲缘关系做出更科学的评价,还能根据病原菌的遗传关系指导病害的防控与抗病育种[25]。镰刀菌根腐病在云南省各州(市)普遍发生,但尚无关于烟草镰刀菌根腐病遗传多样性的研究报道。本文采用ISSR与SRAP两种分子标记对云南省主要烟区尖孢镰刀菌进行遗传多样性分析,解析了云南省主要烟区优势镰刀菌间的遗传差异与亲缘关系。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
烟草尖孢镰刀菌菌株(表1),2019—2021年由云南省烟草农业科学研究院采自云南省10个州市。
表1 40株尖孢镰刀菌菌株信息表

Tab.1 Information of 40 Fusarium oxysporum isolates
1.1.2 供试引物
SRAP引物:序列参照文献[26],由上海生工生物公司合成(表2)。
ISSR引物:从加拿大哥伦比亚大学(UBC)公布的100个通用引物序列中,筛选出7条可用于本研究的引物,由上海生工生物公司合成(表3)。
表2 SRAP引物序列

Tab.2 SRAP Primer sequence
1.2 试验方法
1.2.1 病原菌的分离与纯化
尖孢镰刀菌分离培养采用组织分离法,菌株纯化采用单孢分离法。
1.2.2 DNA的提取及检测
将纯化菌株接种至PDB培养液中富集菌丝,采用DNA提取试剂盒(Fungal DNA Kit,Omiga)提取菌丝DNA,使用Nano Drop ND 2000 蛋白核酸测定仪检测DNA的纯度与浓度。
1.2.3 反应体系与反应参数
ISSR引物筛选与扩增:PCR反应体系(20 µL),包括10 μL2×PCR-mix(大连Takara公司),1 µL DNA模板(50 ng/μL),0.4 µmol 引物,ddH2O补足至20 μL。PCR扩增反应程序:94℃预变性5 min;94℃变性30 s,50~55℃退火45 s(各引物间最适温度不同),72℃延伸30 s,37个循环;72℃终延伸10 min。
在50~56℃间设置不同梯度,根据预实验电泳图谱中各条带的明亮程度获得每个引物的最佳退火温度。
SRAP引物筛选与扩增:PCR反应体系(20 µL),包括10 μL2×PCR-mix(大连Takara公司),1 µL DNA模板(50 ng/μL),0.4 µmol 引物,ddH2O补足至20 μL。PCR反应程序:94℃预变性5 min;94℃变性1 min,35℃复性1 min,72℃延伸1 min,5个循环;94℃变性1 min,50℃复性1 min,72℃延伸1 min,35个循环;72℃终延伸10 min。
随机选取8个基因组DNA,对8个上游引物(Me)和8个下游引物(Em)的64对引物组合进行PCR扩增,筛选出条带清晰、多态性丰富且重复性好的引物。
利用筛选获得的引物对40株菌株基因组进行PCR扩增,取5 µL的PCR产物在1.5%琼脂糖凝胶电泳检测,使用紫外凝胶成像系统拍照分析。
1.2.4 数据统计与分析
分别统计ISSR和SRAP的扩增图谱,按照每个位点的条带有无计数1或0,统计总条带数与多态性条带数,计算多态性比率;利用NT-SYS 2.1.0e软件UPMGA算法进行聚类分析并绘制聚类分析图。
2 结果
2.1 ISSR分子标记
2.1.1 ISSR引物筛选与扩增
供试100条引物中共筛选出7条背景清晰且多态性丰富的ISSR引物用于尖孢镰刀菌的PCR扩增,优化退火温度及扩增条带数(表3)。40株尖孢镰刀菌共扩增到53条谱带,其中44条表现多态性,多态性比率83.02%。各引物的扩增条带数分布在7~9条之间,平均每条引物扩增7.57条多态性谱带,多态性条带比例为62.50%~100.00%,所有引物均表现出较高的扩增多态性,表明ISSR分子标记可用于尖孢镰刀菌遗传多样性分析。
表3 40株尖孢镰刀菌菌株的7条ISSR引物PCR扩增结果
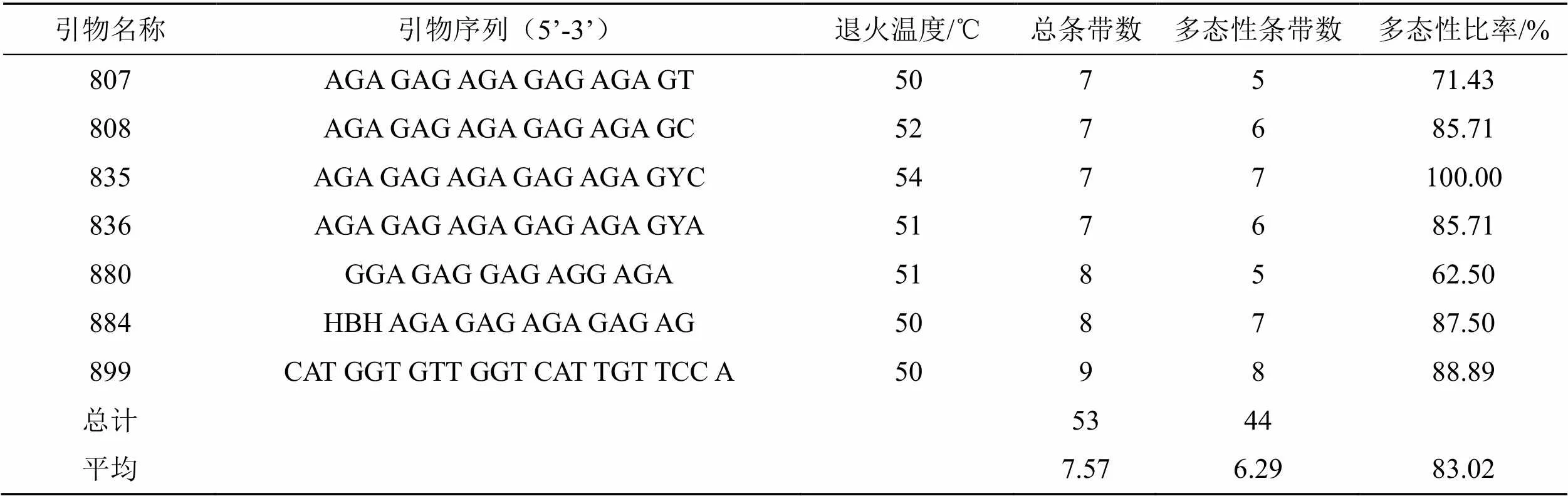
Tab.3 PCR amplification of seven ISSR primers of 40 Fusarium oxysporum isolates
注:*Y=(C,T); B=(C,G,T); H=(A,C,T)。
2.1.2 遗传多样性分析
通过NT-SYS 2.1.0e软件计算得出,供试40株尖孢镰刀菌菌株间的遗传相似系数为0.49~0.96,表明供试菌株间遗传变异较大。各菌株间的遗传相似系数与地理来源没有明显的相关性,其中来自普洱的菌株20和来自红河的菌株21遗传相似系数最大,亲缘性最近;而同来自红河的菌株37和菌株6遗传相似系数最小,亲缘性最远(表4)。
表4 40株尖孢镰刀菌ISSR遗传相似系数
Tab.4 Genetic similarity coefficient of ISSR among 40isolates

2.1.3 聚类分析
在遗传相似系数0.68处可将40株菌株划分为3个类群。第1个类群29株菌株,第2类群5株菌株,第3类群6株菌株。从地理分布可知,第1类群的菌株涵盖10个州市,第2类群的菌株分布于曲靖、普洱、红河以及临沧,第3类群的菌株仅分布于红河与昆明。
同一州市来源的菌株具有不同的遗传背景。红河州的9株菌株聚类在3个类群中,亲缘关系较远;昆明市的5株菌株聚类于第1和第3类群;普洱市的6株菌株聚类于第1和第3类群;临沧市的7株菌株有6株聚集在第1类群;来源于文山州、玉溪市的菌株遗传背景相似。
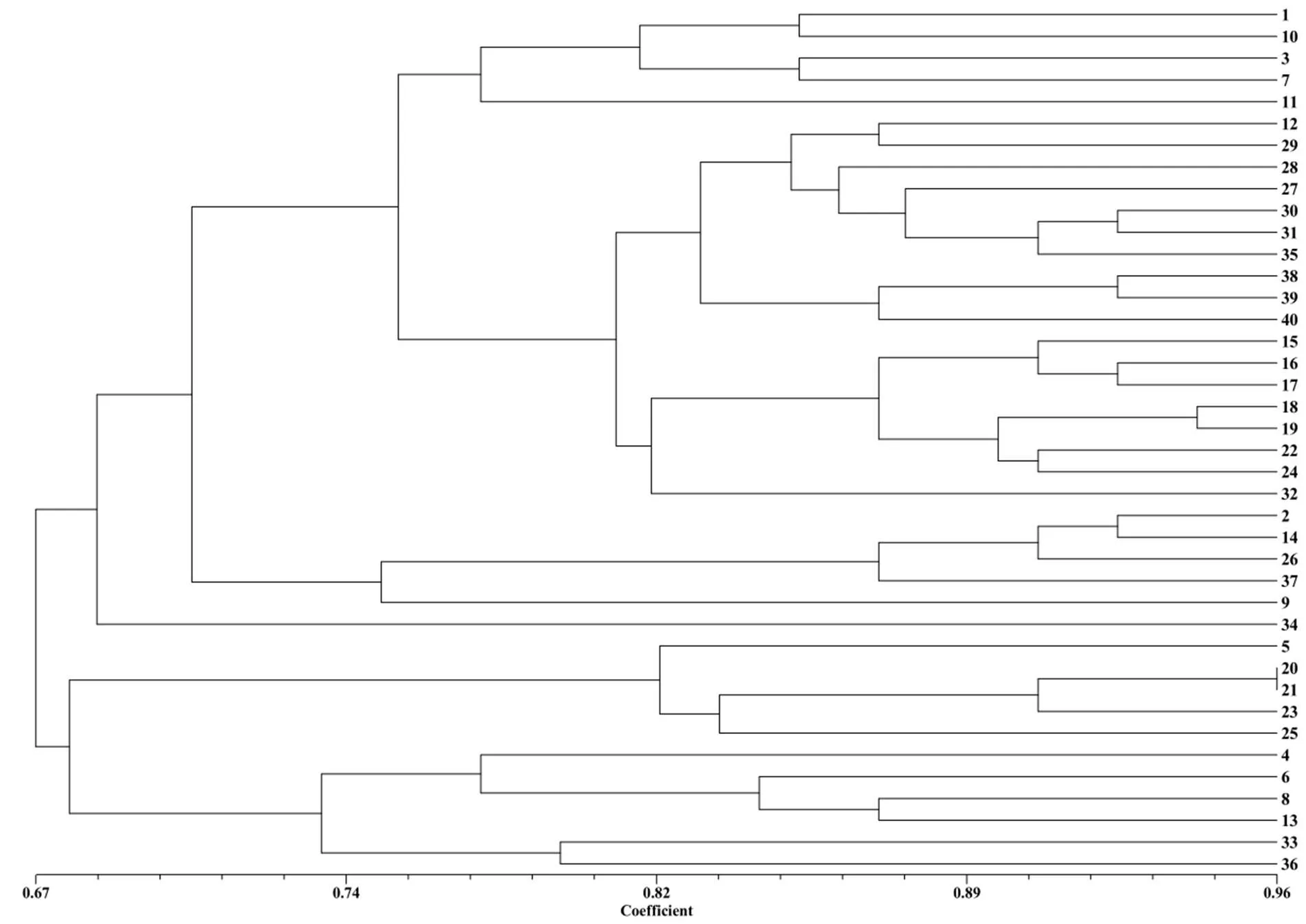
图1 40株尖孢镰刀菌菌株ISSR-PCR标记的UPGMA聚类图
2.2 SRAP分子标记
2.2.1 SRAP引物筛选与扩增
筛选获得7对条带清晰、多态性丰富且重复性较好的SRAP引物(表5)。40株尖孢镰刀菌共扩增出44条条带,其中多态性条带32条,多态性比率72.73%。各引物的扩增条带数在5~8条之间,平均每对引物扩增出6.29条,其中扩增条带数最多为8条,扩增条带数最少为5条。多态性条带比例为50.00%~100.00%。
表5 7对SRAP引物对于40株尖孢镰刀菌菌株的PCR扩增结果

Tab.5 PCR amplification of 40 Fusarium oxysporum isolates using seven SRAP primers
2.2.2 遗传多样性分析
遗传相似系数结果显示,40株尖孢镰刀菌的遗传相似系数在0.55~0.96,表明供试菌株间遗传变异较大。各菌株间的遗传相似系数与地理来源没有明显的相关性,其中菌株20(来源普洱)和菌株21(来源红河),菌株10和菌株19(来源临沧),以及菌株14和菌株37(来源红河)遗传相似系数最大,亲缘性最近;而菌株38(来源普洱)和菌株23(来源曲靖)遗传相似系数最小,亲缘性最远(表6)。
表6 40株尖孢镰刀菌SRAP遗传相似系数
Tab.6 Genetic similarity coefficient of SRAP among 40isolates

2.2.3 聚类分析
在遗传相似系数0.70处可将40株菌株划分为3个类群。每个类群与ISSR聚类结果中的3个类群菌株相同。因此,ISSR与SRAP技术在本研究中分析结果一致,本研究的结论具有一定的可靠性。
3 讨论
本研究参试的40株菌株采集区域覆盖云南省10个州市,具有一定的代表性,ISSR和SRAP标记技术对尖孢镰刀菌遗传多样性分析的结果具有一致性,均可划分为3个类群;SRAP显示遗传相似系数为0.55~0.96,ISSR为0.49~0.96,表现出菌株间的遗传多态性。多态性比率是衡量物种遗传多样性水平的重要指标,ISSR和SRAP的分析结果显示,多态性比率分别在83.02%和72.73%,表现出较高的多态性。从分子水平来看,遗传距离变幅越大,样本的遗传分化越大,遗传多样性越高,遗传背景越复杂[27]。因此,参试的40株菌株具有较丰富的遗传多样性,遗传信息位点丰富,菌株间存在分子遗传差异。
遗传多样性与地理分布关系表明,3个类群中类群1的29株菌株分布在所有采集区域,类群2的5株菌株分布在普洱、曲靖宣威、红河弥勒以及临沧永德;类群3仅包括红河州的4株菌株与昆明石林的2株菌株。从地理来源分析,文山州的3株菌株均聚类于第1类群,亲缘关系近;玉溪市的3株菌株聚类于第1类群,菌株的亲缘关系近。而红河的9株菌株则分别聚类在3个不同类群中,临沧的8株菌株和普洱的7株菌株聚类于第1和第2类群,昆明的5株菌株聚类于第1和第3类群。可以看出,分离自同一区域的菌株间也存在遗传差异,菌株间的遗传相似系数与地理来源没有明显的相关性。
Bentley等研究表明,镰刀菌在很小的地理隔离就有多样性,甚至在间隔l m的种植行种群就出现明显的差异[28]。本研究中,参试菌株间的遗传关系同样与地理间隔没有关系,相同地块来源的菌株间表现出明显的遗传差异,这一结论和已报道的研究结果一致[29-31]。造成这种结果的原因可能与尖孢镰刀菌变异快,受气候条件或土壤环境等多方面影响有关。
4 结论
本研究中,ISSR与SRAP分析结果一致,可将40株烟草尖孢镰刀菌菌株分为3个类群,种间具有较高的遗传差异,遗传多样性丰富;研究结果可为烟草尖孢镰刀菌的遗传差异和亲缘关系研究以及病害防控提供一定的理论依据。
[1] 田艳艳,王伟杰,苗圃,等. 河南烟草镰刀菌的初步分子鉴定[J].烟草科技,2014, (11): 89-92.
TIAN Yanyan, WANG Weijie, MIAO Pu, et al. Preliminary molecular identification ofinfecting tobacco in Henan[J]. Tobacco Science & Technology, 2014, (11): 89-92.
[2] 赵杰. 山东省烟草镰刀菌根腐病病原及生物学特性的研究[D].北京:中国农业科学院, 2013.
ZHAO Jie. Identification and study on biological characteristics of the pathogen of Fusarium causing tobacco root-rot in Shandong province[D]. Beijing: Chinese Academy of Agriculture Sciences, 2013.
[3] 陈瑞泰,朱贤朝,王智发,等. 全国16个主产烟省(区)烟草侵染性病害调研报告[J]. 中国烟草科学,1997(4): 1-7.
CHEN Ruitai, ZHU Xianchao, WANG Zhifa, et al. A report of investigating and studying tobacco infectious diseases of 16 main tobacco producing provinces (regions) in China [J]. Chinese Tobacco Science, 1997(4): 1-7.
[4] 陈鸿逵,王拱辰. 浙江镰刀菌志[M]. 杭州:浙江科学技术出版社, 1992.
CHEN Hongkui, WANG Hongchen. Zhejiang Fusarium[M]. Hangzhou: Zhejiang Science and Technology Press, 1992.
[5] 裴月令,曾凡云,彭军,等. 尖孢镰刀菌与寄主互作机理研究进展[J]. 热带生物学报,2014, 5(1): 92-100.
PEI Yueling, ZENG Fanyun, PENG Jun, et al. Advances inwilt disease and the mechanism of interaction betweenand its host[J]. Journal of Tropical Biology, 2014, 5(1): 92-100.
[6] 钱恒伟,徐鹏程,迟梦宇,等. 尖孢镰刀菌与极细链格孢复合侵染引起甘薯茎枯病[J]. 植物保护学报,2017, 44(5): 867-868.
QIAN Hengwei, XU Pengcheng, CHI Mengyu, et al. Mixed infection byandon sweet potatowilt[J]. Journal of Plant Protection, 2017, 44(5): 867-868.
[7] 符美英,肖彤斌,吴凤芝,等. 南方根结线虫、香蕉穿孔线虫和尖孢镰刀菌4号生理小种对巴西蕉致病力的测定[J]. 广东农业科学,2014, 41(1): 56-60.
FU Meiying, XIAO Tongbin, WU Fengzhi, et al. Determination of virulence of,andf. sp.race 4 on banana[J]. Guangdong Agricultural Sciences, 2014, 41(1): 56-60.
[8] Mysaa Al, Aladdin H, Seid A, et al. Genetic diversity off. sp.isolates affecting chickpea in Syria[J]. Crop Protection, 2019, 104863.
[9] Kaur R, Kaur J, Rama RS. Nonpathogenic Fusarium as a biological control agent[J]. Plant Pathology Journal, 2010, 61(10): 1213- 1217.
[10] Guadet J, Julien J, Lafay JF, Brygoo Y. Phylogeny of somespecies, as determined by large-subunit rRNA sequence comparison[J]. Molecular Biology and Evolution, 1989(6): 227- 242.
[11] O’Donnell K, Cigelnik E, Nirenberg HI. Molecular systematics and phylogeography of theSpecies Complex[J]. Mycologia, 1998, 90: 465-493.
[12] Yli-Mattila T, Paavanen-Huhtala S, Bulat SA, et al. Molecular,morphological and phylogenetic analysis of the/species complex: A polyphasic approach[J]. Mycological Research, 2002, 106: 655-669.
[13] Pavlina K, Tapani YM. IGS-RFLP analysis and development of molecular markers for identification of,,and[J]. Interna-tional Journal of Food Microbiology, 2004, 95(3): 321-331.
[14] Zietkiewicz E, Rafalski A, Labuda D. Genome fingerprinting by simple sequence repeat (SSR) anchored polymerase chain reaction amplification[J]. Genomics, 1994, 20(2): 176-183.
[15] Tsumura Y, Ohba K, Strauss SH. Diversity and inheritance of inter- simple sequence polymorphisms in Douglas-fir ()and Sugi ()[J]. Theoretical and AppliedGenetics, 1996, 92: 40-45.
[16] Mishra PK, Fox RTV, Culham A. Inter-simple sequence repeat and aggressiveness analyses revealed high genetic diversity recombination and long-range dispersal in[J]. Annals of Applied Biology, 2003, 143: 291-301.
[17] 李蕊倩,何瑞,张跃兵,等. 镰刀菌ISSR标记体系的建立及遗传多样性分析[J]. 中国农业科学,2009, 42(9): 3139-3146.
LI Ruiqian, HE Rui, ZHANG Yuebing, et al. Establishment of ISSR reaction system ofand its analysis of genetic diversity. Scientia Agricultura Sinica, 2009, 42(9): 3139-3146.
[18] 王建明,李蕊倩,畅引东,等. 尖孢镰刀菌及芬芳镰刀菌遗传多样性的ISSR分析[J]. 植物病理学报,2011, 41(4): 337-344.
WANG Jianming, LI Ruiqian, CHANG Yindong, et al. ISSR analysis of genetic diversity ofand. ACTA Phytopathologica Sinica, 2011, 41(4): 337-344.
[19] 何婧. 玉米茎腐病病原菌分离鉴定与镰孢菌群体遗传多样性研究[D]. 乌鲁木齐:新疆农业大学,2010.
HE Jing. Isolation, identification of causal agents of maize stalk rot and genetic diversity analysis ofspp[D]. Urumchi: Xinjiang Agricultural University, 2010.
[20] 张述义,李新凤,韦晓艳,等. 33株尖孢镰刀菌遗传多样性的ISSR分析[J]. 生态学杂志, 2013, 32(5): 1195-1202.
ZHANG Shuyi, LI Xinfeng, WEI Xiaoyan, et al. Genetic diversity of 33strains: An ISSR analysis[J]. Chinese Journal of Ecology, 2013, 32(5): 1195-1202.
[21] Li G, Quiros CF. Sequence-related amplified polymorphism (SRAP), a new marker system based on a simple PCR reaction: its application to mapping and gene tagging in Brassica[J]. Theoretical and Applied Genetics, 2001, 103: 455-461.
[22] 延涵,杨瑞秀,姚远,等. 东北地区甜瓜枯萎病菌遗传多样性分析[J]. 北方园艺,2017, (11): 130-134.
YAN Han, YANG Ruixiu, YAO Yuan, et al. Diversity analysis ofin northeast of China[J]. Northern Horticulture, 2017, (11): 130-134.
[23] 田叶韩,侯圆圆,彭彩云,等. 瓜类枯萎病菌遗传多样性和亲缘关系的SRAP分析[J]. 应用生态学报,2017, 28(3): 947-956.
TIAN Yehan, HOU Yuanyuan, PENG Caiyun, et al. Genetic diversity and phylogenetic analysis ofstrains isolated from the Cucurbitaceae hosts revealed by SRAP[J]. Chinese Journal of Applied Ecology, 2017, 28(3): 947-956.
[24] 刘丽芳,肖姬玲,张屹,等. 西瓜枯萎病菌遗传多样性的相关序列扩增多态性分析[J]. 植物保护,2018, 44(5): 194-198.
LIU Lifang, XIAO Jiling, ZHANG Yi, et al. Genetic diversity analysis off.sp.by sequence-related amplified polymorphism[J]. Plant Protection, 2018, 44(5): 194- 198.
[25] Dubey SC, Singh SR. Virulence analysis and oligonucleotide fingerprinting to detect diversity among Indian isolates off. spcausing chickpea wilt [J]. Mycopathologia, 2008, 165(6): 389-406.
[26] 张旭. 基于表型性状及SRAP标记的马铃薯遗传多样性评价[D]. 山西:山西农业大学,2019.
ZHANG Xu. Genetic diversity assessment of potato based on phenotypic traits and SRAP markers[D]. Shanxi: Shanxi Agriculture University, 2019.
[27] Martins M, Tenreiro R, Oliveira MM. Genetic relatedness of Portuguese almond cultivars assessed by RAPD and ISSR markers[J]. Plant Cell Reports, 2003, 22(1): 71-78.
[28] Bentley A R, Milgroom M G, Leslie J F, et al. Spatial aggregation inpopulations from the Australian grain belt[J]. Plant Pathol, 2009, 58: 23-32.
[29] Cramer RA, Byrne PF, Brick MA, et al. Characterization ofisolates from common bean and sugarbeet using pathogenicity assays and random-amplified polymorphic DNA markers[J]. Journal of Phytopathology, 2003, 151(6): 352-360.
[30] Dinolfo MI, Sebastian SA, Moreno MV. ISSR markers detect high genetic variation amongisolates from Argentina and England[J]. European Journal of Plant Pathology, 2010,127: 483-491.
[31] 孙常青,屈非,王晋,等. 57株镰孢菌ISSR分子标记及其遗传多样性分析[J]. 中国农业大学学报,2019, 24(5) : 98-105.
SUN Changqing, QU Fei, WANG Jin, et al. Genetic diversity of 57strains based on ISSR analysis[J]. Journal of China Agricultural University, 2019, 24(5): 98-105.
Genetic diversity ofisolates causing Tobacco Root Rot in Yunnan
GAI Xiaotong1*, DAI Kuai2, HU Yanxia3, WANG Jiming4, JIANG Ning1, LU Canhua1, XIA Zhenyuan1
1 Plant Protection, Yunnan Academy of Tobacco Agricultural Sciences, Kunming 650031, China;2 Technique Center, Yuxi Tobacco Company of Yunnan, Yuxi 653100, China;3 Technique Center, Dali Tobacco Company of Yunnan, Dali 671000, China;4 Technique Center, Lincang Tobacco Company of Yunnan, Lincang 677300, China
[] Root rot caused by Fusarium oxysporum is the main soil-borne disease of tobacco, which occurs in most of the tobacco growing areas in Yunnan province.is the major pathogen causing tobacco root rot. In order to understand the genetic difference and phylogenic relationship among theisolates collected from the different major tobacco growing areas in Yunnan, the genetic diversity of 40isolates separated from diseased plants was examined. [] The genetic diversity of forty Fusarium root rot pathogen isolates collected from different tobacco growing areas in Yunnan province were studied using inter-simple sequence repeats (ISSR) and sequence related amplified polymorphism (SRAP) molecular marker technology. [] (1) A total of 53 loci were obtained using 7 ISSR primers and 44 loci were polymorphic, and the average polymorphism ratio was 83.02%. UPGMA cluster analysis and genetic similarity coefficient showed that 40isolates could be grouped into three distinct families based on similarity coefficient of 0.68. The similarity coefficient of the 40 isolates ranged from 0.49 to 0.96, indicating differences in the genetic background. (2) Using SRAP molecular markers technology, 44 bands were amplified by 7 pairs of primers, including 32 loci polymorphic bands, the average polymorphism ratio was 72.73%, and the similarity coefficient ranged from 0.55 to 0.96. In the UPGMA cluster analysis, the result of SRAP was consistence with ISSR, 40 isolates could be categorized into three distinct families based on the similarity of 0.7. [] ISSR and SRAP markers were both available in the genetic diversity analysis of, and the tested isolates showed high degree of genetic differentiation.
TobaccoFusarium root rot;; genetic diversity; ISSR;SRAP
. Email:gaixiaotong0617@163.com
盖晓彤,代快,户艳霞,等. 云南省烟草镰刀菌根腐病菌遗传多样性分析[J]. 中国烟草学报,2022,28(5).
GAI Xiaotong, DAI Kuai, HU Yanxia, et al. Genetic diversity of Fusarium oxysporum isolates causing Tobacco Root Rot in Yunnan, 2022,28(5).
10.16472/j.chinatobacco. 2022.017
云南省烟草公司科技计划项目“烟草镰刀菌根腐病发生规律及防控研究”(No. 2020530000241012);云南省科技厅科技计划项目“云南省烟草镰刀菌根腐病病原鉴定及遗传多样性分析”(No. 202001AU070012)
盖晓彤(1990—),博士,助理研究员,从事烟草植保研究,Tel:13368777940,Email:gaixiaotong0617@163.com
2022-02-15;
2022-06-22
