烤烟伸根期对低温胁迫的生理响应
2022-11-10谢小玉侯爽郭金格汪芬芬崔凯东杨奇陈锦芬顾开元
谢小玉,侯爽,郭金格,汪芬芬,崔凯东,杨奇,陈锦芬,顾开元
农艺与调制
烤烟伸根期对低温胁迫的生理响应
谢小玉,侯爽,郭金格,汪芬芬,崔凯东,杨奇,陈锦芬,顾开元
西南大学农学与生物科技学院,重庆北碚,400716
【目的】研究低温胁迫对伸根期的烤烟生理特性的影响。【方法】采用盆栽方式,在人工培养箱中对耐冷性不同的烤烟品种红花大金元(低温不敏感型)和K326(低温敏感型)进行低温胁迫处理,研究不同低温胁迫时间烤烟的渗透调节物质、保护酶活性、多酚代谢、光合速率和光合色素等的变化情况,筛选出适用于烤烟耐冷性鉴定的指标。【结果】随低温胁迫时间的延长,烤烟的净光合速率和叶绿素耐冷系数呈下降趋势,下降速率与低温胁迫程度呈正相关,与品种的耐低温能力呈负相关;丙二醛和相对电导率耐冷系数在低温胁迫的前3 d随胁迫时间的延长呈上升趋势,上升速率与品种耐低温能力呈负相关;过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、多酚氧化酶(PPO)和苯丙氨酸解氨酶(PAL)活性和可溶性蛋白、可溶性糖及总酚耐冷系数随低温胁迫时间的延长先升高后下降,低温不敏感型材料上升速度高于低温敏感型材料。相关分析表明,低温胁迫下,烟叶相对电导率耐冷系数与叶绿素、净光合速率、SOD活性的耐冷系数呈极显著负相关,与可溶性蛋白、POD活性、PAL活性的耐冷系数呈显著负相关,与丙二醛、叶绿素a/b的耐冷系数呈显著正相关。主成分分析表明,决定烤烟抗低温能力的第一主成分主要是烟叶相对电导率、丙二醛、可溶性糖、可溶性蛋白、叶绿素(a+b)、叶绿素a/b、SOD活性、POD 活性、总酚和净光合速率的耐冷系数;第二主成分主要包括CAT活性、PPO活性、PAL活性的耐冷系数。【结论】在连续低温胁迫下,烤烟叶片相对电导率、叶绿素、净光合速率、SOD活性的耐冷系数可作为其耐冷种质筛选的依据。烟叶耐低温评价可以渗透调节因子、抗氧化因子及光合作用因子耐冷系数为主要鉴选指标,以多酚代谢因子耐冷系数为次要鉴选指标。
烤烟;低温胁迫;抗氧化酶;多酚代谢;渗透调节;光合
烟草对低温较为敏感。我国大部分烟区自然气候适宜,但仍然存在气温较低或者气温波动较大的极端气候[1]。尤其在南方烟区,倒春寒带来的低温冷害问题普遍存在[2],导致烟苗生长迟缓,烟叶早花、叶狭长、产量降低[3]。了解烤烟对低温的适应机制及抗低温评价指标和方法,提高烤烟抗低温能力是减少低温对烤烟造成损失的重要途径。
前人研究了油菜[4]、小麦[5]、高粱[6]、棉花[7]、海滨雀稗[8]等植物对低温胁迫的生理响应。研究表明,低温胁迫破坏植物叶绿体结构,使叶绿素生物合成受阻[9],叶片内叶绿素a、叶绿素b的含量及叶绿素a/b值均下降[10],光合作用受到抑制[11],叶片净光合速率(Pn)、气孔导度(Gs)以及蒸腾速率(Tr)降低[12-14]。强抗寒品种净光合速率相对较高[15]。低温胁迫还导致植物活性氧类物质积累,引起膜质过氧化物、渗透调节物质和非酶抗氧化剂含量以及抗氧化酶活性变化。具体表现为:低温胁迫下,细胞膜透性、丙二醛含量及脯氨酸含量增加,且抗寒性强的品种增加幅度小[16];植物可通过保护酶系统诸如SOD、POD、CAT、APX等活性上升清除活性氧,减缓低温伤害[8,17-18];同时,植物可通过一些渗透调节物质如脯氨酸、甜菜碱、可溶性糖和可溶性蛋白等物质大量增加,以维持细胞的渗透平衡,减少低温伤害[19];与不耐寒品种相比,耐寒品种有较高过氧化物清除能力和较强渗透调节能力[15]。多酚类物质是构成烟叶品质和香吃味的必备物质[21],而多酚的含量与催化酚类物质生成醌的PPO活性[22]和催化产生酚类前体物质的PAL活性[23]关系密切。研究表明,低温胁迫后,烟叶萎蔫、细胞膜损伤严重,相对电导率升高,CAT活性和总抗氧化能力均低于对照[24],SOD和POD等保护酶活性先升后降,叶绿素含量逐渐减少,可溶性糖与脯氨酸含量增加,可溶性蛋白含量逐渐下降[25-26],MDA含量和PAL酶活性上升[25],而烟叶总酚含量受低温胁迫影响较小。
目前对烟草低温胁迫的相关研究主要侧重于苗期,而对于不同程度和不同持续时间的低温胁迫下不同品种伸根期生理特性变化的研究鲜见报道。本研究采用低温敏感性不同的两个烤烟品种,于伸根期进行3个梯度的低温胁迫处理,探究不同低温敏感型的烤烟伸根期对低温胁迫的生理响应,为阐明烤烟抗低温机制奠定基础,同时对烤烟抗低温品种的选育和鉴定具有重要意义。
1 材料与方法
1.1 供试材料
研究材料为经过抗低温能力鉴定的低温不敏感型红花大金元(简称:红大)和低温敏感型K326两个烤烟品种[27],种子由中国烟草总公司云南省公司提供。
1.2 试验设计
试验于2019年3—12月在西南大学农业生态实验室进行。挑选完整的烟草包衣种子播种于育苗盘中,育苗基质(艾禾稼烟草漂浮育苗专用基质)提前用多菌灵和敌百虫杀菌灭虫,于温室中进行漂浮育苗。幼苗长到4片真叶时,挑选长势好、大小一致的幼苗移栽于装有育苗基质的塑料盆中(盆高17 cm、直径15 cm),移栽后的烟苗放置于相对湿度75%、光照14 h/ 28℃/ 20000 Lx、黑暗10 h/ 25℃的人工气候箱中培养。每隔3 d于早上9:00根施1次1/2 Hoagland营养液直至塑料盆底部见水而不漏水,期间对塑料盆的位置进行随机交换,以保证各个烟苗生长光照条件一致。待长出第11片叶时选择长势一致的烟苗置于4个光照培养箱中进行处理,分别为T0:对照(CK,25℃),T1:轻度低温胁迫(Light cold,LC,16℃)、T2:中度低温胁迫(Mild cold,MC,10℃)和T3:重度低温胁迫(Severe cold,SC,4℃)。每处理3重复,每重复20棵烟株,分别在处理的第0、1、2、3、4、5 d用LI-6400 便携式光合仪测定完全展开的第8~9片叶(从下往上)的净光合速率(Pn)。然后对各处理植株随机选取3株取第7~9片叶,取相对完整的一部分叶片测定相对电导率;再取一部分剪碎混匀后一部分测定叶绿素和丙二醛(MDA)含量;另一部分去掉主叶脉和较大的侧叶脉,液氮速冻,-80℃低温保存后测定POD、SOD、CAT、PPO、PAL酶活性及可溶性糖和可溶性蛋白含量;一部分105℃杀青15 min,75℃烘干粉碎,过30目筛,用于多酚含量测定。
1.3 测定项目及方法
采用彭运生等的方法[28]测定叶绿素含量;参考陈爱葵等的浸泡法[29]测定相对电导率(REC);硫代巴比妥酸法测定丙二醛(MDA)含量,氮蓝四唑法测定超氧化物歧化酶(SOD)活性,愈创木酚法测定过氧化物酶(POD)活性,紫外吸收法测定过氧化氢酶(CAT)活性[30]。采用南京建成生物工程研究所生产的多酚氧化酶(PPO)检测试剂盒(比色法)、苯丙氨酸解氨酶(PAL)检测试剂盒(比色法)和植物总酚检测试剂盒(比色法)、可溶性糖(SS)含量试剂盒(分光光度法)和可溶性蛋白(SP)含量测定试剂盒(分光光度法)测定多酚氧化酶、苯丙氨酸解氨酶活性以及总酚、可溶性糖和可溶性蛋白含量,测定方法参照试剂盒使用说明。
1.4 数据分析
为了消除试验材料基础性状间的差异,参考张鹤等[31]的方法计算耐冷系数(耐冷系数=低温胁迫下测定值/对照下测定值)。利用 Microsoft Excel 2010 对数据进行计算、统计分析和作图,利用 SPSS 16.0对数据进行相关分析和主成分分析。
2 结果与分析
2.1 低温胁迫下烟叶渗透调节物质和丙二醛耐冷系数的变化
如图1所示,低温胁迫下,相对电导率耐冷系数除在重度低温胁迫(4℃)下一直上升外,在轻度及中度胁迫下呈上升下降趋势,第3 d达最大值;低温不敏感型材料比敏感型材料增加幅度小。低温胁迫下,MDA耐冷系数除低温敏感型材料K326在中度和重度胁迫下呈上升趋势外,其他处理呈上升下降趋势,上升幅度与材料抗低温能力呈负相关,与胁迫程度呈正相关。随低温胁迫时间的延长,可溶性糖和可溶性蛋白耐冷系数先上升后下降,10℃低温处理下可溶性糖耐冷系数最高。可溶性蛋白耐冷系数上升幅度与胁迫程度呈负相关,与品种耐冷性呈正相关。

注:HLC、HMC、HSC分别表示红花大金元在LC、MC和SC胁迫下的耐冷系数;KLC、KMC、KSC分别表示K326在LC、MC和SC胁迫下的耐冷系数。下同。
2.2 低温胁迫对烟叶保护酶的影响
如图2所示,烟叶SOD、POD 和 CAT 活性耐冷系数整体表现出随胁迫时间的延长呈上升下降趋势。上升幅度与抗低温能力及胁迫程度呈正相关。在轻度、中度、重度胁迫下,分别在胁迫的第4 d、第3 d、第2 d达到最大值。POD和CAT活性耐冷系数上升幅度总体表现出中度胁迫>重度胁迫>轻度胁迫,上升幅度与材料抗低温能力呈正相关。

2.3 低温胁迫对烟叶多酚代谢的影响
如图3所示,烟叶PPO、PAL活性耐冷系数整体表现出随胁迫时间的延长呈上升下降特征。在第3 d,PPO、PAL活性和总酚耐冷系数上升幅度总体表现出中度胁迫>重度胁迫>轻度胁迫,上升幅度与材料抗低温能力呈正相关。总酚耐冷系数除红大在轻度胁迫下呈快速上升-缓慢上升趋势外,其余处理均呈上升下降特征,上升规律同PPO耐冷系数。

2.4 低温胁迫对烟叶光合速率及光合色素的影响
如图4所示,随着低温胁迫程度的加强和胁迫时间的延长,烟叶净光合速率、叶绿素(a+b)的耐冷系数均呈下降趋势;在同一低温胁迫下,低温敏感型的下降幅度大于低温不敏感型。叶绿素a/b耐冷系数除红大在中度胁迫下呈上升趋势外,其他处理均呈先上升后下降趋势;并随胁迫程度的加剧上升速度加快。

2.5 烟叶生理指标相关性分析
选取低温胁迫时间最长(5 d)的各指标耐冷系数分析各指标与烟叶相对电导率之间的相关性。分析结果如表1所示,低温胁迫下,相对电导率耐冷系数与叶绿素、净光合速率、SOD活性的耐冷系数呈极显著负相关,与可溶性蛋白、POD活性、PAL活性耐冷系数呈显著负相关,与丙二醛、叶绿素a/b耐冷系数呈显著正相关,与其他指标相关程度不显著。因此,低温胁迫下,可通过提高叶绿素、净光合速率、SOD活性、可溶性蛋白、POD活性、PAL活性的耐冷系数,降低相对电导率、丙二醛、叶绿素a/b的耐冷系数,从而提高烟叶的抗低温能力。

表1 低温胁迫下烟叶相对电导率耐冷系数与各指标耐冷系数的相关系数
注:*表示显著相关;**表示极显著相关。
Note: * means significant correlationship; ** means very significant correlationship.
2.6 低温胁迫下各指标耐冷系数主成分分析
以低温胁迫时间最长(5 d)的各指标耐冷系数为基础进行主成分分析,计算出各主成分的特征向量和贡献率,如表2所示,主成分分析特征值中2 个主成分的累计贡献率达到85.069%,超过85%,可以用这2个主成分对烤烟抗低温能力概括分析。决定第一主成分的主要是相对电导率、丙二醛、可溶性糖、可溶性蛋白、叶绿素(a+b)、叶绿素a/b、SOD活性、POD 活性、总酚和净光合速率耐冷系数,它们反映了原始数据63.669%的信息量,这些指标主要与渗透调节作用、清除脂质过氧化产物和光合作用相关,因此可把第一主成分称为渗透调节因子、抗氧化因子和光合作用因子;第二主成分主要包括CAT活性、PPO活性、PAL活性耐冷系数,它们反映了原始数据21.402%的信息量,这些指标主要与多酚代谢有关,可称为多酚代谢因子。因此,可以选择渗透调节因子、抗氧化因子及光合作用因子耐冷系数为烟叶耐低温评价指标体系的主要鉴选指标,以多酚代谢因子耐冷系数为次要鉴选指标。
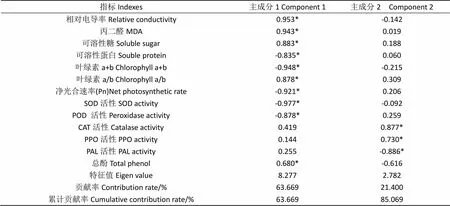
表2 各指标耐冷系数主成分的特征向量及贡献率
注:*表示某指标在各因子中的最大绝对值。
Note: *means the biggest absolute value of each index in all factors.
3 讨论与结论
对烤烟苗期的研究认为,受低温胁迫的烟株叶片明显小于正常烟株,有效叶片数和干物质量大幅减少,早花现象严重,使烟叶产量和质量严重降低[32]。随低温胁迫时间增加,相对电导率、脯氨酸含量和可溶性糖含量不断升高,丙二醛含量先升高后降低[33],随着低温胁迫的加剧相对电导率呈递增趋势,MDA含量呈先升高后下降趋势[34]。由于不同材料在不同生育时期各指标值不同,低温胁迫下某一指标的升高或降低是由材料生育期的变化和低温胁迫两者共同影响的,为消除试验材料生育期的变化对各指标值的影响,本研究参照前人研究结果采用耐冷系数[31]对各指标进行分析,可更好地反映低温胁迫下各指标的变化。本研究表明,在烤烟伸根期,低温胁迫使烟叶相对电导率和MDA的耐冷系数在胁迫的前3d呈上升趋势,且低温敏感型材料较低温不敏感型材料上升幅度大。根据相对电导率耐冷系数的结果表明红大的抗低温能力大于K326,与前人研究[27]和本课题组前期综合鉴定结果一致。
植物在遭受逆境胁迫后会通过积累可溶性糖、游离氨基酸、脯氨酸等可溶性物质来适应逆境胁迫[35]。对烤烟苗期的研究表明,可溶性糖与脯氨酸含量随低温胁迫时间的延长均逐渐增加,而可溶性蛋白含量均逐渐下降[25]。本研究发现,随低温胁迫天数的增加,烟叶可溶性糖(SS)和可溶性蛋白(SP)耐冷系数呈上升下降趋势。10℃处理下可溶性糖的积累速度最大,推测10℃是本研究所用品种的敏感温度,该温度下材料迅速做出应急反应,迅速积累可溶性糖,抵御低温胁迫。相同低温处理下,低温不敏感型材料渗透调节物质耐冷系数增幅大于低温敏感型材料。
在环境胁迫下,植株体内会产生破坏植物分子的物质,如 O2-、H2O2等,使膜脂过氧化作用加剧,同时产生清除这些活性氧的保护酶系统,如 POD、SOD 和 CAT 等。本研究表明,低温胁迫下,烟叶SOD、POD 和 CAT 活性耐冷系数随胁迫时间的延长先上升后下降。这与王欣亚等[36]研究结果一致。本研究还表明,低温胁迫使 POD耐冷系数提高幅度较大,其次是 CAT 和 SOD,表明 POD 对低温胁迫反应更敏感,是低温胁迫的主要保护酶。同一低温胁迫下,红大的SOD、POD 和 CAT 三种保护酶耐冷系数显著高于K326,而MDA 耐冷系数显著低于K326,表明低温胁迫下较强抗氧化能力是红大抗寒性强于K326的主要原因之一。因此,较强的渗透调节能力以及抗氧化能力是烤烟抗低温的主要原因。这与主成分分析的渗透调节因子、抗氧化因子可作为烤烟耐冷性鉴定的主要鉴选指标一致,也与前人研究提出POD、SOD 和 CAT 酶活力及可溶性蛋白浓度可作为耐冷性鉴定的生理指标研究结果一致[7]。此外,本研究还发现,不论哪种材料,均在10℃处理下POD活性最高。
低温胁迫造成叶绿素降解,严重影响植株光合作用[37],尤其叶绿素a合成对于低温胁迫更为敏感[38]。前人[14,2]研究表明低温胁迫达到一定强度时,叶绿素a、叶绿素b、叶绿素(a+b)含量、叶绿素a/b值、净光合速率呈下降趋势。本研究表明,净光合速率、叶绿素(a+b)耐冷系数与低温胁迫程度和低温胁迫时间成负相关,这与前人[39]的研究结果一致。本研究还发现,在低温胁迫的前3 d,叶绿素a/b呈上升趋势,且上升幅度与胁迫强度呈正相关,表明低温胁迫的前期,烟叶通过提高叶绿素a/b提高对光能的利用,以缓解净光合速率的下降,这可能也是烟叶适应低温胁迫的一种机制。这与主成分分析中提出的光合作用因子可作为烤烟耐冷性鉴定的主要鉴选指标一致。
多酚氧化酶(PPO)是植物多酚代谢中的重要酶,通过将酚类物质氧化成醌,提高植株的抗逆能力[40]。苯丙氨酸解氨酶(PAL)是酚类物质代谢最上游的关键限速酶[41],对植物抗逆有着重要的作用。在烟草中,多酚类物质除了影响烟草采后制品品质,对烟草的生长发育也有着重要的调节作用[42]。本研究中,随着低温胁迫的持续,烟叶PPO、PAL和总酚耐冷系数均呈上升下降趋势,第3 d达最大值,表明烟叶通过提高PPO、PAL活性适应低温胁迫的能力是有限的。不论材料抗性如何,10℃处理下,PPO和PAL耐冷系数最高。总酚耐冷系数变化规律与PPO和PAL活性基本一致。
根据保护酶及多酚代谢相关酶的分析,10℃可能是烟叶适宜的低温驯化温度,在10℃低温处理下,烟叶抗氧化酶活性和多酚代谢酶活性升高,酚类物质积累,以清除低温胁迫下产生的活性氧,提高烟叶的抗低温能力。
[1] 刘成伟,郭仕平,何余勇. 低温胁迫对不同品种和苗龄烤烟早花发生的影响[J]. 江西农业学报,2012, 24(3):132-134.
LIU Chengwei, GUO Shiping, HE Yuyong. Effect of low temperature stress on early flowering of different flue-cured tobacco varieties with different seedling-age [J]. Acta Agriculturae Jiangxi, 2012, 24( 3):132-134.
[2] 李琦瑶,陈爱国,王程栋,等. 低温胁迫对烤烟幼苗光合荧光特性及叶片结构的影响[J]. 中国烟草学报,2018, 24(2):30-38.
LI Qiyao, CHEN Aiguo, WANG Chengdong, et alEffects of low temperature stress on photosynthetic fluorescence characteristics and leaf tissue structure of flue-cured tobacco seedlings[J]. Acta Tabacaria Sinica, 2018, 24(2):30-38.
[3] 肖立增. 苗期低温对烟草BR信号通路关键基因表达及发育进程的影响[D]. 重庆:西南大学,2016.
XIAO Lizeng. Influence of BR signaling pathway key gene expression and the development process under low temperature induction in tobacco seedling stage[D]. Chongqing: Southwest University, 2016.
[4] 蒲媛媛,赵玉红,武军艳,等. 北方强冬性甘蓝型冬油菜品种(系)抗寒性评价[J]. 中国农业科学,2019, 52(19):3291-3308.
PU Yuanyuan, ZHAO Yuhong, WU Junyan, et alComprehensive assessment on cold tolerance of the strong winterL. cultivated in Northern China[J]. Scientia Agricultura Sinica, 2019, 52(19):3291-3308.
[5] 王洋洋,贺利,任德超,等. 基于主成分-聚类分析的不同水分冬小麦晚霜冻害评价研究[J]. 作物学报,2022, 48(2): 448-462.
WANG Yangyang, HE Li, REN Dechao, et alEvaluations of winter wheat late frost damage under different water based on principal component-cluster analysis [J]. Acta Agronomica Sinica, 2022, 48(2): 448-462.
[6] 邵文静,张今杰,盖胜男,等. 低温胁迫下高粱幼苗叶片生理变化及相关基因表达分析[J]. 农业生物技术学报,2021, 29(5): 857-870.
SHAO Wenjing, ZHANG Jinjie, GAI Shengnan, et alPhysiological changes and related genes expression analysis of Sorghum () seedlings under low temperature stress [J]. Journal of Agricultural Biotechnology, 2021, 29(5): 857-870.
[7] 张陇艳,程功敏,魏恒玲,等. 陆地棉种子萌发期对低温胁迫的响应及耐冷性鉴定[J]. 中国农业科学,2021, 54(1):19-33.
ZHANG Longyan, CHENG Gongmin, WEI Hengling, et alChilling tolerance identification and response to cold stress ofvarieties (lines) during germination stage [J]. Scientia Agricultura Sinica, 2021, 54(1):19-33.
[8] 张翔,杨勇,刘学勇,等. 外源水杨酸对低温胁迫下海滨雀稗抗寒生理特征的影响[J]. 草业学报,2020, 29(1):117-124.
ZHANG Xiang, YANG Yong, LIU Xueyong, et al. Effect of exogenous salicylic acid on the antioxidant enzyme activities and fatty acid profiles in seashoreunder low temperature stress[J]. ACTA PRATACULTURAE SINICA, 2020, 29(1): 117- 124.
[9] LIU Weicheng, ZHENG Chunfang, CHEN Jinong, et al. Cold acclimation improves photosynthesis by regulating the ascorbate-glutathione cycle in chloroplasts of[J]. Journal of Forestry Research, 2019, 30(3): 755-765.
[10] 杨碧云,叶丽萍,钟凤林,等. 低温处理对紫色小白菜品质及光合特性的影响[J]. 安徽农业大学学报,2019, 46(1): 173-180.
YANG Biyun, YE Liping, ZHONG Fenglin, et alEffects of low-temperature stress on the quality and photosynthetic characteristics of purple cabbage [J]. Journal of Anhui Agricultural University, 2019, 46(1): 173-180.
[11] DING Yanglin, SHI Yiting, YANG Shuhua. Advances and challenges in uncovering cold tolerance regulatory mechanisms in plants[J]. New Phytologist, 2019, 222(4): 1690-1704.
[12] 郑春芳,刘伟成,魏龙,等. 外施褪黑素对低温胁迫下红树植物秋茄光合作用和抗坏血酸-谷胱甘肽循环的调控[J]. 植物生理学报,2019, 55(8):1211-1221.
ZHENG Chunfang, LIU Weicheng, WEI Long, et alMelatonin regulates photosynthesis and ascorbate-glutathione cycle in a mangroveunder low temperature stress [J]. Plant Physiology Journal, 2019, 55 (8): 1211-1221.
[13] 王瑞霞,闫长生,张秀英,等. 春季低温对小麦产量和光合特性的影响[J]. 作物学报,2018, 44(2): 288-296.
WANG Ruixia, YAN Changsheng, ZHANG Xiuying, et al. Effect of low temperature in spring on yield and photosynthetic characteristics of wheat [J]. ACTA AGRONOMICA SINICA, 2018, 44(2): 288-296.
[14] 杨晶,祝建波,张亚敏,等. 低温胁迫对转新疆雪莲基因烟草光合作用的影响[J]. 生态学报,2015, 35(23): 7868- 7877.
YANG Jing, ZHU Jianbo, ZHANG Yamin, et al. Effects of low temperature stress on photosynthesis intransgenic tobacco[J]. Acta Ecologica Sinica, 2015, 35(23) :7868-7877.
[15] 邹娅,米文博,徐明霞,等. 低温胁迫下北方强冬性区甘蓝型冬油菜的低温光合生理特征[J]. 甘肃农业大学学报,2021, 56(2): 105-113.
ZOU Ya, MI Wenbo, XU Mingxia, et al. Physiological and photosynthetic characteristics of winter rapeseed under low temperature stress region[J]. Journal of Gansu Agricultural University, 2021, 56(2):105-113.
[16] 刘海卿,孙万仓,刘自刚,等. 北方寒旱区白菜型冬油菜抗寒性与抗旱性评价及其关系[J]. 中国农业科学,2015, 48(18): 3743-3756.
LIU Haiqing, SUN Wancang, LIU Zigang, et al.Evaluation of drought resistance and cold resistance and research of their relationship at seedling stage of winter rapeseed (L.) in cold and arid regions in North China [J]. Scientia Agricultura Sinica, 2015, 48(18):3743-3756.
[17] 徐舒,李玲,张思梦,等. 基于隶属函数分析的甘薯薯苗耐冷性基因型差异研究[J]. 中国农业科学,2019, 52(17):2929-2938.
XU Shu, LI Ling, ZHANG Simeng, et al.Evaluation of genotype differences of cold tolerance of sweet potato seedlings by subordinate function value analysis [J]. Scientia Agricultura Sinica, 2019, 52(17):2929-2938.
[18] 项洪涛,李琬,何宁,等. 苗期低温胁迫下烯效唑对红小豆根系抗寒生理及产量的影响[J]. 草业学报,2019, 28(7):92-102.
XIANG Hongtao, LI Wan, HE Ning, et al. Effect of S3307 on physiology resistance in root and on yield of adzuki bean under low temperature stress during seedling stage[J]. Acta Prataculturae Sinica, 2019, 28(7):92-102.
[19] BAN Qiuyan, WANG Xuewen, PAN Cheng, et al. Comparative analysis of the response and gene regulation in cold resistant and susceptible tea plants [J]. PLoS One, 2017, 12(12): e0188514.
[20] 常博文,钟鹏,刘杰,等. 低温胁迫和赤霉素对花生种子萌发和幼苗生理响应的影响[J]. 作物学报,2019, 45(1): 118-130
CHANG Bowen, ZHONG Peng, LIU Jie, et al. Effect of low- temperature stress and gibberellin on seed germination and seedling physiological responses in peanut [J]. ACTA AGRONOMICA SINICA, 2019, 45(1): 118-130.
[21] 杨树勋. 烟草酶促棕色化反应机理及其调控研究进展[J]. 作物研究,2019, 33(3):246-250.
YANG Shuxun. Study on mechanism and regulation technology of enzymatic browning of tobacco[J]. Crop research, 2019, 33(3): 246-250.
[22] 王馨雨,杨绿竹,王婷,等. 植物多酚氧化酶的生理功能、分离纯化及酶促褐变控制的研究进展[J]. 食品科学,2020, 41(9): 222-237.
WANG Xinyu, YANG Lvzhu, WANG Ting, et al.Recent progress toward understanding the physiological function, purification, and enzymatic browning control of plant polyphenol oxidases [J]. Food Science, 2020, 41(9): 222-237.
[23] HUANG Junli, GU Min, LAI Zhibing, et al. Functional analysis of thegene family in plant growth, development, and response to environmental stress[J]. Plant Physiology, 2010, 153(4): 1526.
[24] 周培禄,刘光亮,王树声,等. 低温胁迫下烟苗多酚代谢及其抗氧化能力分析[J]. 中国烟草科学,2018, 3 9(5): 33-39.
ZHOU Peilu, LIU Guangliang, WANG Shusheng,et al.Analysis of polyphenol metabolism and antioxidant capacity of tobacco seedlings under cold stress[J]. Chinese Tobacco Science, 2018, 39(5):33-39.
[25] 杜鑫宇,尹航,李莹,等. 低温持续胁迫下不同烟草品种苗期耐寒性生理指标的变化[J]. 内蒙古民族大学学报(自然科学版),2020, 35(2): 124-130.
DU Xinyu, YIN Hang, LI Ying, et al.Changes in physiological indexes of cold tolerance in different tobacco varieties at seedling stage under continuous low temperature stress[J]. Journal of Inner Mongolia University for Nationalities, 2020, 35(2):124-130.
[26] 李莹,杨超群,高梓峰,等. 低温胁迫下4份烟草品种苗期叶绿素及渗透调节物质含量的变化[J]. 延边大学农学学报,2021, 43(2): 44-52.
LI Ying, YANG Chaoqun, GAO Zifeng, et al. Changes of chlorophyll and osmotic adjustment substances in 4 tobacco cultivars at seedling stage under low temperature stress[J]. Agricultural Science Journal of Yanbian University, 2021, 43(2): 44-52.
[27] 李琦瑶. 低温调控烤烟幼苗叶片生长发育的生理机制研究[D].北京:中国农业科学院,2019.5.
LI Qiyao. Studies on the physiological mechanism of low temperature regulation on leaf growth and development of flue-cured tobacco seedling [D]. Chinese Academy of Agricultural Sciences, 2019.5.
[28] 彭运生,刘恩. 关于提取叶绿素方法的比较研究[J]. 北京农业大学学报,1992, 18(3): 247-250.
PENG Yunsheng, LIU En. Studies of method on extract chlorophyll a and b [J]. Acta agriculture universitaties pekinensis, 1992, 18(3):247-250.
[29] 陈爱葵,韩瑞宏,李东洋,等. 植物叶片相对电导率测定方法比较研究[J]. 广东教育学院学报,2010, 30(5): 88-91.
CHEN Aikui , HAN Ruihong , LI Dongyang, et al.A comparison of two methods for electrical conductivity about plant leaves[J]. Journal of Guangdong Education Institute, 2010, 30(5):88-91.
[30] 李合生. 植物生理生化实验原理与技术[M]. 北京. 高等教育出版社,2000, 164-168, 260.
LI Hesheng. Principle and technology of plant physiological and biochemical experiment[M]. Beijing: Higher Education Press, 2000, 164-168, 260.
[31] 张鹤,蒋春姬,殷冬梅,等. 花生耐冷综合评价体系构建及耐冷种质筛选[J]. 作物学报,2021, 47(9): 1753-1767.
ZHANG He, JIANG Chunji, YIN Dongmei, et al.Establishment of comprehensive evaluation system for cold tolerance and screening of cold-tolerance germplasm in peanut [J]. ACTA AGRONOMICA SINICA, 2021, 47(9): 1753-1767.
[32] 段雯,初正春,周胤琦. 苗期低温诱导对烤烟生长发育的影响[J].安徽农业科学,2020, 48(1): 49-51.
DUAN Wen, CHU Zhengchun, ZHOU Yinqi. Effects of low temperature on growth and development of flue-cured tobacco in seeding stage[J]. Journal Anhui Agricultural Science, 2020, 48(1):49-51.
[33] 李琦瑶,王树声,周培禄,等. 低温胁迫对烟苗叶形及生理特性的影响[J]. 中国烟草科学,2018, 39(1):17-23.
LI Qiyao, WANG Shusheng, ZHOU Peilu, et al.Effects of low temperature stress on leaf shape and physiological characteristics in tobacco seedlings[J]. Chinese Tobacco Science, 2018, 39(1): 17-23.
[34] 尹航. 不同烟草品种苗期对低温胁迫的若干生理响应及耐寒性综合评价[D]. 延吉:延边大学,2018.
YIN Hang. Physiological responses of different tobacco varieties to low temperature stress in seedling stage and comprehensive evaluation of cold tolerance[D]. Yanji: Yanbian university, 2018.
[35] 项洪涛,郑殿峰,何宁,等. 植物对低温胁迫的生理响应及外源脱落酸缓解胁迫效应的研究进展[J]. 草业学报,2021, 30(1): 208-219.
XIANG Hongtao, ZHENG Dianfeng, HE Ning, et al. Research progress on the physiological response of plants to low temperature and the amelioration effectiveness of exogenous ABA., 2021, 30(1):208-219.
[36] 王欣亚,吴委林,万悦,等. 低温诱导下2种烤烟品种苗期叶片保护酶活性及烤后化学成分的变化[J]. 延边大学农学学报,2018, 40 (3):44-51.
WANG Xinya, WU Weilin, WAN Yue, et al. Changes of protective enzyme activities and chemical composition of leaves after baking of two flue-cured tobacco varieties at seedling stage under low temperature induction. Agricultural Science Journal of Yanbian University, 2018, 40 (3):44-51.
[37] Miura Kenji, Furumoto Tsyoshi. Cold signaling and cold response in plants. International Journal of Molecular Sciences, 2013, 14: 5312-5337.
[38] 王秀田,卢秋巍,苍晶,等. 低温驯化对冬小麦叶绿素荧光特性及抗氧化酶活性的影响[J]. 植物生理学报,2016, 52(12): 1959-1969.
WANG Xiutian, LU Qiuwei, CANG Jing, et al. Effects of cold acclimation on chlorophyll fluorescence characteristics and antioxidant enzyme activity in winter wheat[J]. Acta Phytophysiol Sin, 2016, 52(12): 1959-1969.
[39] 刘自刚,袁金海,孙万仓,等. 低温胁迫下白菜型冬油菜差异蛋白质组学及光合特性分析[J]. 作物学报,2016, 42(10): 1541- 1550.
LIU Zigang, YUAN Jinhai, SUN Wancang, et al. Differential proteomic analysis and photosynthetic characteristics of winter rapeseed under low temperature stress[J]. Acta Agronomica Sinica, 2016, 42(10): 1541-1550.
[40] 史普酉,贾孟,杨成翠,等. 不同黑胫病发病程度烟株生理特性的比较分析[J]. 江西农业学报,2020, 32(1):19-26.
SHI Puyou, JIA Meng, YANG Chengcui,et alResearch on physiological characteristics of different degree black shank disease of flue-cured tobacco[J]. Acta Agriculturae Jiangxi, 2020, 32(1): 19-26.
[41] 阚娟,林仙佩,万冰,等. 不同溶质型桃果实成熟过程中酚类代谢与抗氧化能力的研究[J]. 现代食品科技,2017, 33(6):74-79.
KAN Juan, LIN Xianpei, WAN Bing, et al. Study of phenolic metabolism and antioxidant activities of two peach cultivars during maturation[J]. Modern Food Science and Technology, 2017, 33(6):74-79.
[42] 张秋芳,刘奕平,刘波,等. 烟草主要酚类物质研究进展[J]. 福建农业学报,2006, 21(2):158-163.
ZHANG Qiufang, LIU Yiping, LIU Bo,et al. Research progress in tobacco polyphenol substance [J]. Fujian Journal of Agricultural Sciences, 2006, 21(2):158-163.
Physiological responses of flue-cured tobacco to low temperature stress at root-extending stage
XIE Xiaoyu*, HOU Shuang, GUO Jinge, WANG Fenfen, CUI Kaidong, YANG Qi, CHEN Jinfen, GU Kaiyuan
College of Agronomy and Biotechnology, Southwest University, Chongqing 400716, China
[] This study aims to study the effect of low temperature stress on physiological characteristics of tobacco during root extension stage. [] The changes of associated physiological indicators including osmotic regulators, protective enzyme activities, polyphenol metabolism and photosynthesis of tobacco were studied using two different cold resistance tobacco varieties (Honghuadajinyuan with high cold resistance and K326 with low cold resistance) at root extension stage under low temperature stress in artificial incubator. On this basis, the suitable indexes for the identification of cold tolerance of flue-cured tobacco were screened. [] With the extension of low temperature stress time, the cold tolerance coefficient of the net photosynthetic rate and chlorophyll (a+b) of tobacco leaves showed a downward trend, and the downward rate was positively correlated with the degree of low temperature stress and negatively correlated with the cold resistance of varieties. The cold tolerance coefficient of malondialdehyde and relative conductivity were increased with the extension of low temperature stress time in the first 3 d, and the rising rate was negative correlated with the cold resistance of varieties. The cold tolerance coefficients of peroxidase (POD), superoxide dismutase (SOD), catalase (CAT), polyphenol oxidase (PPO), phenylalnine ammonialyase (PAL) and the soluble protein, soluble sugar and total phenol increased first and then decreased with the extension of low temperature stress time, and the rising speed of cold insensitive variety was higher than that of cold sensitive variety. Correlation analysis showed that the cold tolerance coefficient of relative conductivity was in extremely significant negative correlation with chlorophyll (a+b), net photosynthetic rate and SOD activity, in significant negative correlation with soluble protein, POD activity, PAL activity, and in significant positive correlation with malondialdehyde and chlorophyll a/b under low temperature stress. Principal component analysis showed that the first principal components determining the cold tolerance of tobacco mainly included the cold tolerance coefficient of relative conductivity, malondialdehyde, soluble sugar, soluble protein, chlorophyll (a+b), chlorophyll a/b, SOD activity, POD activity, total phenol and net photosynthetic rate. The second principal components mainly included the cold tolerance coefficient of the activity of CAT, PPO and PAL. [] The cold tolerance coefficient of leaf relative conductivity, chlorophyll (a+b), net photosynthetic rate and SOD activity can be used as the basis for screening cold tolerant tobacco germplasm under continuous low temperature stress. The cold tolerance coefficient of osmotic adjustment factors, antioxidant factors and photosynthetic factors can be used as the main screen indexes, and the cold tolerance coefficient of polyphenol metabolism factors can be used as the secondary screen indexes in the evaluation of tobacco cold tolerance.
flue-cured tobacco; low temperature stress; antioxidant enzymes; polyphenol metabolism; osmotic adjustment; photosynthesis
. Email: xiexy8009@163.com
谢小玉,侯爽,郭金格,等. 烤烟伸根期对低温胁迫的生理响应[J]. 中国烟草学报,2022,28(5).
XIE Xiaoyu, HOU Shuang, GUO Jinge, et al. Physiological responses of flue-cured tobacco to low temperature stress at root-extending stage[J]. Acta Tabacaria Sinica, 2022,28(5).
10.16472/j.chinatobacco.2021.T0149
中国烟草总公司云南省公司科技计划重点项目“烤烟养分调控与烘烤特性相关性研究”(2020530000241025);“烤烟挂灰烟形成机理与消减策略研究”(2017YN09)
谢小玉(1968—),博士,教授,主要研究方向:植物生理生态与分子生物学,Tel:13883014356,Email:xiexy8009@163.com
2021-08-20;
2022-07-22
