RBF神经网络与癌细胞黏附度活性检测研究
2022-11-10李丹
李 丹
南京中医药大学附属南京医院 南京市第二医院检验科,江苏省南京市 210003
细胞活性评估技术在抗癌新药物测试[1]、细胞毒理学实验[2]以及其他生化反应刺激实验[3]中起着至关重要的作用。传统细胞活性评价方法是细胞计数法[4],即活细胞占总细胞数量的百分比。然而,由于细胞群体的异质性,传统的细胞计数法已经不能满足药物剂量实验的精度要求。因此,如何评估细胞群体的异质性问题,是本论文需要解决的重要的科学问题。众所周知,细胞与其物理环境之间的黏附作用是发育生物学[5]、组织工程[6]与生物技术过程[7]中的核心,同时细胞黏附性还是细胞转移[8]、细胞活性[9]以及细胞凋亡[10]的物理标志,因此,细胞黏附强度被认为是量化评估细胞状态的重要物理指标之一[11]。通过对细胞黏附性的检测,可实现对细胞状态无标记、非侵入性与实时的监测,因此,本论文考虑将细胞黏附性作为评估细胞异质性的方案。
1 材料与方法
1.1 实验细胞、试剂与装置 人胃癌细胞(SGC-7901)由南京第二医院提供,培养基(DMEM+10% FBS)从美国Gibco公司购买,细胞在37℃,5%CO2环境的水套式二氧化碳培养箱(购买自Heal Force®)内培养。30%浓度的H2O2与纯度65%的顺铂[化学式:PtCl2(NH3)2]试剂购买自MOLBASE公司;CCK-8细胞凋亡检测试剂盒购买自美仑科技公司。
离心机购买自上海卢湘仪离心机仪器有限公司,可调节旋转角速度(ω<10 000rad/min)。微流控芯片由汶灏芯片技术有限公司(中国苏州)制造,如图1所示。离心式微流控芯片采用PDMS材料作为基材,含约105cells/ml细胞密度的培养基滴入芯片的入口,将芯片放入二氧化碳培养箱中培养12h,使细胞在离心式微流控芯片的通道中黏附。

图1 离心式微流控芯片的制作
1.2 实验方法 首先将同一批培养的细胞样本分为样本A和样本B,样本A利用离心式微流控芯片进行细胞黏附脱离实验,样本B在96孔板中进行细胞活性检测实验。两个细胞样本各自分为六组子样本,分别用10μl不同浓度(0、10、50、100、200、500μmol/L)的H2O2培养3h,以建立细胞活性梯度,将滴入0μmol/L H2O2的样本作为控制组。(1)细胞黏附脱离实验:通过改变芯片的转速以改变贴附细胞所受离心力,弱黏附性的细胞会被较弱的离心力脱离,强黏附性的细胞会被较强的离心力脱离,从而建立细胞受离心力影响的黏附脱离动力曲线图。用Origin2016软件对该曲线进行Logistic拟合,得到S型函数f(x)。分别令f(x)=0.2、0.5、0.8,得到细胞黏附强度值τ20、τ50与τ80。(2)细胞活性检测实验是用抗癌药物顺铂进行,将10μl不同浓度(0~300μmol/L)的顺铂试剂滴入96孔板中,培养24h,然后进行CCK-8实验;以顺铂溶液浓度作为x轴,以酶标仪计算的细胞指数作为y轴制作药物剂量反应曲线图(S型曲线)。用Origin2016软件对该曲线进行Logistic拟合,得到S型函数g(x)。令g(x)=0.5,得到细胞活性值IC50。(3)信息融合:将细胞多黏附强度值作为输入,细胞活性值作为输出,利用RBF神经网络建立细胞活性预测模型。
1.3 数据统计分析 所有实验数据均独立重复20次,均具有统计学意义,即P<0.05(n=20),其中P是指采样误差引起的样品之间的差异。
2 结果
2.1 细胞离心力 本文中利用离心力对群体细胞的异质性等级进行划分,突破了传统的细胞计数方法评估细胞活性的弊端。如图2所示,在离心式微流控芯片环形通道内的细胞平均受力为[12]:
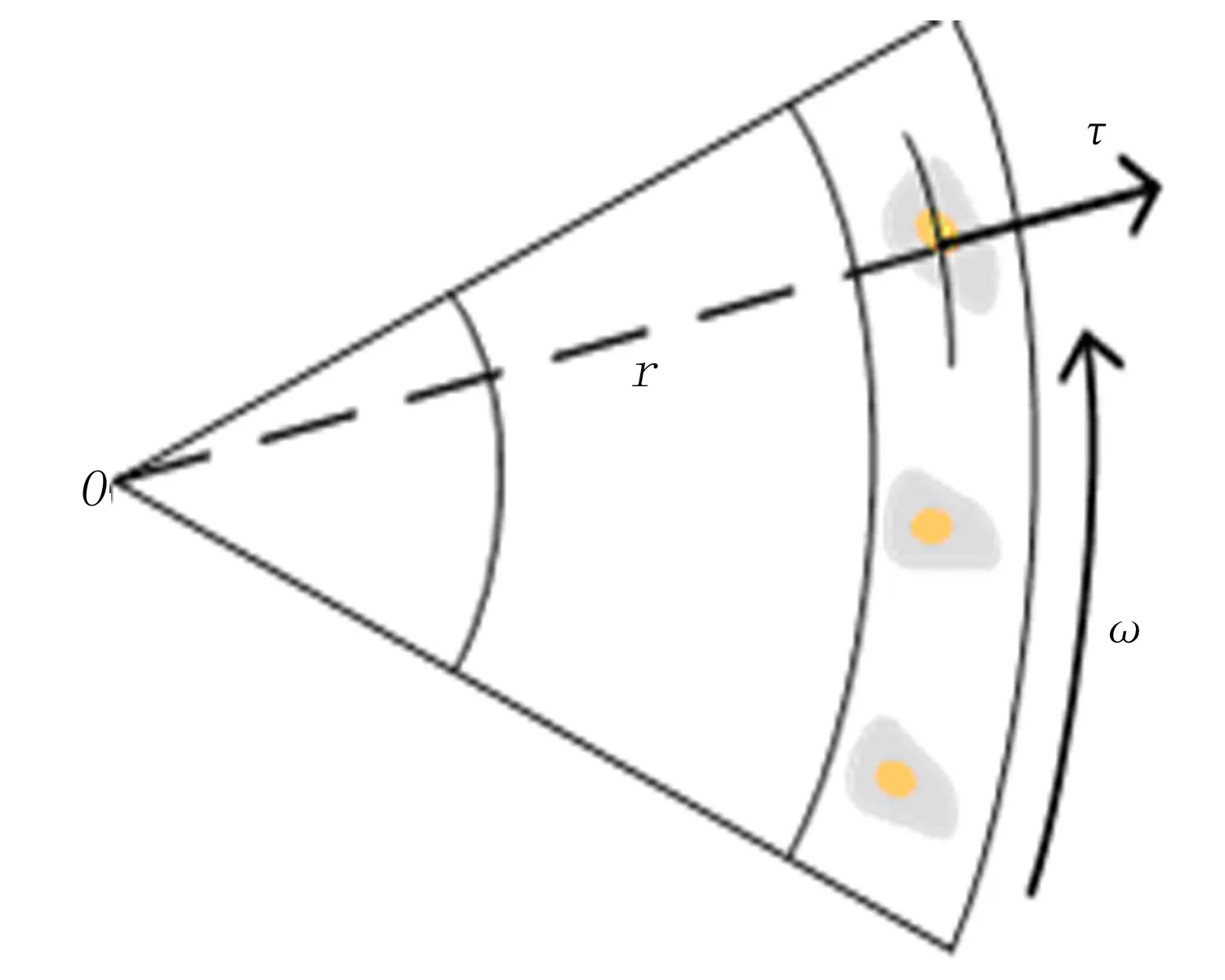
图2 黏附细胞受离心力模型
其中,τ为细胞所受的离心力,r为细胞与芯片中心的距离,ρ为培养基的密度(998.5kg/m3),μ为培养基黏度(0.085dynes·cm-2·s)[13],ω为离心式微流控芯片旋转的角速度。
2.2 细胞黏附强度信息提取 细胞在离心式微流控芯片环形通道内培养贴壁,控制转盘转速以改变离心力,每次持续12min,然后对环形通道内的细胞进行计数,除去最初的细胞数量(控制组)得到细胞指数。将得到的数据用Origin2016进行Logistic函数(S型曲线)拟合,得到图3。其中Logistic函数表达式为:

图3 不同活性梯度下离心力对细胞指数的影响
对图3拟合的结果见表1。

表1 Logistic函数拟合参数表
其中,所有拟合的确定系数(R-Square)均>0.99,同时校正确定系数(Adj.R-Square)也均>0.99,说明图3中的曲线达到了很好的拟合。
根据曲线的拟合,可以计算细胞的黏附强度。τN表示细胞脱离(100-N)%所受的离心力,以此来评估细胞群体的黏附强度。然而,用单一参数评估细胞群体的异质性存在一定的误差,因此,提取τ20、τ50与τ80等三个细胞黏附强度参数,并用RBF神经网络来拟合输出(细胞药物反应实验),以达到精确评估与预测细胞活性的目的,根据公式(2)、图3与表1可计算出τ20、τ50与τ80等三个细胞黏附强度参数。
2.3 细胞活性标定 提高细胞活性评估的准确性,有助于提高新抗癌药物的测试[1],这也是细胞活性研究领域最重要的目标之一。而细胞活性评估的标准方法,是用抗癌药物对癌细胞进行半抑制率(half maximal inhibitory concentration)IC50的测定[14]。这里,采用顺铂作为药物反应实验的试剂,顺铂主要应用于SGC-7901等肿瘤细胞的治疗[15]。用不同浓度的H2O2在96孔板中制备细胞活性梯度,然后进行药剂反应实验,顺铂浓度范围为(1~300μmol/L),得到药物反应曲线,如图4所示。用Graphpad Prism 7.0软件可直接计算出IC50的值,具体步骤为:(1)输入数据,点击analyze→ 点击Transform concentration[x];(2)选择Transform to logarithms;(3)点击analyze→点击Dose-response-Inhibition→点击Log(inhibitor)vs.response-Variable slope(for parameters)。利用该方法计算的IC50的值见表2,作为RBF神经网络的输出。

图4 药物反应实验
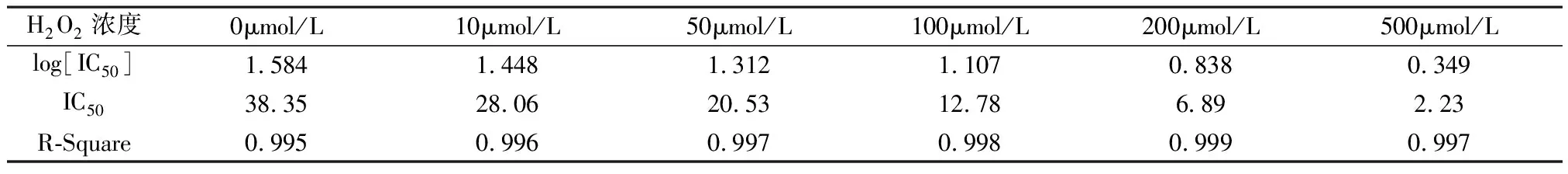
表2 IC50的计算
2.4 基于RBF神经网络的细胞活性评估 将细胞黏附强度τ=[τ20、τ50、τ80]作为RBF神经网络的输入,将抗癌药物反应实验的IC50值作为RBF神经网络的输出,调用MATLAB程序:net=newrb(X_train,Y_train, spread),其中spread为径向基函数的分布密度,这里使spread=1.5。应用训练好的模型对细胞活性进行预测,得到图5,并与传统细胞计数方法进行比较。
由于群体细胞的异质性,以细胞数量作为评价细胞活性的方法会造成药物反应的巨大误差。由图5可知,细胞被不同浓度的H2O2弱化[16],虽然还是活的细胞,但是其抗药物的能力明显降低。黏附强度作为描述细胞状态强有力的物理参数,通过RBF神经网络将三种黏附强度参数融合在一起,综合评价细胞活性,使得细胞活性得到更精确的评估与预测。结果表明,相比于传统细胞计数法的平均误差19.0%,基于多黏附强度信息融合方法与标准方法IC50法的误差更小,平均误差为1.8%,提高了17.2%,如表3所示。因此,本文提出的细胞活性评估方法,对抗癌新药物测试、细胞毒理学试验以及其他生化刺激的剂量反应试验具有重大意义。
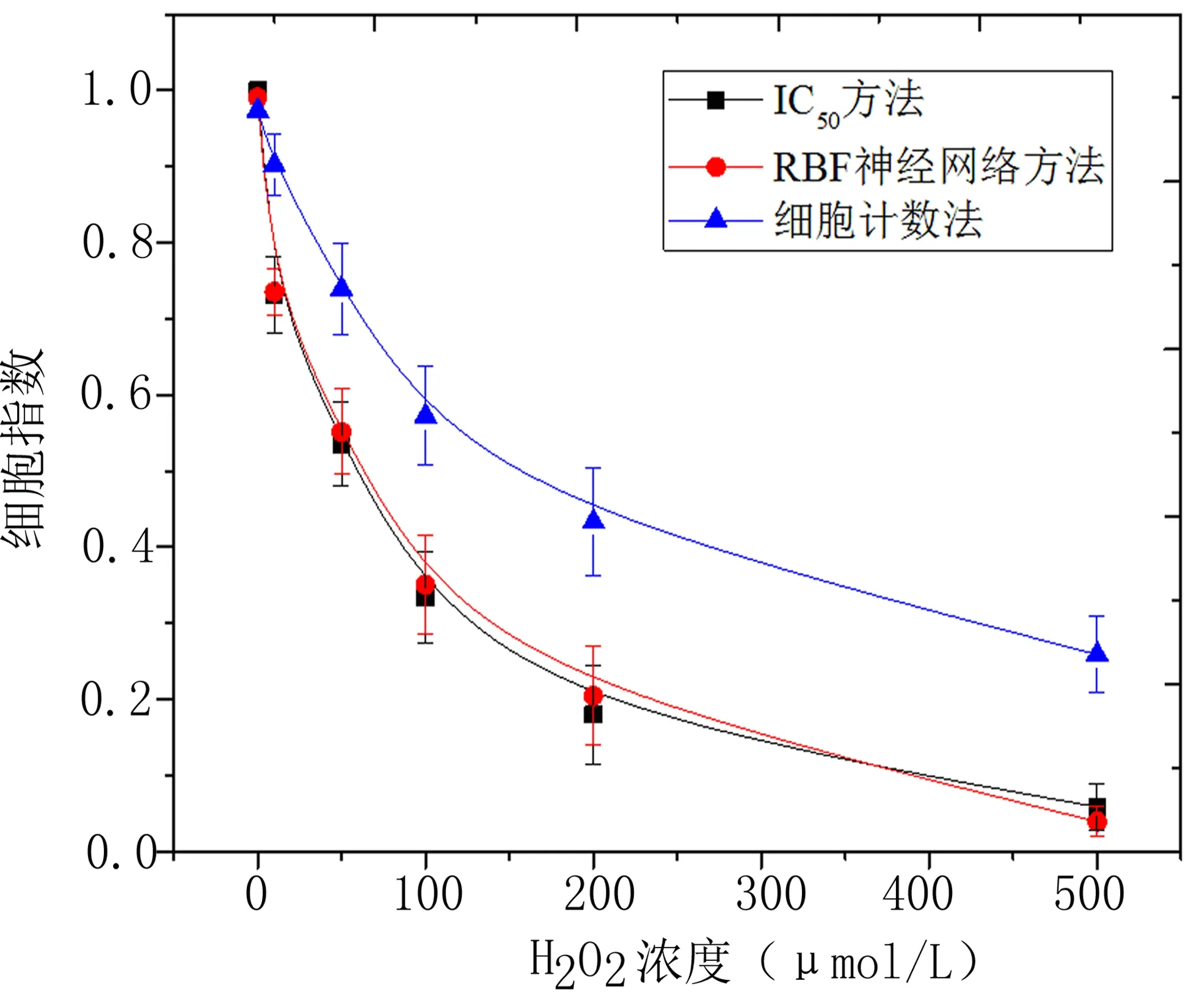
图5 细胞活性评估方法对比

表3 细胞计数法、信息融合法与IC50法比较
3 讨论
细胞的黏附强度是细胞活性重要的物理标志之一,我们制备一种离心式微流控芯片,通过施加不同离心力,同时用细胞计数法统计细胞脱离情况,得到细胞指数与离心力大小之间的曲线关系。结果发现,受较大离心力脱离的细胞都是属于特异性黏附,因为非特异性黏附细胞的黏附状态太弱,易被较弱的离心力冲走,因此表明该项实验具有生物学意义。本文从细胞黏附脱离动态曲线中提取三种黏附强度,表明此方法可以实现细胞群的黏附异质性的评估,且提取的黏附强度参数越多,其表征细胞群黏附强度的梯度越精确。由于细胞所受离心力被位置所限制,因此离心式微流控芯片的通道宽度设计不能超过三个细胞的直径,否则会造成黏附细胞受力不一致;同时,窄通道的设计也有利于细胞计数。另外,细胞对药物的反应能力不只体现在死活上,每个细胞活性状态不一样,因此存在活性异质性问题。结果表明,利用细胞群的多黏附强度信息评估细胞活性,相比于传统仅以死活评价的细胞计数法,其评估细胞药物反应的精确度大大提高。
由于细胞黏附强度的提取需要细胞在微流控芯片中贴壁,贴壁时间大约12h,无法实现细胞活性的快速提取,因此,未来我们将考虑利用缩窄微通道实现单细胞黏附强度的高通量提取,以提升细胞活性评估的效率。另外,虽然本文提取了细胞的多黏附强度信息,但是仍然属于单一的胞外物理特征,将来若结合电化学方法提取细胞膜电容性、胞质浓度或细胞内部电位等信息,并利用深度学习将之融合在一起,则可实现细胞活性更加全面精准的评估。
